Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.43 no.1 Toledo ene./feb. 2019
https://dx.doi.org/10.7399/fh.11036
ORIGINALES
Impacto clínico-económico del cambio de protocolo de uso de basiliximab en el trasplante hepático
1Pharmacy Unit. Hospital Universitario Nuestra Señora de La Candelaria, Tenerife, Islas Canarias. Spain.
2Gastroenterology Unit. Hospital Universitario Nuestra Señora de La Candelaria, Tenerife, Islas Canarias. Spain.
3Research Support Unit. Hospital Universitario Nuestra Señora de La Candelaria, Tenerife, Islas Canarias. Spain.
Introducción
La cirugía del trasplante hepático es laboriosa, con abundante sangrado, transfusiones y utilización frecuente de fármacos vasoactivos que ejercen un efecto nocivo sobre el riñón. Sin inducción, el tacrolimus (TAC) debe introducirse dentro de las primeras 12 horas, con el paciente aún inestable. A esto se añade la dificultad de dosificación, compleja en los primeros días, ya que se comienza con una dosis ajustada al peso pero con una alta variabilidad inter e intraindividual. El daño renal agudo se produce fundamentalmente porque los inhibidores de la calcineurina producen una vasoconstricción tanto de la arteriola aferente como de la eferente, reduciendo como consecuencia la tasa de filtrado glomerular (FG), provocando una mayor morbilidad con prolongación de la estancia en la Unidad de Vigilancia Intensiva (UVI) y requerimientos de hemofiltro o diálisis. La forma crónica de nefrotoxicidad se caracteriza por el desarrollo de daño estructural que es irreversible y que podría conducir a una enfermedad renal terminal1. Por todo ello, se han diseñado diferentes estrategias para intentar reducirla. Un ejemplo es el empleo de anticuerpos interleucina -2 (IL-2R) como inmunosupresores en el periodo de inducción, debido a que no precisa monitorización de niveles séricos y se considera efectivo y seguro según estudios prospectivos o retrospectivos y ensayos aleatorizados, además de ser poco inmunogénico2,3. En cualquier caso, debe utilizarse siempre en combinación con inhibidores de la calcineurina para evitar el rechazo agudo4,5.
Basiliximab es un anticuerpo monoclonal quimérico que se une específicamente y con gran afinidad al antígeno CD25 de los linfocitos-T activados que expresan el receptor de la IL-2R, de gran afinidad. Esto impide la unión de la IL-2 al receptor, que es una señal crítica para la proliferación de las células-T en la respuesta inmune celular implicada en el rechazo de órganos2. Es la única alternativa disponible con el mecanismo de acción descrito, aunque en España solo tiene indicación en prevención del rechazo agudo en trasplante renal, por lo que se protocolizó su uso según el Real Decreto 1015/2009 de Medicamentos en situaciones especiales.
La tasa de infecciones (bacterianas, víricas y fúngicas) es similar entre los pacientes que reciben basiliximab o daclizumab y placebo, incluidas las infecciones por citomegalovirus. Tampoco se han observado diferencias en el número de neoplasias de novo postrasplante al año del tratamiento6,7. Su principal ventaja es que no afectan a la función renal ni a la médula ósea y, por tanto, pueden utilizarse en insuficiencia renal, así como en anemia, leucopenia o plaquetopenia. Como factores negativos, cabe destacar que no se conoce su influencia en la recidiva del virus de la hepatitis C, ya que se ha descrito una mala evolución de la recidiva del virus de la hepatitis C en pacientes tratados con daclizumab y micofenolato de mofetilo, sin confirmación en estudios posteriores. Aunque hoy en día, con los nuevos antivirales para el tratamiento de la hepatitis C y su alta tasa de curación parece que este aspecto podría perder relevancia8,9.
El desarrollo de insuficiencia renal postrasplante hepático inmediato es mayor si el paciente presenta insuficiencia renal previa, ascitis refractaria, desnutrición, un índice pronóstico desfavorable y es donante subóptimo, pero muchos pacientes sin estos factores de riesgo desarrollan también esta complicación2.
La inducción con basiliximab permite retrasar la prescripción del inhibidor de la calcineurina a los 4-7 días postrasplante según el número de dosis de basiliximab administradas. Se deja un intervalo de tiempo libre de inhibidor de la calcineurina para que la función renal sea capaz de recuperarse tras las agresiones recibidas en el periodo perioperatorio, iniciándose habitualmente en planta ante estabilidad clínica. Los niveles terapéuticos objetivo de TAC en las primeras 6 semanas sin basiliximab deberían encontrarse entre 10-15 ng/ml, mientras que con basiliximab podrían situarse entre 8 -10 ng/ml, incidiendo en menor nefrotoxicidad a largo plazo y, según se ha visto recientemente, en una menor recurrencia tumoral en casos de hepatocarcinoma10,11.
Hasta 2013, el protocolo de inmunosupresión de nuestro centro se basaba en la administración de basiliximab sólo a pacientes con factores de riesgo: insuficiencia renal pretrasplante (FG menor de 60 ml/ min/1,73 m2 o creatinina sérica [Cr] mayor de 1,5 mg/dl), insuficiencia renal postrasplante inmediato (primeras 48 horas) definida como oliguria menor de 0,5 ml/kg/h, FG menor de 60 ml/min/1,73 m2 o elevación de Cr mayor de 1,5 mg/dl o en cirrosis con ascitis refractaria y desnutrición severa con presencia de insuficiencia renal pretrasplante. En los pacientes que presentaban los factores de riesgo descritos, la dosis a administrar era de dos perfusiones de 20 mg el día del trasplante y 4 días postrasplante. La segunda dosis se podía no administrar si el paciente en el cuarto día mantenía la función renal estable (FG mayor de 60 ml/ min/1,73 m2 o Cr menor de 1,2 mg/dl y diuresis mayor de 1 ml/kg/h).
Según el actual protocolo de inmunosupresión con administración universal del basiliximab vigente desde 2014, todos los pacientes recibirían una primera dosis de 20 mg el día del trasplante y una segunda dosis de 20 mg el cuarto día postrasplante, que se individualiza según las características basales del paciente y su evolución clínica. La introducción del anticalcineurínico se indica entre el quinto y el séptimo día en los que hayan recibido las dos dosis y el tercero o cuarto día si sólo han recibido una dosis.
Con este cambio de estrategia, se esperaba una reducción del tiempo de hospitalización en la UVI y una menor morbilidad de los pacientes tras el trasplante. Nuestra hipótesis es que el cambio de protocolo no ha tenido los resultados esperados en cuanto a disminución de estancias y mejor evolución de la función renal, por lo que el objetivo de este estudio es evaluar el impacto clínico y económico tras el cambio de protocolo de uso de basiliximab en trasplante ortohepático.
Métodos
Estudio retrospectivo observacional comparativo de dos protocolos que incluye a todos los pacientes adultos trasplantados de hígado en un hospital público entre el 1 de enero de 2013 y el 15 de febrero de 2015 con seguimiento durante los primeros 12 meses postrasplante. El proyecto ha sido clasificado por la Agencia Española del Medicamento como estudio postautorización otros diseños (EPA-OD) y aprobado por un Comité de Ética de la Investigación.
El estudio se desarrolla con dos tipos de pacientes, los trasplantados de hígado durante 2013 siguiendo el protocolo vigente hasta esa fecha y los trasplantados en 2014-2015 siguiendo el protocolo adoptado en 2014. En ambos casos, la terapia inmunosupresora incluyó la introducción de micofenolato de mofetilo el día 1 postrasplante junto a corticoides.
El cuaderno de registro de datos incluyó edad, sexo, año de trasplante, dosis administradas de basiliximab, días para inicio de tratamiento con TAC, días de estancia en UVI, días de estancia del episodio, creatinina y función renal previa al trasplante, a la salida de la UVI, al alta del hospital y al año del trasplante, mortalidad en el postoperatorio antes de recibir el alta, a los tres meses y al año, presencia de diabetes y ascitis refractaria previa al trasplante, hipertensión y diabetes como complicaciones postrasplante y la escala Model for End-stage Liver Disease (MELD)12.
Se definió como presencia de hipertensión postrasplante, la necesidad o cambio de tratamiento antihipertensivo con respecto al tratamiento previo al trasplante, y como diabetes postrasplante la necesidad de insulina o cambio de pauta de tratamiento antidiabético respecto al tratamiento domiciliario previo.
Se consideró disfunción renal cuando el FG, calculado según la fórmula MDRD4, fue menor de 60 ml/min/1,73 m2.
Los datos antropométricos, consumo y coste de viales de basiliximab, días de inicio para el tratamiento con TAC, estancia en UVI y del episodio, se obtuvieron del programa del Servicio de Farmacia Farmatools®.
Los datos analíticos y clínicos, complicaciones postrasplante, la escala MELD se obtuvieron del programa de Historia Clínica Electrónica Selene®.
Los costes por estancia en UVI y en la unidad de hospitalización son los precios públicos del Servicio Autonómico de Salud.
La muestra de este estudio ha estado limitada a la cantidad de trasplantes realizados durante los periodos comparados. Los 34 pacientes del protocolo anterior y los 49 del nuevo permiten detectar diferencias relevante de al menos el 35% y diferencias de medias o medianas de al menos 18 unidades con una potencia del 80% en pruebas bilaterales de hipótesis a un nivel de significación p ≤ 0,05.
Las características de la muestra se describen resumiendo las variables nominales con la frecuencia relativa de sus categorías componentes, las de escala que no siguen una distribución normal con mediana (rango) y las de escala con distribución normal con media (DE). La normalidad se prueba mediante histogramas y prueba de Kolmogorov-Smirnov. Acorde con estas características de las variables sus comparaciones entre los dos protocolos se realzan con la prueba chi2 de Pearson o Exacta de Fisher U de Mann-Whitney o t de Student, respectivamente. Todas estas pruebas son bilaterales a un nivel de significación p ≤ 0,05 y los cálculos pertinentes se realizan con ayuda del paquete estadístico SPSS de IBM Co® 21.0 en entorno operativo Windows XP Professional.
Resultados
El número total de pacientes incluidos en el estudio fue de 83, incluyéndose 34 pacientes según protocolo 1 y 49 pacientes según protocolo 2. En la Tabla 1 se muestran las características basales de ambos grupos, de manera que no se encontraron diferencias estadísticamente significativas en ninguna de las características evaluadas.
Tabla 1. Características de la muestra de pacientes del estudio Impacto clínico-económico del cambio de pauta de empleo de basiliximab en trasplante hepático
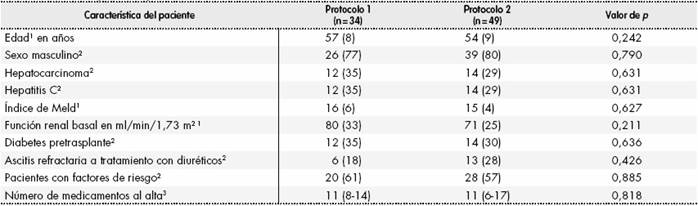
Protocolo 1: Administración de basiliximab sólo en pacientes con factores de riesgo. Protocolo 2: Administración de primera dosis de basiliximab a todos los pacientes. 1Media (DT) comparada con la prueba t de Student para muestras independientes. 2Frecuencia absoluta (frecuencia relativa) comparada con la prueba chi2 de Pearson. 3Mediana (rango) comparados con la prueba U de Mann-Whitney.
En la Tabla 2 se describen las características sobre las administraciones de basiliximab e inicio de TAC con ambos protocolos. En el grupo de pacientes que recibieron basiliximab según protocolo 2, se perdieron 2 pacientes por un exitus prematuro antes de que se pudiera producir una segunda administración de basiliximab. La mayoría de los pacientes incluidos en el período de estudio 2 recibieron basiliximab (93,6% versus 41%). Cabe destacar que con el protocolo 1 el porcentaje de pacientes que recibieron dos dosis fue superior (78,6% versus 43,2%). La mediana de días para la introducción de TAC fue de 4 para el protocolo 2 frente a 1 día para el protocolo 1. En la Tabla 2 se muestran de forma detallada las diferencias en el inicio de la administración de TAC según el protocolo y el número de dosis administradas de basiliximab. Se puede observar que cuando se utilizó el protocolo 1 se cumplió (91% versus 66%) lo establecido previamente en cuanto a la introducción de TAC, encontrándose que cuando se utilizaron 2-3 dosis de basiliximab el 17% de los pacientes iniciaron TAC antes de lo previsto. Sin embargo, cuando se empleó el protocolo 2, el cumplimiento del protocolo cuando se administraron una y dos dosis de basiliximab fue del 61% y 67%, respectivamente. Destaca especialmente el 26% de los pacientes que recibieron una dosis de basiliximab y a los que se les introdujo el TAC antes del intervalo previsto de 3 a 4 días. Esta situación se observó en menor medida (14%) cuando se administraron dos dosis de basiliximab.
Tabla 2. Características sobre el empleo de basiliximab en los pacientes del estudio Impacto clínico-económico del cambio de pauta de empleo de basiliximab en trasplante hepático
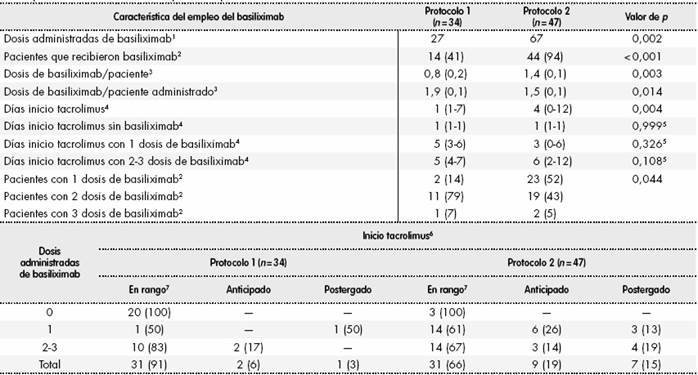
Protocolo 1: Administración de basiliximab sólo en pacientes con factores de riesgo. Protocolo 2: Administración de primera dosis de basiliximab a todos los pacientes. 1Frecuencias absolutas comparadas con la prueba chi2 de Pearson. 2Frecuencia absoluta (frecuencia relativa), comparada con la prueba chi2 de Pearson. 3Media (DT) comparada con la prueba t-Student para muestras independientes. 4Mediana (rango) comparada con la prueba U de Mann-Whitney. 5La no significación se produce por el solapamiento de los intervalos de tiempo. 6Número de pacientes (% respecto al total de dosis de basiliximab administradas). 7En rango: día 1 si 0 dosis de basiliximab, días 3-4 si 1 dosis de basiliximab, días 5-7 si 2 dosis de basiliximab.
Los resultados en salud se muestran en la Tabla 3, no encontrándose diferencias estadísticamente significativas en ninguna de las variables evaluadas: estancia en la UVI y del episodio de trasplante, hipertensión y diabetes postrasplante, función renal con FG < 60 ml/min, mortalidad en el postrasplante inmediato (antes del alta hospitalaria), a los tres meses y al año.
Tabla 3. Variables de resultados en salud y clínicas en los pacientes del estudio Impacto clínico-económico del cambio de pauta de empleo de basiliximab en trasplante hepático
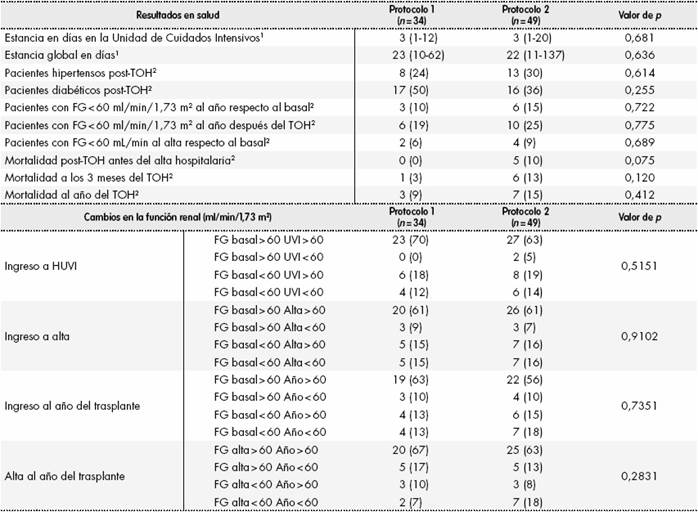
Protocolo 1: Administración de basiliximab sólo en pacientes con factores de riesgo. Protocolo 2: Administración de primera dosis de basiliximab a todos los pacientes. TOH: trasplante ortohepático.1Mediana (rango) comparada con la prueba U de Mann-Whitney. 2Frecuencia absoluta (frecuencia relativa) comparada con la prueba chi2 de Pearson.
En la Tabla 3 se muestra también la evolución de la función renal teniendo en cuenta diferentes cambios: valor basal con respecto al alta de la UVI, valor basal con respecto el alta hospitalaria, valor basal con respecto al año del trasplante y el FG que presentaban en el momento del alta hospitalaria con respecto al que presentaron tras un año del trasplante. En todos los casos no se encontraron diferencias estadísticamente significativas.
En la Tabla 4 se muestran los resultados económicos en cuanto a costes directos relacionados con el mayor consumo de basiliximab con el cambio de pauta. Como podemos observar, el porcentaje de pacientes sin factores de riesgo que recibieron al menos una dosis de basiliximab fue elevado (90% versus 0%). El coste asumido por la administración de basiliximab con el protocolo 2 en pacientes sin factores de riesgo fue de 1.464 € por paciente. Teniendo en cuenta que un 43% de los pacientes incluidos en el protocolo 2 no presentaron factores de riesgo previos a trasplante, y asumiendo unos 34 trasplantes de hígado realizados en adultos en nuestro centro en un año, la diferencia de costes incremental se estima en 21.400 €.
Tabla 4. Resultados económicos del estudio Impacto clínico-económico del cambio de pauta de empleo de basiliximab en trasplante hepático

Protocolo 1: Administración de basiliximab sólo en pacientes con factores de riesgo. Protocolo 2: Administración de primera dosis de basiliximab a todos los pacientes Factores de riesgo: Insuficiencia renal, diabetes o ascitis refractaria previa al trasplante. 1Frecuencia absoluta. 2Frecuencia absoluta (frecuencia relativa).
Discusión
Uno de los estudios que mostró beneficio con el protocolo de administración universal de basiliximab fue el estudio ReSpECT3, un estudio prospectivo, multicéntrico, aleatorizado y abierto que excluyó a los pacientes con insuficiencia renal previa al trasplante y que mostró una mejoría significativa de la función renal de unos 10 ml/min a las 52 semanas en el grupo de inducción, aunque esta diferencia en pacientes con FG mayor de 60 ml/ min podría carecer de relevancia clínica, mientras que en nuestro estudio tuvimos en cuenta el valor basal y al alta de la función renal, diferenciando aquellos pacientes con FG mayor o menor de 60 ml/min, de manera que no se encontraron diferencias clínicamente relevantes. El estudio de J. Cai demuestra que la inducción mejora el pronóstico del injerto y del paciente en el trasplante renal, hepático (43.407 pacientes) y de pulmón de forma muy significativa a 3 meses, 1 año y 5 años13. En el caso del trasplante hepático, la supervivencia mejoró aproximadamente un 3-4%, un dato difícil de encontrar en nuestra muestra debido posiblemente al tamaño muestral, así como las diferencias en el período de seguimiento. Asimismo, en el estudio retrospectivo del registro de receptores de trasplante entre 2002-2009 con y sin hepatocarcinoma, en el que evaluaron los distintos regímenes inmunosupresores y que incluyó un total de 14.658 pacientes, se analizó la supervivencia global a largo plazo (3 y 5 años), aunque fue significativa con la inducción anti- CD25 sólo en el grupo de hepatocarcinoma12. Otros estudios demostraron una incidencia menor de rechazo probado por biopsia, un dato que no se recogió en nuestra población de estudio debido a la dificultad para acceder a los resultados de las biopsias14. Una revisión sistemática y metaanálisis de 18 estudios controlados, sólo 13 aleatorizados, demostraron con la inducción una incidencia significativamente menor de rechazo agudo, incluido el corticorresistente; tendencia a mejor supervivencia no significativa, menor incidencia de diabetes y menor riesgo de disfunción renal, aunque sin encontrar diferencias en la supervivencia del injerto y del paciente, de manera que en datos de supervivencia coinciden con nuestros resultados, aunque difieren en cuanto a que no encontramos diferencias en complicaciones postrasplante como la diabetes o el deterioro de la función renal15. El estudio de Chih -Che Lin y cols. que incluyó a 45 pacientes divididos en dos grupos con el objetivo de determinar si la función renal mejoraba en los pacientes que recibieron la terapia de inducción con basiliximab, se encontraron diferencias estadísticamente significativas a los 3 meses postrasplante, al contrario que en nuestro estudio, que utilizamos un seguimiento a 52 semanas postrasplante10.
Otros estudios, coincidiendo con nuestros resultados, no observaron diferencias estadísticamente significativas en la reducción de la incidencia de episodios de rechazo agudo y en mejorar la función del injerto, aunque midieron la supervivencia a largo plazo (36 meses)16.
Las recomendaciones realizadas dentro de la V Reunión Consenso de la Sociedad Española de Trasplante Hepático, cuyas conclusiones se publicaron a finales de 2015, vienen a coincidir con nuestros resultados, de manera que sólo recomiendan la inducción en pacientes con insuficiencia renal previa al trasplante o en pacientes con alto riesgo de insuficiencia renal postoperatoria, sin encontrarse consenso en su utilización de forma universal17. Por el contrario, la Guía Europea de trasplante hepático publicada a principios de 2016 recomienda, con un grado de recomendación I, el empleo de anticuerpos IL-2R y TAC a dosis más bajas e inicio diferido junto a micofenolato de mofetilo y esteroides, ya que es seguro y mejora significativamente la función renal, aunque se expone cierta preocupación por el alto coste de los IL-2R, un aspecto importante que tuvimos en cuenta en nuestro estudio18. La Guía de Práctica Clínica Americana en adultos sometidos a trasplante ortohepático no describe el uso de estos agentes19.
En relación con los estudios farmacoeconómicos publicados, la mayoría se han realizado con el uso de basiliximab en inducción en pacientes trasplantados de riñón, dos de ellos utilizando biterapia como grupo control (corticoides + ciclosporina), aunque parecen concluir que el empleo de basiliximab en inducción en trasplante renal es coste-efectiva al reducirse las estancias y la menor tasa de rechazo agudo20-22. Ryutaro Hirose, en un editorial publicado en 2002, expone cómo el coste supone un obstáculo para el uso rutinario de los IL-2R en trasplante hepático, pudiendo no estar justificados los sobrecostes, salvo que se demuestre que se reducen significativamente las tasas de rechazo y los reingresos, aspectos que no se han evaluado en nuestro estudio23. Se realizó una búsqueda en Pubmed con las palabras clave “pharmacoeconomic”, “liver transplantation” y “basiliximab”, encontrándose un solo estudio en población pediátrica de 49 pacientes que comparaba un grupo que recibió TAC + basiliximab, libre de corticoides frente a terapia estándar con corticoides + TAC, y concluyó que los costes médicos fueron similares en ambos grupos, aunque ni la población de estudio ni la terapia inmunosupresora empleada serían extrapolables24.
Nuestro estudio presenta algunas limitaciones. Una de ellas podría derivarse del tamaño de muestra, ya que hemos seleccionado pacientes trasplantados desde 2013, puesto que la recogida de datos con anterioridad no fue posible. Otro posible sesgo es que no se ha evaluado la presentación de rechazo agudo resistente a esteroides, un aspecto que podría ser relevante, así como el tiempo utilizado para alcanzar niveles terapéuticos de TAC. No se incluyó el coste de adquisición de TAC por considerarlo irrelevante y encontrarse gran variabilidad de dosificación. El periodo de seguimiento ha sido de un año tras el trasplante ortohepático, pero sería interesante ver la evolución a largo plazo de la función renal, tal y como se ha evaluado en otras series.
En nuestra muestra, el hecho de no haberse objetivado una mejoría en la función renal podría estar relacionado con el inicio de TAC antes del tiempo inicialmente protocolizado, por lo que se planteó como un punto crítico. Estos datos se presentaron al equipo de trasplante hepático, concluyendo que era necesario aumentar la adherencia al protocolo en lo que respecta al inicio de TAC.
Teniendo en cuenta las limitaciones y sesgos, consideramos que los resultados obtenidos no confirman los objetivos esperados con el cambio de protocolo, aunque se han asumido mayores costes. Tal y como se desprende de nuestro estudio y de las nuevas guías consenso, basiliximab desempeñaría un importante papel en los pacientes con valores altos de creatinina o con riesgo de presentar insuficiencia renal.
La evidencia publicada sobre el empleo de basiliximab en trasplante ortohepático es limitada en cuanto a su calidad, existiendo mucha heterogeneidad en las poblaciones seleccionadas, de manera que se necesitarían ensayos clínicos aleatorizados, ciegos, preferentemente independientes, que ayuden en la toma de decisiones clínicas.
Aportación a la literatura científica
La relevancia de nuestro estudio viene determinada por la comparación entre dos protocolos diferentes de uso de basiliximab en trasplante hepático en población adulta, destinado a objetivar si es coste-eficiente el empleo de basiliximab en todos los pacientes o sólo en aquellos con factores de riesgo, mientras que otros estudios publicados comparan un régimen con o sin basiliximab.
Bibliography
Serrano Aulloa MT, Parra Moncasi E, Lorente Perez S. Inmunosupresion en el trasplante hepatico: pautas renoprotectoras. Gastroenterol Hepatol. 2011;34(6):422-7. DOI: 10.1016/j.gastrohep.2010.12.009 [ Links ]
Ramirez CB, Bozdin A, Frank A, Maley W, Doria C. Optimizing use of Basiliximab in liver transplantation. Transplant Research and Risk Management. 2010;2:1-10. [ Links ]
Neuhaus P, Clavien PA, Kittur D, Salizzoni M, Rimola A, Abeywickrama K, et al. Improved Treatment Response with Basiliximab Immunoprophylaxis After Liver Transplantation: Results From a Double-Blind Randomized Placebo- Controlled Trial. Liver Transpl. 2002;8:132-42. [ Links ]
Neuberger JM, Mamelok RD, Neuhaus P, Pirenne J, Samuel D, Isoniemi H, et al. Delayed introduction of reduced- dose tacrolimus, and renal function in liver transplantation: the ‘ReSpECT’ study. Am J Transplant. 2009;9:327-36. [ Links ]
Toso C, Merani S, Bigam DL, Shapiro AM, Kneteman NM. Sirolimus-based immunosuppression is associated with increased survival after liver transplantation for hepatocellular carcinoma. Hepatology. 2010;51:1237-43. [ Links ]
Onrust SV, Wiseman LR. Basiliximab. Drugs. 1999;57:207-13. [ Links ]
Nashan B, Moore R, Amlot P, Schmidt AG, Abeywickrama K, Soulillou JP. Randomised trial of Basiliximab vs placebo for control of acute cellular rejection in renal alllograft recipients. Lancet. 1997;350:1193-8. [ Links ]
Nelson DR, Soldevila-Pico C, Reed A, Abdelmalek MF, Hemming AW, Van der Werf J, et al. Anti-interleukin-2 receptor therapy in combination with mycophenolate mofetil is associated with more severe hepatitis C recurrence after liver transplantation. Liver Transpl. 2001;7:1064-70. [ Links ]
Sellers MT, Mcguire BM, Haustein SV, Bynon JS, Hunt SL, Eckhoff DE. Two-dose daclizumab induction therapy in 209 liver transplants: a single-center analysis. Transplantation. 2004;78:1212-7. [ Links ]
Chih-Che L, Feng-Rong Ch, Chih-Hsiung L, Chih-Chi W, Yaw-Sen Ch, Yueh-Wei L, et al. The Renal-Sparing Efficacy of Basiliximab in Adult Living Donor Liver Transplantation. Liver Transpl. 2005;11:1258-64. [ Links ]
Varo E, Lopez A, Castroagudin JF, Delgado M, Conde R, Ferrer E, et al. Alternative immunosuppression for acute renal failure in liver transplantation: role of ultra-low dose of tacrolimus and Basiliximab. Transplant Proc. 2002;34:1533-4. [ Links ]
Vargas V, Ortiz M. Modelos pronosticos en la cirrosis hepatica. El modelo MELD. Editorial. Gastroenterol Hepatol. 2003;26(4):257-9. [ Links ]
Cai J, Terasaki PI. Induction immunosuppression improves long-term graft and patient outcome in organ transplantation: an analysis of United Network for Organ Sharing registry data. Transplantation. 2010;90:1511-5. [ Links ]
Otero A, Varo E, de Urbina JO, Martin-Vivaldi R, Cuervas-Mons V, Gonzalez-Pinto I, et al. A Prospective Randomized Open Study in Liver Transplant Recipients: Daclizumab, Mycophenolate Mofetil, and Tacrolimus Versus Tacrolimus and Steroids. Liver Trans. 2009;15:1542-52. [ Links ]
Goralczyk AD, Hauke N, Bari N, Tsui TY, Lorf T, Obed A. Interleukin 2 receptor antagonists for liver transplant recipients: a systematic review and metaanalysis of controlled studies. Hepatology. 2011;54:541-54. [ Links ]
Schmeding M, Sauer IM, Kiessling A, Pratschke J, Neuhaus R, Neuhaus P, et al. Influence of Basiliximab induction therapy on long term outcome after liver transplantation, a prospectively randomised trial. Ann Transplant. 2007;12(3):15-21. [ Links ]
Pardo F, Pons JA, Briceno J. V Reunion de Consenso de la Sociedad Espanola de Trasplante Hepatico sobre receptores de riesgo elevado, escenarios actuales de inmunosupresion y manejo del hepatocarcinoma en espera de trasplante. Cir Esp. 2015;93(10):619-37. [ Links ]
European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Liver transplantation. J Hepatol. 2016;64:433-85. DOI: https://doi.org/10.1016/j.jhep.2015.10.006 [ Links ]
Lucey MR, Terrault N, Ojo L, Hay JE, Neuberger J, Blumberg E, et al. Long-Term Management of the Successful Adult Liver Transplant: 2012 Practice Guideline by AASLD and the American Society of Transplantation. Liver Transpl. 2013;19:3-26. [ Links ]
Lorber MI, Fastenau J, Wilson D, DiCesare J, Hall ML. A prospective economic evaluation of Basiliximab (Simulect) therapy following renal transplantation. Clin Transplant. 2000;14:479-85. [ Links ]
Keown PA, Balshaw R, Krueger H, Baladi JF. Economic analysis of Basiliximab in renal transplantation. Transplantation. 2001;71:1573-9. [ Links ]
Walters SJ, Whitfield M, Akerhurst RL, Chilcott JB. Economic implications of the use of Basiliximab in addition to triple immunosuppressive therapy in renal allograft recipients. Pharmacoeconomics. 2003;21:129-38. [ Links ]
Hirose R. Pros and Cons of Using Interleukin-2 Receptor Antibodies in Liver Transplant Recipients. Liver Transpl. 2002;8(2):143-5. DOI: 10.1053/jlts.2002.31384 [ Links ]
Gras JM, Gerkens S, Beguin C, Janssen M, Smets F, Otte JB, et al. Steroidfree, tacrolimus-basiliximab immunosuppression in pediatric liver transplantation: clinical and pharmacoeconomic study in 50 children. Liver Transpl. 2008;14(4):469-77. DOI: 10.1002/lt.21397 [ Links ]
Recibido: 09 de Abril de 2018; Aprobado: 07 de Septiembre de 2018











 texto en
texto en 


