Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Farmacia Hospitalaria
versión On-line ISSN 2171-8695versión impresa ISSN 1130-6343
Farm Hosp. vol.43 no.6 Toledo nov./dic. 2019 Epub 29-Jun-2020
https://dx.doi.org/10.7399/fh.11221
Originales
Evaluación económica y análisis de impacto presupuestario de mepolizumab en asma eosinofílica refractaria grave
1Escuela Andaluza de Salud Pública, Granada. España. Centro de Investigación Biomédica en Red en Epidemiologia y Salud Pública (CIBERESP), Madrid. España. Instituto de Investigación Biosanitaria IBS, Granada. España. Hospitales Universitarios de Granada/Universidad de Granada, Granada. España.
2Servicio de Farmacia, Hospital Universitario de Puerto Real, Puerto Real. España.
3Departamento de Farmacología, Facultad de Farmacia, Universidad de Sevilla, Sevilla. España.
Objetivo
Mepolizumab está indicado como tratamiento adicional del asma eosinofílica refractaria grave. Las diferencias observadas en subgrupos poblacionales según recuento eosinofílico plasmático, existencia de pacientes con altos niveles de inmunoglobulina E candidatos a omalizumab y mepolizumab, e impacto económico de mepolizumab obligan a realizar estudios económicos para tomar decisiones clínicas eficientes. El objetivo fue realizar un análisis de coste/eficacia e impacto presupuestario de mepolizumab.
Método
Se realizó la comparación de costes e impacto presupuestario del uso de mepolizumab desde la perspectiva del Sistema Nacional de Salud. Las alternativas valoradas fueron corticosteroides sistémicos inhalados + agonista β2 de larga duración y/o corticosteroides sistémicos orales en pacientes con asma alérgica grave no mediada por inmunoglobulina E, y este tratamiento junto a omalizumab en pacientes con asma eosinofílica alérgica mediada por inmunoglobulina E. La eficacia se evaluó mediante exacerbaciones clínicamente relevantes evitadas. Se valoraron los costes directos asociados a exacerbación.
Resultados
El coste incremental medio de mepolizumab respecto a omalizumab es de 797 euros por paciente y año. Considerando precio alternativo con descuento de omalizumab, incluir mepolizumab para pacientes con asma eosinofílica alérgica y mediada por inmunoglobulina E supondría incrementar el gasto público de 2,3 a 4,6 millones de euros. Teniendo en cuenta el precio notificado de omalizumab, la introducción gradual de mepolizumab en el Sistema Nacional de Salud supondría ahorrar 3,6 millones de euros en tres años. Para pacientes con asma grave no mediada por inmunoglobulina E, el coste/exacerbación evitada al añadir mepolizumab es de 15.085 euros, con un impacto presupuestario en tres años de 578,4 millones de euros, asumiendo una penetración progresiva de mepolizumab en el mercado. En los pacientes con ≥ 500 eosinófilos/µl, este coste disminuye a 7.767 euros por exacerbación evitada, con un impacto presupuestario de 183,2 millones de euros en tres años con penetración progresiva de mepolizumab.
Conclusiones
La comparación de costes entre mepolizumab y omalizumab en pacientes con asma eosinofílica mediada por inmunoglobulina E señala como razonable utilizar el fármaco de menor coste, promoviendo competencia de precios. Asimismo, priorizar su uso en pacientes con asma eosinofílica refractaria grave no mediada por inmunoglobulina E y niveles plasmáticos ≥ 500 eosinófilos/µl permitiría mejorar la eficiencia y disminuir el impacto presupuestario.
PALABRAS CLAVE: Costes; Evaluación económica; Impacto presupuestario; Mepolizumab; Omalizumab
Introducción
Se estima que el asma afecta aproximadamente al 4,9% de los adultos1. En nuestro entorno, la prevalencia de pacientes con asma grave no controlada o refractaria al tratamiento con corticosteroides y agonistas β2 de larga duración (LABA) es aproximadamente el 3,9% de los asmáticos2. Dentro de este grupo, aproximadamente el 25% padece asma eosinofílica, caracterizada por un inicio tardío, presencia de eosinófilos en biopsias bronquiales y suele asociarse con pólipos nasales, rinosinusitis e infecciones respiratorias3,4.
Omalizumab es un anticuerpo monoclonal indicado en el asma alérgica grave no controlada autorizado en España en 20065. La posología de omalizumab es variable, pudiendo oscilar desde un mínimo de 75 mg cada 4 semanas hasta un máximo de 600 mg cada 2 semanas5. En el año 2015 se comercializa mepolizumab. Este anticuerpo monoclonal está indicado como tratamiento adicional del asma eosinofílica refractaria grave en pacientes adultos6. Mepolizumab actúa uniéndose a la interleucina 5 e impidiendo su interacción con la superficie de los eosinófilos. Esto provoca una reducción en la producción y supervivencia de los mismos. La dosis recomendada es de 100 mg cada 4 semanas. Los estudios que evalúan la dosis de mepolizumab y la respuesta eosinofílica demuestran farmacodinámica similar entre la dosis de 100 mg y 75 mg7.
En los ensayos clínicos pivotales para la autorización de mepolizumab se midió el efecto sobre la frecuencia de exacerbaciones clínicamente relevantes como variable principal8,9. Una exacerbación clínicamente relevante es aquel episodio agudo asmático que requiere del uso de corticosteroides sistémicos durante al menos tres días y/u hospitalización y/o visita a urgencias, o corticosteroides sistémicos al doble de la dosis de mantenimiento durante al menos tres días en pacientes tratados con corticosteroides orales en mantenimiento8,9. Mepolizumab ha demostrado ser eficaz en la reducción de exacerbaciones y de la dosis diaria de corticosteroides sistémicos orales (CSO) en pacientes con asma eosinofílica grave no adecuadamente controlados con dosis elevadas de corticosteroides sistémicos inhalados (CSI) + LABA y/o CSO (tratamiento habitual).
No obstante, se asocia una mayor frecuencia de ataques de asma con un recuento elevado de eosinófilos (> 300-400 células/μ)10,11. En los análisis por subgrupos de los estudios pivotales también se observa que el beneficio relativo es mayor en pacientes con niveles más elevados de eosinófilos en sangre8,9. El análisis por subgrupos está preespecificado y presenta interacción estadística; la diferencia es consistente en los estudios7,12 y existe plausibilidad biológica, pues un inhibidor de la población de eosinófilos podría ejercer mayor acción cuanto mayor sea la contribución de la eosinofilia al proceso asmático.
Cabe destacar que aproximadamente el 30% de los pacientes diagnosticados de asma eosinofílica presentan signos y síntomas compatibles con el fenotipo de asma alérgica persistente mediada por inmunoglobulina E (IgE)13, cumpliendo criterios de tratamiento con omalizumab. Sin embargo, no existe evidencia para decantarse por un tratamiento u otro en esta subpoblación12.
Teniendo en cuenta las diferencias de los subgrupos -según recuento de eosinófilos- en el asma eosinofílica refractaria grave, la existencia de pacientes candidatos a omalizumab o mepolizumab, y el impacto económico que supone el uso de mepolizumab, parece importante realizar un estudio de evaluación económica e impacto presupuestario que ayude a tomar decisiones clínicas eficientes. En el momento de realizar este trabajo, otros fármacos de mecanismo de acción similar a mepolizumab -reslizumab y benralizumab- estaban pendientes de financiación y precio en España14,15. No se han comparado con mepolizumab y resulta complejo establecer diferencias entre ellos. La comparación económica de estos tratamientos del mismo grupo no es materia del presente estudio.
El objetivo del trabajo es realizar un análisis de coste/eficacia e impacto presupuestario (AIP) de la introducción de mepolizumab como tratamiento del asma eosinofílica refractaria grave mediada y no mediada por niveles elevados de IgE en pacientes adultos no adecuadamente controlados con dosis elevadas de CSI + LABA y/o CSO en España.
Métodos
Se desarrolló un análisis de coste eficacia y AIP a nivel nacional desde la perspectiva del Sistema Nacional de Salud (SNS). Sólo se cuantificaron los costes directos, en euros del año 2018. El AIP se realizó para un período de tres años (2018-2020). Los análisis se realizaron considerando las últimas guías de evaluación económica y AIP16,17.
Población de estudio
La población del estudio incluyó a pacientes mayores de 12 años con asma refractaria grave. Para el AIP se emplearon estimaciones de población adulta asmática y prevalencia del asma grave refractaria en España1,2. Posteriormente, se calculó el porcentaje de pacientes con asma grave refractaria al tratamiento que fueron diagnosticados de asma eosinofílica y la población con asma mediada por niveles elevados de IgE candidata a tratamiento con omalizumab, empleando datos del Instituto Nacional de Estadística18. Además, se realizó un AIP por subgrupos de población según recuento plasmático de eosinófilos (Tabla 1).
Tabla 1. Valores de prevalencia, eficacia y costes utilizados en el análisis de impacto presupuestario

CSO: corticosteroides sistémicos orales; EMA: Agencia Europea del Medicamento; IPT: Informe de Posicionamiento Terapéutico; MEPO: mepolizumab.
aLos cálculos se han realizado para la población residente en España. Estas proyecciones se calcularon en octubre de 2014 tomando como referencia la población provisional a 1 de enero de 2014 (última cifra de población disponible en ese momento).
bValores mínimo y máximos según el intervalo de confianza del 95% de los estudios.
cValores mínimos y máximos asumiendo una variación del 20% con respecto a la media.
dEl coste medio corresponde a una estancia media de 9 días, los valores mínimo y máximo se han calculado asumiendo 5 y 12 días de ingreso, respectivamente.
Alternativas terapéuticas evaluadas
El análisis de coste/eficacia y AIP del uso de mepolizumab se ha realizado mediante dos análisis distintos según la población estudiada.
En el análisis 1, la población analizada se diagnosticó de asma eosinofílica alérgica y mediada por IgE. En estos pacientes se comparó la asociación de dosis elevadas de CSI + LABA y/o CSO junto a mepolizumab frente a la misma medicación asociada a omalizumab.
En el análisis 2, la población estudiada padecía asma refractaria grave no mediada por IgE, no considerándose otras alternativas frente a mepolizumab, por lo que se evaluó el uso de dosis elevadas de CSI + LABA y/o CSO junto a mepolizumab frente a dosis elevadas de CSI + LABA y/o CSO.
Este segundo análisis no incluye el 30% de pacientes con asma eosinofílica (tratados con omalizumab).
La posología evaluada de mepolizumab es de 100 mg cada 4 semanas7. Omalizumab se dosifica en función del peso corporal y niveles de IgE basales. La dosis oscila desde 75 mg cada 4 semanas hasta 600 mg cada 2 semanas5. Para el análisis de costes se utilizó un promedio de estos valores (Tabla 1).
Medida de los resultados en salud
La eficacia de los tratamientos se obtuvo del Informe de Posicionamiento Terapéutico de mepolizumab12 y del Informe de evaluación de mepolizumab de la Agencia Europea del Medicamento7. Se estimaron las exacerbaciones clínicas, aquellas que requieren hospitalización o visitas a urgencias y las exacerbaciones clínicas relevantes por subgrupos de población según el recuento plasmático de eosinófilos (Tabla 1). Se evaluó la eficacia de los medicamentos mediante la reducción en la media de exacerbaciones anuales clínicamente relevantes por usar mepolizumab frente a su alternativa terapéutica. La realización de un estudio de minimización de costes exige evidencia de equivalencia clínica de los fármacos analizados. Se carece de evidencia clínica comparativa de calidad entre mepolizumab y omalizumab que demuestre equivalencia clínica o diferencia entre ambos tratamientos.
Por ello, no pudo realizarse un estudio de minimización de costes, pero se desarrolló un estudio de comparación de costes en el análisis 1.
Estimación de costes
Se incluyeron el coste de la medicación (mepolizumab y omalizumab), de una exacerbación clínica relevante, visita a urgencias y hospitalización a causa de la exacerbación asmática. Los tratamientos se valoraron mediante el precio de venta del laboratorio de los fármacos según el Catálogo de Especialidades Farmacéuticas del Consejo General de Colegios Oficiales de Farmacéuticos19. Para omalizumab, se recogió su precio notificado y precio alternativo según práctica clínica habitual con un hipotético descuento del 7,3%. En mepolizumab, el precio notificado y el alternativo coinciden (Tabla 1 y Tabla 2). El coste de una exacerbación clínicamente relevante que requiere hospitalización y/o asistencia en urgencias, y el coste de hospitalización -asumiendo una estancia media de nueve días- se extrajeron del estudio AsmaCost20, actualizándose a euros de 2018. El análisis incluye costes directos de fármacos y de asistencia en urgencias y hospitalización, por su impacto en la definición de exacerbación clínicamente relevante. El estudio no incluye costes derivados de administración hospitalaria de medicamentos.
Este trabajo evaluó el coste-incremental y coste del tratamiento en el AIP del análisis 1, y el coste por exacerbación evitada y coste del tratamiento de la población a estudio en el análisis 2.
Análisis de escenarios e incertidumbre
En el análisis 1 se desarrollaron varios escenarios de introducción gradual de mepolizumab en el mercado en sustitución de omalizumab (50%, 70% y 100%), y con distintos precios de omalizumab (precio notificado y precio alternativo). En el análisis 2 se realizaron análisis de sensibilidad para evaluar la incertidumbre en torno a los valores mínimos y máximos del intervalo de confianza 95%, de los riesgos relativos (RR) de las variables (exacerbación clínica relevante, hospitalización y asistencia a urgencias), así como de los costes de hospitalización y asistencia a urgencias (Tabla 1). Los análisis se realizaron con Microsoft Excel 2016®.
Resultados
La población estimada del estudio se representa en la Tabla 1.
Análisis 1. Población con asma eosinofílica alérgica y mediada por IgE
Se estimó un coste incremental medio de mepolizumab respecto a omalizumab (precio alternativo) de 797 euros por paciente y año, si bien esto depende de cada paciente y posología de omalizumab. En la Tabla 2 se muestran los datos del AIP según penetración en el mercado, precio notificado o alternativo y año para pacientes con asma eosinofílica mediada por IgE. Considerando el precio alternativo con descuento de omalizumab, el escenario de incluir mepolizumab para pacientes con asma eosinofílica alérgica y mediada por IgE supondría un incremento del gasto público de 2,3 a 4,6 millones de euros, según año y grado de penetración de mepolizumab en el mercado. El impacto presupuestario en tres años sería de un aumento de 10,3 millones de euros con penetración gradual en el mercado o 14 millones en un escenario de completa sustitución de omalizumab por mepolizumab. Considerando el precio notificado de omalizumab (mayor al alternativo), la introducción gradual de mepolizumab en el SNS supondría un ahorro de 3,6 millones de euros en tres años, mientras que la sustitución completa de omalizumab por mepolizumab reduciría el gasto público unos 5 millones de euros.
Análisis 2. Población con asma refractaria grave no mediada por IgE
La Tabla 3 muestra los datos de coste por exacerbación evitada aplicable a la población con asma refractaria grave eosinofílica no mediada por IgE, que constituye el 70% de la población susceptible de tratamiento y cuya alternativa terapéutica considerada ha sido CSI + LABA y/o CSO. El coste por exacerbación evitada al añadir mepolizumab es de 15.085 euros. Los datos por subgrupos de pacientes según su nivel plasmático de eosinófilos muestran que para el grupo de mayor afectación clínica basal y mayor eficacia relativa (pacientes con ≥ 500 eosinófilos/µl), el coste es de 7.767 euros por exacerbación evitada.
Tabla 3. Coste por exacerbación evitada en población con asma refractaria grave eosinofílica (aplicable a pacientes con asma
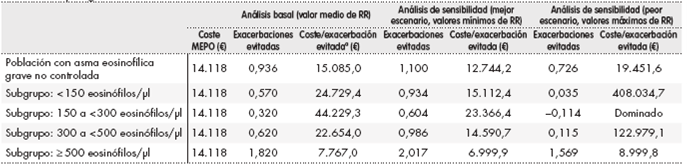
MEPO: mepolizumab; RR: riesgo relativo.
aMEPO + tratamiento habitual versus tratamiento habitual. Tratamiento habitual: corticosteroides sistémicos inhalados + agonista β2 de larga duración + corticosteroides
sistémicos orales.
El análisis de sensibilidad demuestra que el RR es una variable muy sensible a los resultados por subgrupos de pacientes. Al tomar valores máximos del RR, en subgrupos con < 500 eosinófilos/µl se obtienen costes por exacerbación evitada mayores de 100.000 euros adicionales respecto a la población general con asma eosinofílica no controlada. En contraposición, en un escenario de valores mínimos de RR para el subgrupo de pacientes de 300 a < 500 eosinófilos/µl, mepolizumab tendría un coste por exacerbación evitada de 14.591 euros.
La Tabla 4 proporciona los datos del AIP para población con asma refractaria eosinofílica no mediada por IgE y por subgrupos según niveles plasmáticos de eosinófilos. El impacto presupuestario anual de la población con asma eosinofílica no mediada por IgE alcanzaría los 189 millones de euros (568,1 millones en tres años). Si sumamos esta cantidad al resultado de AIP en tres años de pacientes con asma eosinofílica mediada por IgE (30% del global de pacientes con asma eosinofílica), asumiendo una introducción progresiva de mepolizumab en el mercado (10,3 millones de euros según la Tabla 2), obtenemos un AIP total para la población de 578,4 millones de euros. El AIP para población con asma eosinofílica no mediada por IgE desglosado por subgrupos según niveles plasmáticos de eosinófilos (Tabla 4) nos proporciona unas estimaciones de 57,5 millones de euros anuales en el subgrupo con recuento de eosinófilos ≥ 500 células/µl (173 millones en tres años). Si sumamos el resultado de AIP con introducción progresiva de mepolizumab en tres años de pacientes con asma eosinofílica mediada por IgE al AIP del uso de mepolizumab sólo en la población con asma eosinofílica no mediado por IgE con ≥ 500 eosinófilos/µl, el AIP para toda la población en tres años sería de 183,2 millones de euros.
Tabla 4. Análisis de impacto presupuestario de mepolizumab para población con asma eosinofílica grave no mediado por IgE
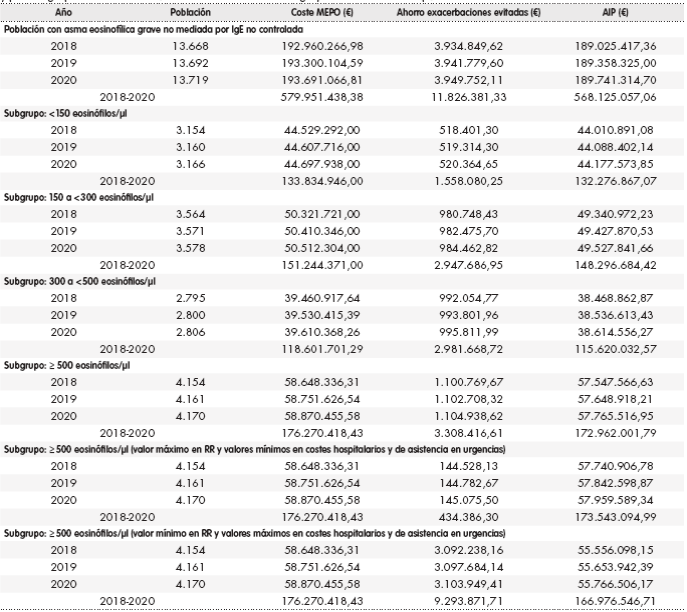
AIP: análisis de impacto presupuestario; MEPO: mepolizumab; RR: riesgo relativo.
En la Tabla 4 se muestra un análisis de sensibilidad del impacto presupuestario de mepolizumab para el subgrupo de pacientes con ≥ 500 eosinófilos/µl para ilustrar las variaciones en el AIP que podrían darse en el mejor y peor escenario de mepolizumab, al variar los costes de urgencias y hospitalización y RR de exacerbaciones clínicas relevantes. Se observa que el AIP en tres años en este subgrupo oscila entre 166,9 y 173,5 millones de euros.
Discusión
La aparición de fármacos de elevado impacto económico hace que sean necesarios estudios económicos que favorezcan la optimización de los recursos21. Esta evaluación económica compara dos alternativas terapéuticas en un grupo de pacientes diagnosticados de asma eosinofílica que presentan signos compatibles con el fenotipo de asma alérgica persistente mediada por IgE. El diseño del análisis económico desarrollado puede ayudar en la toma de decisiones clínicas para mejorar la eficiencia mediante competencia de precios.
El resultado en salud fue valorado mediante el número de exacerbaciones clínicamente relevantes evitadas por el uso de mepolizumab. La variable seleccionada es adecuada para guíar la toma de decisiones, ya que en otros estudios se evaluó la disminución de ingresos hospitalarios, visitas a urgencias o facultativo de Atención Primaria22 23-24. Por otra parte, las comparaciones realizadas respecto a las alternativas terapéuticas (omalizumab y dosis elevadas de CSI + LABA y/o CSO) mejoran la validez del estudio.
Este estudio presenta como limitación la falta de evidencia comparativa de eficacia de calidad entre mepolizumab y omalizumab en pacientes con asma eosinofílica mediada por IgE, población candidata a ambos tratamientos e intersección específica de los dos conjuntos, de la que carecemos de datos empíricos. Se han publicado dos estudios25,26 -uno financiado por el laboratorio GlaxoSmithKline- que realizan una comparación indirecta de mepolizumab frente a omalizumab en pacientes diagnosticados de asma eosinofílica con signos y síntomas compatibles con fenotipo de asma alérgica persistente. Aunque ambos describen ausencia de diferencia en eficacia entre mepolizumab y omalizumab, resaltan la imposibilidad de hacer recomendaciones de uso preferencial de un fármaco frente a otro por la alta heterogeneidad entre ensayos clínicos y los diferentes criterios de selección del uso de los dos medicamentos. Un análisis de comparación indirecta fiable no es posible, ya que mepolizumab se estudió en asma mediada por componente eosinofílico con independencia de los valores de IgE, y omalizumab se estudió en asma mediada por IgE con independencia del componente eosinofílico, y se usa en pacientes con IgE elevada no respondedores a otros tratamientos. Estas limitaciones fueron puestas de manifiesto en informes de evaluación de mepolizumab de países como Canadá27 y Reino Unido28. Por todo ello, no se ha realizado una minimización de costes, sino que sería razonable seleccionar los fármacos mediante una comparación de costes, excepto para determinados pacientes que por alguna razón clínica justificada se prefiera uno o evitar otro.
En el momento de la realización del estudio se aprobaron otros dos fármacos con mecanismo de acción similar a mepolizumab, aunque aún no estaban comercializados en España, por lo que no fueron objeto del presente estudio14,15. Una vez comercializados, y considerando que no se han comparado con mepolizumab, habrá que evaluar si las posibles comparaciones indirectas detectan diferencias clínicamente relevantes, teniendo en cuenta el nivel de eosinófilos plasmático. Su introducción en terapéutica podría permitir la competencia y reducir el impacto presupuestario de estos agentes. Su no inclusión en este estudio es una limitación que habría que completar en estudios posteriores, más dedicados a la posible competencia de estos tratamientos similares, una vez ya se ha introducido el primero de ellos (mepolizumab) en el mercado. La ulterior comparación entre esos fármacos del mismo grupo sería procedente, pero también compleja, porque no se han comparado directamente, sus estudios tienen criterios de inclusión diversos y definieron de forma distinta los subgrupos según el recuento sanguíneo de eosinófilos.
Estudios anteriores demuestran que pacientes con recuento elevado de eosinófilos plasmáticos obtienen mayor beneficio con respecto a pacientes con niveles bajos8,9. En este análisis económico se ha observado que aquellos pacientes con ≥ 500 eosinófilos/µl presentaron un coste eficacia incremental más favorable respecto a los que tenían un menor recuento. Hay que destacar que el análisis por subgrupos de los ensayos pivotales cumple los criterios de preespecificación, interacción, consistencia en los diferentes estudios7,12 y plausibilidad biológica. Los estudios de evaluación económica de mepolizumab publicados en población con asma eosinofílica refractaria, sin tener en cuenta análisis de subgrupos, concluyeron que mepolizumab no es coste-efectivo, instando a realizarse descuentos de precios en torno al 60-70% para ser recomendable su financiación por los sistemas sanitarios29,30. Bermejo I et al.28 describieron el proceso de evaluación de mepolizumab por el National Institute for Health and Care Excellence. En su estudio de evaluación económica definieron la población objetivo en términos de grado de severidad del asma y con niveles ≥ 300 eosinófilos/µl, mostrando resultados igualmente no coste-efectivos para este subgrupo de pacientes, y recomendando su utilización sólo cuando el laboratorio proporcione el descuento de precios acordado y confidencial que haga a este medicamento coste-efectivo para este subgrupo de pacientes.
En conclusión, se carece de evidencia comparativa de calidad entre mepolizumab y omalizumab en pacientes con asma con componente eosinofílico y mediación por IgE. Tampoco existen otros estudios de evaluación económica que comparen estos dos medicamentos. Por este motivo, se desarrolló una comparación de costes en estos pacientes. Desde la perspectiva del SNS, y considerando el elevado impacto económico de mepolizumab, sería razonable utilizar el fármaco de menor coste y promover una competencia de precios. Esta estrategia no excluye la excepcionalidad justificada de preferencia de un tratamiento concreto para algún paciente. Tras este análisis farmacoeconómico, priorizar el uso de mepolizumab en pacientes diagnosticados de asma eosinofílica refractaria grave no mediada por IgE con niveles plasmáticos elevados de eosinófilos (≥ 500 células/µl), tal y como se indica en el Informe de Posicionamiento Terapéutico de mepolizumab de la Agencia Española del Medicamento, permitiría mejorar considerablemente la eficiencia y disminuir el impacto presupuestario12.
REFERENCIAS
Spanish Group of the European Study on Asthma. Prevalence of bronchial hyperreactivity and asthma in young adults from 5 Spanish areas. European study of asthma. Med Clin (Barc). 1996;106(20):761-7. [ Links ]
Quirce S, Plaza V, Picado C, Vennera M, Casafont J. Prevalence of Uncontrolled Severe Persistent Asthma in Pneumology and Allergy Hospital Units in Spain. J Investig Allergol Clin Immunol. 2011;21:6. [ Links ]
Guía Española para el Manejo del Asma (GEMA 4.3) (Internet). Madrid: Luzan. 2018 (accessed 12/05/2019). Available at: https://www.semg.es/index.php/consensos-guías-y-protocolos/279-gema-4-3-guía-Española-para-el-manejo-delasma [ Links ]
Chung KF, Wenzel SE, Brozek JL, Bush A, Castro M, Sterk PJ, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J. 2014;43(2):343-73. DOI: 10.1183/09031936.00202013. [ Links ]
Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica Xolair® 150 mg solución inyectable (internet) Madrid. Centro de información de medicamentos (CIMA) (accessed 12/05/2019). Available at: https://cima.aemps.es/cima/dochtml/ft/05319008/FT_05319008.html [ Links ]
Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica Nucala ® 100 mg polvo para solución inyectable (internet) Madrid. Centro de información de medicamentos (CIMA) (accessed 12/05/2019). Available at: https://cima.aemps.es/cima/dochtml/ft/1151043001/FT_1151043001.html [ Links ]
European Medicines Agency. Ficha técnica de Nucala® (Internet) (accessed 12/05/2019). Available at: https://www.ema.europa.eu/en/medicines/human/EPAR/nucala [ Links ]
Pavord ID, Korn S, Howarth P, Bleecker ER, Buhl R, Keene ON, et al. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial. Lancet. 2012;380(9842):651-9. DOI: 10.1016/S0140-6736(12)60988-X [ Links ]
Ortega HG, Liu MC, Pavord ID, Brusselle GG, FitzGerald JM, Chetta A, et al. Mepolizumab Treatment in Patients with Severe Eosinophilic Asthma. N Engl J Med. 2014;371(13):1198-207. DOI: 10.1056/NEJMx150017 [ Links ]
Tran TN, Khatry DB, Ke X, Ward CK, Gossage D. High blood eosinophil count is associated with more frequent asthma attacks in asthma patients. Ann Allergy Asthma Immunol. 2014;113(1):19-24. DOI: 10.1016/j.anai.2014.04.011 [ Links ]
Price DB, Rigazio A, Campbell JD, Bleecker ER, Corrigan CJ, Thomas M, et al. Blood eosinophil count and prospective annual asthma disease burden: a UK cohort study. Lancet Respir Med (journal at Internet). 2015 (accessed 12/05/2019). Available at: https://www.thelancet.com/journals/lanres/article/PIIS2213-2600(15)00367-7/fulltext. DOI: 10.1016/S2213-2600(15)00367-7 [ Links ]
Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapeutico de mepolizumab (Nucala®) como tratamiento adicional en el asma eosinofilica refractaria grave (Internet). Madrid; 2016 (accessed 12/05/2019). Available at: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-mepolizumab-Nucala-asma_EPOC.pdf [ Links ]
Omalizumab to Mepolizumab Switch Study in Severe Eosinophilic Asthma Patients - Full Text View - ClinicalTrials.gov (Internet). 2016 (accessed 12/05/2019). Available at: https://clinicaltrials.gov/ct2/show/NCT02654145 [ Links ]
Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica Cinqaero ® 10 mg/ml concentrado para solución para perfusion Centro de información de medicamentos (CIMA) (web page)). Madrid (accessed 12/05/2019). Available at: https://cima.aemps.es/cima/dochtml/ft/1161125001/Fichatécnica_1161125001.html [ Links ]
Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica Fasenra ® 30 mg solución inyectable en jeringa precargada. Centro de información de medicamentos (CIMA) (web page). Madrid (accessed 12/05/2019). Available at: https://cima.aemps.es/cima/dochtml/ft/1171252001/FT_1171252001.html [ Links ]
Lopez Bastida J, Oliva J, Antonanzas F, Garcia-Altes A, Gisbert R, Mar J, et al. Propuesta de guía para la evaluación evaluación aplicada a las tecnologías sanitarias. Gac Sanit. 2010;24(2):154-70. DOI: 10.1016/j.gaceta.2009.07.011 [ Links ]
Sullivan SD, Mauskopf JA, Augustovski F, Caro J, Lee Km, Minchin M, et al. Budget Impact Analysis. Principles of Good Practice: Report of the ISPOR 2012 Budget Impact Analysis Good Practice II Task Force - Value in Health (journal at Internet). 2014 (accessed 12/5/19);17(1):5-14. Available at: https://www.valueinhealthjournal.com/article/S1098-3015(13)04235-6/fulltext?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1098301513042356%3Fshowall%3Dtrue. DOI: https://doi.org/10.1016/j.jval.2013.08.2291 [ Links ]
Instituto Nacional de Estadistica. España en cifras 2015 (monography at Internet). 2015 (accessed 12/05/2019). Available at: https://www.ine.es/prodyser/espa_cifras/2015/files/assets/basic-html/page-2.html [ Links ]
Consejo General de Colegios Oficiales de Farmaceuticos. BOT Plus 2. Base de Datos de Medicamentos (database at Internet). Madrid: Consejo General de Colegios Oficiales de Farmaceuticos; 2013 (2016; accessed 12/05/2019). Available at: https://botplusweb.portalfarma.com/botplus.aspx [ Links ]
Martínez-Moragon E, Serra-Batlles J, De Diego A, Palop M, Casan P, Rubio-Terres C, et al. Coste económico del paciente asmático en España (estudio AsmaCost). Arch Bronconeumol. 2009;45(10):481-6. DOI: 10.1016/j.arbres.2009.04.006 [ Links ]
Moon JC, Flett AS, Godman BB, Grosso AM, Wierzbicki AS. Getting better value from the NHS drug budget. BMJ. 2010;341:c6449. DOI: 10.1136/bmj.c6449 [ Links ]
Humbert M, Beasley R, Ayres J, Slavin R, Hebert J, Bousquet J, et al. Benefits of omalizumab as add-on therapy in patients with severe persistent asthma who are inadequately controlled despite best available therapy (GINA 2002 step 4 treatment): INNOVATE Allergy (journal at Internet). 2005 (accessed 12/05/2019); 60(3):309-16 Available at: https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1398-9995.2004.00772.x [ Links ]
Grimaldi-Bensouda L, Zureik M, Aubier M, Humbert M, Levy J, Benichou J, et al. Does Omalizumab Make a Difference to the Real-life Treatment of Asthma Exacerbations?: Results From a Large Cohort of Patients With Severe Uncontrolled Asthma. Chest. 2013;143(2):398-405. DOI: 10.1378/chest.12-1372 [ Links ]
McQueen RB, Sheehan DN, Whittington MD, van Boven JFM, Campbell JD. Cost-Effectiveness of Biological Asthma Treatments: A Systematic Review and Recommendations for Future Economic Evaluations. PharmacoEconomics. 2018;36(8):957-71. DOI: 10.1007/s40273-018-0658-x [ Links ]
Cockle SM, Stynes G, Gunsoy NB, Parks D, Alfonso-Cristancho R, Wex J, et al. Comparative effectiveness of mepolizumab and omalizumab in severe asthma: An indirect treatment comparison. Respir Med. 2017;123:140-8. DOI: 10.1016/j.rmed.2016.12.009 [ Links ]
Nachef Z, Krishnan A, Mashtare T, Zhuang T, Mador MJ. Omalizumab versus Mepolizumab as add-on therapy in asthma patients not well controlled on at least an inhaled corticosteroid: A network meta-analysis. J Asthma. 2018;55(1):89-100. DOI: 10.1080/02770903.2017.1306548 [ Links ]
Canadian Agency for Drugs and Technologies in Health (CADTH). CDR Clinical Review Report for Nucala®. 2016 (accessed 08/03/2018). Available at: https://www.cadth.ca/sites/default/files/cdr/clinical/SR0461_Nucala_CL_Report_e.pdf [ Links ]
Bermejo I, Stevenson M, Cooper K, Harnan S, Hamilton J, Clowes M, et al. Mepolizumab for Treating Severe Eosinophilic Asthma: An Evidence Review Group Perspective of a NICE Single Technology Appraisal. Pharmacoeconomics (journal at Internet). 2017 (accessed 12/05/2019). Available at: http://eprints.whiterose.ac.uk/121723/9/Mepolizumab%20PharmacoEconomics%20author%20version.pdf. DOI: 10.1007/s40273-017-0571-8 [ Links ]
Whittington MD, McQueen RB, Ollendorf DA, Tice JA, Chapman RH, Pearson SD, et al. Assessing the value of mepolizumab for severe eosinophilic asthma: a cost-effectiveness analysis. Ann Allergy Asthma Immunol. 2017;118(2):220-5. DOI: 10.1016/j.anai.2016.10.028 [ Links ]
Tice JA, Ollendorf DA, Campbell JD, Chapman R, Shore KK, Weissberg J, et al. Mepolizumab (Nucala®, GlaxoSmithKline plc.) for the treatment of severe asthma with eosinophilia: effectiveness, value, and value-based price benchmarks: final report. Institute for Clinical and Economic Review ICER 2016:1-88. [ Links ]
Cómo citar este trabajo: García-Mochón L, Gil-Sierra MD, Alegre-del Rey EJ, Alarcón de la Lastra-Romero C, Sánchez-Hidalgo M. Evaluación económica y análisis de impacto presupuestario de mepolizumab en asma eosinofílica refractaria grave. Farm Hosp. 2019;43(6):187-93.
Aportación a la literatura científica:
Se trata de los primeros datos nacionales de eficiencia-impacto presupuestario publicados de mepolizumab en asma.
Implicaciones de los resultados obtenidos para la práctica, investigación, las políticas sanitarias o la farmacia hospitalaria en general: Optimización del uso en la práctica de mepolizumab por comparación de costes y análisis de subgrupos.
Presentación en Congresos: Se presentaron datos preliminares de una parte del trabajo como comunicación bajo el nombre de: “Aplicación farmacoeconómica del análisis por subgrupos en asma eosinofílica refractaria grave” en el 15º Congreso de la Sociedad Andaluza de Farmacia Hospitalaria, celebrado en Almería los días 11 a 13 de abril de 2018.
Recibido: 06 de Febrero de 2019; Aprobado: 03 de Junio de 2019











 texto en
texto en 



