Introducción
Antecedentes
Los sistemas actuales de gestión priorizan la atención sanitaria orientada hacia la calidad y la eliminación o corrección de prácticas inseguras. Así, la Organización Mundial de la Salud1, para conocer la adecuación de los procesos establecidos en la asistencia sanitaria, propone los procedimientos de validación. Estos se definen como la técnica mediante la cual se establece evidencia documentada de que un proceso específico proporciona en forma consistente un resultado que cumple con las especificaciones predeterminadas y sus caracteres de calidad.
Dentro de los complejos procesos asistenciales que tienen lugar en los centros sanitarios, la administración de medicamentos constituye sin duda uno de los más relevantes. Sin embargo, con frecuencia se olvida que, antes de llegar al punto de administración, el medicamento sigue un largo camino que ha implicado una manipulación más o menos sofisticada en el que es necesario garantizar la seguridad, pero en este caso de los profesionales que lo manipulan. Y es conocido que ciertos medicamentos, como los medicamentos peligrosos (MP), llevan implícita una mayor carga de riesgo2.
Hay que tener en cuenta que la exposición a estos riesgos para profesionales se produce tanto durante la estancia en el centro sanitario como en el domicilio de los pacientes. Más aún en el entorno de la atención domiciliaria, en el cual las condiciones en el lugar de trabajo (la casa del paciente) suelen ser no controladas y carentes, en la mayoría de las ocasiones, de supervisión directa3.
En este tipo de contextos, con el objetivo de minimizar errores en los diversos procedimientos, se tiende a generar guías de práctica clínica y recomendaciones de actuación. Un protocolo correctamente definido garantiza en un alto grado la viabilidad teórica, la calidad y la seguridad del proceso para el que se ha diseñado. El factor que determina si se alcanzan dichas metas es la adherencia al protocolo de las diferentes actuaciones llevadas a cabo por los agentes involucrados.
Así pues, en este tipo de contextos de alto riesgo, durante la propia ejecución de los procesos es necesario controlar que se están siguiendo los protocolos preestablecidos y que se obtienen los resultados esperados. Para ello se tiende a definir instantes y/o lugares en los procesos en los que es necesario (o recomendable) monitorizar las actuaciones que se llevan a cabo. Estos elementos se conocen como puntos de control (PC) y permiten la verificación de los requisitos impuestos.
Ahora bien, se deben determinar aquellos PC que necesiten de una especial vigilancia, denominándose puntos críticos de control (PCC)4. A partir de los PC y de los PCC, se generan registros con datos extraídos de la monitorización aplicada, lo que se conocen como trazas, que permiten dejar constancia explícita de los estados y/o de las interacciones existentes entre los diferentes elementos participantes en los diversos procesos. Un historial de trazas exhaustivo y completo permitiría rastrear la historia, aplicación o localización de una entidad. Esta práctica se conoce como trazabilidad.
Es coherente controlar que todas las operaciones se llevan a cabo del modo previsto, y disponer de la documentación necesaria para llevar a cabo una exhaustiva evaluación del proceso de los MP. Pero los sistemas actuales de control son retrospectivos y no es posible evitar ciertas deficiencias en el seguimiento, aunque sirven para identificar puntos con posibilidad de error y por tanto susceptibles de mejora5.
Por el contrario, contar con sistemas de respuesta rápida que consigan evitar, o al menos prevenir, los posibles riesgos de los MP, supondría una mejora sustancial para la seguridad de los profesionales sanitarios. En tal sentido, este proyecto propone la introducción de tecnologías propias de la web semántica y del big data que permitan implementar herramientas capaces de procesar en poco tiempo grandes cantidades de datos para la obtención de patrones que puedan guiar la toma de decisiones.
Hipótesis y objetivos
Aunque la significación clínica del riesgo asociado a la exposición continuada a bajos niveles de MP no está firmemente establecida, existen suficientes indicios de que pueden generar efectos adversos a largo plazo que hacen aconsejable tomar medidas de prevención. Por tanto, el conocimiento y evaluación de los riesgos que configuran el proceso de los MP podría contribuir a minimizar los peligros asociados a estos medicamentos.
El objetivo de este trabajo es describir el protocolo de estudio para el desarrollo e implementación de un sistema integral informatizado de control/verificación del proceso de manipulación de los MP, mediante el análisis de riesgos, que permita el control de la calidad y trazabilidad de los MP, de forma continua y dinámica, a través de las Unidades de Hospital a Domicilio (UHD) mediante modelos big data.
Métodos
Alcance y ámbito de aplicación
Los controles y técnicas que se desarrollen serán aplicables a los riesgos químicos del proceso de conservación, transporte, administración y gestión de residuos de MP, involucrando a los Servicios de Farmacia y a las UHD de los hospitales participantes (dos hospitales generales de tercer nivel).
Diseño
Se diseñarán los procesos mediante notación gráfica normalizada Business Process Model Notation a partir de la metodología implementada anteriormente5, que permitirá la representación de las etapas en un formato de flujo de trabajo.
Medicamentos a estudio
Se considerarán los MP incluidos en las listas del National Institute for Occupational Safety and Health6.
Etapas y control de la trazabilidad
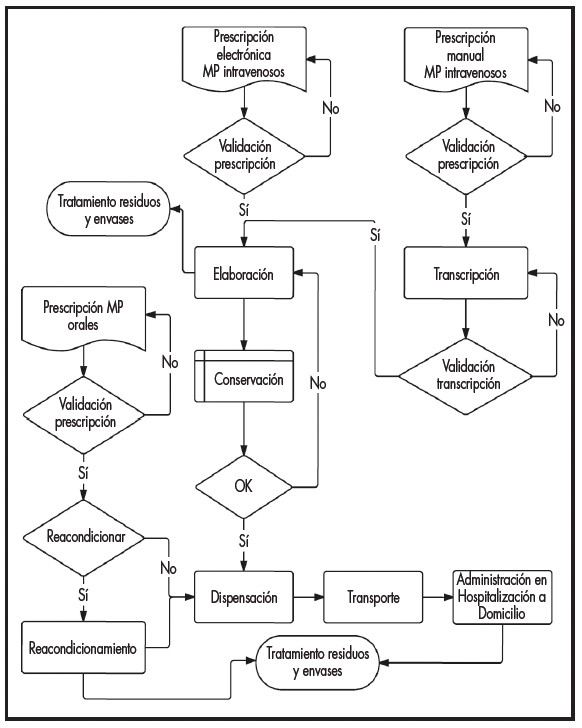
A partir de un flujograma general (Figura 1) se generarán, mediante consenso de expertos, los flujogramas específicos que reflejen con detalle las etapas del proceso y las operaciones que las componen. Las etapas del proceso se obtuvieron a partir de la revisión sistemática llevada a cabo por Bernabeu et al.7 El consenso de expertos se llevará a cabo mediante grupo nominal y técnicas documentales, utilizando un método mixto mediante dos rondas presenciales (reunión de los participantes y aprobación de propuestas) y tres rondas enmascaradas (revisión del material de forma individual).
Análisis de criticidad
A partir de las técnicas normalizadas de control de peligros (hazard identification) se elaborará el cuadro de gestión que permita la identificación de los peligros significativos y la aplicación de las medidas de control apropiadas para eliminar o mitigar el riesgo.
Para la secuenciación de decisiones para identificar los PCC se tendrá en cuenta el Recommended International Code of Practice-General Principles of Food Hygiene CAC/RCP 1-1969, Rev. 5-20208.
Las variables para la caracterización de cada peligro serán: [1] presencia (existencia del peligro); [2] incorporación o contaminación; [3] generación o crecimiento del peligro y [4] supervivencia (persistencia del peligro).
Las variables para la gestión del proceso serán: [1] etapa; [2] probabilidad del suceso (P); [3] gravedad de los daños (G); [4] índice de criticidad (IC): P x G; [5] pasos del árbol de decisiones: P1, P2, P3 y P4; [6] PC; [7] PCC y [8] medida de control.
Cálculo del índice de criticidad para cada uno de los peligros
Para evaluar cada peligro identificado se usarán los criterios establecidos por la International Featured Standards (IFS Global Markets HPC)9.
El índice de criticidad (IC) es el valor que se obtiene del producto entre la probabilidad del suceso y la gravedad de los daños (IC = P x G).
El cálculo del IC permitirá determinar qué puntos serán PC y cuáles deberán ser sometidos a la secuenciación de decisiones para la identificación, o no, como PCC, y poder establecer una medida de control sobre la causa del peligro.
La cuantificación inicial de la P y la G de los daños que permita determinar el IC de cada etapa del proceso se realizará mediante consenso de expertos (grupo nominal y técnicas documentales). Para tal fin se recurrirá a profesionales sanitarios (médicos/as, enfermeros/as y farmacéuticos/as) con reconocida experiencia en la gestión de los MP, bien por su labor asistencial (tanto a nivel hospitalario, ambulatorio o domiciliario) o bien por sus conocimientos técnicos en la materia, consultando para ello al Grupo Español para el Desarrollo de la Farmacia Hospitalaria (GEDEFO) de la Sociedad Española de Farmacia Hospitalaria (SEFH), al grupo de trabajo de gestión y calidad de la Sociedad Española de Hospitalización a Domicilio (SEHAD) y a los profesionales adscritos a servicios de prevención de riesgos laborales y medicina preventiva a través de la Escuela Nacional de Medicina del Trabajo (ENMT).
Desarrollo del soporte tecnológico
Sobre el sistema de análisis de peligros y PCC (APPCC) generado se diseñará un sistema de base telemática para la captura de todos los datos que sean pertinentes (los modelos propuestos para el análisis de riesgos y su trazabilidad también han sido testados en el ámbito hospitalario10,11). Para ello se optará por agentes software cliente que se ejecuten en dispositivos adaptados (tablets y smartphones) y que centralicen los datos en un servidor de datos común.
Tras esta primera fase, se procederá el procesado de estos datos mediante el uso de técnicas de data analytics. El análisis big data se desarrollará mediante modelos matemáticos que permitan controlar tanto los PC como los PCC. Estos modelos se aplicarán sobre los datos que se almacenen en el servidor de proyecto y permitirán conocer en tiempo real los valores para cada parámetro específico.
Recolección de los datos
Los datos de gestión, implantación y pilotaje serán recogidos mediante dispositivos de lectura óptica (tablet o smartphone) compatibles con el sistema Android de última versión y guardados en el repositorio localizado en el servidor del proyecto.
Los datos documentales y del soporte tecnológico serán generados tras el desarrollo del sistema APPCC.
Sistema de control y registro de datos
El registro de eventos se realizará siguiendo un modelo formalizado de conocimiento conforme a los estándares de la web semántica (el lenguaje SPARQL, que permite operaciones para el mantenimiento —creación, modificación y borrado— de datos). Dentro de esta línea, se generará una ontología de dominio transversal que se complementará con una capa superior más enfocada al modelizado de MP. Esta información se almacenará en un repositorio de linked open data (LOD) sobre el que existirá un SPARQL endpoint (esta tecnología facilita el diseño de los flujos de gestión y permite que puedan ser compartidos por diferentes entornos y usuarios).
Verificación técnico-documental
Una vez diseñado el sistema, éste será sometido a una verificación que englobe todos los documentos generados, así como las técnicas implementadas.
Para el testeado se realizarán emulaciones locales para los diversos ámbitos de aplicación. Para ello se llevará a cabo un control test/retest para detectar los posibles errores o situaciones conflictivas en los diferentes contextos y procesos de control a lo largo de todo el ciclo de los MP11, lo que permitirá controlar la validez interna del proceso.
Verificación clínico-farmacéutica del proceso
El sistema de control de MP será verificado independientemente en los centros participantes. Una vez se compruebe la idoneidad de todo el sistema, se fijará el plazo de vigencia, estableciendo el periodo para su revisión y verificación (validez externa).
Compatibilidad con las acciones de vigilancia
El sistema de APPCC será compatible con las acciones de vigilancia de los Servicios de Prevención de los hospitales participantes.
Consideraciones éticas
El proyecto propuesto se basa únicamente en el control de las etapas MP, sin considerar, en ningún momento, datos del paciente. En todo caso, se garantizará la confidencialidad de los datos de los profesionales sanitarios que participen en el proyecto, en aras del cumplimiento de la Declaración de Helsinki de 1975, con sus sucesivas revisiones.
Este estudio ha sido aprobado por el Comité Ético de Investigación Clínica del Hospital General Universitario de Alicante (Ref. CEIC PI2017/93).
Discusión
La Ley española 29/2006, de garantías y uso racional de medicamentos y productos sanitarios, en su artículo 87, alude a la trazabilidad de los medicamentos con el fin de asegurar y reforzar la seguridad de los mismos. Resulta imprescindible, para ello, disponer de un sistema transparente, fiable y ágil que permita reaccionar con rapidez y de forma adecuada ante riesgos detectados de calidad y seguridad de los medicamentos12.
En el contexto de los MP, la trazabilidad permite seguir su movimiento a través de las etapas de su ciclo de vida. En la actualidad existen diferentes propuestas tecnológicas de trazabilidad centradas, en especial, en el ámbito logístico. Pero, desafortunadamente, este tipo de despliegues se basan en el registro automático de la ubicación temporal del producto y no permiten cubrir de forma inmediata todos los requisitos de la gestión integral de control en un contexto como el de los MP. Ahora, las tecnologías móviles están aportando nuevas soluciones basadas en modelos de atención integral que hacen muy atractiva su aplicación en la mejora de la atención clínica13.
Los sistemas computarizados pueden ser de gran ayuda en el proceso de manipulación de MP, ya que estas aplicaciones pueden disponer de sistemas de alerta que ayuden a comprobar las desviaciones de los límites de seguridad que se establezcan en el transcurso de la validación.
En el contexto de los MP, el desarrollo tecnológico se ha centrado fundamentalmente en el ámbito oncohematológico, con especial interés en la etapa de elaboración y administración (sistemas de identificación de medicamentos y pacientes, tales como Radio Frequency Identification, código de barras, data matrix o sistemas de robotización para la preparación). No obstante, el objetivo de estas nuevas tecnologías se focaliza fundamentalmente en garantizar la trazabilidad del proceso y, en última instancia, la seguridad del paciente, pero exceptuando los robots automatizados, la mayoría de ellos no controlan el riesgo de exposición del profesional que los manipula. Hasta la fecha, y salvo omisión, no se encuentran publicados sistemas integrales de gestión de riesgos para el profesional sanitario que manipula MP que utilicen las nuevas tecnologías de la información.
Sin embargo, hoy en día, existen ya propuestas de tecnologías aplicadas a la trazabilidad y el APPCC de las mezclas nutrientes parenterales14 que ofrecen la posibilidad de desarrollar sistemas sencillos de alta seguridad. Un nuevo paso sería la adaptación de estas nuevas aplicaciones a la gestión de los MP. Ahora bien, en este caso no bastaría con el simple conocimiento del cumplimiento y verificación de las etapas del proceso, habría que incidir, en mayor medida, en un sistema de verificación y retroalimentación de los datos, relacionados con la P del suceso y su G, que permitiera un total control de todos los PCC que se establezcan. Es decir, una tarea fundamental en la consecución de estos objetivos sería la obtención y tratamiento de los datos. Resultará necesario un sistema de captura de datos eficiente, no intrusivo e interoperable que permita disponer del soporte documental necesario para poder aplicar los mecanismos de procesado de datos. El problema podría surgir en la selección de las técnicas que se emplearán para este fin. Dado el volumen de datos esperado, no solo en el pilotaje, sino también en fases posteriores de producción, podría resultar que el uso de las técnicas propias de la estadística “clásica” no fuera suficiente. La necesidad de tratar con volúmenes ingentes de datos y su disponibilidad, en muchos casos, en tiempo real (no se conocerán de antemano y sólo estarían a disposición durante el propio cómputo), estimula a proponer el uso de técnicas de data analytics. La idea es, por tanto, recurrir a aproximaciones metodologías de big data (y en particular del ámbito de machine learning) tales como redes bayesianas, redes neuronales, técnicas de clustering automático, etc. Esto permitirá la obtención de patrones, tendencias y modelos para una mayor rentabilidad de datos relacionados con los PCC y, por ende, la posibilidad de la gestión dinámica de los posibles peligros, sumado a la posibilidad de conocer la integridad del sistema en todo momento y poder gestionar el proceso de los MP de forma totalmente eficiente15,16.
Fortalezas
A fin de disponer de una herramienta de estas características, el equipo investigador atesora experiencia contrastable en el diseño e implementación finalista de plataformas como la descrita11,17.
Por otra parte, la buena aceptación de aplicaciones móviles de bajo costo y fácil uso, como la que se propone desarrollar, ha sido demostrada en anteriores estudios, que describen que estas aplicaciones son adaptables y beneficiosas para la aplicación clínica18.
Por último, la exhaustiva revisión de las etapas del proceso y el carácter multicéntrico de este trabajo permitirán la aplicabilidad futura de la herramienta en otros centros.
Limitaciones
Las limitaciones derivan de la no existencia de niveles de referencia de todos los MP (límites críticos) que permitan establecer de forma directa la consecución última del objetivo del sistema APPCC, es decir, la disminución de la exposición a los MP. Ahora bien, la disminución del riesgo al controlar la calidad de la trazabilidad del proceso, así como el conocer de forma actualizada las posibles no conformidades, garantiza un mayor conocimiento de aquellas etapas que pueden producir mayor peligro, y por tanto, de manera indirecta, una reducción de la potencial exposición. Por todo lo anteriormente expuesto, se considera que los MP deben integrarse en un sistema normalizado de gestión con el fin de mejorar la seguridad del paciente y de los profesionales sanitarios, a la vez que se maximiza la eficiencia de los recursos y minimizan los incidentes procesales, garantizando la calidad, la trazabilidad y la seguridad del proceso de manipulación de MP en la UHD.