Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.12 no.7 Madrid oct. 2005
NOTA CLÍNICA
Síndrome doloroso regional complejo tipo 1.
Tratamiento mediante bloqueos simpáticos y más...
B. Garrido1, L. Fernández-Suárez2, F. Bosch3, M. C. Rabí4 y M. Hernández-Arteaga5
| Garrido B, Fernández-Suárez L, Bosch F, Rabí MC, Hernández-Arteaga M. Complex regional pain syndrome type I. Management with sympathetic blockade and other therapies. Rev Soc Esp Dolor 2005; 12: 417-424.
| ||
| SUMMARY Introduction: Complex Regional Pain Syndrome type 1 (CRPS-I) starts with an acute phase of regional neurogenic inflammation that leads to a chronic phase of neuropathic disorders. The involvement of the sympathetic nervous system in its genesis and maintenance is significant, but not exclusive. Consequently, an early and multi-factorial treatment aimed to physiopathological mechanisms is important. Objectives: To study the use of sympathetic blockade associated to other therapies and drugs for the management of CRPS-I. Material and methods: Sixty eight patients with CRPS-1 attending a Pain Clinic were studied. All of them underwent blockade of the sympathetic cervical and lumbar chain of nodes, depending on the location of the problem. All patients received also hydromassages at home. Co-adjuvant drugs were administered for the management of neuropathic, paroxysmal and burning persistent pain. In patients with bone consolidation disorders, local laser-therapy was applied. In patients with greater functional limitations, TENS and Physiatry techniques were used. A visual analogue scale was used (VAS) to assess the degree of analgesia and a physical examination was conducted to assess autonomic disorders. Joint function was assessed using the scale of Enneking and cols. for patients with amputation, modified by us. Results: Pain was controlled in 33 patients and 28 reduced their VAS score to tolerable pain levels, with a therapeutic effectiveness of 89,70%. Joint function was recovered in 30 patients, with a slight limitation remaining in 20. These two groups that achieved a better response represented 73.52% of all patients. A moderate limitation remained in 11 patients and a severe limitation remained in 7 patients, or 10,29%. Vasomotor disorders disappeared in all the patients with a favorable response. Conclusions: The degree of analgesia and control of autonomic symptoms were satisfactory in most patients. They recovered the joint function and, hence, improved their quality of life. The method was useful for the management of patients with CRPS-1, in combination with other therapies. © 2005 Sociedad Española del Dolor. Published by Arán Ediciones, S. L. Key words: CRPS type 1. Neuropathic pain. Pathological pain. Sympathetic blockade.
| RESUMEN Introducción: El síndrome doloroso regional complejo tipo 1 (SDRC-I) cursa con una fase aguda de inflamación neurogénica regional, que conduce a una fase crónica de desórdenes neuropáticos. La participación del sistema nervioso simpático en su génesis y mantenimiento es significativa, pero no exclusiva. De ahí la importancia de un tratamiento precoz y multifactorial, dirigido a los mecanismos fisiopatológicos. Objetivos: Estudiar el uso de los bloqueos simpáticos, asociados a otros procederes y fármacos en su tratamiento. Material y métodos: Se estudiaron 68 pacientes portadores de SDRC-I que acudieron a la Clínica del Dolor, a los que se realizó bloqueo de la cadena simpática ganglionar cervical y lumbar según la localización de la entidad. Todos los pacientes asociaron el hidromasaje en el hogar. Se administraron fármacos coadyuvantes para el control del dolor neuropático, paroxístico y persistente quemante. En los casos con trastornos de la consolidación ósea, se aplicó laserterapia local y TENS en los que presentaban mayor limitación funcional; así como técnicas de fisiatría. Se aplicó la escala análoga visual (EAV) para evaluar la intensidad de la analgesia y se realizó examen físico para la valoración de los trastornos autonómicos. La función articular se consideró mediante la escala de Enneking y cols. para pacientes amputados, modificada por nosotros. Resultados: El dolor se controló en 33 pacientes y 28 descendieron su EAV a niveles álgicos tolerables, para un 89,70% de efectividad terapéutica. La función articular se recuperó en 30 pacientes y 20 quedaron con limitación leve, estos dos grupos con mejor respuesta correspondieron al 73,52% del total de los pacientes, 11 quedaron con limitación moderada y sólo 7, el 10,29% de ellos con limitación severa. Los trastornos vasomotores remitieron en la totalidad de los que presentaron respuesta favorable. Conclusiones: La intensidad de la analgesia y el control de la sintomatología autonómica fue satisfactoria en la mayoría de los pacientes. La función articular fue recuperada en los mismos, por lo que mejoró su calidad de vida. El método se comportó como útil en el tratamiento de los pacientes con SDRC-I estudiados, asociado a otras terapias. © 2005 Sociedad Española del Dolor. Publicado por Arán Ediciones, S. L. Palabras clave: SDRC tipo 1. Dolor neuropático. Dolor patológico. Bloqueos simpáticos.
|
1Especialista de Primer Grado en Anestesiología y Reanimación
2Especialista de Segundo Grado en Anestesiología y Reanimación. Profesor Auxiliar
3Especialista de Segundo Grado en Anestesiología y Reanimación.
Doctor en Ciencias. Profesora Principal de Medicina Tradicional y Natural.
Instituto Superior de Ciencias Médicas de La Habana. Presidenta del Comité
Académico de la Maestría en Medicina Bioenergética y Naturalista
4Especialista de Primer Grado en Cirugía General
5Médico General
HDCQ 10 de Octubre Clínica del Dolor. La Habana, Cuba
Recibido: 25-01-05.
Aceptado: 04-07-05.
INTRODUCCIÓN
El tratamiento del síndrome doloroso regional complejo (SDRC) continúa enfrentando obstáculos; a pesar de vencer las trabas taxonómicas y diagnósticas después que la Asociación Internacional para el Estudio del Dolor (IAPS) introdujo esta definición y criterios en la década del 90, en el orden práctico no existe un acuerdo entre las múltiples disciplinas que convergen en la asistencia del paciente afecto, que marque una pauta individualizada óptima en la conducta a seguir, la cual debe estar dirigida a los mecanismos fisiopatológicos, muchos de los cuales se encuentran aún en el campo de la especulación. Las teorías actuales se refieren a un proceso inicial de inflamación neurogénica periférica, donde la actividad antidrómica de las fibras C es importante por la liberación de neuropéptidos y mediadores amplificadores del proceso; la reacción neuroinmune y la participación de segundos mensajeros, especies reactivas de oxígeno y nitrógeno, determinan un fenómeno de sensibilización periférica, con adquisición de sensibilidad adrenérgica en los nociceptores de fibras C sobrevivientes a la injuria nerviosa parcial, o evocada en estos, por daño selectivo de las eferentes simpáticas. También la generación de focos de hiperexcitabilidad por acúmulo de canales de Na2+ en el sitio del neuroma, coadyuva al bombardeo nociceptivo del cuerno posterior que vía glutamato/NMDA/NO favorece el establecimiento del proceso de sensibilización central. El daño neural predispone a la desinhibición en cuerno posterior y a fenómenos atróficos y regenerativos con expresión de factores de crecimiento nervioso, que conducen a cambios plásticos del sistema nervioso central, los que una vez establecidos son muy difíciles de revertir y generan una fase crónica de disturbios neuropáticos. Por lo que el tratamiento debe ser precoz y multifactorial, precisamente porque la génesis del síndrome lo es y la no intervención a tiempo en fase aguda, deteriora la calidad de vida del paciente afecto.
Los criterios diagnósticos aceptados son el antecedente de episodio nocivo sin lesión nerviosa aparente (SDRC-I) o con ella (SDRC-II), dolor espontáneo o hiperalgesia no limitada a un solo territorio nervioso y desproporcionado en relación con el episodio que lo provocó, presencia de edema actual o pasado con anormalidades de temperatura y sudoración en la parte distal del miembro afectado y exclusión de otros diagnósticos.
La presentación típica consiste en una constelación de síntomas sensoriales, motores y autonómicos, a los que se agregan los cambios tróficos (1-3).
ACERCA DE LOS SÍNTOMAS
El dolor es moderado a intenso, espontáneo, se presenta hiperalgesia ante estímulos mecánicos o con el movimiento de las articulaciones. Está localizado profundamente en los tejidos somáticos (1,4,5). La irradiación es distal al sitio de la lesión inicial, también a otras partes distantes no contiguas, sin patrón metamérico, puede haber diseminación en espejo hacia el territorio contralateral sano. Una tercera parte padece alodinia. La alodinia al frío se considera un síntoma clínico de dolor simpático persistente y es significativamente más frecuente en el SDRC-II. Déficits sensoriales: con una distribución en media o guante en la extremidad afectada, que se expande más allá de la zona afectada de la piel (2). Síntomas motores: se puede observar debilidad, temblor, reflejos tendinosos exagerados, posturas distónicas y sacudidas mioclónicas, estas dos últimas particularmente en el SDRC-II, así como reducción en el rango de movimiento lo que repercute en la calidad de vida (1,2). Se ha descrito el síndrome de Neglect-like motor en algunos pacientes con SDRC, caracterizado por aquinesia, bradicinesia, déficit en la amplitud y frecuencia de movimientos, referido como la necesidad de enfocar toda la atención al miembro afecto para lograr un movimiento voluntario, cognitivamente definido como la sensación de que la extremidad es ajena al paciente. La observación en pacientes con lesiones en la corteza parietal, presume que el déficit en la integración parietal del impulso propioceptivo y visual puede estar involucrado en esta disfunción motora y sugiere cambios en la representación e interpretación de los mapas espaciales (4). Síntomas autonómicos: son el edema y los trastornos vasomotores que fluctúan desde la hiperhemia en fase aguda, a la cianosis en fase crónica, con los consiguientes cambios de temperatura, y sudoración en la parte distal de las extremidades (1,3,4). Cambios tróficos: se producen en más del 50% de los casos; el aumento del crecimiento del cabello y de las uñas se inicia unas pocas semanas después del trauma, pero con el tiempo estos síntomas en más (plus symptoms) cambian a síntomas en menos (minus symptoms), con disminución del crecimiento del cabello, de las uñas y atrofia de la piel. En casos graves se pueden observar úlceras en la piel (1,2).
Nuestro propósito fundamental es la propuesta de una conducta según nuestra experiencia práctica, basada en un tratamiento de inicio precoz, interdisciplinario y multifactorial concebido para cada paciente, que permita su incorporación con calidad a la vida, en la mayor brevedad posible.
OBJETIVOS
Generales
-Conocer la eficacia de los bloqueos simpáticos asociados a otros procederes, en el tratamiento integral del SDRC tipo I.
Específicos
-Evaluar la intensidad de la analgesia en los pacientes tratados.
-Corroborar el control de la sintomatología autonómica.
-Conocer la incidencia de complicaciones.
-Estudiar la función articular, de repercusión en la calidad de vida.
MATERIAL Y MÉTODO
Se estudiaron 68 pacientes portadores de SDRC-I con afectación en miembros superiores e inferiores, indistintos en cuanto a edad, sexo y raza, que recibieron tratamiento en la clínica del dolor, en el periodo de enero 2000 a enero 2001, mediante técnicas de bloqueos de la cadena simpática ganglionar; para miembro superior se utilizó el bloqueo del ganglio estelar mediante la técnica anterior paratraqueal (20) y para miembro inferior el bloqueo de la cadena simpática lumbar por punción única (20). Primero se realizó la desinfección mecánica de la zona operatoria, asepsia, antisepsia y colocación del paciente en decúbito supino con el cuello en hiperextensión para el abordaje del ganglio estelar y sentado con tórax en flexión para el abordaje paravertebral de la cadena simpática lumbar a nivel L3. Se utilizó lidocaína 1% en volúmenes medios de 10 ml. El número de sesiones promedio fue de 10 con frecuencia de días alternos. Todos los pacientes asociaron el hidromasaje en el hogar con lavadora tres veces al día, durante cinco minutos, con agua a temperatura ambiente. Se administraron fármacos coadyuvantes (2,3,11,12,16) para el control del dolor neuropático, siempre que no existiera contraindicación para su uso; carbamazepina (200 mg) dosis 200-800 mg.día-1 para el control del dolor paroxístico y amitriptilina (25 mg) dosis 25-75 mg.día-1, para el dolor persistente quemante. Utilizamos Láser-terapia local (17-19) sobre el foco de fractura, en los pacientes con diagnóstico radiológico de consolidación viciosa, para aumentar la síntesis de osteoblastos y estimular la formación del callo óseo (19). Para este fin se usó el equipo LASERMED102 MD de fabricación cubana (He-Ne) 2 mw/potencia de salida del aplicador, la zona de impacto, localizada por la sensibilidad a la palpación del foco de fractura, fue irradiada con una densidad de 4 joule/cm2 durante 60 seg en número de 10 sesiones. En los que presentaban limitación de la función articular grado II y grado III (3,12,16) se utilizó la neuroestimulación eléctrica transcutánea (TENS); también en número de 10 sesiones con el equipo biometer TS 8000 P, prefijamos una duración de pulso (Pw) de 0,3 mseg, frecuencia de estímulo de 50 Hz, corriente de 0-60 mA, cíclico con time on de 3-5 seg y time off de 5-10 seg (20) (tabla 1)


Evaluamos la intensidad de la analgesia mediante el uso de la escala análoga visual (EVA) donde: 0-no dolor, 1-dolor leve, 2-dolor moderado, y 3-dolor severo (21). La sintomatología autonómica se enmarcó en los cambios de coloración y temperatura de la piel como expresión de las alteraciones vasomotoras hacia la cianosis o la hiperhemia; así como la presencia de hiperhidrosis, evaluadas siempre por el mismo observador. Se considera el grado de edema como: leve, moderado o severo a criterio del observador. La función articular, como indicador de calidad de vida, se exploró mediante el examen físico del arco de movimiento de las articulaciones involucradas; apoyados en la escala de Enneking y cols. (22) para pacientes amputados modificada por nosotros, al evaluar solamente la actividad funcional y factores específicos bien para miembro superior (posición de la mano, destreza y fuerza contra la gravedad) o del miembro inferior (habilidad paseando y modo de andar). Consideramos como normal al individuo que puede reintegrarse a todas sus funciones cotidianas, limitación leve (grado I) al que recupera más del 50%, limitación moderada (grado II) al que recupera menos del 50% y limitación severa (grado III) al que pierde la función articular con limitación laboral. Se consideraron todas las variables antes del tratamiento, al concluir y al mes de concluido el mismo, al realizar la evolución de los pacientes en consulta externa. En los casos que presentaron consolidación viciosa se indicó a los 25 días de finalizado el tratamiento con láser, estudio radiológico evolutivo. La aparición de complicaciones inmediatas al proceder con anestésico fue otro elemento a considerar.
Se recoge la información en el sistema de base de datos Quest Tree, relacionando las variables en busca de resultados. Para los cálculos se utilizó el programa Microsoft Excel para Windows XP.
RESULTADOS
En nuestra casuística de 68 pacientes, fue significativo cómo el SDRC-I se presentó con mayor frecuencia a partir de los 46 años, el rango de mayor incidencia fue entre 56-65 años, prevaleciendo en el sexo femenino (3). En un número importante de pacientes se recolectaron antecedentes patológicos de hipertensión arterial (12 pacientes), síndrome ansioso-depresivo (20 pacientes), diabetes mellitus (8 pacientes) y en 27 de los mismos, asociaciones de estas mismas enfermedades.
Dentro de los factores desencadenantes de mayor significación se destacaron las fracturas en 43 pacientes, para un 63,2%, seguidas por las operaciones del síndrome del túnel carpiano (STC) en 10 pacientes (14,7%).
Se observó cianosis en 31 pacientes (46%), hiperhemia en 28 (41%) y en 9 (13%) fue evidente el fenómeno de livedo reticular.
Se constató edema severo e hiperhidrosis en 27 pacientes (39,7%).
Los síntomas sensoriales observados con mayor frecuencia fueron las parestesias y la hipoestesia en zonas distales, en 46 pacientes, el 67,6% de los pacientes. Los trastornos motores sólo se presentaron en 2 pacientes (2,9%), y observamos temblores del miembro afectado (4,6,9).
La escala EVA para valorar la intensidad del dolor, aplicada inicialmente, al concluir la 10ª sesión de bloqueos o al final y al mes de concluido el tratamiento, mostró los siguientes resultados, apreciables en la Figura 1. Nos referimos ahora comparativamente a los valores iniciales con respecto a los referidos al mes de concluido el tratamiento, por la tendencia a la estabilización de los niveles álgicos y la sintomatología autonómica en esta etapa al suspender los bloqueos: la mayoría de los pacientes, 38 de estos (55,88%), aquejó dolor inicial en el nivel 3, intenso, descendiendo a niveles álgicos tolerables con valor 1 en 21 pacientes (30,88%), a valor 2 en 7 pacientes (10,29%) y a valor 0, o sea no dolor, en 33 pacientes (48,52%) al mes, al evoluarlos en consulta externa.
Los síntomas autonómicos y el edema remitieron evolutivamente asociados al control del dolor de manera significativa en estos 61 pacientes (89,7%). Se consideró fallido el tratamiento en 7 pacientes (10,29%) que continuaron también refiriendo dolor intenso en nivel 3.
Se asociaron fármacos en 50 pacientes (74%), anticonvulsivantes en 7 pacientes, antidepresivos tricíclicos en 20 y asociados en 10 pacientes para el control del dolor neuropático, así como analgésicos antiinflamatorios no esteroideos (AINE) en fase aguda para analgesia y control de la respuesta inflamatoria inicial en 13 pacientes (4,5,11,12).
No se reportaron complicaciones con los bloqueos simpáticos en esta serie.
Las características clínicas del dolor neuropático, en los 63 pacientes que presentaban dolor, se manifestaron como dolor independiente del estímulo en 39 pacientes (61,90%), sin diferencia significativa entre el paroxístico y el persistente. De los 24 (38,09%) con dolor dependiente del estímulo, todos presentaron alodinea mecánica (25) al roce de la piel, a la presión o a los movimientos articulares (1,2,4,5).
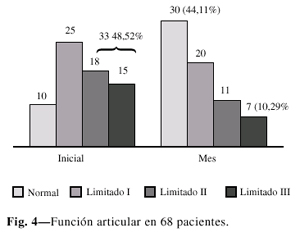
Evaluamos la recuperación de la función articular al mes con respecto al compromiso inicial. Realmente limitados moderados y severos llegaron a nosotros 18 y 15 pacientes respectivamente, o sea 33 pacientes (48,52%), 10 con función articular normal (14,70%) y 25 (36,76%) con limitación leve. Al concluir el tratamiento apoyados en la escala de Enneking (22) modificada por nosotros, pudimos constatar que hubo un desplazamiento hacia la normalidad en 30 pacientes (44,11%), a la limitación leve en 20 y moderada en 11, (45,58%) que podían continuar su recuperación con fisioterapia. Sólo 7 pacientes (10,29%) quedaron con limitación severa (Fig. 2).
Se realizó el estudio radiológico correspondiente a 46 pacientes y uno de los trastornos más frecuentes fue la consolidación viciosa del foco de fractura en 18 pacientes (39,13%).
DISCUSIÓN
El factor traumático puede ser desencadenante en un 65% de los pacientes, en nuestra serie lo fue en el 63,2%. Coincidimos con otros autores en que la fractura de Colles, que se asocia al síndrome del 7 al 37% de los casos (4), fue la más frecuente de las presentadas para un 55,81%; también las pequeñas metacarpianas y metatarsianas, localizadas en zonas corporales con gran densidad de receptores nerviosos y en miembro inferior la del quinto metatarsiano (20,9%) y la bimaleolar (30,23%). Las operaciones del síndrome del túnel carpiano (STC) presentaron el segundo lugar en orden de frecuencia. Es conocido que las lesiones postquirúrgicas ocupan el 24% de los factores desencadenantes, pero esta intervención específicamente puede ser de riesgo para el SDRC, pues los pacientes previamente presentan trastornos neuropáticos (6) y con frecuencia se observa fibrosis postquirúrgica que puede comprometer la irrigación neural. Se reconoce que entre el 10 y 25% de los pacientes no refieren una causa aparente; en nuestra casuística sucedió con 3 (4,41%) de los mismos.
La relación cianosis-hiperhemia en nuestra serie no fue significativa, pues un número de 28 pacientes fueron remitidos a la Clínica de Dolor en fase aguda hiperhémica (1), indicador de la mayor precocidad en el diagnóstico y conducta ante esta entidad. En un estudio realizado en el año 1999 en el Centro Médico de la Universidad de Washington, la duración de los síntomas antes de la derivación al centro especializado, osciló entre 2 a 168 meses, en promedio 30 meses (3). No debe sorprender entonces un pronóstico reservado al intervenir tardíamente en la evolución del síndrome.
Los trastornos sensoriales fueron más frecuentes que los motores. Harden describe una elevada incidencia del 69% de hiperestesia, también una forma de presentación interesante de hipoestesia, asociada a alodinea extrema, es decir, combinación de síntomas negativos y positivos. Ocasionalmente describe el temblor y los movimientos mioclónicos del miembro afectado en un 20% (2).
Predominó el dolor persistente independiente del estímulo, descrito por los pacientes como ardoroso constante y la alodinea mecánica; en estos casos utilizamos antidepresivos tricíclicos (amitriptilina), también consideramos que son superiores a los inhibidores selectivos de la recaptación de serotonina (4). La carbamazepina se utilizó en los casos con dolor paroxístico asociado, con buena efectividad como se describe en estudios anteriores (2,4-6). Los AINE fueron de beneficio sólo en fases iniciales en los casos con inflamación considerable (2).
El grado de analgesia logrado, la mejoría de la sintomatología autonómica y la recuperación de la función articular, tuvieron una evolución armónica, con una tendencia a la estabilización alrededor del mes de haber concluido los bloqueos.
Se asociaron los trastornos de la consolidación ósea, lo que evidentemente obstaculizaba el progreso terapéutico, por lo que decidimos estimular con rayos láser el foco de fractura (19) en 18 de ellos, así como el punto acupuntural intestino grueso 11 (Ig 11). Son conocidas las cualidades biológicas de bajas dosis del láser de baja potencia en los procesos de regeneración y reparación tisular, que determinan un incremento del proceso curativo en general. Su acción se basa en la multiplicación celular, la formación de fibras colágenas y elásticas, la regeneración de vasos, la cicatrización de tejido óseo y la reepitelización del tejido dañado. Al aumentar las mitosis celulares, específicamente de osteoblastos, puede acelerar la consolidación de la fractura. Aclaramos que la estimulación sea sólo en el foco de fractura, sin exceder el número de aplicaciones, pues el láser, también puede acelerar la osteoporosis, lo que sería indeseable en estos casos que la presentan como parte del proceso. La láser-puntura reflexológica puede aumentar la actividad celular y ser una ayuda más en este tratamiento (26). En los 33 pacientes con limitación moderada a severa asociamos tratamiento con neuroestimulación eléctrica transcutánea (TENS), para apoyar la rehabilitación muscular y la función articular (4,12,23,24), siempre que la fractura estuviera consolidada. En resumen asociamos a las técnicas de bloqueos simpáticos, TENS en 33 pacientes, láser en 18, ejercicios de fisiatría en 30, fármacos en 50 e hidromasaje con lavadora en el hogar en la totalidad de los pacientes (Fig. 3).
Los resultados alcanzados son fruto de la constancia en todos estos métodos, del apoyo psicológico logrado con una buena relación médico-paciente y de la participación activa de este en su tratamiento.
CONCLUSIONES
-La intensidad de la analgesia fue satisfactoria en la mayoría de los pacientes.
-El control de la sintomatología autonómica se logró en el mayor número de pacientes.
-No se reportaron complicaciones.
-La función articular se recuperó en la mayoría de los pacientes tratados, por lo que mejoraron su calidad de vida.
-Los bloqueos simpáticos, iniciados precozmente, asociados a hidromasaje, láser-terapia local en el foco de fractura, fármacos, TENS y fisioterapia, fueron muy útiles en el tratamiento de los pacientes con SDRC tipo I estudiados.
|
BIBLIOGRAFÍA
1. Birklein F, Handwerker HO. Síndrome doloroso regional complejo. Una manera de resolver la complejidad. Pain 2001; 94: 1-6 [ Links ]
2. Harden RN. Complex regional pain syndrome. Br J Anaesth. 2001; 87: 99-106. [ Links ]
3. Allen G, Garler B, Sachwartz L. Epidemiología del síndrome doloroso regional complejo. Revisión retrospectiva de 134 pacientes. Pain 1999; 80: 539-44. [ Links ]
4. Díaz PA, Plancarte R, Tamayo AC. Síndrome doloroso regional complejo. Estado actual. Cir Ciruj 2004; 72: 225-38. [ Links ]
5. Martina JF. Síndrome doloroso regional complejo tipo 1. MEDUNAB 2001; 4 (10): 1-7 [ Links ]
6. Manning DC. Reflex sympathetic dystrophy, sympathetically maintained pain, and complex regional pain syndrome: diagnosis of inclusion, exclusion or confusion? Journal of Hand Ther 2000; 13 (4): 260-8. [ Links ]
7. Stanton-Hicks M. Complex regional pain syndrome (type-I, RSD; type-II, causalgia): controversies. Clinical Journal of Pain 2000; 16 (2): 33-40. [ Links ]
8. Baron R, Levine JD, Fields HL. Causalgia and reflex sympathetic dystrophy: does the sympathetic nervous system contribute to the generation of pain? Muscle Nerve 1999; 22 (6): 678-95. [ Links ]
9. Wolf CJ, Mannion RJ. Dolor neuropático, etiología, mecanismos y manejo. The Lancet 1999; 353: 1959-64. [ Links ]
10. Kidd B L, Urban L A. Mecanismos del dolor inflamatorio. British Journal of Anaesthesia 2001; 87 (1): 3-11. [ Links ]
11. De Leo JA, Yezierski RP. Papel de la neuroinflamación y activación neuroinmune en el dolor persistente. Pain 2001; 90: 1-6. [ Links ]
12. Ceraso OL. Dolor Neuropático. Dynia 2000; 3: 34-52. [ Links ]
13. Ceraso OL. Óxido nítrico y dolor inflamatorio. Dynia 2001; 2: 8-15. [ Links ]
14. Woolf CJ, Salter MW. Plasticidad neuronal. Amplificación de la sensación de dolor. Science 2000; 88: 1765-8. [ Links ]
15. Hansson P. Dolor neuropático. Características clínicas y algoritmo diagnóstico. European Journal of Pain 2002; 6: 47-50 [ Links ]
16. Gómez Sancho M, Plancarte Sánchez R. El dolor. Anatomía y Neurofisiología. En: Cuidados Paliativos: Atención integral a enfermos terminales. Las Palmas: ICEPSS Editores S.L. 1998. p. 229-316. [ Links ]
17. Bruce S. Bloqueos simpáticos. En: Técnicas de anestesia regional. Madrid: Editorial Medic Panamericana 1990. p. 187-90. [ Links ]
18. González FH. Laser. En: Actualidades en láser de baja potencia 1ª ed. Ecuador: Ed Ambato, 1996. p. 103-7. [ Links ]
19. Cubiotti A. Lasertherapy in biorregulation processes. Rev OLT. Italia 1984: 11-18. [ Links ]
20. Garrido B, Bosch F, Rabí MC, Hernández M, Fernández L. Láser y dolor neuropático. Rev Cub Anest Rean 2003; 2 (2): 23-35. [ Links ]
21. Melzack R. The short form Mc Gill Pain Questionnaire. Pain 1987; 30: 191. [ Links ]
22. Enneking WF, Dunham W, Gebhadt MC, Malawar M, Pritchard DJ. A system for the funtional evaluation of reconstructive procedures after surgical treatment of tumors of the musculoskeletal system. Clin Orthop 1993; 286: 241-6. [ Links ]