Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.16 no.6 Madrid ago./sep. 2009
Déficits neurológicos y aracnoiditis secundarios a anestesia neuroaxial: rol de parestesias, punciones durales, anestésicos locales y género. Protocolo para su tratamiento
Neurological deficit and arachnoiditis secondary to neuroaxial anesthesia: role of paresthesia, dural puncture, local anesthetics and gender. Treatment protocol
A. Ramírez Bermejoa,*, J.A. Aldreteb,*, N.C. Godínez Cubilloa, S. Bautista Sáncheza, R. Ghalyc, A. Kassian Ranka
aClínica del Dolor, Hospital General de México OD, Ciudad de México, México
bDepartment of Anestesiology, University of Alabama, Birmingham, AL, USA
cHospital Cook County and Hospital Advocate Illinois, Masonic Medical Center of Chicago, IL, USA
Dirección para correspondencia
RESUMEN
Introducción: De las complicaciones de la anestesia neuroaxial, la aracnoiditis y el déficit neurológico representan uno de los problemas más serios a los que pueda enfrentarse el anestesiólogo, aun cuando la frecuencia real es desconocida las consecuencias funcionales para los pacientes y legales para el médico son devastadoras, debido principalmente al hecho que la mayor parte de los pacientes no son tratados con oportunidad y las probabilidades de un desenlace catastrófico aumentan.
Material y método: Revisión de casos.
Resultados: Se presenta una serie de casos en los que se analizan los factores que posiblemente influyeron en la presencia de las complicaciones, los tratamientos empleados y su eficacia para disminuir la incapacidad remanente y lograr su recuperación, así como el resultado de aplicarlo oportunamente.
Discusión: Es necesario reconocer que una vez que estas complicaciones se presentan, el objetivo principal es iniciar un plan terapéutico que evite o disminuya las secuelas permanentes, para lo cual se requiere iniciar inmediatamente un tratamiento específico que permita la pronta recuperación de la función; sin embargo, en la actualidad, aún no hay un protocolo de tratamiento que haya demostrado ser eficaz en la disminución de las secuelas.
Palabras clave: Anestesia neuroaxial; Complicaciones; Aracnoiditis; Déficit neurológico.
ABSTRACT
Introduction: Among the complications of neuroaxial anesthesia, arachnoiditis and neurological deficit represent one of the most serious problems that anesthesiologists can face. Although the real frequency of this complication is unknown, the functional consequences for the patient and legal repercussions for the physician are devastating, mainly because most patients are not treated in a timely fashion, increasing the probability of a catastrophic outcome.
Methods: Case review.
Results: We reviewed a series of cases and analyzed the factors that possibly influenced the presence of complications, the treatments used and their effectiveness in reducing permanent disability and in achieving recovery, as well as the results of their timely application.
Discussion: Once these complications appear, the primary objective is to initiate a therapeutic plan that avoids or reduces permanent sequels. To do this, specific treatment that allows functional recovery must be started immediately. However, currently there is no treatment protocol with demonstrated effectiveness in reducing sequels.
Key words: Neuroaxial anesthesia; Complications; Arachnoiditis; Neurological deficit.
Introducción
La aparente escasez de casos complicados por aracnoiditis y déficits neurológicos después de anestesia neuroaxial1,2 no necesariamente refleja la frecuencia real, ya que por diversos factores es muy probable que no todos los episodios adversos que ocurren sean reportados, entre ellos se cuentan la falta de reconocimiento, inadecuado seguimiento del caso, temor a las consecuencias legales o, simplemente, a la ignominia que resulta al emplear un método casual para obtener la casuística, que resulta en reportes con una aparente baja incidencia en series clínicas que obtienen su información por correo3, por encuesta telefonica4, haciendo una revisión de casos seleccionados por compañías de seguro5,6, o analizando subsecuentes demandas legales una vez que han sido resueltas7; sin embargo, el proceso selectivo de casos y los métodos inadecuados de confirmar objetivamente los datos de cada paciente, ha hecho que sean inapropiados para aceptarse como una verdadera incidencia. Quizás, un factor que contribuye a tal disparidad es el hecho que la severidad de las lesiones neurológicas y de la incapacidad remanente son variables, por lo que quizás en algunas ocasiones no sean identificadas. A continuación se presentan 8 casos de déficits neurológicos subsecuentes a anestesia neuroaxial seguida por una discusión de los factores que pudieron haber influido en el desarrollo de tal patología y la aparente efectividad de un protocolo terapéutico que resulte efectivo, si se lleva a cabo en una etapa temprana de la evolución de estos casos, como han reportado Aldrete y Ghaly8.
Presentación de los casos
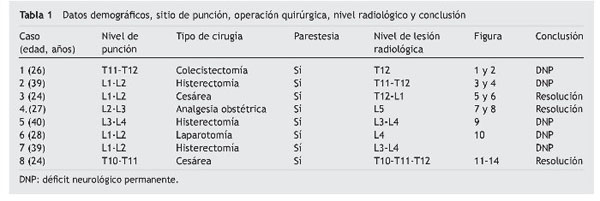
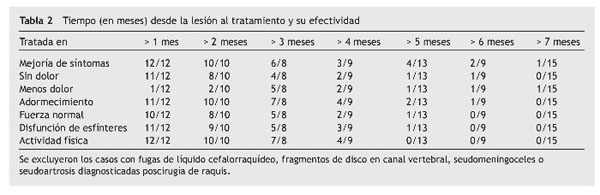
Caso 1
Paciente de 26 años de edad, programada para colecistectomía abierta electiva; sin antecedentes médicos de importancia y valoración preanestesica ASA I. Recibió anestesia epidural, con aguja Tuohy introducida en T11-T12. Después de tener aspiración negativa, se administraron en secuencia lidocaína 2% con adrenalina 1:200.000, 15 ml que también contenía 1,5 ml de NaHCO3. Debido a que no se observó evidencia de anestesia se intentó anestesia espinal que produjo parestesia de los miembros superior e inferior derechos, igualmente inefectiva, por lo que se procedió a la administración de anestesia general. En sala de recuperación, la paciente se quejó de dolor en miembro inferior derecho (MID) (EVA 8-10), tipo ardoroso-quemante, punzante, acompañado de parestesias, disestesias, con adormecimiento, frío y monoparesia. La paciente recibió como tratamiento ketorolaco 30 mg/8 h durante 3 días y fue dada de alta sin aparente cambio de condición clínica. Trece meses después fue referida a una clínica de dolor, aún con la misma sintomatología además de marcha claudicante, pie derecho caído, atrofia de pie, muslo y pierna; los reflejos abdominocutáneos, patelar, aquíleo y plantar del lado derecho estaban ausentes. Había cambios autonómicos distales, la fuerza muscular estaba disminuida en el miembro inferior del mismo lado y la sensibilidad superficial y profunda en los dermatomas de T3 a S1 se encontraban disminuidos considerablemente. La paciente recibió analgésicos antiinflamatorios y complejos vitamínicos B sin respuesta favorable. La resonancia magnética (RM) (figs. 1 y 2) reveló "imagen lineal en lado derecho de médula espinal de 42 mm de longitud por 4 mm de ancho en T12, que sugirió una dilatación de médula con características cavitarias probablemente siringomielia". Los estudios neurofisiológicos reportaron: "degeneración axonal del plexo lumbosacro derecho sin datos de reinervación". No obtuvo respuesta favorable a otras terapias convencionales.
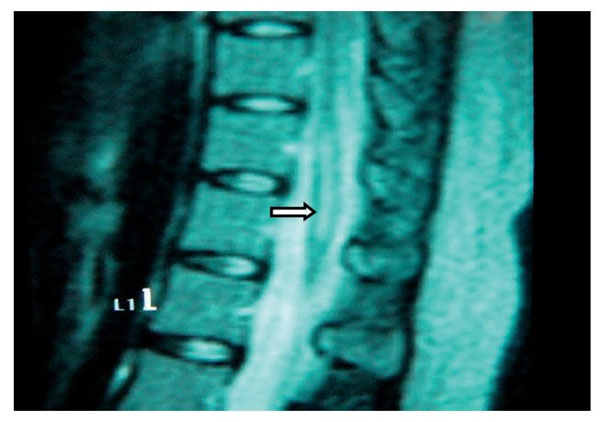
Figura 1 Vista sagital de la columna torácica en la que se observa una cavidad en el parénquima
(flecha) de la médula espinal que simula siringomielia, causada por punción con aguja de Tuohy.
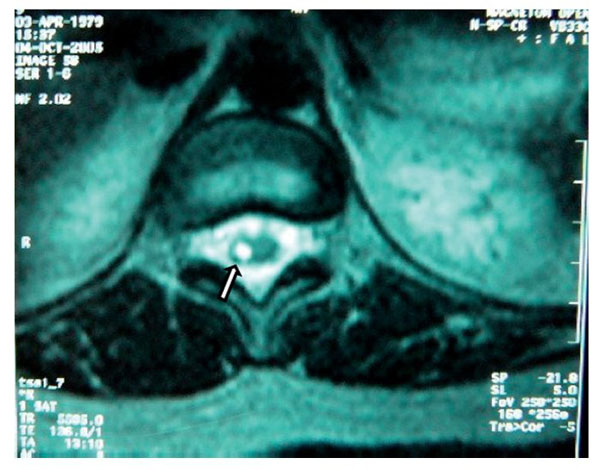
Figura 2 Vista axial de vértebra T12 en la que se observa siringomielia en la mitad derecha de
la médula espinal (flecha), con aparente expansión y edema medular.
Caso 2
Mujer de 39 años, programada para histerectomía abdominal, la valoración preanestésica fue ASA I. Se intentó realizar bloqueo epidural lumbar; se introdujo aguja de Tuohy G 17 en L1-L2, que provocó parestesia del MID que llegó hasta la punta de los dedos. En el posquirúrgico inmediato presentó cefalea y disminución de la movilidad del MID, así como adormecimiento y disestesias, dolor ardiente continuo y tipo punzante. Se dio de alta de sala de recuperación, con puntuación total en la escala de Aldrete de 9. La cefalea y el dolor se trataron con dexametasona, ketorolaco, carbamazepina y diclofenaco con vitaminas B. Después de 60 días continuaba con dolor de las mismas características, además de atrofia muscular de MID y pie caído. El llenado capilar y la temperatura cutánea aparecieron disminuidos. Se encontró hipostesia en dermatomas L2, L3, L4, L5 y S1 con alodinia y propiocepción ausente; los reflejos patelar, aquileo y abdominocutáneos ausentes. En la RM (figs. 3 y 4) se encontró en la médula espinal (segmentos T11 y T12) una "lesión central hiperintensa que podría corresponder a mielopatía de origen primario por edema e isquemia". La electromioneurografía reporto: "reposo con silencio eléctrico desde T8 a S1; reflejo H del tibial izquierdo prolongado con relación al contralateral de forma significativa; conducción sensorial del sural, con latencias discretamente prolongadas". Los potenciales evocados somatosensoriales fueron descritos como "el tibial derecho con latencia de P37 prolongada discretamente con relación al contralateral". La impresión diagnóstica final fue "aracnoiditis y mielopatía". Tres años después, el déficit neurológico persistió manifestándose como ausencia sensorial continua desde T11 hasta S1 del lado derecho; el dolor neuropático se extendía hasta la región cervical; la debilidad muscular en píe, pierna y muslo derechos era bastante marcada, a pesar de intensa rehabilitación. El tratamiento con gabapentina 1.800 mg/ día resultó en beneficio mínimo.
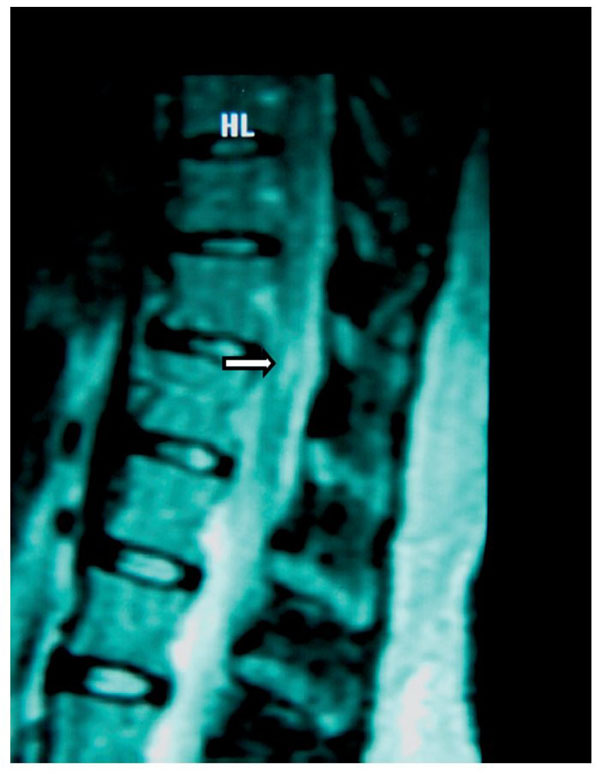
Figura 3 Imagen de resonancia magnética de T11 en la que se observa una lesión central
hiperintensa (flecha), que podría corresponder a mielopatía de origen secundario,
probablemente debida a punción por aguja de Tuohy.
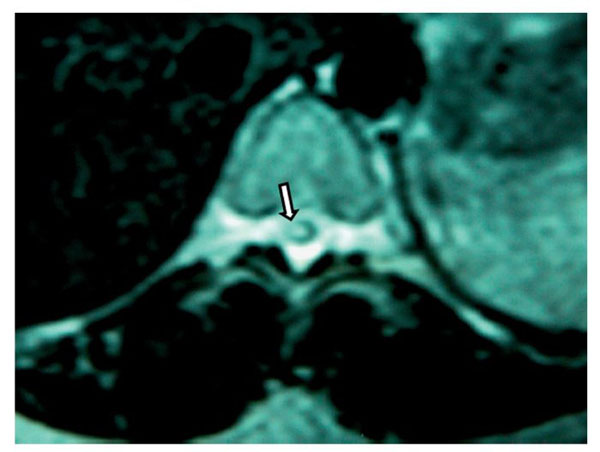
Figura 4 Imagen de resonancia magnética, vista axial de vértebra T11 en la que se observa
una lesión hiperintensa (flecha) dentro de la médula espinal, probablemente secundaria a traumatismo.
Caso 3
Mujer de 24 años, enviada a nuestra unidad con el diagnóstico de puerperio quirúrgico inmediato y radiculopatía secundaria a punción de duramadre. La paciente había sido sometida a cesárea con anestesia epidural con abordaje a en L1-L2 con aguja Tuohy G 17; durante la aplicación del bloqueo se presentó punción incidental de la duramadre, seguida inmediatamente por parestesia hacia el miembro inferior izquierdo (MII) incluyendo los dedos. En recuperación la paciente refirió dolor de las mismas características, además dolor ardoroso continuo, de intensidad de 7-8. Fue tratada con gabapentina, carbamacepina y ketorolaco. Doce días después el dolor persistía y se habían agregado parestesias y disestesias, así como incapacidad física por dolor. Tenía problemas para la deambulación, los movimientos de la columna lumbar con limitación y dolor, dificultad a la marcha puntatalón. En MII los reflejos aquileo y plantar estaban abolidos, propiocepción ausente, presencia de alodinia e hipoestesia en dermatomas L5 y S1. El pie izquierdo tenía disminución de la fuerza. El tratamiento incluyó prednisona 50 mg inicial y reducción gradual por 10 días, gabapentina 400 mg/8 h, amitriptilina 25 mg/24 h y tramadol 50 mg/8 h por 2 meses. Se evaluó a la paciente a los 60 días y reportó ausencia del dolor aunque persistían aisladamente las parestesias.
En la RM se observó inflamación de raíces nerviosas lumbares bajas, además de un proceso inflamatorio de la duramadre adyacente (figs. 5 y 6).
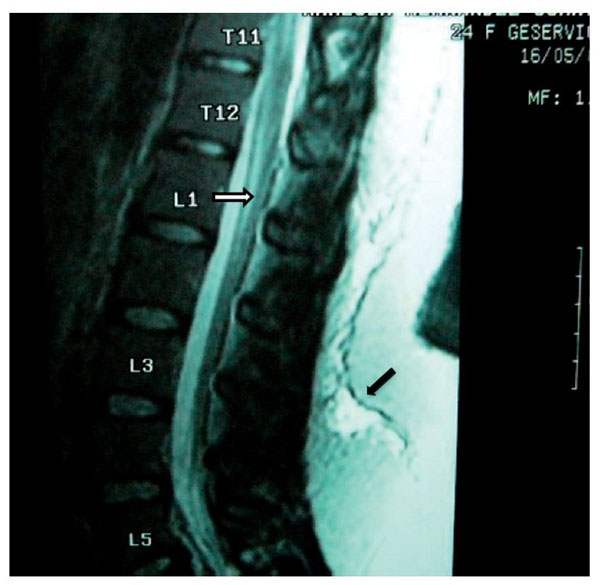
Figura 5 Vista sagital en la que se observa una lesión de la porción inferior de la médula
espinal (flecha), que se extiende de T12 a L2, con aparente rizo en la porción posterior de
la médula en el disco T12-L1. Hay una aparente fuga de líquido cefalorraquídeo en L1 que
se extiende caudalmente en los tejidos blandos hasta L4 (flecha negra).
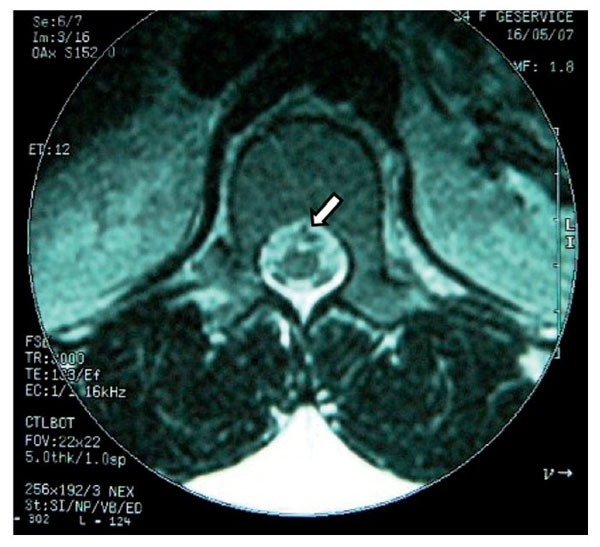
Figura 6 Vista axial en la que se observa edema de la médula y de las raíces anteriores
en posición que sugiere un seudoquiste (flecha).
Caso 4
Mujer de 27 años, primigesta en trabajo de parto que fue sometida a analgesia obstétrica con técnica epidural realizada con aguja de Tuohy 17 G en espacio lumbar L2-L3, colocando un catéter que produjo parestesia en el MII y aspiración negativa; se aplicó bupivacaína 0,5% ml y lidocaína 1% inyectada fraccionadamente. Aproximadamente a los 15 min la paciente se quejó de dolor y de bloqueo motor en el MII, que persistió durante la atención del parto (15 min). A los 60 min, ya en la sala de recuperación, el dolor continuaba en el mismo sitio, describiéndolo como ardiente, con paroxismos de "choques eléctricos" de intensidad 10, acompañándose de prurito, pesantez, sensación de debilidad en pierna izquierda e imposibilidad para la dorsiflexión del pie. Además, se identificó pie izquierdo caído, alodinia e hipoestesia en pierna y pie, la propiocepción estaba ausente. El reflejo patelar estaba disminuido y el de Aquiles ausente. El signo de Lasegué fue positivo. Su tratamiento consistió en ketorolaco, diclofenaco con complejo vitamínico B, dexametasona 8 mg intramuscular cada 8 h. Se solicitó consulta a especialista en medicina del dolor, quien prescribió metilprednisolona (MTP) 500 mg intravenosa (i.v.) cada 8 h por 3 días, pregabalina 150 mg/12 h, amitriptilina 25 mg por la noche y tramadol 50 mg/8 h. Solicitaron RM y electromiografía con velocidades neuroconducción. La imagen reportó "degeneración quística de la vaina nerviosa de L5 o variante anatómica de una doble raíz, así como proceso edematoso e inflamatorio de las raíces L5 y S1 (figs. 7 y 8). La electromiografía, tomada a los 45 días, concluyó que había "axonotmesis" del nervio peroneo izquierdo sin datos de reinervación". Al cuarto día se redujo la prednisolona a 10 mg diarios por vía oral (v.o.) por 10 días. A los 30 días la paciente fue enviada a rehabilitación. A los 90 días la paciente manifiesto disestesias nocturnas y la fuerza muscular había mejorado más del 80%. No hubo disfunción de esfínteres.
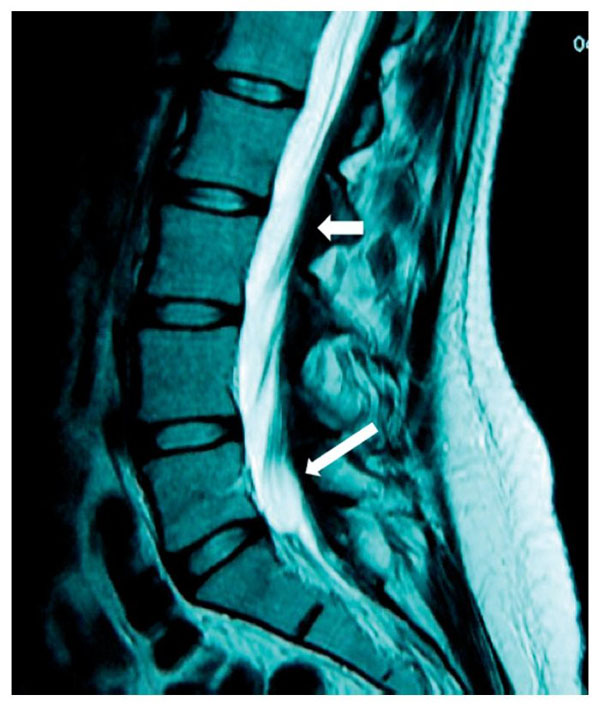
Figura 7 Vista sagital de la columna lumbar en la que se sugiere un adosamiento de las raíces en
el disco L2-L3 hasta el disco L4-L5, donde precisamente se aprecia una aparente duplicidad
de raíz anterior a la pared posterior del saco dural (flecha corta), hay prolongación en continuidad
de las raíces desde el disco L4-L5 hasta el disco L5-S1, que sugiere un seudoquiste (flecha larga).
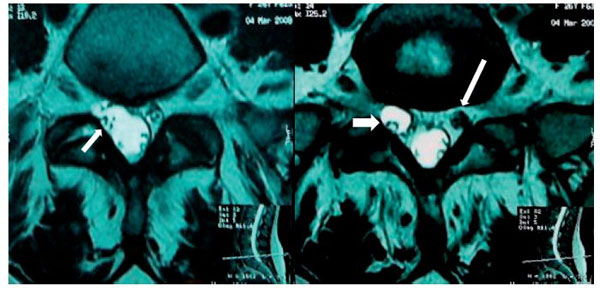
Figura 8 A) Vista axial de una resonancia magnética (RM) en la que se observa una alteración
de la morfología del saco dural (flecha) con extensión hacia el manguito que rodea la raíz derecha
de L5-S1, en la que sugiere una tracción de saco dural que rodea la raíz correspondiente. Hay
una clara espondilosis bilateral. B) Vista axial de RM del disco L5-S1 con el manguito que rodea
la raíz derecha L5 con el manguito distendido, probablemente por una obstrucción.
Raíz izquierda sugestiva de edema e inflamación (flecha blanca).
Caso 5
Mujer de 40 años de edad, ASA I que recibió anestesia raquídea para una histerectomía abdominal. En la sala de recuperación la paciente se quejó de dolor lumbar intenso (EVA 10), urente y sensación de choque eléctrico con irradiación hacia la pierna izquierda, asociándose con parestesias. Después de 48 h de la cirugía refirió cefalea, que se incrementaba al sentarse y deambular, motivo por el que aplicó parche hemático (15 ml) que aparentemente resolvió la cefalea, pero persistió el dolor en el MII, al cual se agregaron disestesias y disminución de la fuerza muscular en 3/5 y 4/5 en el derecho, así como incontinencia del esfínter vesical. El tratamiento consistió en analgésicos anti-inflamatorios no esteroideos, vitaminas, benzodiacepinas, y carbamacepina sin mejoría en la sintomatología. En el reporte de la RM tomada 8 meses después de la lesión, se notó un adosamiento de las raíces nerviosas lumbares en racimo (fig. 9) compatible con la imagen de aracnoiditis en la región lumbar, más evidente en L3-L4.
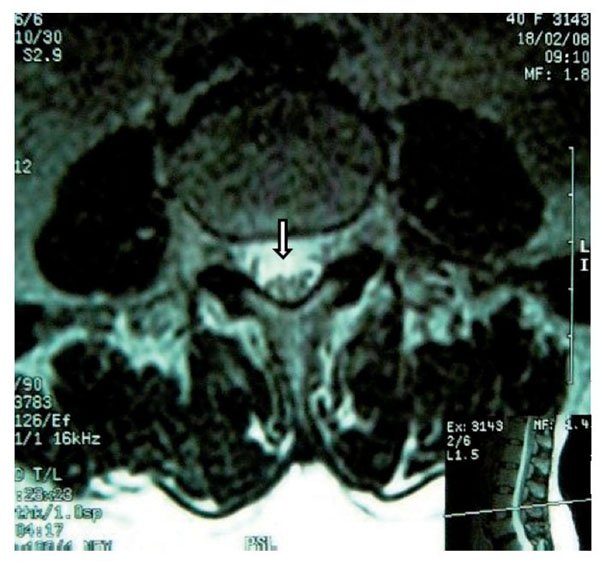
Figura 9 Vista axial de una resonancia magnética en la que se ven las raíces nerviosas distribuidas
asimétricamente, localizadas en la porción posterior del saco dural y adheridas unas a otras
en racimos a la altura de la vértebra L4.
Caso 6
Mujer de 28 años, programada para laparotomía exploradora con anestesia epidural lumbar, evaluada con una condición física ASA II. Durante el procedimiento anestésico la paciente se quejó de parestesia al introducir la aguja de Tuohy; en el período de recuperación anestésica permaneció con bloqueo sensitivo y motor de los miembros inferiores por más de 24 h, posteriormente recuperó movimiento y sensibilidad del lado derecho. El lado izquierdo empezó a recuperarse simultáneamente con dolor intenso, opresivo, punzante, urente con EVA de 10, sin recuperación motora, por lo que recibió tratamiento con pregabalina, tramadol y clonazepan, el dolor persistió sin mejoría funcional por los siguientes 5 meses. Al referirla a la clínica del dolor se encontró dolor continuo con EVA de 8, de las mismas características, además de dolor fulgurante en todo el miembro inferior, que aumentaba con movimiento. Se observó marcha claudicante, apoyada por muletas, miembros pélvicos asimétricos, izquierdo con hipotrofia con diferencia de 3 cm en muslo y pierna en comparación al derecho, hipostesia en los dermatomas L2 a S3, debilidad de músculos extensores, fuerza 3/5 en todos los grupos musculares, dorsiflexión ausente, reflejo patelar +++, aquileo ausente. La RM concluyó "el filum terminal presenta hiperintensidad lineal de L1 a L3, raíces nerviosas con disposición periférica simulando un "saco vacío" a partir de L5 a S1, que pudieran representar cambios por aracnoiditis adhesiva focal". La conducción de nervios y el electromiograma de las extremidades inferiores reportó "bloqueo axonal completo de nervios tibial y peroneo izquierdos e inestabilidad de membrana muscular (denervación)".
Posteriormente, se tomó otra resonancia que demostró, en una vista sagital de la región lumbosacra, que las raíces nerviosas estaban adheridas a la pared posterior del saco dural separándose anteriormente hasta la quinta vértebra lumbar, representando un seudoquiste debido al desplazamiento parcial de las raíces nerviosas hacia delante (anterior) (fig. 10).
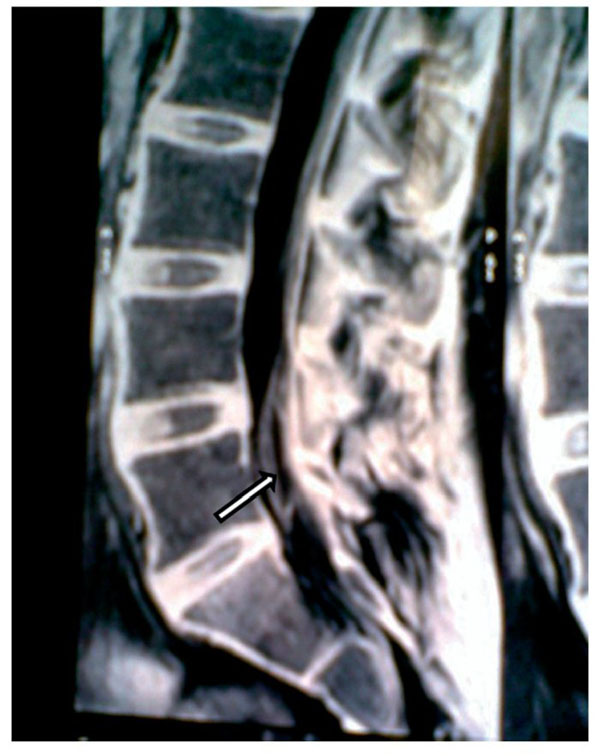
Figura 10 Vista sagital de una resonancia magnética de la columna vertebral e la que las raíces
nerviosas en L5 se han movilizado hacia delante, dando la imagen de un seudoquiste que
está adherido a la pared posterior del saco dural (flecha).
Caso 7
Paciente del sexo femenino de 39 años, que fue sometida a histerectomía total abdominal electiva con estado físico preanestésico ASA I, a quien se le administró anestesia regional con bloqueo epidural lumbar, insertando la aguja en el espacio L1-L2. Durante el procedimiento se produjo sensación de choque eléctrico de intensidad severa en la extremidad inferior derecha; después de administrar 15 ml de 1,5% de lidocaína, se produjo anestesia en glúteo, periné, vulva, ano y MID, y además permaneció un dolor ardoroso y sensación intermitente de choque eléctrico de EVA de 10, por unos 20 min. Una vez terminado el efecto del bloqueo y durante su estancia en el área de recuperación, reapareció el dolor de las mismas características y localización, agregándose parestesias, disestesias, adormecimiento e imposibilidad para mover el pie derecho así como dolor al contacto de la sabanas, sensación de cuerpo extraño en recto, estreñimiento, constipación, pujo y tenesmo, e incontinencia urinaria. La paciente recibió tratamiento a base de ketoprofeno, carbamacepina y dexametasona 4 mg v.o. diarios. El servicio de neurocirugía sugirió el mismo tratamiento por un período de 10 días más, sin producir resultados favorables; entonces fue referida a la clínica de dolor. Al evaluar a la paciente se encontró que tenia dolor de tipo neuropático ardiente con los mismos síntomas ya descritos; a la exploración física se encontró facies dolorosa, actitud antiálgica, marcha claudicante con apoyo en bastón, hipotrofia de muslo y pierna derechos, imposibilidad de marcha punta talón; los reflejos patelar y aquileo estaban ausentes en el lado derecho, y en el izquierdo disminuidos; la maniobra de Lasegué presente a 25º, fuerza muscular en MID; flexión y extensión 3/5; aducción abducción 3/5. Flexión y extensión de la pierna de 3/5, dorsiflexión y extensión del pie de 2/5. En el MII la fuerza muscular era 4/5 para todos los grupos musculares. La sensibilidad demostró hipostesia, disestesias, parestesias, alodinia en dermatomas L4, L5, S1 y S2 del lado derecho. Al tacto rectal se notó incremento en el tono del esfínter anal. El las imágenes sagitales de la RM se observó irregularidad y edema en el borde posterior en el saco dural en L3/L4; en los cortes axiales se notó aglutinación de las raíces en la parte posterior y medial del saco dural con discreta captación del medio de contraste en la parte posterior, sugiriendo aracnoiditis. Los estudios de velocidad de conducción nerviosa indicaron denervación en miotomas L5/S1 de predominio derecho. La electromiografía reportó una lesión mixta (en cono medular y en cauda equina).
Caso 8
Mujer de 24 años, programada para colecistectomía abierta electiva, con valoración preanestésica ASA I. Recibió anestesia combinada espinal-epidural con abordaje en T10-T11. Al intentar la punción epidural con aguja Tuohy se perforó la duramadre, provocando intensa parestesia que se irradió hacia la cabeza, miembro superior e inferior derecho, por lo que se retiró la aguja y se reinsertó en el espacio T12-L1 hasta obtener pérdida de la resistencia; posteriormente se coloco aguja espinal a través de la Tuohy y se inyectaron 12 mg de bupivacaína hiperbárica (dextrosa al 7,5%) en el espacio subaracnoideo, se retiró aguja espinal y se colocó un catéter epidural cefálico. La cirugía transcurrió sin incidentes y al finalizar se administraron 5 ml de sangre autóloga a través de catéter epidural, con objeto de sellar el orificio previamente causado mediante un "parche epidural profiláctico". A la inyección de sangre, la paciente nuevamente se quejó de dolor intenso en MID que persistió en sala de recuperación, por lo que fue vista por la clínica del dolor. Allí, la paciente refirió dolor intenso (EVA 10), parestesias espontáneas y sensación de adormecimiento en todo el MID, así como alodinia e hiperalgesia; las parestesias aumentaban al intentar mover el muslo derecho. También manifestó pérdida del control de esfínteres y disminución de la fuerza muscular 0/5 en MID y 3/5 en MII. La exploración física en el lado derecho reveló hipoalgesia e hipostesia en dermatomas T6 a T12 en el lado derecho, alodinia mecánica y térmica desde L1 hasta S1, ausencia de propiocepción de L3 a L5, y fuerza muscular 0/5 para todos los músculos. Los reflejos patelar disminuido, aquileo ausente y el tono del esfínter anal disminuido. El lado izquierdo con hipoalgesia e hipostesia de T10 a T11, disminución de la fuerza muscular en 3/5 para abductores, flexores y extensores, hiporreflexia patelar y del tendón de Aquiles. Fue imposible valorar la marcha porque no podía ponerse de pie. La imagen de RM demostró hematoma intramedular que abarcaba T11 y T12, con datos de aracnoiditis y zonas de poca intensidad en el cono medular (figs. 11 y 12). La paciente fue tratada inmediatamente con perfusión i.v. de MTP 1 g/12 h durante 5 días, gabapentina 600 mg v.o. cada 8 h, imipramina 10 mg v.o. cada 24 h y tramadol 100 mg cada 12 h. También se dio perfusión de lidocaína 200 mg i.v. diariamente por los primeros 3 días y se inició rehabilitación física moderada.
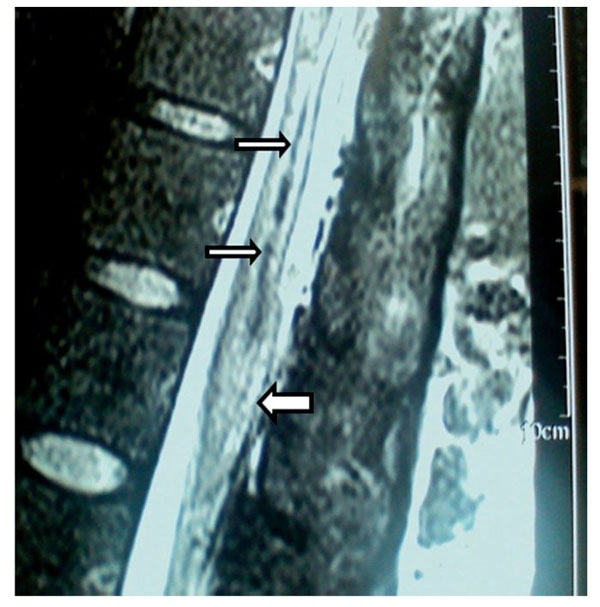
Figura 11 Imagen sagital de resonancia magnética en la que se observa un hematoma medular
de T11 (flechas estrechas), y el contraste en el cono medular (flecha gruesa) sugiere una extensión
fibrilar causada, probablemente, por el parche hemático.
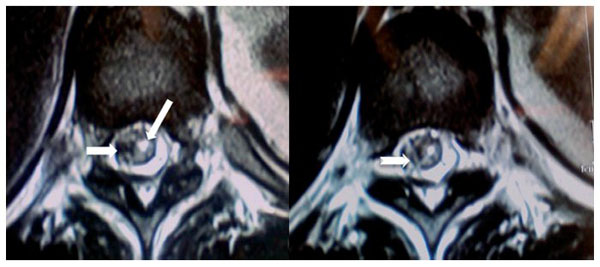
Figura 12 A) Corte axial en T11 donde se observa, en la posición derecha, un hematoma
intramedular y, en la posición izquierda, el conducto central desplazado (flechas). B) Se observan
2 trayectos de inserción, y entrada de la aguja de Tuohy al saco dural y médula en forma de X (flecha).
Su evolución fue favorable, con disminución del dolor en las primeras 48 h, desaparición de la alodinia al quinto día, así como mejoría gradual del déficit motor pero persistiendo con parestesias en MID, por lo que se decidió continuar con MTP por 5 días más a dosis de 500 mg i.v. cada 24 h y con los otros medicamentos sin cambio. A los 10 días de iniciar el tratamiento, la paciente realizó movimientos voluntarios de MID, aunque continuó con disminución de la fuerza muscular de 2/5 en MID y 4/5 en MII, reportando además recuperación parcial de la función de esfínteres, normalizando la función a los 20 días. El tratamiento continuó con gabapentina 300 mg v.o. cada 8 h, tramadol más paracetamol (37,5 mg con 325 mg) e imipramina 10 mg v.o. diariamente.
Dos meses después había recuperación completa de los esfínteres y de la actividad sexual; la fuerza muscular era de 5/5 en MII y aún con 4/5 en MID. Continuaba tomando gabapentina 300 mg cada 12 h v.o. A los 6 meses, la paciente se encontró en condiciones de poder regresar a su trabajo, recuperada clínicamente en un 90% del problema motor, con una imagen de RM que sugiere una mejoría importante de la lesión medular, conservando aún una alteración que semeja un higroma residual (figs. 13 y 14).
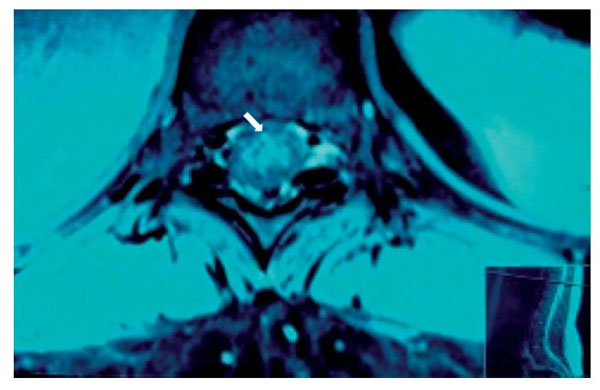
Figura 13 Corte axial de resonancia magnética, tomada 6 meses después de la lesión, en la que
se observa higroma medular a la altura de T11 donde se encontraba el hematoma y la lesión inicial (flecha).
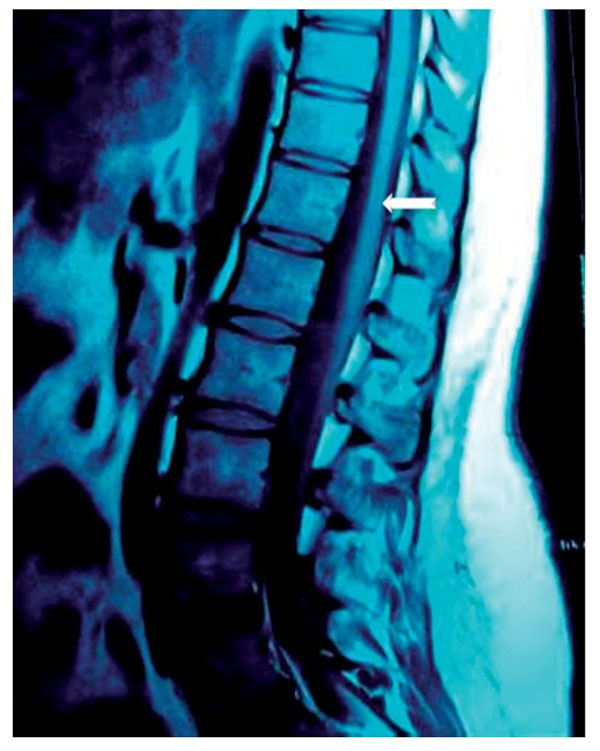
Figura 14 Corte sagital de resonancia magnética, tomada 6 meses después del episodio.
En la médula espinal se observa un pequeño sirinx en la lesión (flecha). Por lo demás,
se ve recuperada casi en su totalidad.
Discusión
Los síndromes de déficits neurológicos subsecuentes a anestesia extra e intradural generalmente se producen por intervenciones dentro del canal vertebral. Se ha considerado que en intervenciones del raquis con intención de producir anestesia neuroaxial, las agujas o catéteres introducidos en el neuroeje, seguidas a menudo por la administración de anestésicos locales y otros medicamentos adyuvantes (opiáceos, NaHCO3, vasoconstrictores, benzodiacepínicos y otros), que en ciertas condiciones pueden ser neurotoxicos9-11, sobre todo cuando se administran después de un contacto o punción de una raíz nerviosa o de la médula espinal9, representado como parestesia, la cual se considera una manifestación ominosa como preludio a una complicación neurológica seria6,8. En los 8 casos aquí descritos se presentaron parestesias (tabla 1), lo cual confirma observaciones anteriores7, advirtiendo que la rutina usual12,13 de proceder a inyectar anestésicos locales subsiguientes al presentarse parestesias debe reconsiderarse y, si es posible, administrar sólo medicamentos sin aparente posibilidad de neurotoxicidad (opiáceos), complementando con adyuvantes intravenosos o, si es necesario, considerar anestesia general.
La administración de anestésicos locales en altas concentraciones14, con bajo15 o alto11,16 pH se han involucrado como agentes causantes de algunos casos de déficits neurológicos postanestesia raquídea o epidural. Todos los anestésicos locales se han considerado potencialmente neurotóxicos si se dan en altas dosis o concentraciones17,18. Actualmente, se consideran varios mecanismos propuestos para explicar tales lesiones; los más en boga y con mayor aceptación son los de Kitagawa et al19, que proponen que debido a sus propiedades detergentes producen disrupción de la membrana axonal; mientras que Johnson et al20 demostraron lesiones de las mitocondrias neurales mediadas por activación de la caspasa, sobre todo producida por lidocaína21; mientras que Haller et al22 notaron que la misma lidocaína producía neurotoxicidad a través de mediación especifica del p38 mitógeno-activado por la proteína cinasa y mediado por metabolitos del ácido araquidónico. Obviamente, la lidocaína se ha estudiado con más frecuencia. Es posible que algunos de los mecanismos mencionados también participen en la toxicidad notada después del uso de otros agentes anestésicos locales, aunque esta posibilidad no se ha confirmado objetivamente. Sin embargo, se ha considerado que estos fármacos son potencialmente neurotóxicos al ser inyectados en el canal vertebral, sobre todo en concentraciones altas23, volúmenes exagerados24, estenosis vertebral25 en que se atrapan las dosis usuales por largo tiempo, especialmente si se usan en soluciones hiperbáricas26, y cuando hay antecedentes de enfermedades neurológicas previas (poliomielitis, esclerosis múltiple, radiculopatía por fibrosis epidural y otras patologías semejantes)27,28.
Aunque la secuencia de lesión traumática de raíces nerviosas seguida por la administración de anestésicos locales rara vez se identifica como la causa de esas complicaciones3-7, para racionalizar su mecanismo debe reconocerse las peculiaridades de la anatomía de las raíces nerviosas que en su trayecto desde su salida de la médula espinal hasta su éxodo de la columna vertebral, pasando por el foramen lateral y a través del manguito de la duramadre, se encuentran desprotegidas, ya que no tienen la cubierta de mielina que provee el perineuro, de tal forma que el trauma directo producido por el bisel de las agujas de Tuohy 16 a 18 G y aun las mismas agujas de raquia que en las últimas décadas se han empleado, 25, 27 G y a veces hasta 29 G, pueden lesionar traumáticamente la médula espinal o las raíces nerviosas contenidas en el saco dural, ya que se encuentran sin la protección de mielina (fig. 15). Estas lesiones generalmente se manifiestan con sensación de parestesias (choque eléctrico) dirigidas hacia las extremidades inferiores si la punción se realiza en una de las raíces nerviosas; por otra parte, si se lesiona la médula espinal la sensación de parestesia se va a percibir en el cerebro y/o en las extremidades superiores28. Frecuentemente, suelen resultar no sólo en fuga del líquido cefalorraquídeo sino también en un síndrome que se caracteriza por lumbalgia, rigidez de cuello, meningismo, postración y cefaleas dependientes de la postura. Que a veces suelen concluir en higromas intracraneales o intramedulares, lesiones del cono medular, por lo que se consideran un signo ominoso de probable compromiso neurológico7,8,9,29,30.
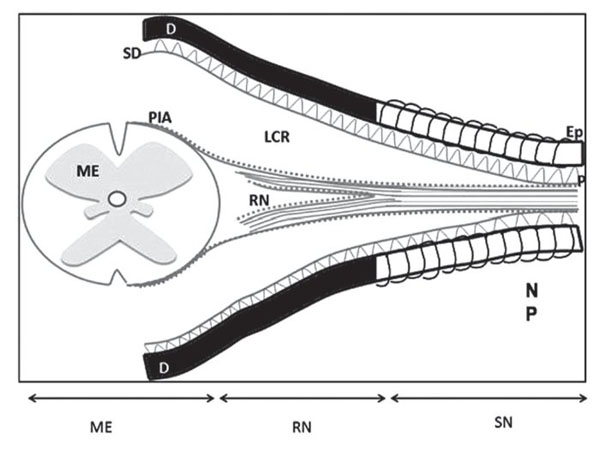
Figura 15 Esquema de la médula espinal y su contenido. El perineuro es una continuación del
la aracnoides; el epineuro es una continuación de la duramadre; el endoneuro cubre y rodea
los axones. D: duramadre; Ep: epineuro; LCR: líquido cefalorraquídeo; ME: médula espinal;
NP: nervio periférico; P: perineuro; PIA: piamadre; RN: raíz nerviosa; SD: subdural.
En los casos en que el anestésico local se administró después de una parestesia, hay la posibilidad de que penetre a través del orificio hecho por la aguja en el perineuro, entonces se considera que los axones han sido dejados vulnerables y expuestos a una concentración del anestésico local considerada aceptable si se da extradural y la dura esta íntegra; pero al administrarse extradural con un orificio adyacente en la duramadre, entonces permite su paso a través de ese orificio creado por la aguja en la dura y en el perineurio, convirtiéndose en sustancias neurotoxicas (fig. 16) para los axones17-19,23-26.
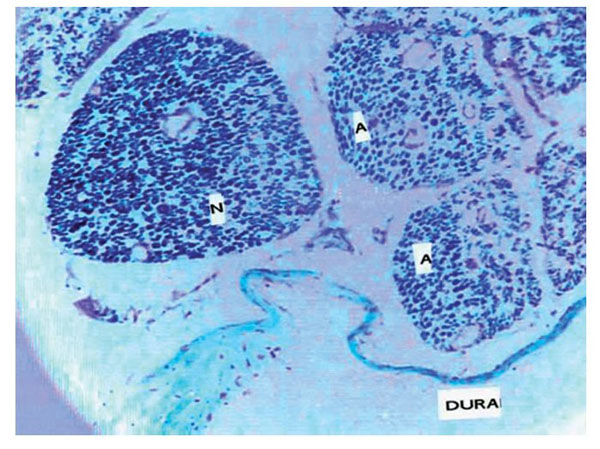
Figura 16 Macrofotografía de un corte microscópico de duramadre y raíces nerviosas en rata,
en la que se observa una raíz normal (N) y el efecto de la administración de bupivacaína que había
penetrado a través de una punción dural en raíces con axones afectados por ésta (A) (×30).
En la paciente descrita en el caso 1, la parestesia usualmente implica punción de la duramadre y lesión de unas de las raíces lumbares; por la evidencia del "pie caído" y la reducción de las funciones sensitiva y motora, así como los cambios de los reflejos, sugieren que fue la raíz L5 la afectada. Otero et al11 demostraron que el bicarbonato de Na con un pH de 8,4, usado en proporción de 1:10, sube el pH de la lidocaína 2% de 6,8 a 7,8, pudiendo ocurrir algo semejante cuando el pH del anestésico es muy ácido, como la cloroprocaína (2,8 a 3,1)24,31 o cuando se agrega adrenalina a los anestésicos locales, requiriendo un pH bajo para evitar la oxidación11.
Aunque el curso clínico y las imágenes radiológicas que representan los déficits neurológicos de cada paciente son diferentes, se encuentra una cierta similitud aunque con características variables, por ejemplo: punciones de la médula espinal resultaron en un cuadro clínico más severo que frecuentemente afectaba ambas extremidades, aunque siempre un miembro inferior pareció ser más afectado que el otro, generalmente coincidiendo con el sitio de la lesión radicular, lo cual se relaciona con otros reportes32,33.
Pacientes tratados consistentemente con el protocolo terapéutico recomendado (casos 3, 4 y 8) evolucionaron más favorablemente que los que no lo recibieron o en los que no se llevó a cabo en su totalidad; lo cual reveló la importancia de ejecutar el protocolo íntegramente durante la "ventana de oportunidad" poslesión apropiada. Igualmente, los pacientes que recibieron elementos del protocolo, pero no en las dosis ni en la duración recomendada (casos 1, 2, 5, 6 y 7), tuvieron mejoría insignificante o no la tuvieron.
La evolución clínica de los pacientes que recibieron los medicamentos enlistados, en las dosis, la posología y la duración recomendadas parecen haber evolucionado más favorablemente, ya que su mejoría fue más pronta y persistente. Específicamente, el dolor lumbar severo, las alteraciones de la sensibilidad, los déficits motores y la disfunción de esfínteres fueron corregidos más rápida y perdurablemente, lo cual fue semejante a lo reportado por Aldrete y Ghaly8. De los medicamentos empleados, la MTP es la más esencial, administrada en dosis y posología recomendadas, ya que su efecto antiinflamatorio es notable y superior a los de los otros corticosteroides.
Racionalización
Ya que la aracnoides se considera como el "guardián" inmunológico del sistema nervioso central, al penetrar cualquier objeto o sustancia extraña en el saco dural, incita a que un proceso inflamatorio se inicie con liberación de mediadores tisulares que primero producen vasodilatación. Eventualmente se liberan las citocinas en un intento de bloquear tal invasión, activando el eje hipotalámico-hipófisis-adrenal (H-P-A) (fig. 17). Tal función paradójica se ha descrito como "algo de inflamación es útil, pero por demasiado tiempo o en cantidad excesiva, es desastrosa".
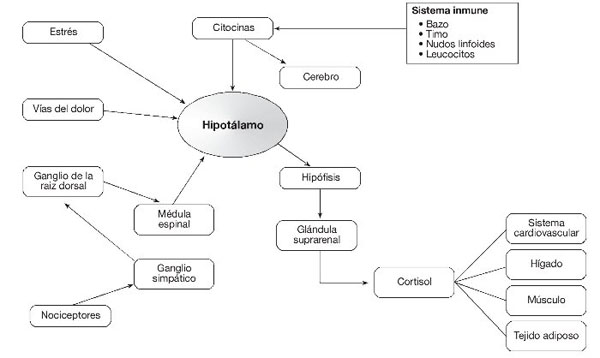
Figura 17 Relaciones entre el sistema inmunológico y el eje hipófisis-pituitario-adrenal.
Al estimularse el eje H-P-A, se incita la convergencia de citocinas alrededor del plexo hipofisiario, regulando la secreción de corticotropina que a su vez induce y regula la secreción de cortisol por las glándulas suprarrenales34. Una vez convertido en cortisona, a través de un proceso enzimático, ésta se localiza en receptores de esteroides que son relativamente específicos, ya que pueden inhibir la inflamación a través de efectos genómicos y de mecanismos no genómicos. Generalmente, se encuentran inactivos en el protoplasma celular pero pueden ser activados por un proceso de fosforilación35. Las interacciones entre el eje H-P-A y otros componentes del sistema inmune aparecen en la figura 17, en la que se ilustra como las citocinas y otros mediadores activan los receptores periféricos de dolor cuyos axones llegan al cuerno dorsal de la medula espinal, haciendo sinapsis con el tracto de lemniscos que generalmente transporta estímulos dolorosos hacia el tálamo y la corteza somatosensorial (fig. 17). Las citocinas también actúan directamente sobre el cerebro, estimulando la acción del eje H-P-A, sugiriendo que el dolor físico, las emociones traumáticas y la disminución de la ingestión de calorías pueden ocurrir en sinergismo, afectando la evolución clínica36.
Algunas observaciones experimentales
El uso terapéutico de los esteroides para prevenir daño tisular en casos de trauma medular ha sido demostrado por Means et al37 en felinos, por Chicawa et al38 en murinos y Braughler et al39 en un modelo experimental. Ghaly40, al administrar dosis amplias de MTP, revirtió el deterioro de un paciente con un hematoma epidural intracraneano, antes de evacuarlo quirúrgicamente. Su utilidad en edema cerebral ha sido demostrada por Hall41, usando dosis elevadas (30 mg/kg).
Se ha observado que la MTP a dosis altas (30 mg/kg), inhibe la peroxidasa de lípidos y reduce la formación de radicales libres42,43, además ofrece neuroprotección al inhibir la transcripción de citocinas inflamatorias, al activar a través del receptor del glucocorticoide y de las ínterleucinas (IL) (proteínas fosforiladas o glucosiladas), específicamente la IL-6 involucrada en la regulación de respuestas inmunoinflamatorias. Otros procesos relacionados, que tienen un rol multifactorial, son los llamados "procesos secundarios a la injuria" que participan en la síntesis de radicales libres y citocinas. Al respecto, se ha notado que si se interviene administrando la IL-1-beta a tiempo, se reducen significativamente las lesiones tisulares en el cerebro y en la médula espinal. Fu y Saporta44 notaron que MTP en dosis suficientes suprimió la activación de células gliales que participan en la liberación de mediadores de las citocinas e interrumpen la producción de radicales libres45, notaron que las citocinas se encuentran generalmente en el nivel medular lesionado, así como en un espacio arriba y otro debajo de éste, pero sólo se encontraron valores elevados de citocinas en el sitio de la lesión, supuestamente secretadas por neuronas, células gliales y leucocitos presentes alrededor de la lesión traumática46.
Metilprednisolona y traumatismo en la médula espinal
Quizás los esfuerzos más notables que han demostrado la eficacia de la MTP en lesiones traumáticas celulares han sido los trabajos de Bracken47, que ha llevado a cabo estudios comparativos (frente a naloxona)48, controlados y aleatorizados, así como la determinación de la "ventana de oportunidad" durante la cual se encontró los mejores resultados49. El mismo grupo llevó a cabo estudios comparativos de la eficacia de MTP frente a naloxona, que soportaron la eficiencia de la primera50 y, eventualmente, investigaron cuál era el tiempo óptimo antes del cual se debería de administrar la MTP para obtener los mejores resultados51.
Eventualmente, se desató un debate acerca del análisis estadístico de las series del grupo de Bracken52, objetando la selección de los grupos que, aparentemente, no calificaban para ser aceptados bajo el criterio de "medicina basada en la evidencia". Subsecuentemente, Rakchesky et al53 notaron que los cálculos de la cantidad de tejido medular recobrado se habían realizado incorrectamente, lo que motivó que la Asociación de Cirujanos Neurólogos de Estados Unidos emitiera una advertencia sugiriendo que "el tratamiento de las lesiones traumáticas de la médula espinal con MTP debería considerarse como una opción, ya que puede producir efectos adversos"54. No obstante estas opiniones negativas, los trabajos de Braken55 y otros56 han continuado con resultados alentadores.
Es evidente que heridas en la médula espinal o en las raíces nerviosas por punción de agujas o por catéteres, son de menor cuantía física que las producidas por contusión o por desgarro traumático directo en la médula espinal, de todos modos, resultan en lesiones anatómicas y funcionales graves, sobre todo al agregar medicamentos potencialmente neurotóxicos y/o sangre, que pueden, en conjunto, producir daño tisular y funcional medular permanente afectando las funciones vesical, rectal y sexual, además de producir un dolor neuropático constante.
Protocolo terapéutico
La experiencia recientemente publicada por Aldrete y Ghaly8 se adquirió cuando los médicos tratantes se comunicaron, por internet o por teléfono, con los autores, quienes sugirieron emplear el protocolo que a continuación se describe:
- MTP 500 mg en perfusión, diluida en 250 ml de 0,9% de NaCl administrada en 2 h por 5 días consecutivos. Si a la semana siguiente todavía hay algunos de los síntomas originales, se recomienda dar otra serie de MTP por 3 días.
- Antiinflamatorios, que pueden ser indometacina 50 mg, celecoxib 200 mg o dipirona 500 mg 2 veces/día, con los alimentos o acompañado de un antiácido, por 6 semanas o más.
- Anticonvulsionante, que puede ser gabapentina 400 mg 3 veces al día o pregabalina 75 mg 2 veces al día, por 6 semanas o más.
- Antidepresivos tricíclicos v.o., amitriptilina o nortriptilina 10 mg 3 veces/día o 25 mg 2 veces al día, por 3 semanas o más.
- Agonista de los receptores adrenérgicos alfa2, como clonidina, 0,1 mg v.o. 2 veces al día por 2 semanas si hay componente sensorial (hiperestesia, alodinia, hiperalgesia, etc.), o un parche de 0,1 mg aplicado en el dorso del pie de la extremidad más afectada.
- Si el dolor persiste como síntoma predominante, se agrega perfusión i.v. diaria con bloqueadores de receptores NMDA, como lidocaína 5 mg/kg con o sin ketamina 0,4 mg/kg, cuando los pacientes se quejan de espasmos musculares o sensación de torniquete en el miembro inferior se puede incorporar a la perfusión 15 mg/kg de MgS04 goteado en 2 h cada día, o 400 mg 3 veces al día v.o. hasta que estos síntomas sean manejables por vía oral.
- Como suplemento analgésico se ha utilizado tramadol 50 mg con o sin acetaminofen 500 mg, propoxifeno 50 mg o dipirona 500 mg, 3 veces al día.
Observaciones clínicas preliminares
Como se ha mencionado anteriormente, debe reconocerse que las lesiones causadas en la médula espinal y/o a las raíces nerviosas secundarias a la anestesia neuraxial son de diferente intensidad y efecto que las observadas en casos de lesiones postraumáticas, por lo que comparaciones entre ambas son limitadas. Se reconoce que es difícil determinar la efectividad de un protocolo terapéutico con sólo los 8 casos aquí presentados, por lo que se mencionan los reportes previos por Aldrete y Ghaly8 y de Ghaly40 para apoyar tal premisa. De cualquier manera, se intenta informar a los lectores de la posibilidad de revertir, parcial o totalmente, los déficits neurológicos que ocasionalmente suelen ocurrir después de anestesia neuraxial y después de intervenciones quirúrgicas en el raquis. Ya que el proceso inflamatorio que caracteriza la fase inicial de la aracnoiditis es breve, se sugiere iniciarlo prontamente, una vez que se confirme el diagnóstico mediante consulta a un neurólogo y una RM de la columna lumbosacra y, si es necesario, hasta de la región torácica, dependiendo del nivel sensorial y motor que prevalezca afectado.
Estos 2 prerrequisitos son importantes porque complicaciones como el hematoma epidural, las infecciones, los tumores y otros necesitan intervenirse quirúrgicamente con urgencia si producen tal grado de déficit neurológico. En la experiencia inicial se utilizó el protocolo para tratar 26 pacientes que fueron referidos a uno de los autores (JAA), hasta el 1 de abril de 2008; se incluyeron también otros 38 pacientes, diagnosticados con aracnoiditis en fase inflamatoria, que fueron examinados durante la fase aguda, pero no tratados con el protocolo, los cuales sirvieron de grupo control56. Los resultados se describen en la tabla 2.
A pesar de que el grupo tratado antes de los 3 meses tuvo una regresión de síntomas más exitosa, es de interés una paciente lesionada al poner un bloqueo peridural en trabajo de parto, con subsecuente dolor lumbar y disfunción de esfínteres rectal y vesical, que fue tratada 7 meses después y que tuvo una mejoría importante, sugiriendo que quizás el límite de 90 días es variable. Los pacientes en el grupo control (no tratado) desarrollaron aracnoiditis permanentemente, demostrada por continuación de los síntomas e imagenología.
Se recomienda que el tratamiento se adhiera al protocolo descrito, en dosis, periodicidad y secuencia, para obtener los resultados más deseables y prevenir un síndrome neurológico y/o aracnoiditis de carácter permanente.
Se reconoce que las críticas promovidas por asociaciones profesionales deben tenerse en cuenta; sin embargo, en este caso, la ausencia de alternativas impide ofrecer una opción que pudiese ser de beneficio a pacientes en una situación desesperada. Obviamente, estas opciones deben considerarse dentro del margen riesgo-beneficio; en caso de no intervenir oportunamente puede que se presente la aracnoiditis proliferativa, la cual desarrolla mayor tejido cicatricial, fibrosis y adherencias entre las mismas raíces o bien con la pared interna del saco dural, impidiendo el movimiento natural del tejido nervioso por un anclamiento. Esto, a su vez, condiciona dolor en el paciente cada vez que se mueve57. Tales consecuencias merecen el intento de un esfuerzo terapéutico basado en dirigir la reacción inflamatoria hacia una función restaurativa.
Usubiaga58, en su clásica revisión de complicaciones neurológicas de 1977, lamentó: "es preciso confesar que, hasta esta fecha, el tratamiento de las secuelas neurológicas debidas a la anestesia epidural ha resultado insatisfactoria en grado sumo". El protocolo aquí descrito parece ofrecer la primera resolución efectiva de los déficits neurológicos que ocurren después de anestesia neuroaxial, siempre y cuando se sigua diligentemente lo aquí descrito, si se administra en cuanto se establezca el diagnóstico, preferentemente antes de 90 días postepisodio injurioso. La realidad actual es que cualquier mejoría debe aprovecharse, mientras que no haya efectos secundarios adversos, esperando que en el futuro se puedan hacer más adelantos.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Horlocker TT, Abel MD, Messick JM Jr, Schroeder DR. Small risk of serious neurologic complications related to lumbar epidural catheter placement in anesthetized patients. Anesth Analg. 2003;96: 1547-52. [ Links ]
2. Horlocker TT, McGregor DG, Matsushige JM, Schroeder DR, Besse JA. A retrospective review of 4767 consecutive spinal anesthetics: CNS complications. Anesth Analg. 1997;84:578-84. [ Links ]
3. Moen V, Dahlgren N, Iristedt L. Neuroilogical complications after central neuraxial blockades in Sweden. 1990-1999. Anesthesiology. 2004;101:950-9. [ Links ]
4. Auroy Y, Benhamou D, Brages L, et al. Major complications of regional anesthesia in France. The SOS Regional Anesthesia Hot Line service. Anesthesiology. 2002;97:1274-80. [ Links ]
5. Aroma U, Lahdensuu M, Cozanitis DA. Severe complications associated with epidural and spinal anaesthesia in Finland. 1987-1993: A study on patients' insurance claims. Acta Anaesthesiol Scand. 1997;41:445-52. [ Links ]
6. Chenney FW, Domino KB, Caplan RB, Posner KL. Nerve injury associated with anesthesia: a closed claim analysis. Anesthesiology. 1999:90:1062-9. [ Links ]
7. Lofsky AS. Complications of cervical epidural blocks attract Insurance company attention. APSF News Letter. 2005;20:45-60. [ Links ]
8. Aldrete JA, Ghaly RF. Timing of early treatment of neurological deficits postintervention and operative spinal procedures. Anesthesiology. 2008;109:A1704. [ Links ]
9. Tezlaff JE, Detzler JA, Wu C, Smith MP, Bell G. Influence of lumbar spine pathology on the incidence of paresthesia during spinal anesthesia. Reg Anesth Pain Med. 1998;23:560-3. [ Links ]
10. Rowlingson JC. Toxicity of local anesthetic additives. Reg Anesthe. 1993;18 6 Suppl:456-60. [ Links ]
11. Otero P, Aldrete JA, Terragona L, Guizar G. Síndrome de cauda equina y arachnoiditis consecuencia de una puncion dural incidental e inyeccion de lidocaína + NaHCO3 epidural: informe de dos casos y observaciones de laboratorio. Rev Arg Anest. 2005; 63:150-5. [ Links ]
12. Parry H. Spinal cord damage. Anaesthesia. 2001;56:290. [ Links ]
13. Selander D. Neurotoxicity of local anesthetics: animal data. Reg Anesth. 1993;18:461-8. [ Links ]
14. Lambert LA, Lambert DH, Strichartz GR. Irreversible conduction block in isolated nerve by high concentrations of local anesthetics. Anesthesiology. 1994;80:1082-93. [ Links ]
15. Moore DC, Spierdijk J, Van Kleef MD, Coleman RL, Love GF. Chloroprocaine neurotoxicity: four additional cases. Anesth Analg. 1982;61:151-9. [ Links ]
16. Rackle JP, Jourden L, Benknadra A. Effect of adding Na bicarbonate to bupivacaine for spinal anesthesia in elderly patients. Anesth Analg. 1988;67:570-3. [ Links ]
17. Pizzolato P, Renegra OJ. Histopathologic effects of long exposure of local anesthetics on peripheral nerves. Anesth Analg. 1959;38:138-44. [ Links ]
18. Gentili F, Hudson AR, Hunter D, Kline DG. Nerve injection injury with local anesthetic agents: a light and electron microscopic, fluorescence microscopic and horseradish peroxidase study. Neurosurgery. 1980;6:263-72. [ Links ]
19. Kitagawa N, Oda M, Totoki T. Possible mechanisms of irreversible nerve injury caused by local anesthetics: detergent properties of local anesthetic and membrane disruption. Anesthesiology. 2004;100:967-7. [ Links ]
20. Johnson ME, Uhl CB, Spittier K, Wang H, Gores GJ. Mitochodrial injury and caspase activation by the local anesthetic lidocaine. Anesthesiology. 2004;101:1184-94. [ Links ]
21. Hall ED. Neuroprotective action of glucocorticoid and non-glucocorticoid steroids in acute neuronal injury. Cell Molec Neurobiol. 1993;13:415-32. [ Links ]
22. Haller I, Hausott B, Tomaselli RA, Keller C, Klimaschewski L. Neurotoxicity of lidocaine involves specific alteration of the p38 mitogen-activated protein kinase, but not extracellular signal-regulated or c-jun N-terminal kinases, and is mediated by arachidonic acid metabolites. Anesthesiology. 2006;105:24-33. [ Links ]
23. Casatti A, Fanelli G, Aldegheri G, Leoni A, Casaletti E. A transient urologic deficit following intrathecal injection of 1% bupivacaine hyperbaric for unilateral spinal anesthesia. Europ J Anaesthesiol. 1998;15:112-3. [ Links ]
24. Covino BG, Marx GT, Finster M, Zsigmond EK. Prolonged sensory/motor deficits following inadvertent spinal anesthesia. Anesth Analg. 1980;59:399-40. [ Links ]
25. López-Soriano F, Lajarín B, Verdún JM, Rivas F, López RJ. Cauda equina hemysindrome after intradural anesthesia with bupiva-caine for hip surgery. Rev Esp Anest Reanim. 2002;49:494-6. [ Links ]
26. Rudolph H, De Jong HR. Last round for a "heavyweight". Anesth Analg. 1994;78:2-4. [ Links ]
27. Vandam DL. Concerning neurologic sequelae of spinal anesthesia. Anesthesiology. 2004;100:176-7. [ Links ]
28. Aldrete JA. Neurologic deficits and arachnoiditis from neuraxial anaesthesia. Acta Anaesthesiol Scand. 2003;47:3-12. [ Links ]
29. Reynolds F. Damage to the conus medularis following spinal anaesthesia. Anaesthesia. 2001;56:238-47. [ Links ]
30. Tsui BHC, Asmstron K. Can direct spinal cord injury occur without paresthesia? A report of spinal cord injury after epidural placement in an awake patient. Anesth Analg. 2005;101:1212-4. [ Links ]
31. Aldrete JA. Neurological deficit and arachnoiditis from chloro-procaine intended epidural entering the subdural space. Submited for publication. [ Links ]
32. Sghirlazoni A, Marazzi R, Pareyson D, et al. Epidural anesthesia and spinal arachnoiditis. Anaesthesia. 1989:44;317-20. [ Links ]
33. Aldrete JA, Ferrari H. Myelopathy with syringomyelia following thoracic epidural anaesthesia. Anaesth Intensive Care. 2004;32: 100-3. [ Links ]
34. Nesaturay S. Steroids and spinal cord injury: revisiting the NASCIS-2 and the NASCIS-3 trials. J. Trauma. 1998;45:1088-93. [ Links ]
35. Rhen T, Cidlowoski JA. Anti-inflammatory action of glucocorticoids-new mechanism for old drugs. N Eng J Med. 2005;353:1711-23. [ Links ]
36. Radwas IA, Saito S, Goto F. Neurotrophic factors can partially reverse morphological changes induced by mepivacaine and bupivacaine in developing sensory neurons. Anesth Analg. 2003; 97:503-11. [ Links ]
37. Means ED, Anderson DK, Waters TR, Anderson DK. Effects of MTP in compression trauma to the feline spinal cord. J Neurosurg. 1981;55:200-8. [ Links ]
38. Chicawa T, Ikata T, Katoh S, et al: Preventive effect of lecithinized superoxidase dismutase and MTP on spinal cord injury in rats; transcriptional regulation of inflammatory and neuropathic genes. J Neurotrauma. 2001;18:93-103. [ Links ]
39. Braughler JM, Hall ED, Means ED, et al. Evaluation of intensive MTP Na succinate dosing regimen in experimental spinal cord injury. J Neurosurgery. 1987;67:102-5. [ Links ]
40. Ghaly RF. Recovery after high dose methylprednisolone and delayed evacuation. J Neurosurg Anesth. 2001;13:323-8. [ Links ]
41. Hall ED. Neuroprotrctive actions of glucocoticoid and non-glucocorticoid steroidal in neuronal injury. Cell Molec Neurobiol, 1993;338:47-54. [ Links ]
42. Hashimoto K, Hampl K, Nakamura Y, Bollen AW, Feiner J, Drasner K. Epinephrine increases the neurotoxic potential of intrathecally administered lidocaine in the rat. Anesthesiology. 2001;94:876-81. [ Links ]
43. Takeda K, Sawamura S, Sekiyama H, Tamai H, Hanaoka K. Effect of methylprednisolone on neuropathic pain and spinal glial activation in rats. Anesthesiology. 2004;100:1249-57. [ Links ]
44. Fu ES, Saporta S. Methylprednisolone inhibits production of Interleukin-1beta and Interleukin-6 in the spinal cord following compression injury in rats. J Neurosurg Anesthesiol. 2005;17: 82-5. [ Links ]
45. Hayashi M, Ueyama T, Senba E. Expression of neurotropin and IL-1beta, RNAs following spinal cord injury and the effects of MTP. Kaibogaku Zasshi. 1997;72:209-13. [ Links ]
46. Weller RO, Engelhardt B, Phillips MJ. Lymphocyte targeting of the central nervous system: a review of afferent and efferent CNS-immune pathways. Brain Pathol. 1996;6:275-88. [ Links ]
47. Bracken MB, Collins WF, Freeman DF, Shepard MJ, Wagner FW, Silten RM, et al. Efficacy of MTP in acute spinal cord injury. JAMA. 1984;254:45-54. [ Links ]
48. Bracken MB, Theodore R, Holford TR. A randomized control trial of MTP or naloxone in the treatment of spinal cord injury: results of the second national acute spinal cord injury study. N Eng J Med. 1990;322: 1405-11. [ Links ]
49. Bracken MB, Shepard MJ, Collins WF, Holford TR, Young W, Baskin DS, et al. Methylprednisolone or naloxone treatment after acute spinal cord injury: 1 year follow-up data. J Neurosurgery. 1992;76:23-31. [ Links ]
50. Bracken MB, Shepard MJ, Collins WF, Holford TR, Baskin DS, Eisenberg HM, et al. Effects of timing of MTP or naloxone administration and the recovery of segmental and long tract neurological function in NASCIS2. Neurosurgery. 1993;79:500-7. [ Links ]
51. Bracken MB, Shepard MJ, Holford TR, Summers LL, Aldrich EF, Fazl M, et al. Administration of MTP for 24 or 48 hrs or tirilazad mesylate for 48 hrs in the treatment of acute spinal cord injury. Results of the 3rd National Acute Spinal cord injury randomized Controlled trial. JAMA. 1997;277:1397-604. [ Links ]
52. Fehlings MG, Sekhorn LHS, Tator C. The role and timing of decompression in acute spinal cord injury. Spine. 2001;26:S101-10. [ Links ]
53. Rabchevsky AG, Fuggacia I, Sullivan PG, et al. Efficacy of MTP therapy for the injured rat spinal cord. J Neurosic Res. 2002;68: 7-18. [ Links ]
54. American Association of Neurological Surgeons and the Congress of Neurologic Surgeons, Guidelines of the American Association of Neurological Surgeons. Pharmacological therapy after acute spinal cord injury. Neurosurgery. 2002;50 Suppl: 63-72. [ Links ]
55. Bracken MB. Methylprednisolone and acute spinal cord injury: an update and randomized evidence. Spine. 2001:26 24 Suppl: 547-54. [ Links ]
56. Takea K, Sawuamura S, Skiyama H, Tamai H, Hanaoka K. Effects of MTP on neuropathic pain and spinal glial activation in rats. Anesthesiology. 2004;100:1249-57. [ Links ]
57. Aldrete JA, Ghaly RF. Treatment of the inflammatory phase of Arachnoiditis: in: the evidence revealed. 2nd ed, México DF: Editorial Alfil. En prensa. [ Links ]
58. Usubiaga JE. Complicaciones neurológicas en la anestesia epidural. Clínica Anestesiológica. Barcelona: Salvat Editores S.A.; 1977. p. 110. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: a.lucas65@yahoo.com.mx
(A. Ramírez Bermejo).
Correo electrónico: aldrete@arachnoiditis.com
(J.A. Aldrete).
Recibido el 11 de marzo de 2009.
Aceptado el 13 de mayo de 2009.