INTRODUCCIÓN
El dolor músculo-esquelético crónico no reumático afecta a un 20 % de la población mundial, con una prevalencia de tendencia progresiva 1), (2. Actualmente, su tratamiento es solamente sintomático, usándose AINE, analgésicos, corticoides y otros, que ha resultado pobremente eficaz y oneroso. La caracterización del síndrome en estudio es: dolor, habitualmente descrito por los pacientes como "dolor de huesos", sordo, cansado, indefinible, a veces algo eléctrico, inicialmente localizado, que en sus etapas tempranas comienza sin causa aparente. Dura un corto periodo, generalmente horas o menos de un día, y luego remite espontáneamente. La característica semiológica principal del mencionado síndrome, que llamaremos dolor fibromiofascial (que podríamos denominar gota no articular, pero resultaría confuso) es su comienzo imperceptible, puesto que el dolor y otros síntomas se presentan leves y breves, con largos periodos de remitencia espontánea; después cambian de lugar o se agregan otros.
Luego, el dolor se expande a otros segmentos corporales sin ningún patrón neural o vascular, muchas veces desde distal a proximal o desde un hemicuerpo al otro. Si el dolor es bilateral, generalmente predomina en un lado. Cuando se trata de un dolor localizado, es frecuente que este produzca impotencia funcional progresivamente. Con el curso del tiempo, tales signos y síntomas se tornan más intensos, frecuentes y persistentes, hasta llegar a ser generalizados. En etapas avanzadas, se va comprometiendo progresivamente la capacidad funcional de los segmentos afectados hasta llegar a ser altamente invalidante, siendo, tal situación final, crítica para la continuidad de la vida activa normal de los pacientes, por lo que esta enfermedad produce un fuerte impacto biopsicosocial y económico 3. Otra consecuencia de la situación descrita es que existen muchas personas que no pueden "demostrar" su dolor, especialmente si el problema de salud es laboral o profesional 4), (5. Usualmente, antes de que se presente el dolor o concomitantemente, algunos pacientes relatan percibir molestias de tipo neuropático: disestesia, parestesia, hiperestesia, hipoestesia, alodinia, incluso causalgia y "pinchazos eléctricos".
Generalmente, los exámenes biomédicos son normales o no explican el dolor ni otras molestias asociadas ni su evolución 6), (7. Además, su respuesta a analgésicos, antinflamatorios y tratamientos alternativos 8), (9 es pobre o nula, y el efecto de la kinesiterapia clásica es parcial y efímero. No se presentan signos inflamatorios 10.
En algunos casos el edema duro localizado de tegumentos, cápsulas, sinoviales, ligamentos y tendones, acompaña al dolor.
De ellos, muchos son personas en edad laboral. Generalmente, el dolor y otras molestias aumentan en la noche, también en forma progresiva, alterando además el sueño y presentándose frecuentemente fatiga muscular, astenia y depresión.
Para establecer la hipótesis etiológica, se recurrió a un análisis clínico semiológico comparado y a estudio anatomofisiohistopatológico de las fascias 11, como sustrato morfológico-funcional en el que ocurre el dolor descrito y a la revisión sistemática de la literatura referida al dolor músculo-esquelético crónico, concluyendo en el estudio de la inmunopatogenia de la gota 12), (13.
Como resultado, se establece la siguiente hipótesis etiológica para el síndrome en estudio: el dolor es producido por la impregnación progresiva de cristales de urato monosódico (forma ionizada del ácido úrico) en las fascias correspondientes al sustrato fibromiofascial y al tejido conjuntivo laxo, y eso, independientemente de los niveles de uricemia de cada paciente (puesto que la impregnación progresiva en el tejido conjuntivo de cristales de sal insoluble de urato monosódico no tiene relación con los niveles de ácido úrico disuelto en el plasma), es lo que desencadena la cascada del dolor, estimulando las terminaciones nerviosas nocipropioceptivas, mediada por monocitos, neutrófilos y citoquinas 14), (15, que luego cedería debido a la fagocitosis y apoptosis celular, principalmente de macrófagos 16, lo que le daría su característica evolución, inicialmente autolimitada y, luego, recurrente y progresiva. El edema duro doloroso de piernas, manos u otras focalizaciones, que participa en algunos casos como parte del síndrome o como signo único, podría ser producido por la estimulación del urato monosódico sobre los mastocitos del tejido conjuntivo laxo y liberación de autacoides, especialmente calicreína-cininas. Los puntos gatillo 17 observados en algunos pacientes se deberían al acúmulo de estos cristales en algunos focos tisulares neuromusculares, que producirían un estímulo sostenido que induciría persistencia de la fase refractaria de la membrana de sus células 18, provocando el bloqueo citoelectroiónico y contractura persistente de tales tejidos. Planteada esta hipótesis, el tratamiento propuesto fue el uso de hipouricemiantes vía oral, sin importar la uricemia que presente el paciente antes y después de la intervención y, además, desbloqueo de algún punto gatillo eventualmente persistente, aplicando solo lidocaína transdérmica en parche gel 19, por ser eficaz y no invasiva.
El objetivo general de esta investigación fue determinar las características semiológicas y clínicas de la definición de caso de esta enfermedad y el efecto del tratamiento propuesto. El objetivo específico es la búsqueda, en la población señalada, de variables relacionadas con a) el diagnóstico: perfil semiológico y anamnésico que determine la mayor sensibilidad diagnóstica, y b) el tratamiento: adherencia y efectividad.
MATERIAL Y MÉTODOS
Este ensayo clínico ha sido previamente aprobado por el Comité de Ética y Bioética de la Universidad de Tarapacá, en Arica, Chile. Se eligió un estudio de cohorte dinámico, prospectivo, aleatorio, cuasi experimental no controlado. Sin ser experimental con humanos, según los preceptos de la Declaración de Helsinki y Comité de Revisión Ética de la OPS, dado que se administra tratamiento efectivo a cada participante. Todos los pacientes incluidos en el estudio participaron en forma voluntaria, con consentimiento informado. Este estudio se llevó a efecto en la ciudad de Arica, desde el 15 de noviembre de 2010 hasta el 3 de noviembre de 2012.
DEFINICIÓN DE CASO
Se consideran pacientes, con o sin tratamiento anterior, en etapa inicial o avanzada de la enfermedad, cuya semiología e historia natural se ha caracterizado y descrito.
POBLACIÓN BLANCO
Pacientes enfermos ya tratados, que presentan todo o parte de la definición de caso, tanto en las etapas iniciales como avanzadas de esta enfermedad. También se incluye un grupo de pacientes no tratados que presentan todo o parte de la definición de caso, con el fin de ponderar la sensibilidad del método clínico de diagnóstico.
CRITERIOS DE INCLUSIÓN
Enfermos ya tratados que presentan dolor músculo-esquelético crónico, según descripción de caso, y pacientes sin diagnóstico ni tratamientos previos que presenten signos y síntomas clínicamente atribuibles al síndrome o a los sub-síndromes ya descritos.
Criterios de exclusión
Enfermos que presentan gota común típica o concomitante con el síndrome estudiado, enfermedades autoinmunes o degenerativas avanzadas.
SELECCIÓN DE LA MUESTRA
Pacientes que consulten espontáneamente por dolor músculo-esquelético que cumpla los criterios de inclusión. Un auxiliar paramédico recepcionista entrenado les aplica una encuesta abreviada para preseleccionar a los candidatos. El médico evalúa a cada paciente preseleccionado y aplica una encuesta extendida, previamente diseñada, en la que se anotará todos los signos, síntomas y otros detalles clínicos que relaten dirigida y libremente, y determina su inclusión o exclusión en el estudio, su tratamiento y alta, considerando los informes de control de evolución de un kinesiólogo externo.
APLICACIÓN DEL TRATAMIENTO
A todos los pacientes de la muestra, adultos en un rango de 23 a 81 años de edad, se les indicó dieta hipopurínica y abstención absoluta de analgésicos formales y alternativos, y antinflamatorios esteroidales y no esteroidales. Se les administró colchicina vía oral en dosis ajustadas a la tolerancia individual, generalmente 0,5 mg/3 veces al día, hasta la remisión del dolor o máximo durante 2 meses; luego, 0,5 mg al día por 2 meses desde remisión total del dolor y mantención de 0,5 mg cada 1 semana. Además, se administró alopurinol 300 mg vía oral, por 1 vez al día hasta 2 meses después de ceder el dolor, luego, 100 mg al día, con indicación permanente. A quienes presentaron efectos secundarios digestivos tolerables, se les disminuyó gradualmente las dosis diarias de estos medicamentos hasta disminuir esos efectos. Eventualmente, se usó lidocaína transdérmica en parches de gel al 5 % para tratar algún punto gatillo persistente.
La elección de los periodos de control se estableció en base a la disponibilidad de tiempo de las personas participantes, puesto que la mayoría tenía obligaciones laborales permanentes: 1 semana, 2 semanas, 3 semanas, 1 mes, 2 meses, 3 meses, 6 meses, 9 meses y 1 año.
CONTROL DEL TRATAMIENTO
Un kinesiólogo externo evalúa a cada paciente midiendo la persistencia de su dolor, funcionalidad y otros síntomas y signos presentados al inicio, y su persistencia al cumplirse cada periodo y al alta, usando una escala porcentual comparada con el dolor inicial individual, sin conocer los datos de sus fichas clínicas (Tabla I). Obtenidos suficientes relatos de síntomas y signos que permiten definir las variables que integran progresivamente la definición de caso de los pacientes ya tratados, se usaron estas para pesquisar y dar un diagnóstico primario de la enfermedad a pacientes nunca antes tratados. Agregándose dinámicamente al estudio los datos anamnésicos y semiológicos que todos ellos aportaron. Reaplicando la encuesta en cada control a cada paciente.
MÉTODOS ESTADÍSTICOS
En una primera instancia, se obtuvo estadísticos descriptivos de variables sociodemográficas y antecedentes previos al tratamiento. Posteriormente se realizó la caracterización de la enfermedad, en base al análisis clínico-semiológico de la signo-sintomatología presentada por el conjunto de la muestra. Luego, se realizó un análisis de supervivencia con el procedimiento "tablas de mortalidad", con el objetivo de obtener estimaciones del tiempo medio de recuperación, en conjunto de una evaluación exhaustiva de los tiempos de espera (intervalos de tiempo definidos en el estudio). Finalmente se comparó los tiempos de recuperación entre hombres y mujeres y el tiempo de recuperación entre pacientes con y sin tratamiento previo, con el objetivo de valorar si existen diferencias estadísticamente significativas entre los grupos. El análisis estadístico de los datos se realizó a través del paquete estadístico IBM SpssStatistics 21.
RESULTADOS
La población de estudio correspondió a 70 personas, de las cuales fueron excluidos 21: 6 por corresponder a gota, 4 no corresponden a definición del caso, 4 abandonaron el tratamiento el primer día por intolerancia a los fármacos (7,5 % de 53 pacientes) y 7 no iniciaron tratamiento sin causa conocida. Lo que corresponde a un 81,66 % de adhesión al tratamiento. Finalmente la muestra quedó constituida por 49 pacientes, de los cuales cada uno recibió el tratamiento y se controló durante 1 año. La muestra está constituida por 17 hombres (32,7 %) y 32 mujeres (65,3 %), con una edad media de 58,5 años y una desviación típica de 15,04. En la presente muestra se diferenciaron 2 grupos, 39 pacientes que recibieron tratamiento con anterioridad, sin mejorar, y 10 pacientes que no recibieron tratamiento previo. En cuanto a la cantidad de años que los pacientes declaran sufrir la enfermedad, el rango va desde los 0 años hasta los 27 años, con una media de 4,08 años (DT = 5,23).
Los controles de la evolución de cada paciente los ejecuta e informa un kinesiólogo externo al consultorio, sin acceso a las ficha clínicas, en los periodos preestablecidos, quien informa los resultados según una pauta de evaluación que mide el porcentaje de recuperación comparado con el dolor inicial individual, siendo 100 % la magnitud del dolor y otras molestias inmediatamente antes del inicio del tratamiento.
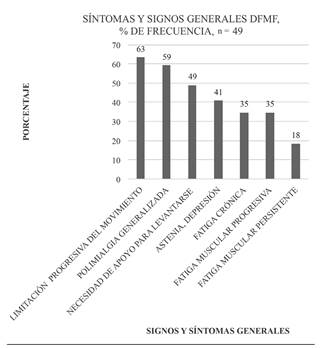
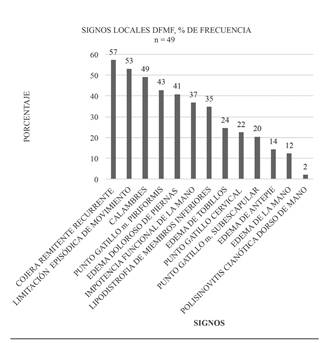
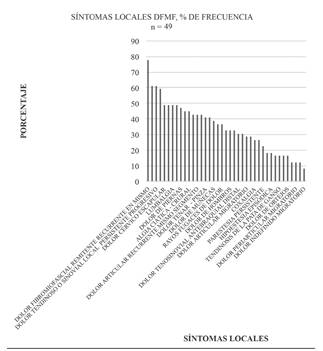
Al finalizar el seguimiento, el total de los pacientes tratados reportaron una mejoría del 100 % de la signo-sintomatología inicial. Asimismo, de los 49 pacientes tratados, solo 12 de ellos (24,5 %) presentó reacciones adversas tolerables, frente a 37 pacientes (75,5 %) que no presentaron reacciones adversas. A eso se debe agregar los 4 pacientes que abandonaron el tratamiento el primer día por intolerancia absoluta a alguno de los fármacos utilizados y que, en consecuencia, no fueron tratados. Para la caracterización de la enfermedad, se evaluó la distribución de las frecuencias de los síntomas y signos en cuartiles (Tabla II) y en gráficos de frecuencia (Figura 1, Figura 2 y Figura 3). Como se observa en la Tabla II, el síntoma más característico es el dolor fibromiofascial. Una historia natural similar, pero local, se observa en algunos subsíndromes, como el hombro doloroso, el edema doloroso de las piernas, la entesitis anserina o las tendinosis o sinovitis de las extremidades.
Tabla II Frecuencia de expresión de síntomas y signos generales y locales del síndrome
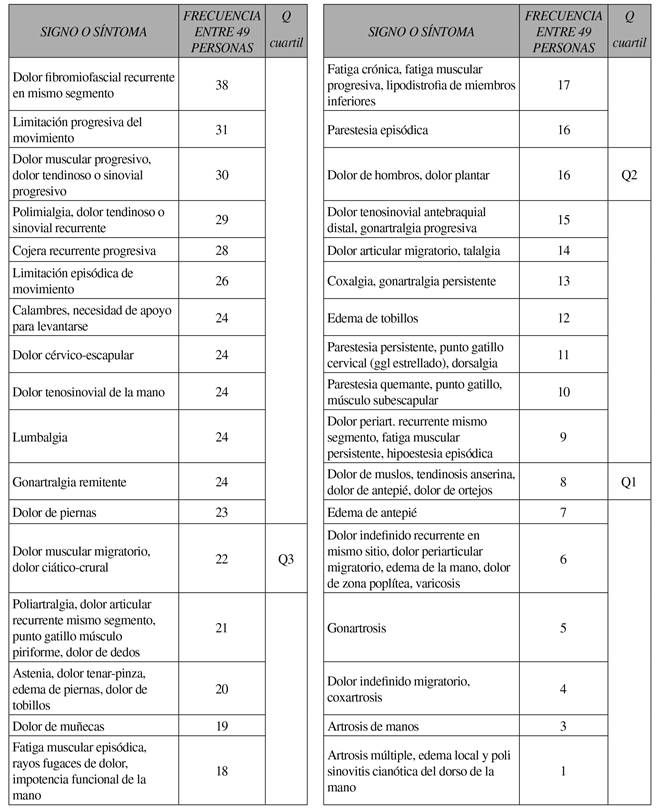
En una muestra de 49 pacientes, el síntoma más frecuente es el dolor fibromiofascial recurrente en un mismo segmento y el signo menos frecuente es la polisinovitis cianótica de la mano.
Con la finalidad de explorar el comportamiento de la recuperación a lo largo del tiempo contemplado en el presente estudio, se obtuvo las frecuencias de mejoría en cada rango de tiempo evaluado. Debido a que la totalidad de pacientes incluidos en el presente estudio reportaron el 100 % de mejoría finalizado el tiempo de tratamiento y evaluación, se realizó un análisis de supervivencia con el objetivo de evaluar los tiempos de espera (intervalos de tiempo comprendidos en el estudio). El método utilizado fue Tablas de Mortalidad (Tabla III). En esta se observa que, en la medida que avanza el tratamiento, el número de personas que presentan una mejoría total de la signosintomatología presentada va aumentando paulatinamente, obteniéndose al cabo de 1 año la mejoría del total de pacientes tratados.
Tabla III Tabla de Mortalidad DFMF
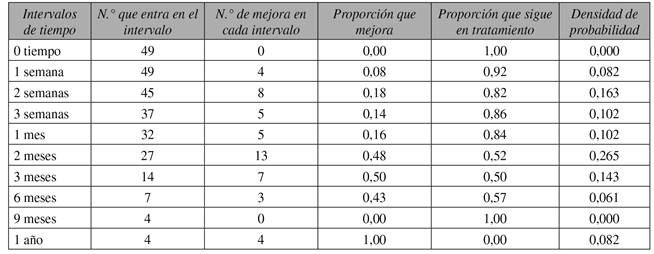
Nota: se considera mejora al número de pacientes que presentan un 100 % de recuperación de sus signos y síntomas iniciales.
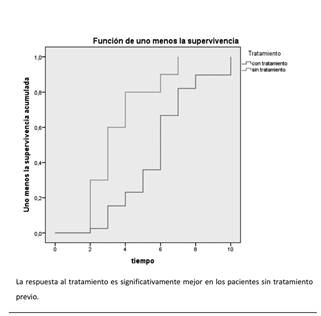
A la primera semana de tratamiento ya comienza a apreciarse recuperación, 4 pacientes reportan mejoría del 100 % de síntomas y signos iniciales. A la segunda semana de tratamiento, 8 sujetos presentan mejoría total (18 % del total de sujetos que se encuentran en tratamiento) y el 82 % de la muestra sigue sintomático. Al cabo de 2 meses de tratamiento, se observa la mayor tasa de recuperación, 13 de 27 pacientes que aún siguen sintomáticos (48 %), reportan una recuperación total de la sintomatología y el 52 % de la muestra continúa sin recuperación completa. A los 3 meses de tratamiento, queda un total de 14 pacientes sintomáticos, de los cuales 7 presentan una mejoría total, quedando solo 7 pacientes que aún siguen sin recuperación absoluta de la enfermedad. Desde este punto, se observa una recuperación más lenta. Entre los 6 meses a 1 año se obtiene la recuperación completa del resto de la muestra. El tratamiento es efectivo para el 100 % de la muestra. En 1 paciente de la muestra, atleta de 81 años de edad, persiste un 5 % de dolor localizado en la región crural derecha hasta la segunda semana del mes 12 de control; se usó medio parche de lidocaína transdérmica en gel al 5 %, de liberación de 0,37 % cada hora, por 12,5 horas cada día, por 3 días seguidos, para desbloquear 1 punto gatillo persistente en el músculo piriforme derecho, que cedió en 3 días, sin recidivas. No se aplicó esta técnica sino hasta su último mes de control para disminuir al máximo el sesgo en la evaluación del efecto del tratamiento. Con el objetivo de evaluar si existen diferencias de género en los tiempos de recuperación, se comparó el tiempo de recuperación media entre hombres y mujeres a través del estadístico de Wilcoxon, no evidenciándose diferencias estadísticamente significativas entre ambos (p = 0,277), es decir, hombres y mujeres responden de manera similar al tratamiento, teniendo tiempos de recuperación media similares (en torno a los dos meses de tratamiento). De igual modo, se comparó el tiempo de recuperación media entre pacientes con y sin tratamiento previo al estudio, con el mismo procedimiento usado anteriormente, encontrándose diferencias estadísticamente significativas (p = 0,003). Específicamente, los pacientes que no tuvieron tratamiento previo presentan un tiempo medio de mejoría más corto, en torno a las 2 y 3 semanas de tratamiento, que aquellos que sí tuvieron antes otros tratamientos, sin mejorar, de entre 2 y 3 meses (Figura 4).
DISCUSIÓN
En la literatura médica actual no se encuentra publicación alguna que describa la caracterización de esta enfermedad, su hipótesis causal ni su tratamiento efectivo, tal como se hace en este estudio. Para el dolor músculo-esquelético crónico no reumático, actualmente se emplea solamente tratamiento sintomático, cuya expectativa es recuperar algo de calidad de vida y reducción del dolor 20, que no cambia su evolución progresiva. Solo hay estudios acerca de los procesos fisiopatológicos tisulares y moleculares de la reacción inflamatoria 21, por tanto no podemos comparar resultados.
Se pudo identificar un grupo numeroso de enfermedades que cumplen con el patrón de dolor fibromiofacial, cuyo diagnóstico es exclusivamente semiológico. De todas estas enfermedades con etiología conocida, solo se pudo identificar a una de estas, que cumple con el patrón recién descrito, pero que es inflamatoria; esta es la gota. En la gota clásica, un aumento anormal de concentración úrica en el líquido sinovial provoca episodios autolimitados de intensa inflamación articular, muy dolorosa. Aunque se han descrito ataques de gota sin que se haya encontrado cristales de urato en el líquido sinovial extraído de la articulación afectada 22 y, otros, sin hiperuricemia 23 (Anexo 1).
Los resultados de este estudio permiten confiar en la sensibilidad de la caracterización semiológica clínica para determinar el diagnóstico y demuestran la eficacia del tratamiento empírico y da una alta probabilidad de validación de la hipótesis etiológica y, considerando que los pacientes recibieron solo y exclusivamente el tratamiento descrito anteriormente, se puede afirmar que la mejoría obtenida en la presente muestra es atribuible a la efectividad del tratamiento y no a otras variables. Las pruebas estadísticas aplicadas respaldan la validez de los resultados de este estudio. Queda pendiente la verificación fisio-histo-patológica y molecular de la hipótesis etiológica aquí planteada. Asimismo, es muy importante encontrar un método para medir la cantidad de urato monosódico impregnado en el tejido conectivo fibromiofascial y laxo.