INTRODUCCIÓN
El dolor crónico no oncológico y el mal uso de los opioides prescritos son dos realidades muy prevalentes. La prescripción de opioides para el dolor crónico se ha incrementado notablemente en las últimas décadas; sin embargo, las dudas sobre su seguridad a largo plazo dificultan la toma de decisiones clínicas 1) (2) (3. Existen médicos, preocupados por posibles problemas de adicción en sus pacientes, que son reacios a prescribir estos fármacos, contribuyendo con ello a un tratamiento insuficiente del dolor crónico 4. Esta situación ha hecho que múltiples sociedades científicas elaboren guías sobre el uso racional de opioides 5) (7) (8) (9) (10) (11) (12) (13) (14. Estas establecen que los pacientes con factores de riesgo de adicción no necesariamente deben ser excluidos de la terapia con opioides si se ha determinado que precisan dicho tratamiento, sino que deben utilizarse después de establecer un plan terapéutico y de monitorización individualizada 15.
Pero, ¿de qué medios dispone el médico para afrontar esta realidad? Por un lado, se han recomendado distintas herramientas de cribado para estratificar a los pacientes según su riesgo de posible mal uso de opioides 16) (17, que requerirán de un seguimiento más estrecho. Algunas de estas herramientas son válidas para pacientes en los que el tratamiento ya se ha iniciado 18) (19) (20. Por otro, la elección del opioide mayor debería tener en cuenta los diferentes mecanismos de acción de los opioides, que pueden influir en su potencial de abuso 21) (22. En cualquier caso, es necesario saber reconocer las conductas aberrantes asociadas a opioides (CAAO) para poner en marcha las estrategias de seguimiento y tratamiento más adecuadas para cada paciente 23.
MATERIAL Y MÉTODOS
Revisión sistemática de guías de práctica clínica, ensayos clínicos y revisiones disponibles en Pubmed y Cochrane Databases. Los términos utilizados fueron "pain y opioid*", o cualquiera de los dos con los términos con "chronic opioid, chronic, non cancer pain, chronic opioid therapy, chronic non-malignant pain, guidelines, practice guidelines, clinical practice guidelines, aberrant drug related behavior, drug abuse, drug dependence, noncompliance, addiction, misuse, overdose, drug screens, urine toxicology screens". La estrategia y los términos de la búsqueda se detallan en Tabla I.
DEFINICIONES
Con respecto al trastorno por consumo de sustancias opioides, los síntomas de la dependencia a los opioides y el abuso de opioides, entidades antes separadas, en el "Diagnostic and Statistical Manual of Mental Disorders 5th Edition" (DSM-IV) se integran en una nueva definición 24, considerándolas una sola enfermedad. El paciente que presente más de dos síntomas padece un trastorno asociado al consumo de opioides (Tabla II).
Tabla II CRITERIOS DIAGNÓSTICOS DE ALTERACIONES EN EL USO DE OPIOIDES SEGÚN EL DIAGNOSTIC AND STATISTICAL MANUAL OF MENTAL DISORDERS, 5TH EDITION (DSM-5) 24
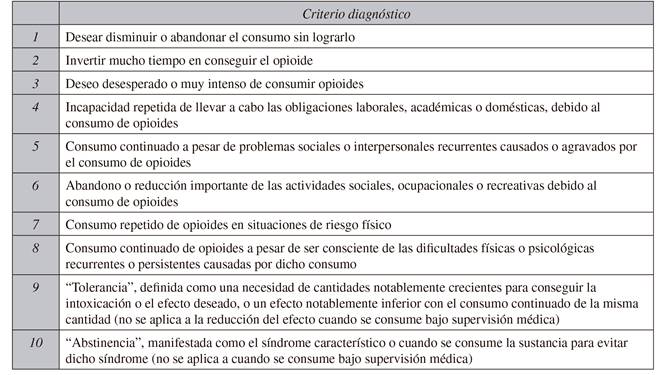
Se requieren un mínimo de 2-3 criterios para un diagnóstico de alteración leve, 4-5 en el caso de moderada, y 6-7 en el caso de severa.
Conductas aberrantes asociadas a opioides (CAAO)
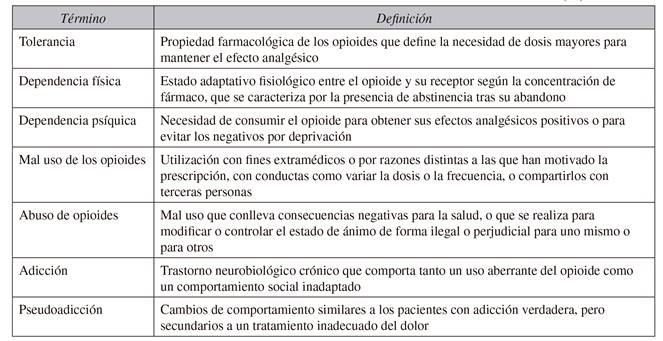
En primer lugar, conviene distinguir entre distintos aspectos relacionados con el consumo de opioides, tales como la tolerancia, la dependencia física, la adicción o el abuso 25. La Sociedad Española del Dolor (SED) ha actualizado recientemente estas definiciones 26 (Tabla III).
Aunque se desconoce la prevalencia real del uso indebido de opioides, se han comunicado tasas del 18-32 % en distintas poblaciones clínicas 25) (27) (28) (29. Este uso incorrecto suele mostrar patrones de conducta característicos, tales como "préstamos" de medicamentos, uso de fármacos no prescritos o ilegales, solicitud de recetas anticipadas, mayor número de médicos consultados para obtener más recetas (conocido como "doctor shopping") 30, consumo de opioides para conseguir efectos no analgésicos, etc. Sin embargo, ninguna de estas conductas proporciona pruebas concluyentes de adicción y pueden responder a una pseudoadicción 31, llevando a concluir erróneamente que los pacientes están usando mal los medicamentos cuando en realidad están recibiendo una dosis inadecuada o están siendo tratados insuficientemente 32.
Las guías acerca del tratamiento crónico con opioides en dolor no oncológico concluyen que los antecedentes de trastornos por consumo de sustancias son el mejor factor predictivo de un uso indebido y de una mala respuesta al tratamiento 27.
RESULTADOS
Estrategias de gestión de riesgos con el uso de opioides
Las guías clínicas internacionales publicadas hasta el momento establecen unos principios generales y recomendaciones básicas comunes, con ligeras diferencias, para el uso de opioides en pacientes con dolor crónico no oncológico de la manera más segura y eficaz para el paciente 5) (6) (7) (8) (9) (10) (11) (12) (13) (14:
Evaluación inicial del paciente mediante una completa historia clínica de su dolor, exploración física, factores desencadenantes, características, tratamientos farmacológicos o intervencionistas previos 32) (33. Se debe realizar una valoración del dolor, además de cómo afecta este a sus actividades cotidianas y funcionalidad 5) (6) (7) (8) (9) (10) (11) (12) (13) (14. Se hará énfasis en identificar factores de riesgo relacionados con los efectos secundarios de los opioides, así como una valoración psicosocial que pueda alertar de un posible mal uso o abuso de fármacos 34. Asimismo, se realizará algún cuestionario de valoración del riesgo de adicción a los opioides, junto con una valoración de antecedentes de consumo de tabaco, alcohol o abuso de alguna otra sustancia 35) (36.
Se suele recomendar una fase de prueba al opioide para decidir posteriormente si se sigue o no con el tratamiento 16.
Se proporcionará al paciente una información adecuada sobre los beneficios que se espera conseguir y los posibles riesgos. Se obtendrá un consentimiento informado/pacto terapéutico, preferiblemente firmado, en el que se detalle toda la información 37 (Figura 1).
Generalmente se reservarán los opioides como tratamiento de segunda línea cuando el resto de tratamientos farmacológicos e intervencionistas no hayan sido eficaces.
La selección del opioide, su vía de administración y dosis de mantenimiento se harán en función de las características del paciente y de su respuesta al tratamiento.
El tratamiento se iniciará con la menor dosis requerida para obtener un alivio significativo del dolor y/o mejoría de la funcionalidad o actividades (generalmente de más de un 30 %), 38 con los mínimos efectos secundarios. Para titular la dosis se utilizarán preferentemente formulaciones de acción rápida o corta hasta llegar a la dosis necesaria eficaz y segura.
Comenzado el tratamiento, se realizarán controles periódicos para detectar una posible desaparición de la mejora, o la aparición de efectos adversos o de conductas aberrantes asociadas 39.
Aunque los opioides mayores no tienen techo terapéutico, en casi todas las guías se recomienda una dosis máxima, ya que se observa que aparece una "dosis de estancamiento" con la que no aumenta la mejoría del dolor/funcionalidad y sí los efectos adversos y riesgos de adicción para el paciente. Esta dosis máxima varía según las guías, desde la equivalencia de 200 mg de morfina/día 5, 120 mg 6, 120-180 mg 8, 120 mg 7 hasta la más reciente y restrictiva de 90 mg 12.
Las recomendaciones en cuanto al análisis de opioides en orina también son variadas. Hay guías que recomiendan hacerlo previamente al inicio del tratamiento y de forma rutinaria para monitorizar la adherencia 6, mientras que otras lo reservan solo a aquellos pacientes con un riego elevado de conductas aberrantes 5.
Debe considerarse la rotación de opioide cuando el anterior haya perdido eficacia, o en función de efectos secundarios, necesidad de dosis máxima o aparición de conductas aberrantes 40. Algunas guías recomiendan disminuir un 50 % la dosis equivalente del nuevo opiáceo por riesgo de sobredosis 7 para volver a titular de nuevo la dosis óptima.
Herramientas para valorar el riesgo de adicción
Entre las herramientas (cuestionarios autoadministrados) para valorar previamente al tratamiento el riesgo de que un paciente pueda desarrollar conductas aberrantes y/o adicción a los opioides, destacan el "Opioid Risk Tool" (ORT) 41 y el "Screeener and Opioid Assessment for Patients with Pain", tanto en su primera versión (SOAPP) 42) (43 como en una segunda revisada (SOAPP-R) 44) (45) (46.
El ORT, que valora 4 parámetros, encontró, en un estudio prospectivo a 12 meses en 185 pacientes en tratamiento crónico con opioides, que presentaban conductas aberrantes un 6 % de los pacientes valorados como de bajo riesgo (puntuación 0-3), un 28 % de aquellos con riesgo moderado (4-7 puntos) y un 91 % de aquellos con alto riesgo (> 8 puntos). El estudio no valoró, sin embargo, la presencia de mal uso mediante análisis de orina 41.
El SOAPP v.1, que también es un cuestionario autoadministrado al paciente, consta de 24 ítems. En dos estudios prospectivos 42) (43 realizados en 397 y 175 pacientes tras 5 y 6 meses con tratamiento opioide, se obtuvo que pacientes con puntuaciones > 7-8 eran de alto riesgo, con un ratio de probabilidad positiva de 2,90 y 2,90, respectivamente. La valoración de mal uso se realizó mediante cuestionarios y análisis de orina.
El SOAPP-R, también con 24 ítems, fue creado posteriormente para que las preguntas no fueran tan indicativas de que se estaba estudiando el abuso de sustancias. Fue valorado prospectivamente en un estudio de 283 pacientes, durante 5 meses, con una sensibilidad de 0,8 y una especificidad de 0,68, y un ratio de probabilidad positiva de 2,5 46.
Sin embargo, aunque estos cuestionarios pueden servir para documentar el riesgo, su evidencia es limitada 47 y no se ha demostrado que proporcionen más información que la que se obtiene simplemente preguntando al paciente si ha consumido drogas o medicación con fines diferentes a los prescritos 48. Por tanto, una historia clínica completa, junto con sus revisiones correspondientes, es la mejor medida para detectar cualquier uso indebido de opioides 49.
Casi todos estos cuestionarios, así como otras materiales o herramientas para el tratamiento de los pacientes, se pueden obtener de diversas fuentes de información, como por ejemplo https://www.painedu.org/.
Seguimiento del paciente en tratamiento opioide
Aunque existen múltiples cuestionarios para seguir al paciente una vez instaurado el tratamiento (muchos de ellos adaptados desde el campo de la psiquiatría), se ha recomendado la escala de medición del uso indebido actual de opioides (Current Opioid Misuse Measure to Monitor [COMM]). Esta escala ayuda a identificar a aquellos pacientes tratados con opioides que los están usando de forma incorrecta; fue validada en pacientes tratados con opioides durante una media de 5,7 años 37) (20. La escala COMM es una autoevaluación breve desarrollada con el asesoramiento de un grupo de expertos en dolor y adicciones. Se identificaron 6 cuestiones clave para determinar si los pacientes que ya reciben tratamiento a largo plazo con opioides exhiben conductas aberrantes como signos y síntomas de intoxicación, labilidad emocional, datos indicativos de una respuesta deficiente a los medicamentos, adicción, patrones de mal uso de los servicios de salud, y comportamiento problemático con respecto a la medicación. Consta de 17 puntos y deben sumarse las calificaciones de todas las preguntas; una puntuación ≥ 9 se considera positiva e indicativa de riesgo de adicción.
Otra herramienta para el seguimiento y detección del fenómeno "doctor shopping" es la informatización de la dispensación de opioides. Actualmente el sistema de "receta electrónica" permite conocer la medicación prescrita retirada por el paciente, tanto con recetas oficiales como con recetas privadas.
Sin embargo, la evaluación clínica del paciente en las revisiones tiene que ser una de nuestras mejores herramientas. Casi todas las guías de práctica clínica recomiendan la reevaluación de "las cuatro A's": analgesia, actividades de la vida cotidiana, efectos adversos y aparición de conductas aberrantes 50. La mejora analgésica y funcional estará mostrando la eficacia del tratamiento opioide, que debería ser de, al menos, un 30 %. Los efectos adversos se tratarán anticipándose a ellos y buscando el equilibrio con la mínima dosis eficaz de opioides. La aparición de CAAO, dosis máxima, efectos secundarios no tolerables, o bien la pérdida de eficacia del tratamiento, obligarán a replantear el plan terapéutico del dolor crónico.
Selección de opioides en función de su potencial adictivo
La selección del fármaco y la vía de administración deben hacerse en función de la intensidad del dolor, los tratamientos previos con opioides, las enfermedades concomitantes y las características de cada paciente.
Una primera elección, si la intensidad del dolor es moderada, deben ser los opioides de segundo escalón (codeína, tramadol o mezclas disponibles en el mercado como paracetamol-tramadol) 13. El tramadol es un opioide sintético; está clasificado de segundo escalón por su menor potencia analgésica sobre los receptores μ y por su activación de las vías inhibitorias descendentes por inhibición de la recaptación de serotonina y noradrenalina. Sus tasas de abuso desde su comercialización en 1994 han permanecido extremadamente bajas 51. Además, se ha estudiado como alternativa para los programas de deshabituación tanto con metadona 52 como con buprenorfina 53.
En caso de dolor severo, se seleccionará un opioide mayor, siendo la morfina el patrón de referencia por razones de precio. La oxicodona, el fentanilo, la hidromorfona, la buprenorfina o el tapentadol serán opciones válidas dependiendo de las circunstancias específicas de cada paciente y de la vía de administración elegida 9.
La buprenorfina, único agonista opioide parcial, merece una consideración aparte. Es eficaz tanto para el dolor agudo 54 como para el crónico 55 y el dolor oncológico 56. Presenta un buen perfil de seguridad, sobre todo en pacientes con insuficiencia renal. También se ha utilizado, por su capacidad de agonismo parcial, en programas de deshabituación a opioides 57.
Finalmente, el tapentadol, último opioide comercializado, muestra un buen perfil de seguridad y tolerabilidad dada la sinergia de su doble mecanismo de acción, agonismo de los receptores μ y activación de las vías inhibitorias descendentes mediante la inhibición de la recaptación de noradrenalina 58. Presenta, asimismo, buenos resultados en diversos modelos de dolor neuropático 59) (60.
Se postula que la menor actividad intrínseca y menor potencia sobre los receptores opioides en el locus coeruleus cerebral de tapentadol 61 puedan ser la razón de su menor potencial adictivo. La probabilidad de recibir un diagnóstico de mal uso de opioides entre los pacientes que iniciaron el tratamiento con tapentadol de liberación inmediata fue un 65 % menor que entre los que comenzaron con oxicodona de liberación inmediata; también fue menor el riesgo de "doctor shopping" 62. Diversos estudios desde su comercialización en EE. UU. han comunicado interesantes menores tasas de adicción y conductas aberrantes, tanto en su forma de liberación retardada como de liberación inmediata 63) (64) (65.
Opciones terapéuticas en el paciente con conductas aberrantes a opioides
Ante la aparición clínica de conductas aberrantes, ya sean reconocidas por el paciente o halladas mediante detección en orina, las guías y revisiones clínicas recomiendan varias opciones en función de su gravedad:
1. Remitirse al consentimiento informado/pacto terapéutico del paciente (en el que se debe incluir que, ante el incumplimiento del tratamiento, se puede suspender la prescripción de opioides) y remitirlo a un Centro de Deshabituación para el tratamiento de su adicción o consumo indebido de opioides.
2. Reevaluar el tratamiento y realizar los cambios que se consideren para controlar este cuadro. Para ello habrá que considerar el aumentar la frecuencia de visitas o los controles de análisis de orina, reforzar la información al paciente de los riesgos para su salud, o bien rotar a otro opioide que se considere más seguro. También habrá que tener en cuenta que muchos de los casos en los que aparecen signos y síntomas de adicción/abuso son en realidad casos de pseudoadicción o infratratamiento del dolor.
Entre los opioides "más seguros" se encuentran los utilizados en los tratamientos de deshabituación (metadona y buprenorfina sola o asociada a naloxona). El empleo de metadona como analgésico es controvertido en las guías, que la recomiendan solo en profesionales con experiencia en su manejo. Por otra parte, la buprenorfina es de uso habitual en dolor crónico y se encuentra dispone para su administración por vía transdérmica, oral sublingual e inyectable.
En el caso de rotación de opioide debida a tolerancia al opioide previo, se podrían tener en cuenta, por su doble mecanismo de acción sinérgico y su baja tasa de uso excesivo, el tramadol en dolor moderado y el tapentadol en dolor moderado-severo.
Al reevaluar el tratamiento se deben valorar de nuevo la causa del dolor, la medicación farmacológica no opioide (paracetamol/AINE y coadyuvantes antiepilépticos o antidepresivos), la posibilidad de técnicas percutáneas intervencionistas, el tratamiento psicológico, las técnicas no farmacológicas, etc.).
CONCLUSIONES
Hay que seguir avanzando en el manejo del dolor crónico. Las nuevas evidencias sobre los riesgos de CAAO, de sobredosis y de adicciones iatrogénicas obligan a reconsiderar la práctica clínica en este ámbito. No existen soluciones sencillas, pero hay recomendaciones que pueden reducir estos riesgos y mejorar el tratamiento del dolor crónico no oncológico (Tabla IV):
Conocer las herramientas y recomendaciones de las sociedades científicas y ponerlas en práctica. Hace años se pensaba que no había techo terapéutico con los opioides mayores en el tratamiento del dolor; sin embargo, al llegar a dosis equivalentes a 100-200 mg diarios de morfina, habrá que revisar de nuevo todo el tratamiento que se haya ofrecido al paciente.
Aumentar la educación a los profesionales de la salud acerca del tratamiento del dolor crónico, fundamentalmente en Atención Primaria, donde se prescriben cerca del 70 % de los opioides. Hay profesionales que no han recibido la formación necesaria para saber cuándo prescribir cada fármaco, las características farmacológicas de cada uno, las complicaciones con las que se pueden encontrar y cómo manejarlas. Es necesario que sociedades científicas solventes como la SED den recomendaciones básicas para abordar este problema. En España, aunque no se dispone de datos recientes, el problema de abuso y adicciones no es grave, pero convendría anticiparse y evitar que ocurra lo que ha pasado en países como EE. UU.
Aumentar la investigación en el campo del dolor. Son necesarios más estudios a largo plazo (> 6 meses) con opioides mayores. La falta de evidencia actual no supone que haya que excluirlos del tratamiento integral. Los escasos datos que existen, procedentes de la fase abierta de ensayos clínicos terminados, sugieren que hay pacientes que sí se benefician y mejoran su calidad de vida a largo plazo, aunque hay que seguir investigando. Del mismo modo, se requieren investigaciones más extensas que corroboren el menor potencial adictivo a más larga duración de los fármacos con doble vía de acción o de combinaciones farmacológicas sinérgicas.
Solo después de una evaluación exhaustiva de la situación médica del paciente, una vez confirmado el diagnóstico y evaluada la relación riesgo-beneficio, se puede considerar el tratamiento con opioides mayores. Los pacientes con un alto riesgo de mal uso de la medicación deben seguir siendo tratados adecuadamente y, si su dolor lo precisa, deben recibir opioides mayores, aunque con estrategias más estructuradas. El protocolo de tratamiento podría incluir un consentimiento informado/pacto terapéutico escrito o verbal donde se indiquen los riesgos y beneficios de la terapia opioide, se explique lo que se espera del paciente, se le eduque sobre el empleo del fármaco y se especifiquen las conductas que se considerarían inaceptables. Igualmente, deberían aplicarse otras medidas como establecer visitas más frecuentes, recetar menos unidades por prescripción, verificar el cumplimiento y, si está indicado, realizar un asesoramiento motivacional y análisis de orina para su cuantificación. En todo caso, la monitorización se adaptará al riesgo de adicción percibido para cada paciente.
Una vez establecido el tratamiento, en caso de pacientes que presenten un riesgo elevado de sufrir conductas adictivas, podrán emprenderse medidas de seguimiento como derivarlos al especialista, optimizando con ello el tratamiento del dolor crónico y el uso de los opioides mayores en aquellos pacientes que los necesitan.