Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.26 supl.2 Pamplona 2003
Test de activación de basófilos en el diagnóstico de alergia a medicamentos
Basophil activation test in the diagnosis of allergy to medicines
M.L. Sanz1, M.C. García1, M.R. Caballero1, I. Diéguez1, P.M. Gamboa2
| RESUMEN En el presente trabajo se estudia la fiabilidad del test de activación de basófilos (TAB) en el diagnóstico in vitro de alergia a betalactámicos y a metamizol y se analiza la sensibilidad y especificidad de la técnica. Palabras clave. Alergia a medicamentos. Diagnostico in vitro. Expresión de CD63. Alergia a metamizol. Alergia a betalactámicos. | ABSTRACT In this paper we study the reliability of the basophil activation test (BAT) in the in-vitro diagnosis of allergy to betalactams and to metamizol, and the sensitivity and specificity of the technique are analyzed. Key words. Allergy to medicines. In-vitro diagnosis. CD63 expression. Allergy to metamizol. Allergy to betalactams. |
| 1. Departamento de Alergología e Inmunología Clínica. Clínica Universitaria de Navarra. Facultad de Medicina. Universidad de Navarra. 2. Servicio de Alergia. Hospital Basurto. Bilbao | Correspondencia: Dra. María Luisa Sanz Larruga Departamento de Alergología e Inmunología Clínica Clínica Universitaria de Navarra Apartado 4209 31080 Pamplona Teléfono: 948 255400 Fax: 948 296500 E-mail: mlsanzlar@unav.es |
INTRODUCCIÓN
Las reacciones alérgicas a medicamentos representan, en numerosas ocasiones, un grave problema diagnóstico. Esto se debe, por una parte, al riesgo potencial de los métodos in vivo, y, por otra, a la falta de pruebas in vitro o al bajo rendimiento de las mismas, especialmente para ciertos medicamentos.
En nuestro país, los antibióticos betalactámicos constituyen la primera causa de reacciones mediadas por IgE frente a medicamentos y las pirazolonas la segunda en lo que a frecuencia se refiere1. Existe la posibilidad de determinar IgE específica frente a betalactámicos pero, hasta el momento, no existe ningún tipo de test diagnóstico in vitro que haya demostrado una efectividad comprobada en el diagnóstico de alergia a pirazolonas.
Los basófilos constituyen una fracción minoritaria de leucocitos en sangre periférica (<0,2%), son capaces de liberar el contenido de sus gránulos tras un proceso de activación dependiente del estímulo antigénico. La degranulación ocurre tras el puenteo entre receptores de IgE por acción de un alergeno bivalente. Esta activación provoca la fusión intracitoplasmática de los gránulos y la fusión de la membrana de éstos con la membrana plasmática, con lo que las moléculas expresadas en la membrana granular (CD63), se expresan en la membrana del basófilo cuando éste se encuentra activado2.
La molécula CD 63 es una proteína granular tetraespan de 53 Kda que se expresa no sólo en los gránulos del basófilo y en la superficie de éste cuando se activa, sino también en monocitos, macrófagos y plaquetas. La expresión de este marcador se correlaciona con la degranulación, lo que hace que esta molécula sea un marcador ideal de activación del basófilo3.
El test de activación de basófilos (TAB) mide la expresión de la proteína CD63 presente en estado de reposo en los gránulos citoplasmáticos de los basófilos inactivos, que se expresa en su superficie cuando se activan. Esta molécula puede ser detectada mediante citometría de flujo, utilizando dos anticuerpos monoclonales: Anti CD63 PE y anti IgE FITC.
La citometría de flujo ha sido confirmada como un método fiable para cuantificar la degranulación de basófilos tras el estímulo antigénico en reacciones de hipersensibilidad tal y como demostrara Nagakawa y col2. Posteriormente, Knol y col3 observaron cómo estimulando basófilos con FMLP la expresión de CD 63 aumentaba 100 veces. Por otra parte, Gane y col4 demuestraron que más del 80% de las células que expresan CD 45 e IgE de alta densidad son basófilos. Estos mismos autores observaron un aumento en la expresión de CD 63 tras estímulo Ag. En 1994 Saint-Laudy5-7 aplicó esta técnica al diagnóstico alergológico utilizando 2 marcadores: anti-IgE-FICT (Fce RI) y anti-CD63-PE como marcador de activación. Posteriormente se han publicado estudios que demuestran la fiabilidad diagnóstica de este método como herramienta de diagnóstico in vitro.
Paris-Kohler y col8 describieron el uso del kit comercial Basotest para el diagnóstico de la alergia al polen de ciprés; refirieron que el método tiene una sensibilidad del 91% y una especificidad del 100%. En cuanto a la investigación en alimentos, Mouneret-Vautrin et al9 concluyeron de su estudio que la citometría de flujo da resultados comparables al test de liberación de leucotrienos (LTC4) y es más eficiente que el test de liberación de histamina en el diagnóstico de alergia alimentaria. Esta técnica también ha sido utilizada para la investigación de sensibilización al veneno de himenópteros10. En cuanto a los medicamentos, Moneret y col11 utilizaron un ensayo de citometría de flujo a tres colores (IgE, CD45, CD63) en 4 pacientes con anafilaxia inducida por drogas miorrelajantes, correlacionando los resultados con pruebas intradérmicas positivas. Abuaf y col12 estudiaron la activación de basófilos por drogas miorrelajantes utilizando el ensayo BASIC, que mide los cambios en la intensidad de la fluorescencia en oposición del porcentaje de células positivas. Los autores demuestran una curva dosis-respuesta característica, pero señalan que las concentraciones altas de la droga pueden actuar como activadores inespecíficos de basófilos.
Hemos estudiado la fiabilidad diagnóstica de esta técnica en el diagnóstico in vitro de la alergia frente diferentes medicamentos, tales como antibióticos betalactámicos y metamizol.
MATERIAL Y METODOS
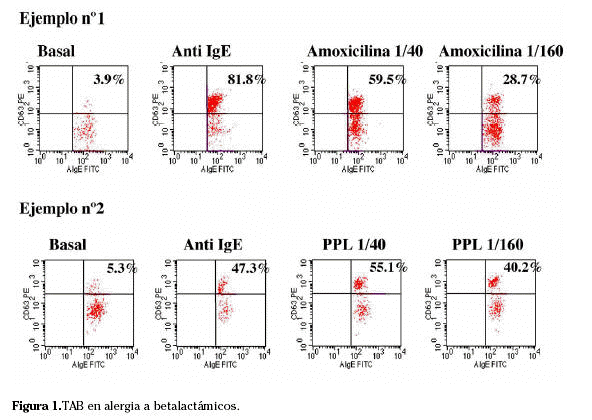
Tab en alergia frente a betalactámicos
Se estudió un grupo de 58 pacientes con clínica de alergia a antibióticos betalactámicos y que presentaban pruebas cutáneas positivas a al menos uno de los alergenos probados: MDM, PPL, penicilina, ampicilina, amoxicilina y cefalosporinas. Como controles se incluyeron 30 sujetos sanos.
Se incluyeron en este grupo 58 pacientes, 21 de los cuales eran varones y 37 mujeres, con una edad media de 51,5 años (ds 15,2), seleccionados por presentar una reacción alérgica inmediata tras la administración de betalactámicos.
Como grupo control se incluyeron 30 pacientes no alérgicos (13 varones y 17 mujeres) (52,5 años; 14,9). Todos ellos presentaban pruebas cutáneas negativas frente a betalactámicos y toleraban su administración.
Los criterios de inclusión fueron: historia de anafilaxia o urticaria-angioedema inmediatamente tras la administración de betalactámicos y al menos una prueba cutánea positiva frente a uno de los reactivos derivados de betalactámicos probados. En 46 casos referían reacción con amoxilicina-clavulánico, frente a penicilina G en 6 casos , frente a cefuroxima en 5 casos y frente a cefazolina en un caso (n=58).
A todos ellos se les realizaron test cutáneos, determinación de IgE específica y TAB.
Tab en alergia frente a metamizol
Se incluyó un grupo de 26 pacientes alérgicos a metamizol y 30 controles sanos.
De los 26 pacientes, 6 eran varones y 20 mujeres (41,6 ± 13,6 años), de los cuales 14 habían presentado anafilaxia, 12 urticaria-angioedema inmediatamente (menos de una hora) tras la administración exclusiva de metamizol. Fueron excluidos del estudio todos los pacientes con historia previa de intolerancia frente a otros analgésicos tales como aspirina u otros analgésicos antiinflamatorios no esteroideos o con historia de urticaria recurrente o crónica. Los pacientes tenían que estar asintomáticos durante al menos un año tras la administración de pirazolonas.
Once pacientes habían presentado urticaria/angioedema y 15 anafilaxia. Los test cutáneos fueron positivos en 13 pacientes (50%), dos en prick tests y once en intradermo. El periodo de tiempo medio entre la reacción clínica y la realización del estudio fue de 16,9 ± 30,6 meses.
Los 30 sujetos controles sanos presentaban test cutáneos negativos y test de provocación oral negativo con metamizol y aspirina.
Fueron excluidos del estudio pacientes con infecciones, enfermedades cardiológicas, hepáticas o endocrinológicas. Los pacientes estaban libres de medicación con antihistamínicos durante 5 días antes de la extracción de la muestra (durante 6 semanas para el Astemizol) y al menos un mes libres de corticosteroides.
Todos los sujetos incluidos en el estudio fueron informados oralmente de la realización del estudio y firmaron el correspondiente consentimiento informado. Asimismo, el estudio fue aprobado por el Comité de Ética.
MÉTODOS
Pruebas cutáneas
Las pruebas cutáneas fueron realizadas de la forma habitual13. Los prick tests, utilizando lancetas ALK Abelló, y cuando la prueba era negativa se pasa a intradermo con agujas hipodérmicas 261/2 inyectando 0,05 ml de la sustancia a testar en el antebrazo. Las concentraciones de betalactámicos utilizadas fueron las siguientes: Benzilpeniciloyl-polilisina (PPL) (5 x 10-5 mol/L, Allergopharma, Hamburg, Germany), mezcla de determinantes menores (MDM) (2 x 10-2 mol/L, Allergopharma, Hamburg, Germany), penicilina G sódica (1000 UI/ml; Laboratorio Level, Barcelona, Spain), ampicilina (20 mg/ml, Antibióticos SA, León, Spain) y amoxicilina (20 mg/ml, Beecham,Toledo, Spain). La concentración de metamizol fue de 0,1 mg/ml (Boehringer Ingelheim, Barcelona Spain). Como control positivo se utilizó hidrocloruro de histamina (10 mg/ml) y ClNa 0,9% como control negativo.
Los resultados se leyeron a los 15 minutos con la técnica prick y a los 20 minutos con la intradermorreacción, y fueron interpretados como positivos cuando el diámetro de la pápula era mayor de 3 mm con respecto al control negativo en prick, y mayor de 5-10 mm con respecto al control negativo en intradermo.
Determinación de IgE específica
Se determinó IgE específica mediante CAP (Pharmacia Uppsala, Sweden) en los casos de alergia a betalactámicos con peniciloil G, peniciloil V, ampicilina y amoxicilina. Resultados iguales o mayores a 0,35 kU/l fueron considerados como positivos.
Test de activación de basófilos
Medicamentos
Antibióticos betalactámicos: concentraciones finales de benzylpenicilina (3,9 y 0,975 mg/ml), ampicilina (2,5 y 0,625 mg/ml), amoxicillina (2,5 y 0,625 mg/ml) mezcla de determinantes menores (MDM) (27,5 y 6,87 ng/ml), peniciloil-polylisina (PPL) (0, 5 y 0,125 mg/ml), cefuroxima (0,83 y 1,2 mg/ml), y cefazolina (0,4 y 0,16 mg/ml).
Metamizol: (Europharma), 5 y 0,625 mg/ml.
Test de activación de basófilos
Se extraen seis mililitros de sangre venosa periférica en tubos ACD (Vacutainer, Becton Dickinson, Meylan Cedex, France) y se guardan a 4ºC, hasta 24 horas. Por cada tubo se pueden estudiar 3 alergenos. Luego se centrifuga durante 10 minutos a 4ºC y a 550 g. Se recogen las células separadas en el halo sobre los eritrocitos y se centrifugan durante 10 min a 4º C a 550 g. Se decanta el sobrenadante y se añade 500 microl de tapón HEPES, buffer calcio, denominado tampón de estimulación (HEPES 20 mM, NaCl 133mM, KCl 5mM, Cacl 7 mM, MgCl2 3,5 mM, HSA 1 mg/ml, ph 7,4) que contiene IL3 (2ng/ml) y 10 microl de heparina (5000 UI/ml, ROVI, Madrid, Spain) a cada tubo, se mezcla y se agita. Cuando el alergeno es un medicamento añadimos a cada pocillo 10 ml de C5a(Sigma, Madrid, Spain) 10-9 M en placas en U de poliestireno (Greiner Microlon, Zaragoza, Spain). Se añade al pocillo correspondiente 50 ml de las diluciones de antígeno. Como control positivo hemos utilizado una solución de Ac monoclonal AntiIgE Le27 (Bühlmann, Allschwil, switzarland). Como control negativo añadimos 50 microl de tampón de muestra. Se añade 50 microl de la suspensión celular de la sangre del paciente, se agita y se incuba durante 40 minutos a 37º C. Se detiene la reacción añadiendo 100 ml de tampón HEPES ph 7,3 sin calcio ni magnesio pero con EDTA (HEPES 20 mM, NaCl 133 mM, KCl 5mM, EDTA 0,27 mM), tampón de lavado. Las placas se centrifugan durante 5 minutos a 4ºC, 1000 g. Los basófilos se marcan añadiendo 20 ml de anticuerpo anti-CD63 PE (Caltag Laboratories, Burlingama, USA) diluido 1:80 en tubos de citómetro Falcon y anticuerpo anti-IgE FITC (Caltag Laboratories, Burligame, USA) diluido 1:60 en tampón de lavado. Se incuba durante 30 minutos a 4ºC (protegidos de la luz), añadimos 4 ml de reactivo de lisis (Ortho-Mune lytic reagent, Ortho Diagnostic System Inc, San Fernando de Henares, Madrid) en cada tubo y los dejamos 5 min a temperatura ambiente. La lisis celular se para añadiendo 1 ml de tampón de lavado. Se centrifuga durante 5 minutos a más de 1000 g, se decanta el sobrenadante y añadimos 500 ml de buffer de lavado en cada tubo. El análisis de los marcadores de membrana se hace mediante citometría de flujo en un citómetro FACScan 448 nm equipado con un láser argón de 15 nW (Beckton Dickinson) y el análisis de los resultados se realiza en un software CellQuest. En un histograma se define forward scatter y side scatter y se traza una ventana inicial alrededor de los linfocitos, con el fin de seleccionar con ellos los basófilos, que se encuentran en la zona periférica de éstos. La segunda ventana se traza alrededor de las células que muestran marcaje de Anti-IgE-FITC de alta afinidad, definidos como basófilos. En cada tubo medimos al menos 500 basófilos. El otro parámetro analizado para identificar los basófilos activados es el CD63-PE.
Análisis estadístico
Los datos fueron analizados mediante un programa SPSS 10.0. Los datos se expresan en medias ± desviación estándar. La reproducibilidad del TAB fue analizada mediante el coeficiente de correlación intraclase. Los valores p<0,05 fueron considerados como significativos.
Para obtener el punto de corte aplicamos curvas ROC (Receiver operating characteristic).
RESULTADOS
Tab en alergia a antibióticos betalactámicos
Aplicamos curvas ROC para analizar los puntos de corte y la sensibilidad y especificidad de la técnica. En nuestros resultados la sensibilidad de la técnica fue del 50% y la especificidad 93,3% para un punto de corte de activación de basófilos mayor de 5% y un índice de estimulación (IE) mayor de 2 (IE= activación frente al medicamento/activación basal). La determinación de IgE específica mediante CAP (Pharmacia) presenta una sensibilidad del 38% y una especificidad del 86,7%. La utilización conjunta de CAP (Pharmacia) y TAB nos permitió la identificación del 65% de los pacientes.
De los 58 pacientes incluidos en el estudio, 29 fueron positivos en TAB al menos frente a un betalactámico de los ensayados (Ejemplos 1 y 2 en Fig. 1). Sólo 2 controles de los 30 mostraron un TAB positivo.
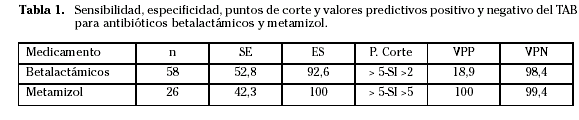
El valor predictivo positivo del TAB fue 18,9% y el valor predictivo negativo 98,4%. La razón de verosimilitud para un resultado positivo fue del 7,46 (CI 3,7-14,9) y la razón de verosimilitud para un resultado negativo 0,54 (CI 0,27-1,08) (Tabla 1).
Tab en alergia frente a metamizol
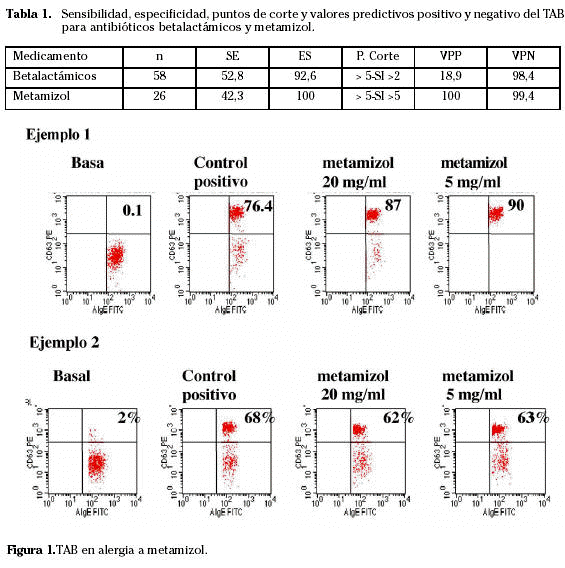
En 11 casos de los 26 pacientes, el TAB fue positivo, mientras que todos los controles resultaron negativos. La sensibilidad de la técnica fue del 42,3% y la especificidad del 100% para un punto de corte de activación de basófilos mayor de 5% y un índice de estimulación (IE) mayor de 5. No existen datos recientes sobre la prevalencia de alergia a metamizol, pero si asumimos una prevalencia similar a la de los antibióticos betalactámicos (1%), el valor predictivo positivo del TAB es de 100% y el valor predictivo negativo es 99,4. La razón de verosimilitud para un resultado positivo porque la especificidad fue del 100% y la razón de verosimilitud para un resultado negativo fue del 0,58 (Tabla 1) (Ejemplos 1 y 2 en Fig. 2).
Reproducibilidad
La reproducibilidad de la técnica es muy alta, siendo su coeficiente de variación intraensayo de 0,89 (p<0,0001) para betalactámicos y de 0,99 (p<0,0001) para metamizol.
DISCUSIÓN
El diagnóstico in vitro de la alergia frente a medicamentos es un problema difícil y no resuelto hasta el momento actual. Estudios previos sugieren que las pruebas in vivo, tales como los test cutáneos frente a penicilina, bencilpenicilina G y determinantes menores de la penicilina (MDM) pueden identificar hasta un 95% de los pacientes con alergia frente a betalactámicos14. Según algunos autores15 unas pruebas cutáneas negativas frente a PPL, bencilpenicilina G y MDM, permiten la administración segura de penicilina. Sin embargo, el 5% de los pacientes con historia positiva y test cutáneos negativos muestran una prueba de provocación positiva. Las pruebas in vitro que miden IgE específica frente a betalactámicos no se consideran demasiado fiables16.
La citometría de flujo y concretamente la detección de CD63 en células activadas ha resultado útil en el diagnóstico de diferentes patologías alérgicas17-19.
Así, se ha referido su alta fiabilidad en el diagnóstico in vitro de alergia mediada por IgE frente a inhalantes tales como Der p, Lol p.20, polen de ciprés8, látex21 y alergenos alimentarios22.
En pacientes sensibilizados frente a betalactámicos observamos una activación de basófilos significativa tras la incubación de las células con dichos antibióticos, en el 50% de los pacientes estudiados con una reacción clínica inmediata y pruebas cutáneas positivas frente a algún reactivo derivado de la penicilina.
En el grupo de pacientes con alergia a metamizol encontramos que el TAB presenta una especificidad del 100% y una sensibilidad del 42,3%. Las reacciones mediadas por IgE frente a pirazolonas constituyen la segunda causa de alergia a medicamentos en nuestra área, con reacciones que a menudo son de carácter grave. Hasta ahora, la única prueba disponible era la prueba cutánea y la prueba de provocación, con el riesgo que implica. En nuestra serie encontramos una sensibilidad de las pruebas cutáneas frente a metamizol del 50%, algo mayor que las referidas por otros autores23,24. Otros autores encuentran una pobre correlación entre pruebas cutáneas y alergia a pirazolonas25.
En humanos la determinación de IgE específica frente a pirazolonas es objeto de controversia. Así, Kowalski24 no detectó IgE específica en ningún caso de una serie de 28 pacientes con alergia inmediata frente a pirazolonas. Wüthrich23 encuentró que el 28% de sus pacientes con reacciones mediadas por IgE frente a pirazolonas mostraban IgE específica positiva frente a 4-amino antipirina. Otros autores26 encuentraron IgE específica positiva frente a 1-fenil-2.3-dimetil-3-pirazolina-5 en un elevado porcentaje de sus pacientes. Pero la utilidad de estos tests no puede evaluarse porque no están comercializados.
Con lo que podemos afirmar que en la alergia frente a metamizol no existen otras técnicas en el mercado que permitan detectar una sensibilización in vitro, al igual que ocurre con otros muchos medicamentos tales como heparinas, antibióticos, omeprazol, corticoides, relajantes musculares, etc.
Hay poco trabajos en la literatura que validen la fiabilidad de esta técnica en alergia a medicamentos; entre ellos, los realizados por nosotros27-31 documentan la sensibilidad y especificidad del TAB así como su fiabilidad respecto a otras técnicas tales como CAP y la determinación de sulfidoleucotrienos mediante CAST.
Nuestros resultados confirman que la sensibilidad del TAB es mayor que la del CAP (deteminación de IgE específica) en alergia frente a betalactámicos.
En nuestra experiencia el uso combinado de las diferentes técnicas in vivo e in vitro nos permite identificar una elevado número de pacientes alérgicos a betalactámicos y a metamizol. Tal y como hemos comentado, la asociación de esta técnica con la determinación de IgE específica en alergia frente al grupo de antibióticos betalactámicos, permite detectar una sensibilización en el 65% de los casos. En el caso del metamizol su asociación a las pruebas cutáneas nos permite detectar un 70% de los casos, lo que supone un alto porcentaje de pacientes diagnosticados en cuyos casos se podría obviar la prueba de provocación.
El test de activación de basófilos presenta una excelente especificidad y una moderada sensibilidad en el diagnóstico in vitro de alergia frente a betalactámicos y metamizol.
La elevada reproducibilidad de esta técnica, como demuestra el excelente coeficiente de correlación encontrado en nuestras series, junto con los resultados obtenidos en nuestras series, nos permite validar esta técnica para el diagnóstico in vitro de alergia frente a betalactámicos y metamizol.
CONCLUSIONES
El test de activación de basófilos es una nueva y eficaz herramienta en el diagnóstico in vitro de la alergia frente a antibióticos betalactámicos y metamizol.
BIBLIOGRAFÍA
1. Alergológica. Factores epidemiológicos clínicos y socioeconómicos de las enfermedades alérgicas en España. Sociedad Española de Alergología e Inmunología Clínica y Alergia e Inmunología Abelló. Madrid 1995. [ Links ]
2. Nagakawa T, Stadler BM, De Weck AL. Flow-cytimetric analysis of human basophil degranulation. Allergy 1981; 36: 39-47 [ Links ]
3. Knol EF, Mul FP, Jansen H, Calafat J, Roos D. Monitoring human basophil activation via CD63 monoclonal antibody 435. J Allergy Clin Immunol 1991; 88: 328-338. [ Links ]
4. Gane P, Pecquet C, Crespeau H, Lambin, Abuaf N, Leynaider F, Rouger P. Flow cytometric monitoring of allergen induced basophil activation. Cytometry 1995; 19: 361–365. [ Links ]
5. Sainte-Laudy J, Vallon C, Guerin JC. Analysis of membrane expression of the Cd63 human basophil activation marker. Applications to allergologic diagnosis. Allerg Immunol (Paris) 1994; 26: 211-214. [ Links ]
6. Sabbah A, Sainte Laudy J. Flow cytometry applied to the analysis of lymphocyte and basophil activation. ACI International 1996; 8: 116-120. [ Links ]
7. Sainte Laudy J. Application of flow cytometry to the analysis of activation of human basophils. Immunologic validation of the method. Allerg Immunol (Paris) 1998; 30: 41-45. [ Links ]
8. Paris-Kohler A, Demoly P, Persi L, Lebel B, Bousquet J, Arnoux B. In vitro diagnosis of cypress pollen allergy by using cytofluorimetric analysis of basophils (Basotest). J Allergy Clin Immunol 2000; 105: 339-345. [ Links ]
9. Moneret-Vauttrin DA, Sainte Laudy J, Kanny J, Fremont S. Human basophil activation measured by CD 63 expresion and LTC4 release in IgE-mediated food allergy. Ann Allergy Asthma Immmunol 1999; 82: 33-40. [ Links ]
10. Stevens S, Drouet M, Lauret MG, Loiry M, Sabbah A. Basophil activation test using flow cytometry in Hymenoptera venom allergy. Allerg Immunol (Paris) 1999; 31: 11-14. [ Links ]
11. Monneret G, Gutowski MC, Bienvenu J. Detection of allergen induced basophil activation by expression of CD 63 antigen using a tricolour flow cytometic methods. Clin Exp Immunol 1999, 115: 393-396. [ Links ]
12. Abuaf N, Rajoely B, Ghazouani E, Levy DA, Pecquet C, Chabane H, Leynadier F. Validation of flow cytometry assay detecting in vitro basophil activation for the diagnosis of muscle relaxant allergy. J Allergy Clin Immunol 1999; 10: 411-418. [ Links ]
13. Dreborg S, Backman A, Basomba A. Skin tests used in type I allergy testing. Allergy 1989; 44 (Suppl. 10): 1-59. [ Links ]
14. Gadde J, Spence M, Wheeler B, Adkinson F. Clinical experience with penicillin skin testing in a large inner-city STD clinic. JAMA 1993; 270: 2456-2463. [ Links ]
15. Macy E, Richter PK, Falkoff R, Zeiger R. Skin testing with penicilloate prepared by an improved method: amoxiciline oral challenge in patients with negative skin-test responses to penicillin reagents. J Allergy Clin Immunol 1997; 100: 586-591. [ Links ]
16. Sanz ML, Garcia BE, Prieto I, Oehling A. Specific IgE determination in the diagnosis of beta-lactam allergy. J Invest Allergol Clin Immunol 1996; 6: 89-93. [ Links ]
17. Sabbah A, Lauret MG, Maillard H. Preliminary study of basophil activation test for drug allergy using anti-membrane antibodies and flow cytometry. Allerg Immunol 1995; 27: 276. [ Links ]
18. Sainte Laudy J, Vallon C, Guerin. Diagnosis of latex allergy. Comparison of histamine release and flow cytometric analysis of basophil activation. Inflamm Res 1996; 45: 35-36. [ Links ]
19. Sainte Laudy J, Drouet M, Lauret MG, Loiry M, Sabbah A. Test dactivation des basophiles par cytometrie en flux dans lallergie aux venins d´hyménoptères. Allerg Immun 1999; 31: 11-14 [ Links ]
20. Sanz ML, Sánchez G, Gamboa PM, Vila L, Uasuf C, Chazot M et al. Ag-induced basophil activation: CD63 cell expression detected by flow cytometry in patients allergic to Dermatophagoides pteronyssinus and Lolium perenne. Clin Exp Allergy 2001; 31: 1007-1013. [ Links ]
21. Sanz ML, Gamboa PM, García-Avilés C, Diéguez I, Antépara I, De Weck A.L. Flow cytometric cellular allergen stimulation test in latex allergy. Int Arch Allergy Immunol 2003; 130: 33-39. [ Links ]
22. García-Avilés C, Sánchez-López G, Sanz ML, Uasuf C, Diéguez I, Chazot M et al. Flow-cytometric cellular allergen stimulation test (FAST) in the in vitro diagnosis of food allergy. Allergy 2000, 55:128. [ Links ]
23. Wüthrich B, Fabro L, Walti M. Sofforttyp-Reaktionen auf pyrazol-derivative: Ergebnisse von hauttesten und antikorpenbertsimmungen. Dermatologica 1986, 173: 24-28. [ Links ]
24. Fabro K, Wüthrich B, Wälti M. Acetylsalicylsäure- und Pyrazol-Allergie oder Pseudo-Allergie. Z Hautkr 1987, 62: 470-478. [ Links ]
25. Kowalski ML, Bienkiewicz B, Wosczek G, Iwaszkiewicz J, Poniatowska M. Diagnosis of pyrazolone drug sensitivity: clinical history versus skin testing and in vitro testing. Allergy Asthma Proc 1999, 20: 347-352. [ Links ]
26. Zhu D, Becker W, Schulz K, Schubeler K, Schlaak M. Detection of IgE antibodies specific for 1-phenyl-,3-dimethyl-3-pyrazolone-5-one by RAST: A serological diagnostic method for sensitivity to pyrazoline drugs. Asian Pac J Allergy Immunol 1992, 10: 95-101. [ Links ]
27. Sanz ML, Gamboa PM, Antépara I, Uasuf C, Vila L, García-Avilés C, Chazot M, De Weck AL. Flow cytometric basophil activation test by detection of CD63 expression in patients with immediate-type reactions to Beta-lactam antibiotics. Clin Exp Allergy 2002; 32: 1-10. [ Links ]
28. Gamboa PM, Sanz ML, Caballero MR, Antépara I, Urrutia I, Jáuregui I et al. Use of CD63 expression as a marker of in vitro basophil activation and leucotriene determination in metamizol allergic patients. Allergy 2003; 58: 312-317. [ Links ]
29. Sanz ML, Maselli JP, Gamboa PM, García-Avilés C, Oehling A, Diéguez I, et al. Flow Cytometric Cellular Allergen Stimulation Test. A Review. J Invest Allergol Clin Immunol 2002; 12: 143-154. [ Links ]
30. Sanz ML, Gamboa PM, De Weck AL. Clinical evaluation of in vitro tests in diagnosis of immediate allergic reactions to betalactam antibiotics. ACI International 2002; 14/5: 185-192. [ Links ]
31. De Weck AL, Sanz ML. Flow Cytometric Cellular Allergen Stimulation Test (FAST/ Flow CAST). Technical and clinical evaluation of a new diagnostic test in allergy and pseudoallergy. ACI International 2002; 14/5: 204-215. [ Links ]