Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
RCOE
versión impresa ISSN 1138-123X
RCOE vol.7 no.1 ene./feb. 2002
El tratamiento de la periimplantitis en base
a protocolos científicos. Revisión de la literatura

Cabello-Domínguez, Gustavo*
González-Fernández, David Alfredo**
Herrero-Climent, Mariano***
Herrero-Climent, Federico****
* Máster en Periodoncia y Especialista en Osteointegración por la Universidad Complutense de Madrid.
Profesor de Medicina Bucal y Periodoncia en la Universidad Alfonso X El Sabio. Profesor invitado al
Master de Periodoncia y Osteointegración de la UCM.
** Máster en Periodoncia y Especialista en Osteointegración y doctor en Odontología por la UCM.
*** Médico-Estomatólogo. Profesor invitado al Master de Periodoncia y Osteointegración de la UCM.
**** Máster en Periodoncia. Profesor de Medicina Bucal y Periodoncia en la Universidad Alfonso X El Sabio.
Profesor invitado al Master de Periodoncia y Osteointegración de la UCM.
Periimplantitis treatment on the basis of scientific protocols. Literature review
Resumen: La comprensión de la patología alrededor de los implantes, no ha sido constatada en modelos experimentales hasta muy recientemente. A raíz de estos estudios se ha podido evidenciar el factor infeccioso como causa principal en estas patologías. Por otro lado, y al margen de estos hallazgos, se han planteado una serie de protocolos sobre modelos clínicos y experimentales en relación a la conducta terapéutica a seguir a la hora de abordar el tratamiento clínico de la periimplantitis. El presente artículo se centra en la recopilación y análisis de la evidencia publicada a este respecto.
Palabras clave: Periimplantitis, Infección periimplantaria, Tratamiento de la periimplantitis.
Abstract: The comprehension of the periimplant pathology has been recently evidenced. On the basis of these studies the infectious aetiology of this pathology has been demonstrated. On the other hand, and regardless these findings, diverse protocols based on experimental and clinical models provide a therapeutic sequence in order to treat periimplantitis cases. The present article focuses on the review and analysis of the evidence published regarding periimplantitis treatment modalities.
Key words: Periimplantitis, Periimplant infection, Periimplantitis treatment.
Correspondencia
Gustavo Cabello Domínguez
Paseo de Reding, 41- 1ºIzq.
29016 Málaga
Fecha recepción: 17-10-2000 Fecha última revisión: 29-03-2001 Fecha aceptación: 28-05-2001
BIBLID [1138-123X (2002)7:1; enero-febrero 1-132]
Cabello-Domínguez G, González-Fernández D, Herrero-Climent M, Herrero-Climent F. El tratamiento de la periimplantitis en base a protocolos científicos. Revisión de la literatura. RCOE 2002;7(1):61-70.
Introducción
La pérdida de soporte de los implantes osteointegrados (IOI) como consecuencia de una infección de los tejidos marginales periimplantarios se conoce como periimplantitis (PI). En la última década, el origen etiológico de la PI ha quedado demostrado en múltiples estudios en animales y en humanos, considerándose el factor más importante relacionado con la pérdida de osteointegración (OI)1-6. Por el contrario, en el momento actual existen escasas evidencias de que el trauma oclusal se pueda considerar un factor determinante en la pérdida de OI7-9. Sin embargo, tradicionalmente se ha aceptado la doble vertiente etiológica en la patología periimplantaria.
A principio de los noventa aparecieron los primeros artículos centrados en el análisis de estos procesos1-6, a partir de los que se pudieron identificar dos principios terapéuticos distintos: la terapia antiinfecciosa frente al agente etiológico, ya sea mecánica o química, y la regeneración ósea guiada (ROG), frente al tratamiento de la pérdida de soporte. En el presente artículo se revisan aspectos relativos al tratamiento de la PI, como son las distintas modalidades terapéuticas, la recuperación de soporte óseo mediante ROG y las características histológicas del nuevo hueso periimplantario regenerado.
Material y método
La búsqueda del material científico revisado fue realizada a través del buscador MEDLINE que ofrece el portal web healthgate.com. Se emplearon como términos de búsqueda: Periimplantitis, periimplant infection y treatment of periimplantitis, y se excluyeron todos aquellos artículos publicados antes del año 1990.
Resultados
Tratamiento de la PI mediante terapia antiinfecciosa
La clasificación propuesta en el 1st. European Workshop on Periodontology en 1993, establece dos tipos de lesiones periimplantarias: la mucositis periimplantaria, que es un proceso inflamatorio reversible que solo afecta a la mucosa periimplantaria, y que, por tanto, cursa sin pérdida de soporte; y la PI, que se define como un proceso de naturaleza inflamatoria, y etiología bacteriana, y que cursa con pérdida de soporte óseo periimplantario. Por lo tanto, desde el punto de vista etiopatogénico, existen dos niveles de tratamiento: el etiológico, frente a la infección, y el tratamiento de las secuelas, es decir, de los defectos óseos secundarios a la infección. En este sentido, se puede considerar terapia antiinfecciosa aquella que va dirigida a la eliminación de la infección, y no a la correción del defecto, incluyendo técnicas como el desbridamiento de las lesiones, la detoxificación de la superficie del implante y empleo de antibioterapia sistémica y/o antisépticos locales.
Mombelli y cols10** plantearon la posibilidad de realizar tratamiento antimicrobiano alrededor de implantes con lesiones perimplantarias en nueve pacientes portadores de implantes ITI®. La pauta de tratamiento consistía en desbridamiento mecánico seguido de irrigación de las bolsas periimplantarias con profundidad de sondaje mayor o igual a 3 mm con clorhexidina al 0,5%, y administración sistémica de 1.000 mgr de Ornidazol durante 10 días. Se produjeron mejorías en los parámetros clínicos (índice de placa, índice de sangrado y profundidad de sondaje), aunque los datos microbiológicos demostraron una recidiva en la composición de la microbiota. El estudio no aporta datos clínicos a largo plazo, pero la recidiva microbiológica cuestiona la efectividad del tratamiento10**.
Marinello y cols11 analizaron en un modelo animal en perros beagle, las alteraciones que se producían tras la inducción de periimplantitis mediante ligaduras de seda en implantes de tipo Brånemark®. Los resultados mostraron que:
- Un mes después de retiradas las ligaduras existía una lesión inflamatoria destructiva en los tejidos blandos y en el hueso periimplantario.
- Tres meses después de retiradas las ligaduras, en la mayoría de los implantes se detectaba tejido conectivo cicatricial adyacente al epitelio de la bolsa (cicatrización de las lesiones).
Los autores concluyeron que el proceso de remisión de las lesiones periimplantarias inducidas por ligaduras una vez retiradas es más lento que el mismo proceso alrededor de los dientes, y que las lesiones periimplantarias infecciosas pueden remitir parcialmente, si cesan las causas que la producen .
El efecto de los antibióticos sistémicos fue estudiado igualmente en el perro labrador por Ericsson y cols12. Lesiones periimplantarias inducidas por ligaduras en implantes de tipo Brånemark® fueron tratadas mediante amoxilina y metronidazol durante tres semanas, junto con desbridamiento a colgajo de los defectos e irrigación con delmopinol. Tras cuatro meses de cicatrización, la terapia con antibióticos sistémicos junto con el abordaje quirúrgico de las lesiones produjo como resultado:
- Resolución de la infección periimplantaria.
- Recesión de la mucosa periimplantaria.
- Escasa regeneración de los defectos óseos.
Los tejidos blandos periimplantarios de las zonas no tratadas quirúrgicamente (lado control) mostraban un epitelio de la bolsa ulcerado con un infiltrado inflamatorio, que en un 25% contactaba con el hueso.
Similares resultados fueron encontrados por Persson y cols en lesiones periimplantarias inducidas mediante ligaduras alrededor de implantes Brånemark®13. Analizaron en un modelo animal (perros beagle), la efectividad del tratamiento con antibioterapia sistémica (amoxicilina y metronidazol durante tres semanas), junto con desbridamiento quirúrgico local (mediante curetas de plástico) y dos modalidades de detoxificación de la superficie (piedra pómez aplicada mediante un cepillo de profilaxis o lavado con solución salina). El estudio clínico e histológico evidenció la resolución de las lesiones inflamatorias. Asimismo, se observaba una capa de tejido conectivo denso, de 50 a 200 mm de grosor, que separaba el hueso neoformado (aproximadamente el 60% del defecto original) de la superficie del implante.
Tratamiento de la PI mediante terapia antiinfecciosa y ROG en modelos animales
Tomando como fundamento el principio de la ROG, en virtud del cual es posible dirigir la reparación de un defecto óseo para evitar la formación de tejido conectivo inespecífico en favor del tejido óseo, algunos autores se plantearon el tratamiento regenerativo de defectos periimplatarios.
Jovanovic y cols14* analizaron en un modelo experimental en perros beagle, la reparación de defectos periimplantarios provocados mediante la colocación de ligaduras sobre tres tipos diferentes de superficies: titanio maquinado (implantes Brånemark®), implantes de plasma de titanio (IMZ®) e implantes cubiertos de hidroxiapatita (HA) (Integral®). Se realizó desbridamiento a colgajo del defecto, seguido de acondicionamiento de la superficie empleando una unidad de aire abrasivo (Prophy-Jet®) durante 30 segundos y aplicación de ácido cítrico durante 30 segundos. En la cortical vecina al defecto se realizaron perforaciones, y finalmente se cubrió con una membrana no reabsorbible de politetrafluoruro etileno expandido (PTFEe). La colocación de las ligaduras conllevó la formación de defectos circunferenciales en todos los implantes, con una mayor destrucción alrededor de los implantes de HA. Tras el tratamiento mediante ROG, el estudio histológico permitió ver regeneración ósea en todos los implantes tratados, evidenciándose en algunas áreas un nuevo contacto hueso-implante sin interposición de tejido conectivo, es decir una nueva osteointegración (NOI). Los implantes de HA mostraban una mayor superficie relativa de NOI, alternándose con zonas de actividad de células fagocíticas (macrófagos y células gigantes). Las localizaciones control no tratadas mostraron mínima formación de hueso.
Estos resultados están en concordancia con Singh y cols15 al analizar en un modelo animal, en cerdos, el tratamiento de defectos experimentales mediante ROG o tratamiento resectivo. Las modalidades de tratamiento comparadas fueron:
- desbridamiento de la lesión y colocación de una membrana de PTFEe,
- desbridamiento y cierre del colgajo sobre los implantes,
- desbridamiento dejando el implante no sumergido (control negativo).
Los resultados clínicos mostraron una ganancia máxima de hueso de 5 mm (valor medio 2,13 mm) adyacente a las fijaciones que recibían tratamiento mediante ROG. Histológicamente, el 35,6% del hueso regenerado mostraba NOI, mientras que el resto presentaba una interfase fibrosa en la zona de contacto con el implante. Los implantes que eran sumergidos sin colocación de membrana mostraban una ganancia máxima de hueso de 3 mm (valor medio 1,37 mm) y una mínima NOI (7,8%). Los implantes control exhibían una ganancia de hueso mínima (0,87 mm) sin NOI.
Los resultados de este último estudio contrastan con Grunder y cols16**, quienes no encontraron resultados positivos tras la ROG de defectos en PI experimental en perros sobre implantes de titanio maquinado. Los implantes fueron tratados mediante cirugía, desbridación, y descontaminación de la superficie del implante con un dispositivo de aire a presión; tras esto un grupo de implantes recibían membranas de PTFEe (grupo experimental), mientras que otro grupo no recibían tratamiento regenerativo (grupo control). Dentro del grupo experimental se establecieron dos subgrupos, uno al que se le retiraron los pilares, con lo que quedaban sumergidos tras colocar la membrana, y otro en el que no se retiraban. Dos meses después los animales eran sacrificados y se preparaban las muestras para el análisis histológico, que no mostró diferencias significativas entre implantes control y los dos grupos de tratamiento experimental. En todos los grupos se observaba tejido conectivo entre la cresta alveolar y el epitelio del surco, con mínimas proporciones de tejido óseo neoformado. Los autores sugieren que la alteración de la energía superficial de los implantes por el aire a presión, la exposición y contaminación prematura de las membranas barrera, y la proximidad entre implantes, como causas de los resultados negativos del estudio.
Igualmente, Persson y cols17 encontraron resultados negativos tras la terapia mediante ROG de defectos alrededor de implantes de titanio maquinado de tipo Brånemark®. El estudio comparaba un tratamiento experimental mediante antibioterapia durante tres semanas con amoxicilina y metronidazol, desbridamiento a colgajo, detoxificación de la superficie con delmopinol y colocación de membranas de PTFEe, frente al control, donde no se realiza ningún tratamiento local. En ambos grupos se produjo la cicatrización mediante tejido conectivo con infiltrado inflamatorio, y ausencia de NOI.
La combinación de ROG con la colocación de materiales de relleno óseo fue objeto de estudio por Hürzeler y cols18, quienes compararon el tratamiento de defectos periimplantarios experimentales en implantes Brånemark® en 4 perros beagle. Las modalidades de tratamiento fueron:
- desbridamiento,
- desbridamiento y colocación de HA reabsorbible,
- desbridamiento y colocación hueso liofilizado,
- desbridamiento y recubrimiento con membranas,
- desbridamiento, colocación de HA reabsorbible y recubrimiento con membranas,
- desbridamiento, colocación de hueso liofilizado, y recubrimiento con membranas.
En todos los grupos de tratamiento se descontaminaba la superficie de los implantes con aire abrasivo (Prophy Jet®). Se evidenció que los valores de pérdida ósea inicial se reducían en todos los grupos de tratamiento, pero donde se empleaba ROG aparecía un mayor grado de relleno óseo, seguido de los grupos de injerto de hueso y desbridamiento a colgajo. No se encontraron diferencias entre la ROG y la ROG más injertos óseos. Histológicamente los defectos tratados con ROG e HA reabsorbible resultaban ser el grupo con mayor porcentaje de NOI (2,3 mm), seguido de ROG y DFDB (2,2 mm). Con respecto al relleno del defecto, los grupos experimentales no mostraron diferencias significativas19.
Usando proteína morfogenética ósea tipo 2 recombinante humana (rhBMP-2) como material de relleno, Hanisch y cols20* evaluaron el tratamiento de defectos periimplantarios experimentales en implantes recubiertos de hidroxiapatita en 4 monos rhesus; las modalidades de tratamiento comparadas fueron:
- Grupo experimental: se realizó, bajo un programa de control de placa con clorhexidina (CHX), el acceso quirúrgico al defecto, desbridamiento con curetas, sin alterar la superficie del implante, y, finalmente, detoxificación de la superficie con ácido cítrico y aire abrasivo. El defecto fue rellenado entonces con rhBMP-2 (0,43 mg/ml implante).
- Grupo control: el tratamiento del defecto fue el mismo, sin recibir rhBMP-2.
Los resultados del estudio mostraron que la evolución clínica de los implantes que recibían rhBMP-2 fue mejor que los del grupo control, de forma que de los primeros sólo se expuso uno mientras que del segundo grupo se expusieron seis. El aumento vertical de hueso fue de 2,6 ± 1,2 mm en el grupo test y de 0,8 ± 0,8 mm en el grupo control. Esto quiere decir que en los implantes que recibían rhBMP-2 se regeneraba un 70% del defecto original, presentando el nuevo hueso unas características histológicas normales. Finalmente, el porcentaje de NOI fue del 29% ± 10,5 en el grupo test y de 3,5% ± 2,5 en el grupo control.
Recientemente Wetzel y cols21, examinaron en 7 perros beagle el potencial de cicatrización y NOI de defectos periimplantarios adyacentes a distintas superficies de implantes ITI®: TPS, SLA (superficie tratada con chorro de arena de grano grueso y grabado ácido) y titanio pulido. Tras inducir la periimplantitis, se realizaron dos tratamientos: desbridamiento e irrigación de las lesiones y los implantes con clorhexidina y recubrimiento con membrana de PTFEe en unos implantes y sin membrana en otros. El tratamiento regenerativo produjo un relleno del 73% del defecto en los implantes de TPS, 83% en el grupo SLA y 62% en el grupo de superficie pulida. El tratamiento no regenerativo se tradujo en un relleno de sólo el 14% del defecto en los implantes de TPS, 15% en el grupo SLA y finalmente 31% en el grupo de superficie pulida. Por el contrario, los porcentajes de NOI no pasaron del 14% en ningún caso.
En un estudio muy reciente, Persson et al.22** investigaron la importancia del tipo de superficie del implante en la reosteointegración tras periimplantitis. Examinaron en cuatro perros beagle el potencial de reosteointegración tras inducir periimplantitis con pérdida de más del 50% de hueso en tres implantes ITI de superficie SLA y tres implantes ITI de superficie lisa.
Tras retirar las ligaduras a cada animal se le administró tabletas de amoxicilina y metronidazol por un período de 17 días. Al tercer día de la terapia antibiótica, se levantó colgajo, se eliminó el tejido de granulación, se limpió la superficie con suero salino y se sumergió los implantes. Seis meses después se obtuvieron biopsias.
El tratamiento dio como resultado un 76% de relleno de defecto en los implantes de superficie SLA y un 72% de relleno en los implantes de superficie lisa. El porcentaje de reosteointegración fue del 22% en los implantes de superficie lisa y del 84% en los implantes de superficie SLA.
Los autores señalan que las diferencias en el porcentaje de reosteointegración era significativas y consistentes. No se explican completamente el porqué de esas diferencias, atribuyéndolas a la capacidad osteofílica de la superficie SLA.
Tratamiento de la PI en el hombre
Hasta el momento actual no existen en la literatura estudios controlados sobre el tratamiento de la PI en el hombre, limitándose la documentación a la descripción, más o menos detallada, de casos clínicos.
Lehman y cols23** presentaron un caso clínico de un paciente de 50 años tratado con dos implantes ITI® para rehabilitar un extremo libre inferior. Cinco semanas después de la cirugía, la mucosa que cubría los implantes, aparecía inflamada, con supuración a la palpación y una profundidad de sondaje de 9 mm en vestibular; el implante no presentaba movilidad. El defecto residual fue tratado mediante antibioterapia con amoxicilina 750 mgr/12 horas/10 días y ornidazol 500 mgr/12 horas/10 días y abordaje del defecto, instrumentación mecánica e irrigación con CHX, para cubrir finalmente el defecto con una membrana de PTFEe. Cinco meses después se retiró la membrana, momento en el cual se verificaba el relleno del defecto óseo, quedando un mm de plasma de titanio en la zona vestibular expuesto. El análisis por substracción radiográfica digital demostró ganancia ósea radiográfica a 1, 2, 4, 5 y 6 meses de la colocación de la membrana. Igualmente hubo una mejoría significativa de los parámetros clínicos.
Herrero y Herrero24 presentaron dos casos de pérdida prematura de la OI en implantes con cubierta de HA (Integral-Omniloc®), siendo uno de ellos una periimplantitis aparecida en el cuarto mes tras la colocación de las fijaciones. Tras el desbridamiento a colgajo de la lesión, se eliminó la cubierta de HA expuesta con curetas metálicas y ultrasonidos, dejando visible la superficie de titanio. Seguidamente se procedió a la detoxificación de la superficie expuesta con doxiciclina durante 2-3 minutos y lavado. El defecto se rellenó con HA no reabsorbible y sangre del paciente, y se cubrió con una membrana de PTFEe. La reentrada a los seis meses mostró la resolución completa del defecto.
Hämmerle y cols25 presentaron dos casos tratados con éxito, en los que se combinaba terapia antiinfecciosa y terapia regenerativa. Cuatro años después de colocar las fijaciones (implantes ITI® de plasma de titanio), se presentaron sendas periimplantitis, con sangrado al sondaje, supuración, profundidad de sondaje de 4 a 9 mm y una disminución del nivel de inserción de 2 a 10 mm. El análisis radiográfico mostró una pérdida de hueso marginal de 3,6 a 7,1 mm. El tratamiento consistió en desbridamiento a colgajo de los defectos e irrigación con CHX y ROG mediante membranas de PTFEe. El análisis radiográfico al año de la retirada de membranas mostraba 1,5 a 3,6 mm de ganancia de hueso, lo que permitió el mantenimiento de los implantes.
Melloning y cols26 presentaron tres casos clínicos de tratamiento de lesiones periimplantarias alrededor de implantes ITI® huecos de plasma de titanio con tres modalidades de tratamiento diferentes:
- el primer caso fue un implante unitario con profundidad de sondaje de 10 mm, sin movilidad y con pérdida ósea de 9 mm de altura y 4-6 mm de anchura. Se trató mediante desbridamiento, detoxificación de superficie con tetraciclina, colocación de material de relleno (Interpore® 200 con pasta de tetraciclina) y cobertura con una membrana de PTFEe. La membrana se expuso a las nueve semanas, por lo que fue retirada. Al año, la profundidad de sondaje se redujo a 2 mm y se observó un relleno óseo radiográfico completo.
- el segundo caso fue un implante unitario inferior izquierdo, que presentaba profundidad de sondaje de 10 mm y pérdida ósea radiográfica con supuración y dolor leve. El tratamiento incluyó el desbridamiento, detoxificación con tetraciclina, y relleno del defecto con hueso liofilizado y tetraciclina. El material de relleno y el defecto se cubrieron con una membrana de PTFEe. Al año la profundidad de sondaje se redujo a 2 mm y se observó un relleno óseo de 6 mm.
- el último caso se centra en un implante inferior izquierdo con una barra para una sobredentadura. El implante mostraba una profundidad de sondaje de 12 mm, con presencia de supuración y pérdida ósea radiográfica, siendo un defecto circunferencial. El tratamiento se realizó mediante desbridamiento quirúrgico, detoxificación de superficie con tetraciclina y relleno con hueso liofilizado con tetraciclina; igualmente fue cubierto con una membrana PTFEe. La membrana se expuso a las seis semanas, por lo que fue retirada. Al cabo de un año la profundidad de sondaje se redujo en 7 mm y se observó relleno óseo radiográfico.
En un estudio sobre 31 pacientes no fumadores, Von Arx y cols27 valoraron la efectividad del tratamiento de periimplantitis alrededor de implantes ITI®, de plasma de titanio. El protocolo de tratamiento seguido fue antibioterapia sistémica (amoxicilina con ácido clavulánico durante una semana, comenzando el día antes de la cirugía), desbridamiento a colgajo de los defectos y descontaminación con CHX 0,5%, relleno del defecto óseo mediante injerto óseo autógeno y empleo de membranas barrera reabsorbibles (Guidor®). Seis meses después del tratamiento se evidenció la estabilidad clínica de los implantes tratados y el relleno radiográfico de los defectos.
Recientemente, Behneke y cols28* presentaron un estudio en el que proponen un tratamiento regenerativo sin membranas barrera de lesiones periimplantarias con profundidad de sondaje mayor de 5 mm y defectos óseos circunferenciales. Se analizaron un total de 25 implantes ITI® en 17 pacientes que presentaban periimplantitis. El tratamiento de estas lesiones consistió en desbridamiento a colgajo del tejido de granulación, pulido de la superficie del implante mediante aire abrasivo, seguido de la colocación de injertos óseos cortico-esponjosos obtenidos de la zona retromolar mandibular o del mentón y fijados con tornillos, o particulados, que se estabilizaron con un gel de fibrina alrededor del defecto. En dos de los 25 casos se obtuvieron resultados insatisfactorios. En el resto de casos se realizó reentrada quirúrgica para evaluar el resultado, lo que permitió comprobar un 90% de relleno del defecto (la profundidad media de los defectos se redujo de 6,9 mm a 0,7 mm). Un seguimiento posterior a tres años confirmó la estabilidad clínica de los implantes tratados.
Finalmente, Haas y cols29* han presentado un estudio clínico en el que analizaron la efectividad de un tratamiento alternativo de la PI, en 17 pacientes con un total de 24 implantes de plasma de titanio (IMZ®) afectados. Tras el desbridamiento a colgajo de los defectos, se realiza la descontaminación de la superficie empleando para ello azul de toluidina durante un minuto, seguido de lavado con solución salina e irradación con láser de 906 nm de longitud de onda durante un minuto por la superficie vestibular y un minuto por la superficie lingual. Tras la descontaminación, los defectos fueron rellenados con hueso autólogo y cubiertos con una membrana no reabsorbible de PTFEe, dejando sumergidos los implantes. En 21 de los 24 implantes se observó relleno limitado del defecto óseo (valor medio del 21,8% del defecto inicial). Los otros tres implantes aumentaron su pérdida ósea tras el tratamiento.
Discusión
La revisión de la literatura objeto de este artículo muestra que no se puede hablar de un protocolo establecido para el tratamiento de las PI. Sin embargo, si parece un hallazgo común la pobre eficacia de la terapia antiinfecciosa sin terapéutica regenerativa adicional (desbridamiento de las lesiones, detoxificación de la superficie del implante y empleo de antibioterapia sistémica y antisépticos locales)10**,12,13. Por el contrario, la combinación de un abordaje antiinfeccioso y regenerativo ha demostrado ser relativamente eficaz para obtener el relleno óseo de los defectos originados por la periimplantitis, si bien el relleno completo de los defectos es un hallazgo infrecuente14*,15,18-21,23**,28*,29*.
En relación al tejido óseo neoformado, múltiples estudios que incluyen histología en animales de experimentación, confirman que las características del tejido tras el uso de membranas de barrera es similar al del hueso vecino original14*,15,19-21. Sin embargo la NOI al implante no es un hallazgo habitual en los modelos animales estudiados. El estudio de Persson y cols22 ofrece el máximo porcentaje de NOI obtenido en los estudios publicados. Por otro lado numerosos estudios en donde se siguen protocolos terapeúticos mixtos (antiinfeccioso y regenerativo) fracasan a la hora de obtener nueva unión hueso-implante o la obtienen en porcentajes muy bajos16**,17,21. No obstante, hoy en día la NOI no puede contemplarse como un requisito imprescindible para mantener viable un implante tratado por PI. En estos casos, el relleno óseo del defecto, con o sin NOI, junto con el enfoque antiinfeccioso permite crear un tejido perimplantario sano y estable en el tiempo.
Caso clínico
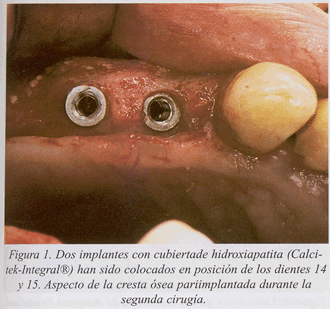
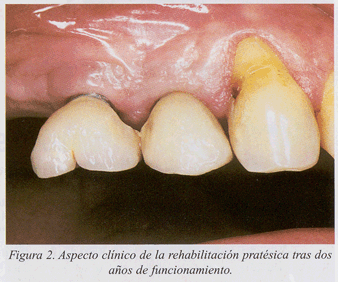
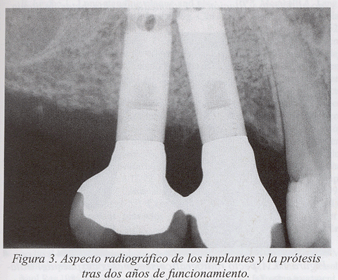
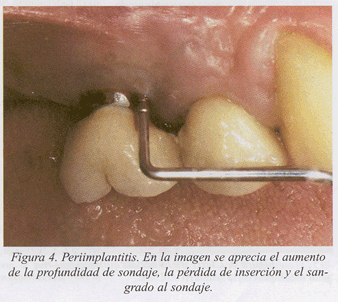
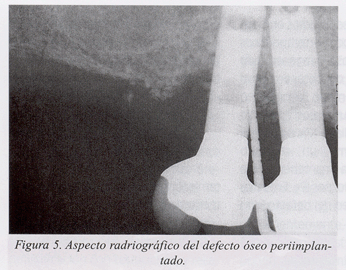
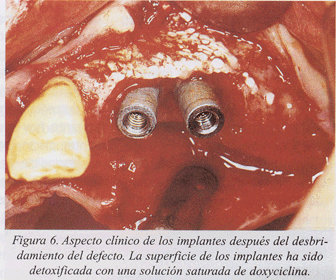
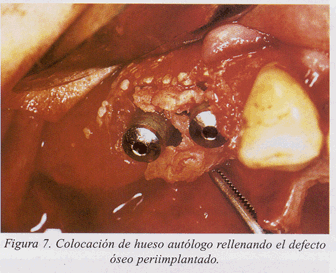
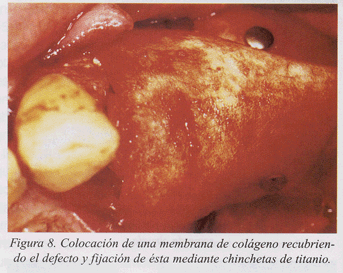
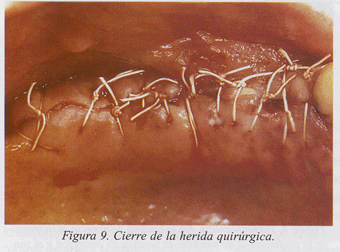
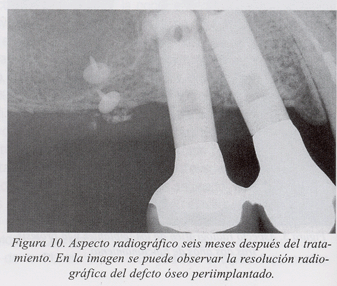
Presentamos un caso clínico de tratamiento de la periimplantitis documentado paso a paso (fig. 1-10).
Conclusiones
Dentro de las limitaciones que un artículo de revisión tiene, por su propia naturaleza, se pueden exponer las siguientes en relación con el tratamiento de la PI:
1. No existe acuerdo ni evidencia científica de la existencia de protocolos universales válidos para el tratamiento de esta patología.
2. Como proceso infeccioso, parece que la antibioterapia sistémica debe estar presente durante la fase previa y/o quirúrgica del tratamiento.
3. La terapia regenerativa es la única que ofrece expectativas de resolución de los defectos óseos periimplantarios, aunque los resultados no pueden considerarse predecibles.
4. La evidencia histológica apoya el uso de membranas barrera frente al relleno o injerto óseo solo. En cuanto al tipo de membrana de barrera a emplear, la mayoría de los estudios que hemos revisado utilizan membranas no reabsorbibles de PTFEe. Esto quizás se explica por el hecho de que hasta muy recientemente la cinética de degradación de las membranas reabsorbibles era demasiado rápida, lo que las hacía útiles en regeneración periodontal, pero no en regeneración ósea. Sin embargo, hoy en día se disponen en el mercado de membranas reabsorbibles de reabsorción lenta, cuyo empleo podría permitir minimizar los inconvenientes de las membranas reabsorbibles en estos procedimientos.
5. La NOI no parece un fenómeno predecible mediante las modalidades de tratamiento conocidas hasta la fecha.
Bibliografía recomendada
Para profundizar en la lectura de este tema, el/los autor/es considera/an interesantes los artículos que aparecen señalados del siguiente modo: *de interés **de especial interés.
1. Berglund H, Lindhe J, Ericsson I, Liljenberg B. Soft tissue reaction to de novo plaque formation on implants and teeth. An experimental study in the dog. Clin Oral Impl Res 1992;3:1-8. [ Links ]
2. Lindhe J, Berglund H, Ericsson I, Liljenberg B, Marinello C. Experimental breakdown of peri-implant and periodontal tissues. A study in the beagle dog. Clin Oral Impl Res 1992;3:9-16. [ Links ]
3. Ericsson I, Berglundh T, Marinello C, Liljenberg B, Lindhe J. Long-standing plaque and gingivitis al implants and teeth in the dog. Clin Oral Impl Res 1992;3:99-103. [ Links ]
4. Lang NP, Brägger U, Walther D, Beamer B, Kormman KS. Ligature-induced peri-implant infection in cinomolgus monkeys. Clinical and radiographic findings. Clin Oral Impl Res 1993;4:2-11. [ Links ]
5. Schou S, Holmstrup P, Stoltze K, Hjorting-Hansen, Kornman KS. Ligature-induced marginal inflammation around osseointegrated implants and ankylosed teeth. Clinical and radiographic observations in cynomolgus monkeys (Macaca fascicularis). Clinical Oral Implants Research 1993;4:12-22. [ Links ]
6. Pontoriero R, Tonetti MP, Carnevale G, Mombelli A, Nyman SR, Lang NP. Experimentally induced peri-implant mucositis. Clin Oral Impl Res 1994;5:254-9. [ Links ]
7. Isidor F. Loss of osseointegration caused by occlusal load of oral implants. A clinical and radiographic study in monkeys. Clin Oral Impl Res 1996;7:143-52. [ Links ]
8. Isidor F. Histologic evaluation of peri-implant bone at implants subjected to occlusal overload or plaque accumulation. Clin Oral Impl Res 1997; 8:1-9. [ Links ]
9. Ogiso M, Tabata T, Tsun Kuo P, Borgese D. A histologic comparison of the functional loading capacity of in occluded dense apatite implant and the natural dentition. J Prosthet Dent 1994;71:581-8. [ Links ]
10**. Mombelli A, Lang NP. Antimicrobial treatment of peri-implant infections. Clin Oral Impl Res 1992;3:162-8. [ Links ]
Referencia de la literatura que muestra la relativa eficacia de un abordaje antiinfeccioso puro (sin empleo de métodos regenerativos) en el tratamiento de lesiones periimplantarias. Posiblemente el mantenimiento de los defectos óseos alrededor de los implantes facilite la recolonización bacteriana de zonas previamente descontaminadas, por la perpetuación de nichos ecológicos adecuados para los microorganismos patógenos.
11. Marinello CP, Berglundh T, Ericsson I, Klinge B, Glantz PO, Lindhe JJ. Resolution of ligature-induced peri-impalntitis lesions in the dog. Clin Periodontol 1995;22:475-9. [ Links ]
12. Ericsson I, Persson LG, Berglundh T, Edlund T, Lindhe J. The effect of antimicrobial therapy on perimplantitis lesions. Clin Oral Impl Res 1996;7:320-8. [ Links ]
13. Persson LG, Araújo MG, Berglundh T, Gröndhal K, Lindhe J. Resolution of peri-implantitis following treatment. An experimental study in the dog. Clin Oral Impl Res 1999;10:195-203. [ Links ]
14*. Jovanovic SA, Kenney B, Carranza F, Donath K. The regenerative potential of plaque-induced peri-implant bone defects treated by a sumerged membrane technique: an experimental study. Int J Oral Maxillofac Implants 1993;8:13-8. [ Links ]
Una de las primeras referencias de la literatura que muestra, a través de un modelo experimental en animales, la eficacia del tratamiento antiinfeccioso y regenerativo en el abordaje de lesiones perimplantarias.
15. Singh G, O'neal RB, Brennam WA, Strong SL, Horner JA, van Dike TE. Surgical treatment of induced periimplantitis in the micro pig: clinical and histological analysis. J Periodontol 1993;3:984-9. [ Links ]
16**. Grunder U, Hüzeler MB, Schüpbach P, Strub JR. Treatment of ligature-induced peri-implantitis using guided tissue regeneration: A clinical and histological study in the beagle dog. Int J Oral Maxillofac Implants. 1993;3: 282-93. [ Links ]
Referencia de la literatura que aporta los datos más decepcionantes con respecto al abordaje terapéutico de referencia en el tratamiento de lesiones periimplantarias en un modelo animal. Los autores especulan a cerca de las causas de tan deplorables resultados.
17. Persson LG, Ericsson I, Berglundh T, Lindhe J. GBR in the treatment of perimplantitis. Clin Oral Impl Res 1996;7:366-72. [ Links ]
18. Hüzeler MB, Quiñones CR, Morrison EC, Caffesse RG. Treatment of peri-implantitis using gbr and bone grafts, alone or in combination, in beagle dogs. part 1: clinical findings and histologic observations. Int J Oral Maxillofac Implants 1995;10:474-84. [ Links ]
19. Hüzeler MB, Quiñones CR, Schüpback P, Morrison EC, Caffesse RG. Treatment of peri-implantitis using gbr and bone grafts, alone or in combination, in beagle dogs. part 2: histologic findings. Int J Oral Maxillofac Implants 1997;12:168-75. [ Links ]
20*. Hanisch O, Tatakis DM, Boskovic MM, Roher MD, Wikesjö UME. Bone formation and reosseointegración in peri-implantitis defects following surgical implantation of rhBMP-2. Int J Oral Maxillofac Implants 1997;12:604-10. [ Links ]
Primera referencia de la literatura que abre las puertas a nuevas alternativas en el tratamiento de la periimplantitis desde el campo de la ingeniería bioquímica (empleo de proteínas morfogenéticas óseas)
21. Wetzel AC, Vlasis J, Caffesse RG, Hammerle CHF, Lang NP. Attempts to obtain re-osseointegration following experimental peri-mplantitis in dogs. Clin Oral Impl Res 1999;10:111-9. [ Links ]
22.** Persson L, Berglundh T, Sennerby L, Lindhe J. Re-osseointegration after treatment of periimplantitis at different implant surface. An experimental study in the dog. Clinical Oral Implants Research 2001;12:595-604. [ Links ]
Este estudio marca el listón de lo máximo que se ha logrado en el tratamiento de la periimplantitis con respecto al porcentaje de reosteointegración del hueso neoformado a la superficie tratada del implante.
23**. Lehman B, Brägger U, Hämmerle CH, Fourmousis I, Lang NP. Treatment of a early implant failure according to the principles of GTR. Clin Oral Impl Res 1992;3:42-8. [ Links ]
Este artículo hace referencia a uno de los primeros casos clínicos presentados en la literatura en los que se trata con acierto lesiones periimplantarias en humanos, empleando protocolos terapéuticos hoy por hoy de referencia.
24. Herrero F, Herrero M. Fracaso precoz de implantes con cubierta de hidroxiapatita: tratamiento mediante RTG. Periodoncia 1994;1:91-9. [ Links ]
25. Hämmerle CH, Fourmousis I, Winkler JR, Weigel C, Brägger U, Lang NP. Succesful bone fill in late peri-implant defects using guide tissue regeneration. A short communication. J Periodontol 1995;66:303-8. [ Links ]
26. Melloning JT, Griffiths G, Mathiys E, Spitznagel J. Treatment of the failing implant: case report. Int J Periodont Rest Dent 1995;15:385-95. [ Links ]
27. Von Arx T, Kurt B, Hardt N. Treatment of severe peri-implant bone loss using autogenous bone and resorbable membrane. Case report and literature review. Clin Oral Impl Res. 1997;8:517-26. [ Links ]
28*. Behneke A, Behneke N, Hoedt B. Treatment of peri-implantitis defects with autogenous bone grafts: six-month to 3-year results of a prospective study in 17 patients. Int J Oral Maxillofac Implants 2000;15:125-38. [ Links ]
Artículo de secuencia de casos clínicos en el que se presenta un abordaje regenerativo de la periimplantitis sin empleo de materiales barrera. Se emplea únicamente hueso autógeno como material de relleno de los defectos periimplantarios descontaminados.
29*. Haas R, Baron M, Dörtbudak O, Watzek G. Lethal photosensitization, autogenous bone and e-PTFE for the treatment of peri-implantitis: Preliminary results. Int J Oral Maxillofac Implants 2000;15:374-82. [ Links ]
Presentación de un nuevo abordaje físico (láser) para la descontaminación de la superficie del implante, con resultados no del todo satisfactorios.