INTRODUCCIÓN
El cáncer colorrectal es el tipo de cáncer más frecuente en el mundo teniendo en cuenta ambos sexos, con una incidencia anual de casi 1,4 millones de nuevos casos en todo el mundo1. Se estima que en el momento del diagnóstico un 30% de los pacientes presentan metástasis, y más del 50% acabarán desarrollándolas2. El tratamiento habitual del cáncer de colon metastático (CCRm) comprende la cirugía, la quimioterapia basada en dobletes de oxaliplatino o irinotecán y fluoripirimidinas, con o sin agentes biológicos anti-VEGF (bevacizumab, aflibercept o ramucirumab) y anti-EGFR (cetuximab y panitumumab) en caso de pacientes sin la mutación del oncogén RAS (KRAS o NRAS)3. El pronóstico de los pacientes diagnosticados de CCRm ha mejorado progresivamente en los últimos 25 años, pasando de una supervivencia media de menos de un año a 30 meses4.
Regorafenib y trifluridina/tipiracilo (TAS-102) se comercializaron en Europa en agosto de 2013 y enero de 2017, respectivamente, para el tratamiento de CCRm tras el fracaso a las principales líneas terapéuticas. En España, la Agencia Española de Medicamentos y Productos Sanitarios realizó informes de posicionamiento terapéutico de los dos fármacos, concluyendo que ambos suponían un efecto muy modesto en la supervivencia global y ninguna mejoría en la calidad de vida en el caso de regorafenib, y sin datos en el caso de TAS-102; siendo los pacientes más jóvenes y con un mejor estado funcional (escala Eastern Cooperative Oncology Group (ECOG) de 0-1) los que podrían obtener mayor beneficio5,6. En base a las recomendaciones del IPT se elaboró un protocolo de uso de estos fármacos por la Comisión de Farmacia y Terapéutica, en la que se definió que únicamente aquellos pacientes con un buen estado basal eran candidatos a iniciar tratamiento con los mismos.
Regorafenib actúa bloqueando algunas de las proteinkinasas responsables de la angiogénesis tumoral (VEGFR1, -2, -3, TIE2), oncogénesis (KIT, RET, RAF-1, BRAF, BRAF-V600E), metástasis (VEGFR3, PDGFR, FGFR) e inmunidad celular (CSF1R), con lo que consigue un bloqueo de la proliferación celular tumoral7. En el estudio CORRECT (fase III) se comparó la eficacia de regorafenib en pacientes con CCRm frente a placebo, obteniéndose resultados favorables para el fármaco. La mediana de la supervivencia libre de progresión (SLP) fue de 1,9 frente a 1,7 meses (HR 0,494 (IC: 0,419-0,582)) y la de la supervivencia global (SG) de 6,4 meses frente a 5,0 meses (hazard ratio (HR) 0,774 (IC: 0,636-0,942))8. Regorafenib se administra por vía oral a una dosis inicial de 160 mg (4 comprimidos de 40 mg) los días 1 al 21 de cada ciclo de 28 días7.
TAS-102 está compuesto por trifluridina (un análogo de timidina) y por tipiracilo hidrocloruro (un inhibidor de la timidina fosforilasa). Trifluridina interfiere en la replicación del DNA de las células tumorales, bloqueando su proliferación. Tipiracilo hidrocloruro inhibe la TPasa, una enzima que degrada rápidamente trifluridina y que es también responsable de su efecto de primer paso9. La eficacia y seguridad de TAS-102 fue testada en el estudio fase III (RECOURSE), comparándose frente a placebo. Los resultados en la SLP fueron de 2,0 vs. 1,7 meses (HR 0,48 (IC 0,41-0,57)) y en la SG de 7,1 meses vs. 5,3 meses (HR 0,68 (IC 0,58-0,81))10. TAS-102 se administra por vía oral a una dosis inicial de 35 mg/m2 dos veces al día los días 1 al 5 y 8 al 12 de cada ciclo de 28 días9.
Estos estudios sugieren que tanto regorafenib como TAS-102 son válidos para el tratamiento del CCRm una vez que se produce la progresión a las terapias estándar8,10. Sin embargo, debido a la falta de ensayos clínicos aleatorizados que comparen ambos, resulta difícil posicionar uno frente a otro en los pacientes con CCRm que han fracasado a otras líneas de quimioterapia previas.
El objetivo de este estudio es analizar y comparar la efectividad y la seguridad de regorafenib y TAS-102 en pacientes con CCRm tras progresión a la quimioterapia estándar.
MÉTODOS
Selección de pacientes y variables
Se realizó un estudio retrospectivo observacional en el que fueron incluidos todos los pacientes con CCRm refractario que iniciaron tratamiento con regorafenib o TAS-102 entre febrero de 2013 y mayo de 2017.
Los pacientes se identificaron mediante el programa de dispensación a pacientes externos FarHos®. Se recogieron variables demográficas (sexo, edad al inicio del tratamiento), diagnósticas (mutación gen RAS, metástasis en el momento del diagnóstico) y terapéuticas (número de líneas previas) con el programa de historia clínica electrónica HP-HCIS®.
Para evaluar la toxicidad, se recogieron los efectos adversos (EAs) atribuibles al fármaco correspondiente (clasificados según los Common Terminology Criteria for Adverse Effects v4.0 del National Cancer Institute)11 y las reducciones de dosis.
Para evaluar la efectividad se calcularon la SLP, definida como tiempo transcurrido entre la fecha de inicio de tratamiento y la fecha de progresión, y la SG, definida como tiempo transcurrido desde el inicio del tratamiento hasta la muerte. Además se determinó la mediana de seguimiento de los pacientes.
Análisis estadístico
Las variables cualitativas fueron comparadas con el test de chi-cuadrado y las cuantitativas con el test de t-student.
La SLP y la SG se calcularon con el método de Kaplan-Meier. Las diferencias en las supervivencias entre los dos medicamentos fueron evaluadas mediante la determinación del HR con un modelo de riesgo proporcional de Cox.
El análisis estadístico se llevó a cabo utilizando el programa Stata® 14.
RESULTADOS
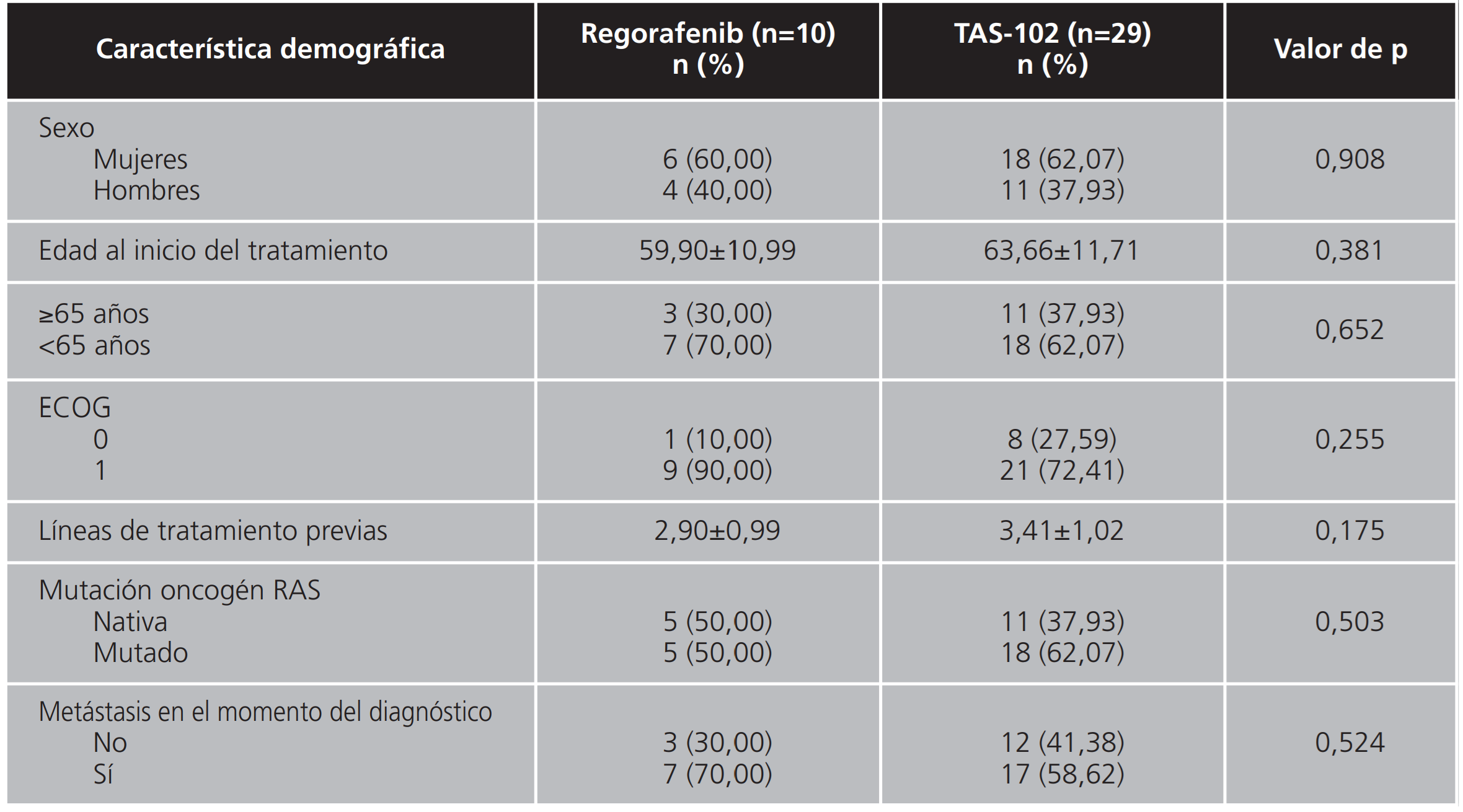
Se incluyeron un total de 39 pacientes, de los cuales el 25,64% (n=10) comenzaron tratamiento con regorafenib y el 74,36% (n=29) con TAS-102. El 61,54% (n=24) fueron mujeres, con una edad media al inicio del tratamiento de 62,69±11,51 años. El 76,92% (n=30) de los pacientes tenía un ECOG de 1 y habían recibido una media de 3,28±1,02 líneas de tratamiento previas. El 58,97% (n=23) tenía además mutación del oncogén RAS y el 61,53% (n=24) presentaba metástasis en el momento del diagnóstico de la enfermedad. No hubo diferencias estadísticamente significativas entre los dos grupos en cuanto a las variables anteriormente descritas (Tabla 1). La mediana de seguimiento de los pacientes fue de 13 meses.
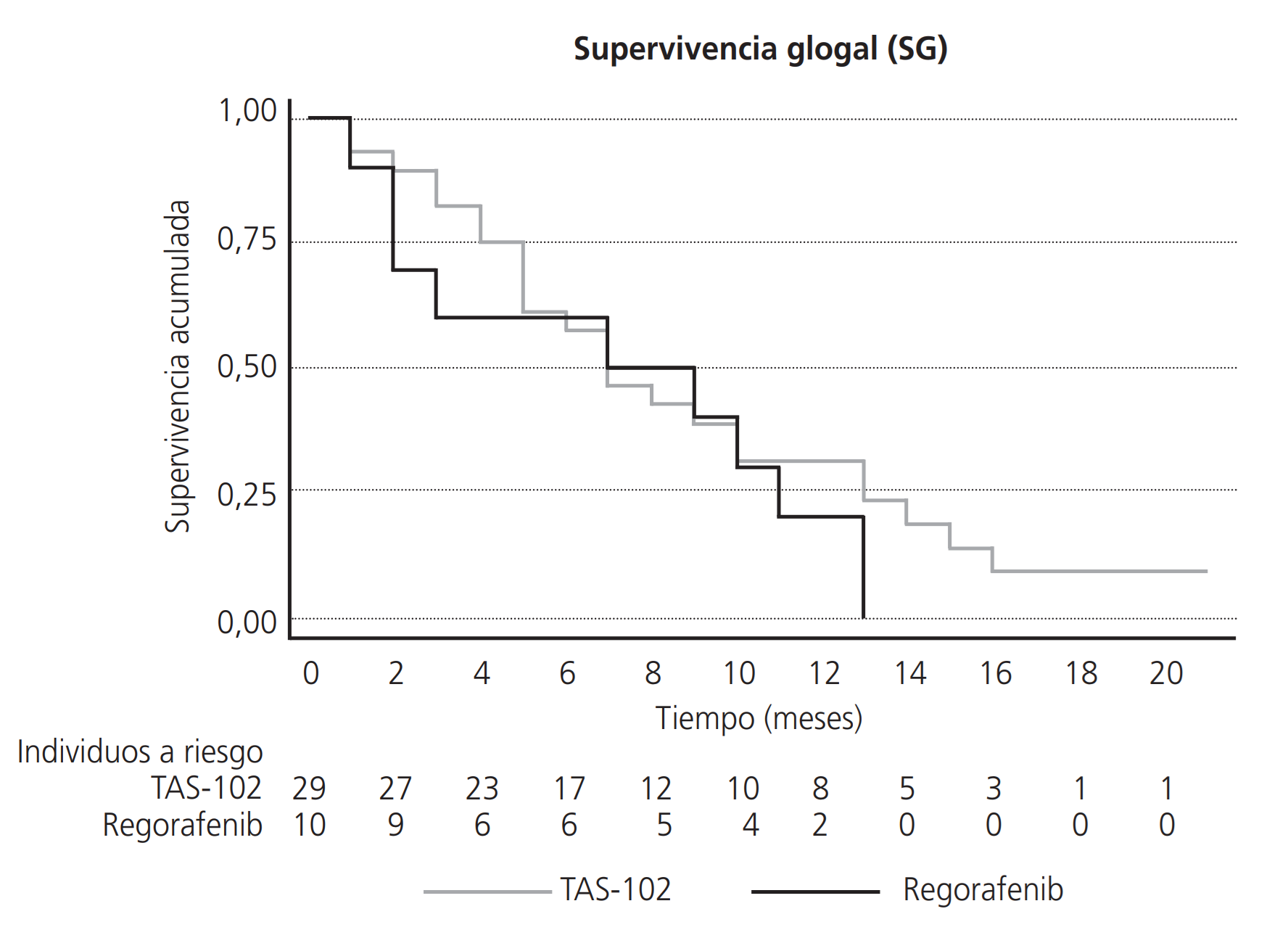
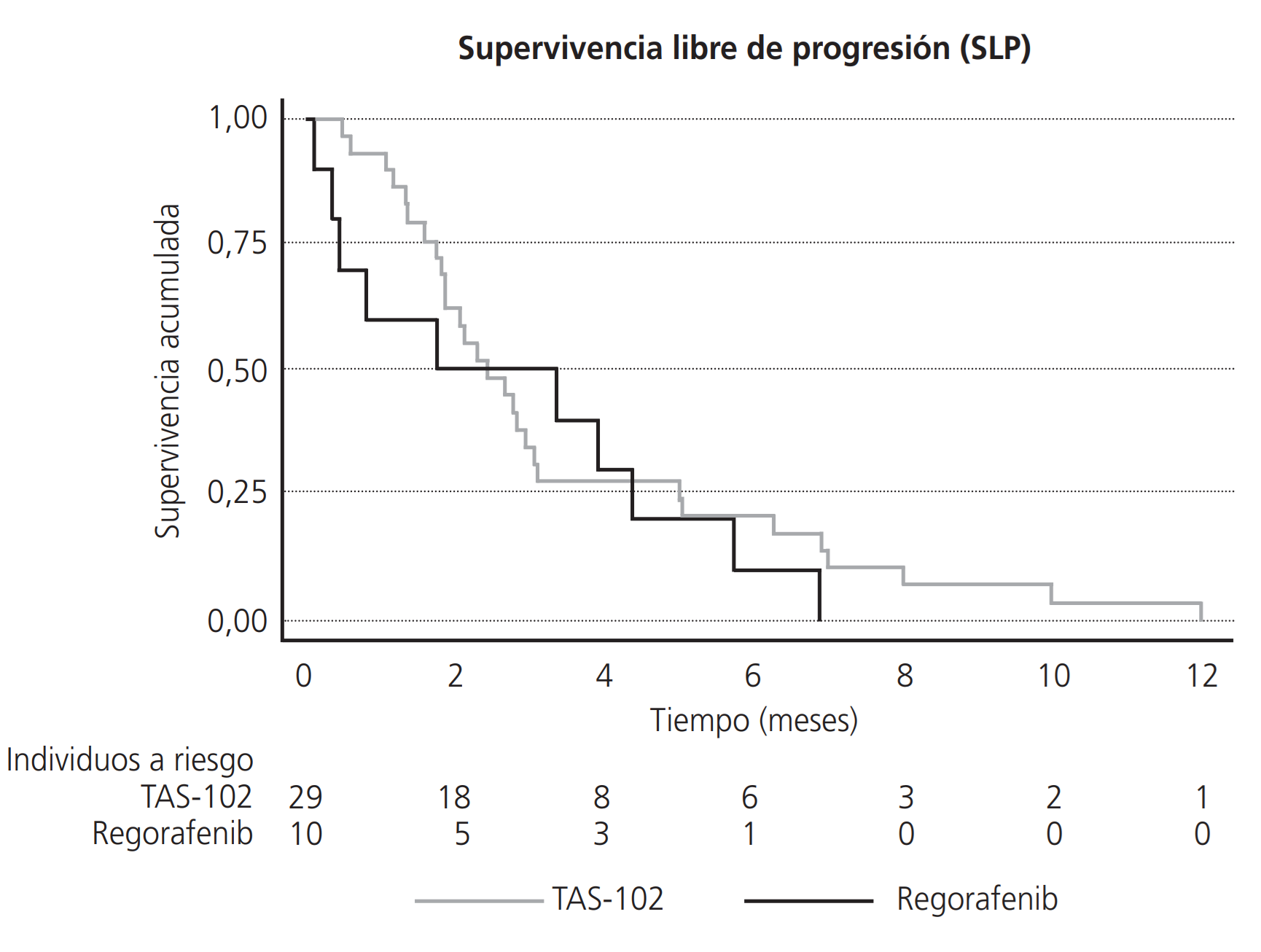
La SLP en el grupo tratado con regorafenib fue de 1,77 meses (IC 0,13-4,36) y la SG de 7,00 meses (1,00-11,00), mientras que en el tratado con TAS-102 fueron, respectivamente, de 2,46 (IC 1,84-3,08) y de 7,00 (5,00-10,00) meses. No existieron diferencias estadísticamente significativas entre ambos grupos de pacientes en cuanto a la SLP (HR=1,35 (0,64-2,85), p=0,428) y la SG (HR 1,45 (0,68-3,09), p=0,335) (Figuras 1 y 2).
La media de EAs asociados al tratamiento por paciente fue de 3,70±2,35 en los pacientes tratados con regorafenib y de 2,55±2,16 en los tratados con TAS-102. La mayoría de ellos fueron de grado (G) 1 ó 2. Los EAs G3 o superior con regorafenib fueron el 5,40% (n=2) del total frente al 16,22% (n=12) con TAS-102. La totalidad de EAs presentados se recogen en la tabla 2.
Fue necesario disminuir la dosis de regorafenib en el 30,00% (n=3) de los pacientes debido a astenia G2 (n=1) y G3 (n=1) y a una infección del tracto urinario (n=1). Las reducciones de dosis con TAS-102 se dieron en el 27,58% (n=8) de los individuos por causa de neutropenia G2 (n=1) y G3 (n=4) afebriles, neutropenia G4 febril (n=2) e hiperbilirrubinemia G2 (n=1). El 30,00% de los pacientes tratados con regorafenib (n=3) tuvieron que abandonar el tratamiento: uno antes de finalizar el primer ciclo debido a empeoramiento de la enfermedad y dos por toxicidad (edemas y hepatotoxicidad, respectivamente).
DISCUSIÓN
En nuestro estudio tanto los pacientes tratados con regorafenib como los tratados con TAS-102 obtuvieron una SG y una SLP similar, con un perfil de toxicidad diferente.
Los ensayos clínicos que llevaron a la comercialización de ambos fármacos muestran unas SLP y SG similares a las obtenidas en nuestro estudio8,10. En el ensayo CONCUR, en el que se comparó regorafenib frente a placebo en población asiática, la mediana de la SLP fue de 3,2 meses y la de la SG de 8,8. Este aumento en las SLP y SG respecto al ensayo CORRECT podría deberse a que una menor proporción de los pacientes seleccionados para el ensayo CONCUR había recibido previamente tratamiento con fármacos biológicos anti-VEGF o anti-EFGR (59,80%), frente al 100% de pacientes del CORRECT, que había recibido al menos uno de los dos12. Abrahao et al. llevaron a cabo una revisión sistemática en la que se compararon indirectamente los resultados en eficacia de los ensayos clínicos de regorafenib y TAS-102. En él no se encuentran diferencias estadísticamente significativas entre la SLP (HR=0,85 (0,4-1,81), p=0,67) y la SG (HR=0,96 (0,57-1,66), p=0,91) de los pacientes tratados con uno y otro fármaco13.
Recientemente se han publicado algunos estudios retrospectivos en los que se compara la efectividad y seguridad de estos dos fármacos en la práctica clínica real. En todos ellos se obtuvieron datos de efectividad similares a los obtenidos en nuestro estudio. En la comparación llevada a cabo por Moriwaki et al. en 550 pacientes, la SLP fue de 2 meses en los dos grupos, la SG con regorafenib fue de 7,9 meses y con TAS-102 de 7,414. En el estudio comparativo de 37 pacientes de Sueda et al., las SLP y SG en el grupo de regorafenib fueron de 3 y 5,8 meses, respectivamente, y en el de TAS-102 de 2,1 y 6,3 meses15. En el estudio de Masuishi et al., en el que se incluyeron 200 pacientes, se obtuvo una SLP de 2,1 meses con ambos fármacos y unas SG de 6,7 meses con regorafenib y de 6,5 meses con TAS-10216. Unseld et al. obtuvieron unas SLP de 3,1 meses en los pacientes tratados con regorafenib y de 2,8 en los tratados con TAS-10217. Tanaka et al. obtuvieron unas SG de 9,1 meses en el grupo que recibió regorafenib y de 9,3 meses en el de TAS-10218. En ninguno de estos estudios las diferencias entre ambos grupos fueron estadísticamente significativas14,15,16,17 18.
En nuestro estudio observamos un mayor número de EAs por paciente con regorafenib (3,70 vs. 2,55), al igual que se recoge en la bibliografía existente13,18. La tolerancia fue peor en el caso de este medicamento ya que, aunque ambos fármacos presentaron tasas de reducción de dosis similares, las interrupciones de tratamiento fueron superiores en el brazo de regorafenib.
El perfil de EAs observado con los dos medicamentos fue acorde a lo descrito en la literatura8,10,12. Con regorafenib se observó una mayor incidencia de toxicidad gastrointestinal, cutánea y muscular, mientras que el tipo de toxicidad más característica de TAS-102 fue la hematológica.14,15,16,18
En cuanto al grado de los EAs, se observa variabilidad en los estudios publicados. Tanto Abrahao, Sueda y Moriwaki recogen más EAs G3 o superior con regorafenib que con TAS-10213,14,15. En el estudio de Tanaka, la incidencia de EAs G3 o superior fue similar en ambos grupos (65% con regorafenib y 63% con TAS-102)18. En cambio, Masuishi muestra una incidencia de EAs G3 y G4 mayor con TAS-10216. En nuestra población, recogimos una mayor incidencia de EAs G3 o superior con TAS-102, consistiendo la mayoría en EAs hematológicos. Estos efectos adversos fueron manejables con reducciones de dosis y no causaron interrupciones del tratamiento.
En los estudios previos se observan más reducciones de dosis para controlar la toxicidad en los pacientes tratados con regorafenib que en los tratados con TAS-102. En el estudio de Masuishi, el 54% de pacientes de regorafenib sufren una reducción de dosis frente al 20% de los tratados con TAS-10216. Los resultados fueron similares en el trabajo de Sueda: a un 65,2% de los tratados con regorafenib se les disminuye la dosis vs. al 14,3% de los tratados con TAS-10215. En nuestro estudio observamos tasas de reducción de dosis similares en los dos grupos (30,00% en regorafenib vs. 27,58% en TAS-102). Esto se debió a que se disminuyó la dosis en seis pacientes tratados con TAS-102 con toxicidades G2 y neutropenia G3 afebril a pesar de que las recomendaciones de ficha técnica indican sólo necesidad de reducción de dosis en aquellos pacientes con toxicidad no hematológica G3, neutropenia febril o neutropenia G49.
Al igual que en nuestro estudio, en la bibliografía existente se observan más interrupciones de tratamiento debidas a toxicidad en el grupo tratado con regorafenib que en el tratado con TAS-14,15,16,18.
Las principales limitaciones de nuestro estudio fueron su carácter retrospectivo y el bajo número de pacientes incluidos. Sin embargo, hemos considerado necesaria su realización debido a la escasez de estudios comparativos entre ambos fármacos, especialmente en población europea.
Aunque existen algunos proyectos en los que se están evaluando distintos marcadores que podrían estar disponibles para la práctica clínica18,19, en la actualidad no existen marcadores biológicos que pronostiquen la eficacia de estos fármacos; por ello la selección del tratamiento debe basarse en el juicio clínico4, teniendo en cuenta la situación basal del paciente y el perfil de toxicidad del fármaco.
En nuestro estudio, los resultados de efectividad de regorafenib y TAS-102 han sido modestos y similares entre sí, no encontrándose diferencias estadísticamente significativas entre los dos grupos de tratamiento. Por ello, los distintos perfiles de toxicidad de los fármacos son los que deben tenerse en cuenta a la hora de seleccionar un tratamiento u otro para un paciente concreto.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.