INTRODUCCIÓN
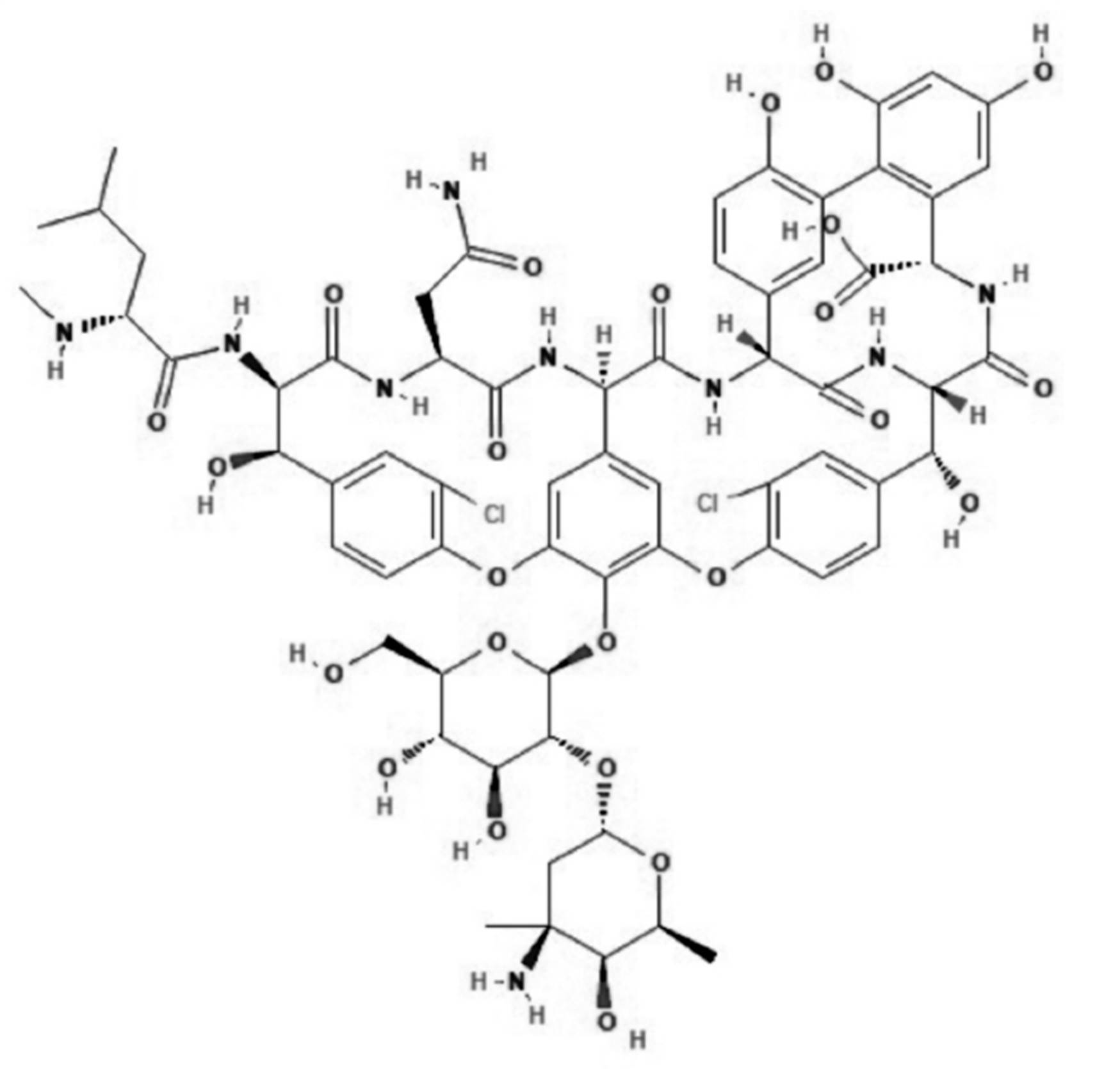
La vancomicina es un antibiótico glicopéptido que actúa inhibiendo la síntesis del peptidoglicano de la pared celular (Figura 1). Es activo frente a la mayoría de las bacterias gram positivas incluyendo Staphylococcus aureus y epidermidis meticilino resistentes, y es uno de los antibióticos de elección para el tratamiento empírico o confirmado de numerosas infecciones nosocomiales. La acción antibacteriana de vancomicina es dependiente del tiempo que su concentración se mantenga por encima de la concentración inhibitoria mínima (CIM)1.
Por su elevada hidrofilia (log -3.1)2 y su alto peso molecular (1.449,2 g/mol)3, la biodisponibilidad oral es despreciable2, por lo que el tratamiento de infecciones que requieren una acción sistémica requiere la administración por una vía parenteral (endovenosa); quedando la administración oral circunscripta al tratamiento de infecciones intestinales, donde la vancomicina ejerce un efecto local en el lumen intestinal1,2,3,4,5.
El volumen de distribución (Vd) de vancomicina es aproximadamente de 0,4-1,0 L/kg. La vancomicina difunde muy poco al sistema nervioso central a menos que las meninges estén inflamadas. Se une en un 50% a las proteínas de plasma (albúmina). En los pacientes con infecciones graves como en el caso de sepsis severa o shock séptico, esta unión es menor. En los pacientes con la función renal normal, la semivida de eliminación de vancomicina en plasma es de unas 6 horas (4-11 h). Esta semivida aumenta en los ancianos y en los pacientes con insuficiencia renal. Se excreta por filtración glomerular, recuperándose en la orina de 24 horas el 75 al 80% de la dosis administrada y una pequeña cantidad en las heces1,2,3,4.
Es bien conocido que los pacientes críticos poseen características fisiológicas que modifican el devenir del fármaco en el organismo, lo que puede acarrear dificultades para lograr niveles plasmáticos efectivos y seguros. En este contexto, se recomienda la monitorización de los niveles plasmáticos de vancomicina para (i) disminuir el riesgo de nefrotoxicidad vinculado a concentraciones plasmáticas elevadas, sobre todo en presencia de otros antibióticos nefrotóxicos, y para (ii) disminuir el riesgo de resistencia. De hecho, la aparición de enterococos resistentes a la vancomicina, y, más recientemente, Staphylococcus aureus resistente a la vancomicina, es de particular preocupación ya que los niveles subterapéuticos contribuyen al desarrollo de resistencia y comprometen el éxito del tratamiento. Para ello se recomiendan concentraciones valle (Cv) de 15 a 20 mg/L. Dichas concentraciones séricas deben alcanzar un área bajo la curva de concentración-tiempo durante un período de 24 horas dividido por la concentración inhibitoria mínima de las bacterias sospechosas (relación ABC24/CIM) de ≥400 (suponiendo una CIM ≤1 mg/L)1,4,5,6,7,8,9,10,11,12,13,14,15,16,17.
En pacientes con sepsis severa o shock séptico, estas concentraciones objetivo son más difíciles de lograr debido a los cambios repentinos que experimentan (aumento de la permeabilidad capilar, formación de edema, vasodilatación e hipotensión)6,9,10,12,15,18 y a las medidas tomadas para revertir esta situación. Estos factores pueden conducir a Cv de vancomicina bajas y a la subdosificación, lo que lleva a una muerte bacteriana inadecuada y al posible fracaso del tratamiento. Además, una dosificación insuficiente puede facilitar el desarrollo de resistencia. Como la vancomicina se elimina por vía renal y se distribuye ampliamente por todo el cuerpo, su farmacocinética puede verse alterada por las alteraciones fisiopatológicas inherentes a la sepsis. Por lo tanto, regímenes de dosificación convencionales de vancomicina de 500 mg cada 6 h o 1 g cada 12 tienen poca evidencia que respalde su eficacia en pacientes críticos y se sugiere que es poco probable que las pautas de dosificación estándar logren el índice farmacodinámico requerido de exposición a vancomicina necesario para una actividad óptima. Debido a esto es que en un consenso de la American Society of Health System Pharmacists, the Infectious Diseases Society of America, and the Society of Infectious Disease Pharmacists (ASHP/IDSA/SDIP) se recomendó dosis más agresivas para lograr el objetivo6. En pacientes sépticos, se incrementa el Vd y el aclaramiento renal del fármaco y, por otro lado, si no se logra erradicar la infección se produce un fallo multiorgánico que conlleva una disminución de la eliminación del antibiótico. Ya que la línea que divide ambas situaciones es muy estrecha, será imprescindible realizar un ajuste de las dosis basado en la monitorización de antimicrobianos, principalmente aquellos de carácter hidrofílico o levemente lipofílico como es la vancomicina.
El hospital es de gestión pública provincial de nivel III de atención19, es un centro de referencia de atención a pacientes adultos en cirugías cardiacas, trasplantes y atención a quemados de toda la región. Cuenta aproximadamente con 175 camas distribuidas en 14 servicios de diferentes especialidades médicas.
Posee las siguientes unidades de atención a pacientes críticos: Unidad de Cuidados Coronarios (U.C.O), con 11 unidades de atención, Unidad de Terapia Intensiva (U.T.I), con 13 unidades de atención, Unidad de Terapia Intensiva de Quemados (U.T.I.Q), con 7 unidades de atención, Unidad de Cuidados Intermedios (U.C.I), con 12 unidades de atención.
Pese al uso frecuente de vancomicina y a las recomendaciones internacionales de monitorización de sus niveles en sangre1,5,11, esta práctica aún no está implementada en el Hospital y las decisiones de dosificación se toman de manera empírica, en base a parámetros como peso y altura, sin consideración de las modificaciones fisiológicas que podrían ocurrir en los pacientes críticos. En consecuencia, se desconoce si las pautas de dosificación de vancomicina de la institución llevan a concentraciones plasmáticas efectivas y seguras.
En este contexto, los objetivos de este trabajo fueron:
• Describir el porcentaje de pacientes críticos que poseen Cv de vancomicina dentro del rango terapéutico recomendado por literatura y si esas concentraciones logran alcanzar un ABC/CIM ≥400.
• Intervenir desde el Servicio de Farmacia en el manejo de la terapia con vancomicina mediante la provisión de informes farmacoterapéuticos.
• Determinar la necesidad de instaurar la monitorización de vancomicina como servicio profesional en el hospital.
MATERIALES Y MÉTODOS
Se realizó un estudio piloto, prospectivo, unicéntrico, en las unidades de atención de pacientes críticos. El periodo fue de 14 semanas (desde 12/09/2018 hasta el 18/12/2018). El proyecto fue aprobado por el Comité de Capacitación y Docencia, y el Comité Institucional de Ética en Investigación en Salud (CIEIS, numero de acta 346) del establecimiento.
Criterios de inclusión y exclusión
Se incluyeron todos los pacientes de edad igual o mayor a 16 años, internados en las unidades de atención de pacientes críticos, que recibieron vancomicina por vía de administración endovenosa intermitente.
Se excluyeron aquellos pacientes con insuficiencia renal (creatinina sérica mayor a 1,1 mg/dL para mujeres y 1,3 mg/dL para hombres)20,21 y pacientes con tratamiento de hemodiálisis.
Variables
- Concentración valle
La determinación de Cv se realiza en el estado estacionario, que para pacientes con funcionalidad renal normal se alcanza a las 48 horas del inicio del tratamiento.
Se obtuvieron muestras de 2,5 mL de sangre venosa a predosis matutina en tubos Vacutainer sin anticoagulante de tapa amarilla, y fueron inmediatamente enviados al Laboratorio de Bioquímica de la institución para su análisis.
La cuantificación de vancomicina fue realizada mediante técnica de inmunoensayo de fluorescencia polarizada (analizador COBAS c501 de Roche).
- Concentración inhibitoria mínima (CIM)
El examen bacteriológico fue realizado por el Servicio de Bacteriología. La identificación y determinación de las CIM de los microorganismos aislados fueron realizadas utilizando métodos automatizados (Phoenix100. Becton. Dickinson con paneles PMI/ID 107 y Vitek 2 compact. BioMerieux con tarjetas AST-P 577).
- Cálculo de área bajo la curva en 24 horas (cABC24) y ABC24/CIM
Para el cálculo del área bajo la curva de concentración-tiempo durante un período de 24 horas se requiere la determinación de por lo menos dos concentraciones de vancomicina (por ejemplo, valle y pico), pero esto en la práctica clínica muchas veces no es factible22.
Calculamos el ABC24, (cABC24) utilizando la ecuación 1; donde requiere el valor del clearence de creatinina (CLCr); ya que la vancomicina es eliminada principalmente por excreción renal y, por ende, el clearance de vancomicina es aproximado al CLCr1,10,21,22,23,24.
El CLCr fue calculado en forma teórica utilizando la fórmula de Cockcroft y Gault a partir de datos de creatinina sérica de los pacientes25.
El cálculo de cABC24 se calculó de acuerdo con la ecuación 1 propuesta por varios estudios24,26:
cABC24 = D/ [[(CLCr × 0.79) + 15.7] × 0.06] Ec.1
Donde D es la dosis en mg.
Diseño de la monitorización
Por ser la primera vez que se realiza esta actividad, y a los fines de recabar la información relevante para realizar un informe farmacoterapéutico, el Servicio de Farmacia del hospital diseñó una planilla de monitorización de vancomicina (Anexo I), que implica acciones coordinadas entre los Servicios Médicos, de Laboratorio y el Servicio de Farmacia11,12.
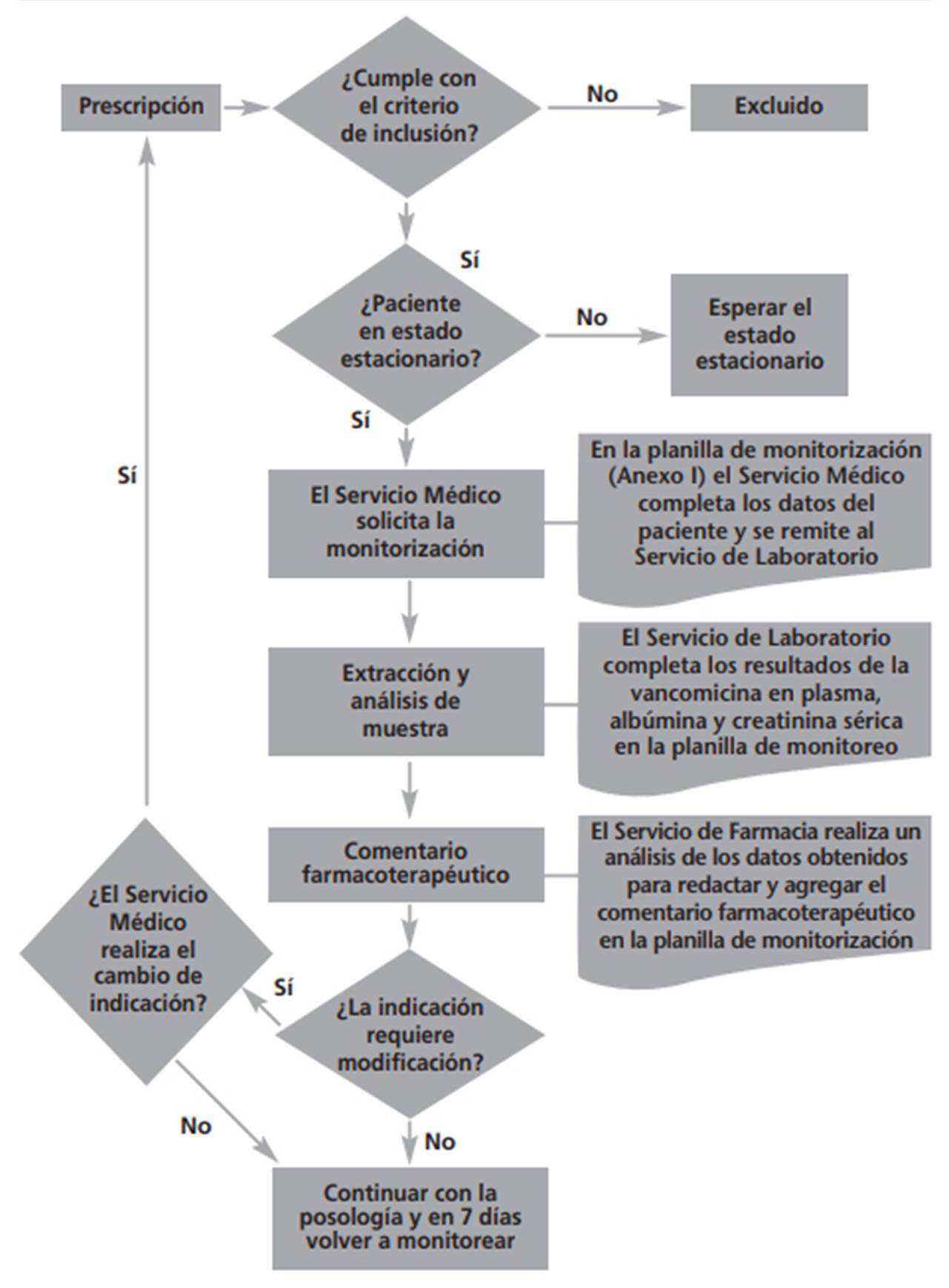
Los pasos para realizar la monitorización de vancomicina se describen en el siguiente diagrama de flujo (Figura 2):
En los Servicios Clínicos las posologías que requieren una administración cada 12 horas se realizan a las 8:00 y a las 20:00 h; y las que son cada 8 horas se realizan a las 8:00, 16:00 y 00:00 h.
Una vez identificado el paciente que cumple los criterios de inclusión y alcanzado el estado estacionario, el Servicio Médico correspondiente solicitó la monitorización de vancomicina al Servicio de Laboratorio mediante la planilla correspondiente, elaborada ad-hoc para este proyecto (Anexo I).
Complementariamente, se acordó con el Servicio de Laboratorio la recepción de las planillas de solicitud de monitorización y luego se realiza la extracción de una muestra de sangre a predosis para la determinación de la Cv. Además, el Servicio de Laboratorio determinó la creatinina sérica, la CIM en conjunto con los resultados del análisis microbiológico y la albúmina sérica.
El Servicio de Farmacia retira el informe de laboratorio con el resultado de Cv y redacta el comentario farmacoterapéutico en la planilla. La planilla se devuelve a la unidad de atención donde el paciente está internado para ser adjuntado a la Historia Clínica.
Durante el estudio se obtuvo la siguiente información desde la Historia Clínica del paciente y se registró en una planilla Excel:
Datos del paciente: nombre, cama, edad, peso, sexo, patología informada en la solicitud de monitorización.
Datos del tratamiento con vancomicina: día de comienzo de tratamiento con vancomicina, pauta de administración previa a la extracción, hora de la última administración de dosis, medicación concomitante.
Datos de laboratorio: última creatinina sérica, albúmina sérica y resultados de bacteriología (tipo de muestra analizada, germen aislado y CIM).
Los datos obtenidos fueron utilizados para la realización de los cálculos (CLCr, cABC24, cABC24/CIM) y la elaboración del comentario farmacoterapéutico.
Comentario farmacoterapéutico
Con la información obtenida del paciente y el valor de Cv se redacta el comentario farmacoterapéutico. En él se sugieren las pautas a seguir de acuerdo al resultado; esto puede ser una propuesta de aumento o disminución de dosis o cambios de intervalos de administración de vancomicina y el momento de una siguiente monitorización11.
En esta primera etapa no se recabó la información sobre la aceptación o no de las propuestas de cambio de dosis aportadas en los comentarios farmacoterapéuticos.
RESULTADOS Y DISCUSIÓN
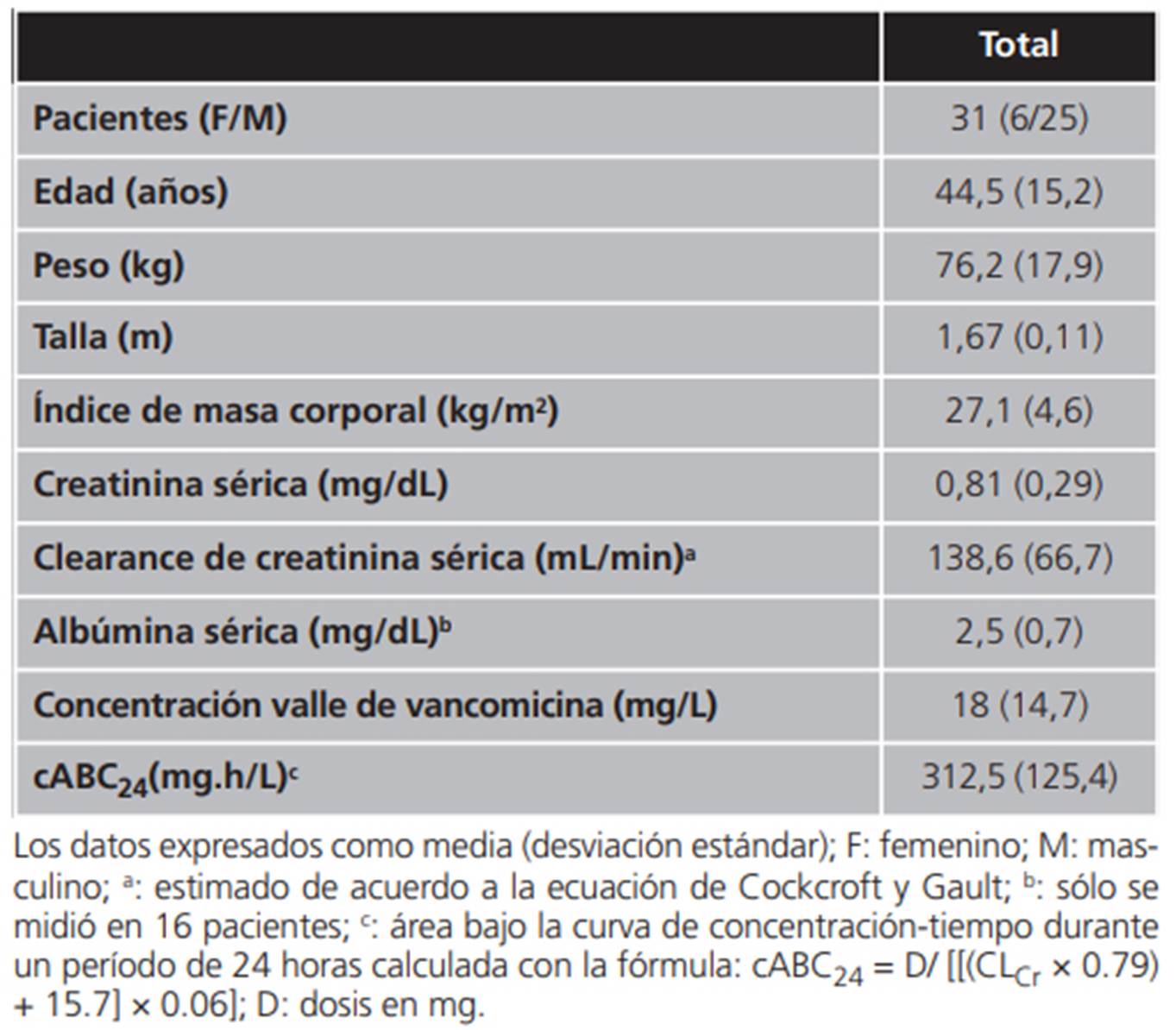
Durante el período de estudio, 53 pacientes recibieron indicación de vancomicina, de los cuales 12 no cumplieron con el criterio de inclusión y 10 pacientes no fueron monitoreados por alguno de los siguientes motivos: óbito, suspensión del tratamiento con vancomicina, traslado de servicio de internación, omisión de solicitud de monitoreo de vancomicina. 31 pacientes cumplieron con criterios de inclusión. En la tabla 1 se describen los datos demográficos y otras características de los pacientes monitoreados.
Como indica la tabla, sólo se obtuvieron los datos de albúmina de 16 pacientes y se puede observar que el valor medio (± DE) es bajo (2,5 g/dL ± 0, 7) (valor normal: 3,4 a 5,4 g/dL). Esto concuerda con la hipoalbuminemia observada comúnmente en pacientes críticos27.
La dosis recomendada de vancomicina en adultos con función renal normal es de 30 mg/kg/día dividida en 2-4 dosis1,4-10. Por la ausencia de un protocolo de uso de vancomicina en la institución, las pautas de dosis o tipo de administración (continua o intermitente) no son homogéneas y obedecen al criterio del médico tratante. Las indicaciones de vancomicina en este estudio fueron: infusión intermitente de 1 g cada 12 h (85%), 1 g cada 24 h (6%), 1,5 g cada 12 h (6%) y de 1 g cada 8 h (3%).
Se obtuvieron 36 Cv de vancomicina ya que en 5 pacientes se obtuvieron dos concentraciones.
En la figura 3 se observan las dosis normalizadas administradas en 24 horas respecto a las Cv determinadas de cada paciente. Un alto porcentaje de pacientes (50%) presenta Cv de vancomicina, menores a 15 mg/L lo que puede llevar a un fracaso terapéutico y un 28% presenta Cv por encima de 20 mg/L, lo que en algunos casos puede conducir a una nefrotoxicidad.
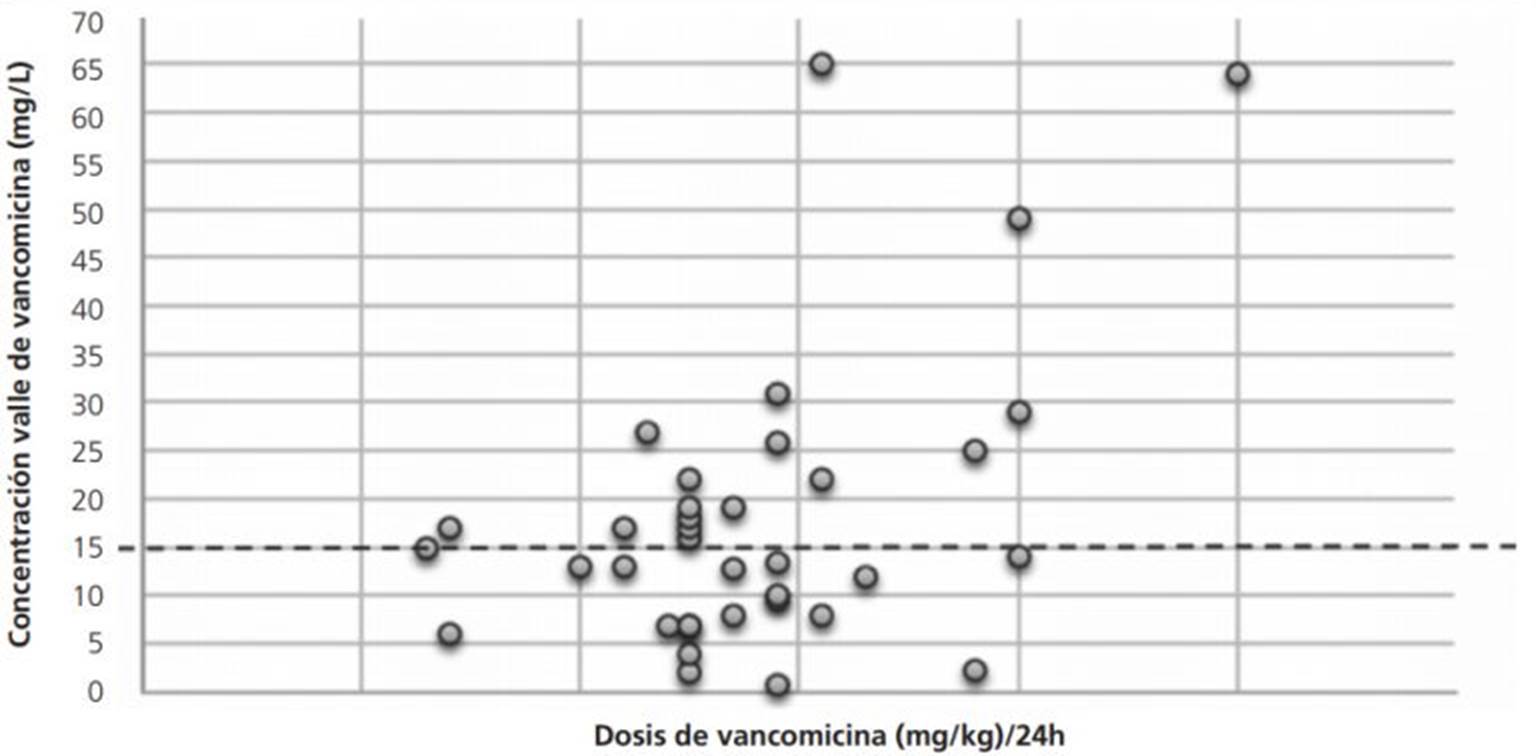
Figura 3. Concentraciones valle de vancomicina de acuerdo a la dosis diaria administrada normalizada por peso. La línea de trazos indica concentraciones valle de 15 mg/L
Se realizaron 36 informes. Cada informe contenía un comentario farmacoterapéutico aportando una sugerencia para la continuación del tratamiento con vancomicina en función del valor de Cv obtenido. Los comentarios fueron (i) continuar con la misma dosis y repetir la monitorización a los 7 días, (ii) corregir dosis, adjuntando una propuesta de modificación en cantidad o posología, y repetir monitoreo a las 48 h de ser aceptado el cambio de dosis.
Es importante destacar que se observó baja adherencia a la sugerencia de repetir la monitorización a los 7 días del primero, probablemente por falta de costumbre y de protocolización de la actividad. Por otra parte, no se recabó información respecto de la aceptación de la sugerencia aportada en el comentario farmacoterapéutico. Estos aspectos deben ser fortalecidos en caso de implementar la monitorización de vancomicina en forma sistemática en el futuro.
En 36 informes realizados de monitorización de vancomicina, 17 fueron acompañados por el resultado bacteriológico, de los cuales 9 informaban el valor de CIM que correspondieron a 8 pacientes. Los microorganismos identificados fueron: Estafilococo epidermidis, Estafilococo capitis, Estafilococo aureus y Enterococcus faecalis.
La relación entre el cABC24 y las Cv de vancomicina en estado estacionario se observa en la figura 4. Si bien la correlación es significativa (p<0,001), algunos resultados de algunos autores demostraron que el cABC24 calculada con el CLCr claramente está subestimada en comparación con ABC24 estimada basándonos en datos farmacocinéticos individuales. En consecuencia, debe considerarse que una dosis más alta de vancomicina podría recomendarse inapropiadamente cuando se usa el cABC2424,26.
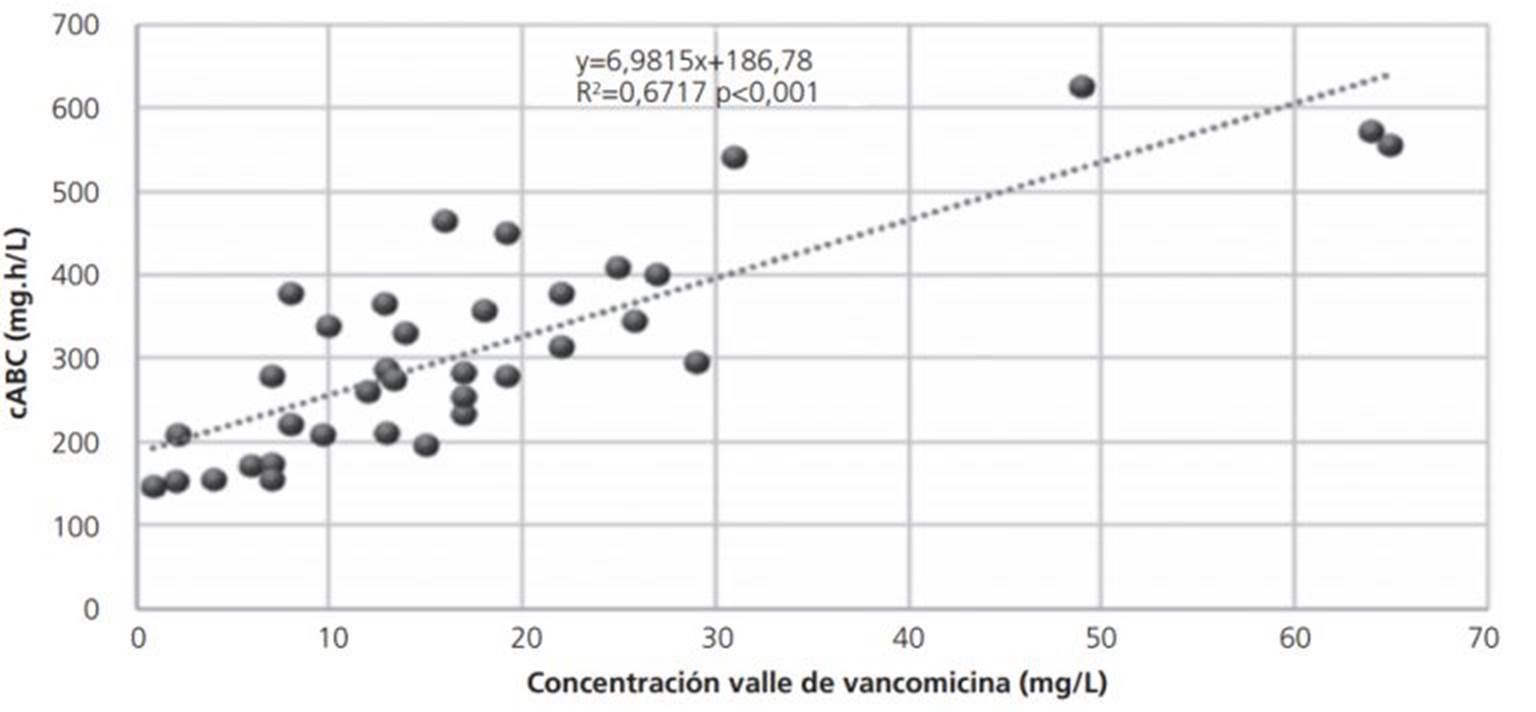
Figura 4. Relación entre el cABC24 y las concentraciones valle de vancomicina en estado estacionario
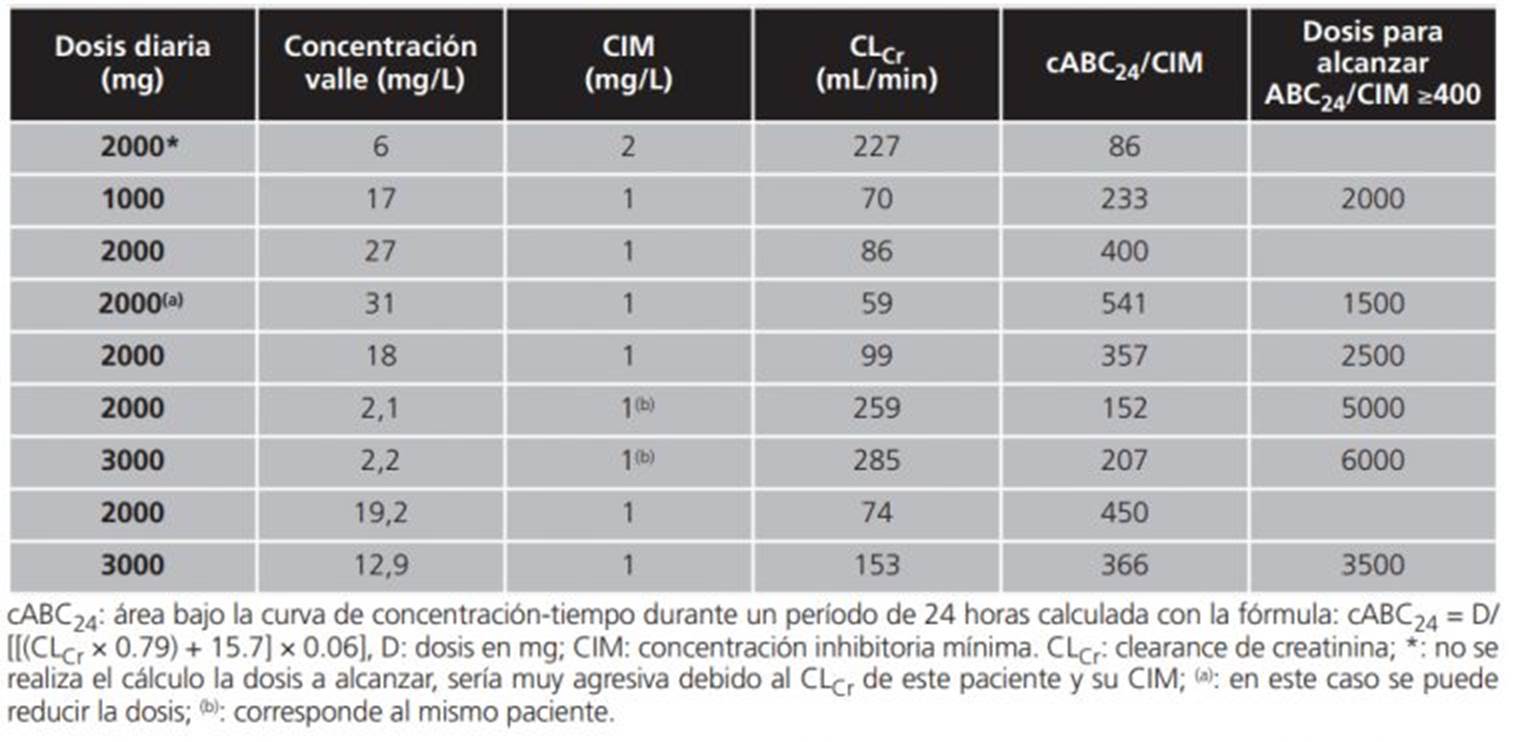
En la tabla 2 se detallan los valores de cABC24/CIM y las respectivas Cv de vancomicina para aquellos pacientes en que se pudo determinar la CIM. Asimismo, se muestra qué dosis estimada de vancomicina habría que administrar para llegar a un ABC24/CIM ≥400 suponiendo que su comportamiento fuera lineal. Como se puede apreciar sólo un paciente con una Cv entre 15-20 mg/L logra un cABC24/CIM mayor a 400. Otros dos logran llegar a ese objetivo, pero sus Cv están fuera de rango referenciado en literatura. Uno de los pacientes tenía una CIM=2 y un CLCr elevado lo que implicaría necesariamente una dosis muy elevada para lograr el objetivo terapéutico28.
A pesar de lo comentado anteriormente sobre la subestimación de cABC, se podría decir que dosis mayores que 2000 mg diarios se necesitarían en la mayoría de los casos de acuerdo al CLCr. En esta tabla 2 se muestra a un paciente con CLCr elevado (259 mL/min), Cv de vancomicina obtenida en la primera instancia muy baja (2,1 mg/L) y una dosis de 2000 mg de vancomicina diaria. En este caso se debería haber comenzado con una dosis agresiva de 5000 mg por día de vancomicina para erradicar la infección y revertir el aumento de permeabilidad observado en este paciente que presentaba sepsis severa. En la segunda monitorización de Cv de vancomicina el valor obtenido (2,2 mg/L) permanece bajo a pesar del aumento de dosis a 3000 mg, por lo tanto, el paciente mantiene sus condiciones de sepsis.
Tabla 2. Datos individuales para aquellos pacientes a los cuales e les pude determinar la CIM y la dosis que se debería proponer para alcanzar un ABC/CIM ≥400 de los pacientes
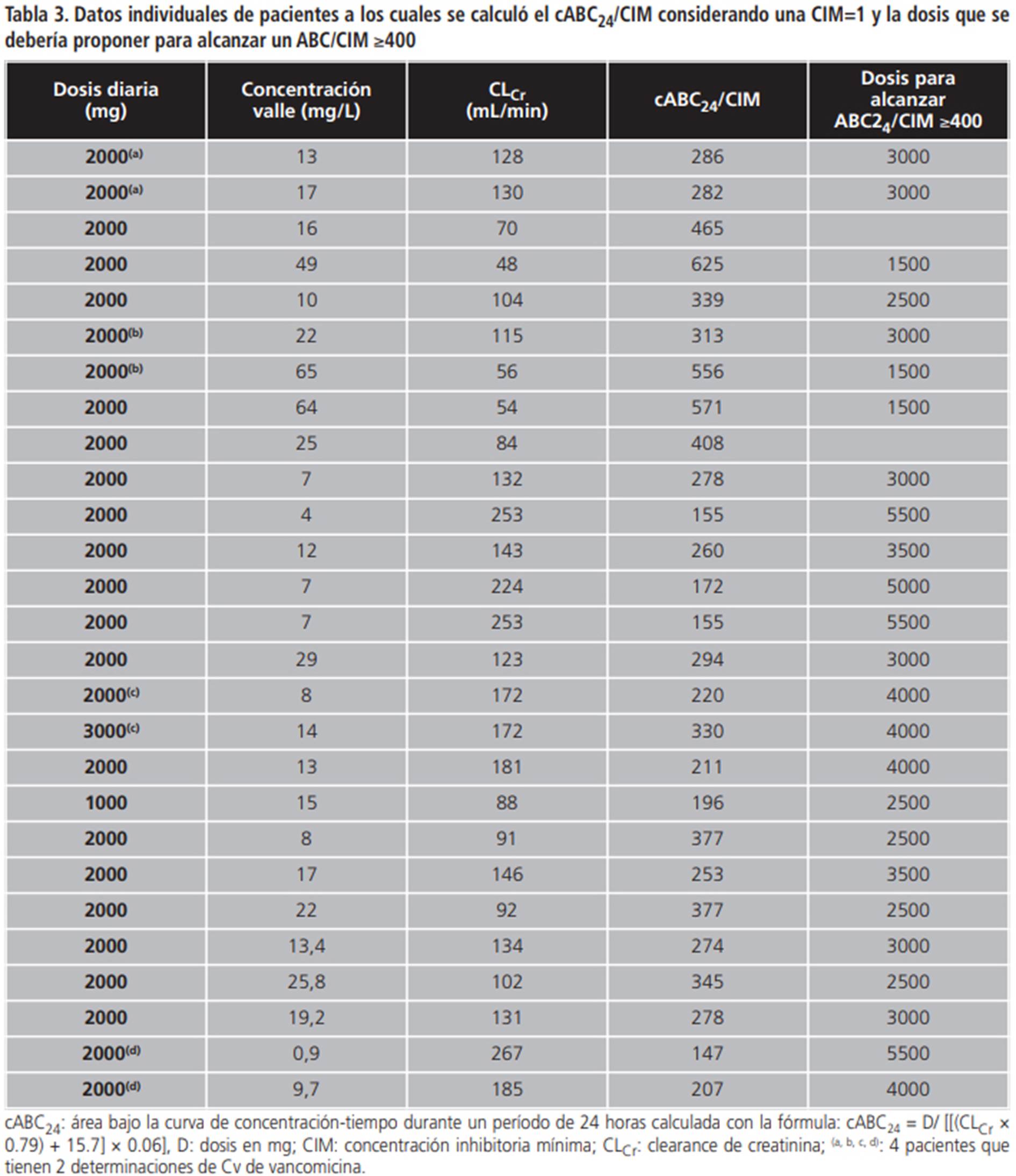
En la tabla 3 se muestran los datos individuales de pacientes a los cuales se calculó el cABC24/CIM considerando una CIM=1 y la dosis que se debería proponer para alcanzar un ABC/CIM ≥400. Sólo en 5 pacientes se alcanzó el objetivo y en algunos con Cv muy altas que ameritaban una disminución de dosis.
Parce obvio afirmar que el CLCr sigue siendo la determinante más importante en la farmacocinética de la vancomicina para lograr el objetivo terapéutico28,29.
Tabla 3. Datos individuales de pacientes a los cuales se calculó el cABC24/CIM considerando una CIM=1 y la dosis que se debería proponer para alcanzar un ABC/CIM ≥400
Algunos autores propusieron un algoritmo de dosis de mantenimiento de vancomicina de acuerdo al CLCr del paciente. Así para CLCr de 101-170 mL/min proponen dosis de 4000 a 6000 mg/día30. Nuestros pacientes con CLCr comprendidos entre 48 y 104 mL/min requerirían dosis de 1500 a 2500 mg/día, los que poseen CLCr entre 115 y 185 mL/min dosis de 3000 a 4000 mg /día y los de CLCr entre 224 y 285 mL/min dosis de 5000 a 6000 mg/día.
Si bien en general, se acepta que un objetivo de la monitorización de vancomicina para infusiones intermitentes es una concentración mínima entre 15 y 20 mg /L, también se ha demostrado que este objetivo se correlaciona mal con un ABC/CIM ≥400 debido a una alta variabilidad interindividual. De acuerdo a algunos autores concentraciones valle entre 15-25 mg/L se correlacionan mejor30. También deberíamos señalar que el régimen empírico de uso común de 1 g cada 12 horas solo logró ABC24/CIM aceptables para pacientes con un CLCr entre 48-86 mL/min (ocho de nueve pacientes). Pacientes que presentaron CLCr mayores no lograron el objetivo terapéutico.
Este estudio tiene algunas limitaciones. Primero, no se obtuvieron datos del estado clínico del paciente, lo que es fundamental para saber si el paciente evoluciona favorablemente o no. Segundo, en la mayoría de los pacientes se asumieron CIM=1 y si la CIM es menor o mayor, las dosis estimadas no serían las adecuadas. Tercero, pocos pacientes (5 de 31) se volvieron a monitorear luego de la primera determinación de Cv.
CONCLUSIONES
Este estudio fue el primer paso para implementar la farmacocinética clínica en la institución y evidenció la importancia de la monitorización terapéutica y la individualización de la dosis. Es fundamental determinar el CLCr y así establecer una dosis inicial de acuerdo a su valor. En pacientes críticos y con un CLCr elevado se necesitarían dosis mayores a las utilizadas en este estudio y el objetivo en algunos pacientes de lograr Cv entre 15-20 mg/L no sería adecuado y se deberían alcanzar Cv más elevadas.
Estos datos respaldan una reevaluación de las recomendaciones de dosificación de vancomicina en pacientes críticos con nuevos enfoques para alcanzar de manera más rápida y consistente los objetivos clínicamente relevantes de PK/PD, por lo tanto, la monitorización más frecuente sería de vital importancia para ver cómo evolucionan las concentraciones y así poder realizar los ajustes posológicos rápidamente.
Agradecimientos: La Farm. Alejandra Suarez agradece la colaboración del Servicio de Laboratorio y al equipo médico de Unidades de Atención a pacientes críticos de la Institución por la predisposición para hacer este trabajo; y a la Especialización en Farmacia Hospitalaria de la Facultad de Ciencias Químicas, UNC por el financiamiento parcial al entrenamiento en Farmacocinética Clínica en el Centro de Monitoreo que dio origen a la idea de este trabajo.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.