INTRODUCCIÓN
La comercialización de distintos fármacos biológicos, como los dirigidos contra el TNF (inhibidores del TNF o anti-TNF) supuso un punto de inflexión en el manejo de la enfermedad inflamatoria intestinal (EII) (enfermedad de Crohn (EC) o colitis ulcerosa (CU))1. Sin embargo, hasta un 30% de los pacientes no alcanzan el beneficio clínico tras el inicio de estas terapias (fallo primario o falta de respuesta primaria (FR1)), y otro grupo importante de personas perderá la respuesta al biológico con el tiempo después de un resultado inicial favorable (fallo secundario o pérdida secundaria de respuesta (FR2)), requiriendo un incremento de la dosis o el cambio de fármaco2.
Entre las causas que se asocian con más frecuencia a un fracaso terapéutico destaca la inmunogenicidad asociada a estos medicamentos3. Además, el empleo de anti-TNF como infliximab y adalimumab no está exento de reacciones adversas ya que, debido a su mecanismo de acción, afectan a la actividad normal del sistema inmune4,5. Todo esto, junto al elevado coste de los fármacos biológicos, la reciente aparición de biosimilares y la existencia de alternativas terapéuticas limitadas para el tratamiento de pacientes con EII, hace necesaria una adecuada individualización de la terapia con el fin de optimizarla, reduciendo la probabilidad de eventos adversos y mejorando la eficiencia.
Actualmente, se dispone de una herramienta no invasiva que puede ser útil para evaluar la exposición individual al fármaco y guiar la optimización de la pauta posológica: la monitorización farmacocinética de concentraciones plasmáticas del fármaco o “Therapeutic Drug Monitoring” (TDM).
En los últimos años se han publicado estudios que corroboran la relación entre el efecto terapéutico de los anti-TNF, su concentración plasmática (Cp) y la presencia de anticuerpos frente al fármaco (AAF)6,7,8,9. Así pues, aunque es lógico pensar que la TDM pueda tener utilidad en el ajuste de dosis personalizado en EII, la mayoría de los trabajos que respaldan su uso son retrospectivos y existe una gran heterogeneidad entre ellos10.
Si bien las guías publicadas por la Sociedad Británica de Gastroenterología (BSG)11 y la Sociedad de Gastroenterología de Australia (GESA)12 abogan por el uso de la TDM para orientar el manejo de pacientes con EII, las directrices de la Asociación Americana de Gastroenterología (AGA)13 establecen que la evidencia publicada es insuficiente para recomendarla.
Dada la breve evidencia disponible acerca de la TDM de anti-TNF, este proyecto pretende aportar experiencia de su utilidad en la práctica clínica habitual del manejo de la EII. Así pues, se establece como objetivo describir las monitorizaciones farmacocinéticas de infliximab y adalimumab realizadas a pacientes con EII durante 2017 y 2018 en el Servicio de Farmacia de un hospital general. Se pretende evaluar tanto los resultados de la monitorización como las recomendaciones efectuadas por el Servicio de Farmacia. Adicionalmente, se busca analizar el impacto de la monitorización en la toma de decisiones terapéuticas y en la evolución clínica de los pacientes.
MATERIAL Y MÉTODOS
Se diseñó un estudio retrospectivo, descriptivo, transversal. Se evaluaron las determinaciones de agentes anti-TNF (infliximab y adalimumab) en pacientes con EII en seguimiento por el Servicio de Medicina Digestiva de un hospital de tercer nivel. El periodo de estudio fue el comprendido entre el 1 de enero de 2017 al 31 de diciembre de 2018.
Se seleccionó a todas las personas mayores de 18 años, no incluidas en ensayos clínicos y con patología digestiva tratada con infliximab o adalimumab, a las que se les realizó, al menos, una monitorización farmacocinética de las Cp de anti-TNF en el Servicio de Farmacia del hospital durante el periodo de estudio. El especialista en Medicina Digestiva fue quien efectuó la solicitud de monitorización en el momento que consideró oportuno.
Se excluyó del estudio a aquellas determinaciones cuyo resultado no estaba disponible, por un error en la extracción de la muestra o porque el valor no fue interpretable y, por tanto, no se pudo realizar el estudio e informe farmacocinético.
Se recogieron variables demográficas y clínicas: edad, sexo, diagnóstico (CU o EC) y biomarcadores (calprotectina fecal (CF) y proteína C reactiva (PCR)) en 2 tiempos diferentes (el momento previo a la monitorización y tres meses tras ésta); y variables farmacoterapéuticas (tipo de fracaso (FR1 y FR2)).
Además, se consignaron datos de la TDM: motivo de solicitud (monitorización reactiva/proactiva) y resultado determinación de anti-TNF según su relación con el intervalo terapéutico objetivo (IT). Se consideró como intervalo terapéutico óptimo:
Cp entre 3,5 y 7 mcg/ml para infliximab y Cp entre 5 y 12 mcg/ml para adalimumab.
Otras variables estudiadas fueron el resultado de determinación de anticuerpos frente al fármaco biológico (AAF) (en el caso de que ésta estuviera disponible) y la recomendación farmacocinética informada.
Finalmente, se analizó el impacto de la monitorización en el manejo clínico. Para ello, se comprobó la aceptación o el rechazo de la recomendación farmacéutica por parte del especialista en Medicina Digestiva solicitante de la prueba.
Los datos relacionados con las muestras, así como los informes farmacocinéticos se obtuvieron del Sistema Integrado de Gestión de Laboratorio corporativo. Esta información se completó con datos clínicos obtenidos de las historias clínicas electrónicas a través de la aplicación informática corporativa.
Para el análisis de datos se utilizó el programa estadístico SPSS Statistics 22®. Se utilizó la prueba Chi Cuadrado para evaluar la asociación entre dos variables cualitativas y la prueba no paramétrica de Wilcoxon para datos apareados con el fin de comparar los resultados de la misma muestra obtenidos en dos momentos diferentes. Se asumió significación estadística cuando los p-valores en las pruebas fueron menores de 0,05.
RESULTADOS
Descripcción de la población
En las fechas de estudio (enero 2017-diciembre 2018) se identificó un total de 126 personas con EII tratadas con anti-TNF (66 adalimumab y 60 infliximab), de las cuales 66 (52%) fueron elegibles para el estudio por disponer, al menos, de una monitorización farmacocinética.
La mayoría de los pacientes eran hombres tratados con infliximab. Las características demográficas y clínicas de los sujetos monitorizados se presentan en la tabla 1.
Motivo de solicitud de evaluación farmacocinética
En el periodo de estudio se realizaron un total de 137 determinaciones pertenecientes a la muestra de pacientes seleccionada. De éstas, se excluyeron 4 determinaciones (1 adalimumab; 3 infliximab) por extracción inadecuada de la muestra. Finalmente, 133 mediciones (61 adalimumab; 72 infliximab) fueron evaluables. La media de determinaciones por paciente y año fue mayor en el grupo de adalimumab (2,4 determinaciones por paciente y año frente a 1,7 para el grupo de infliximab).
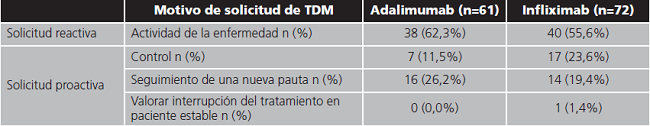
Los motivos por los cuales se solicitó el análisis de las concentraciones plasmáticas de fármaco se resumen en la tabla 2.
Clasificación del tipo de fallo terapéutico
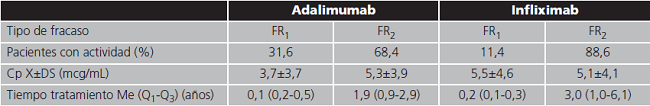
El grupo de pacientes que fueron monitorizados por presentar enfermedad activa se estratificó según si se trataba de un fallo primario del tratamiento experimentado durante la inducción (FR1) o de una pérdida de respuesta secundaria experimentada tras haber logrado un beneficio clínico inicial (FR2). La duración del tratamiento hasta el fracaso y la concentración plasmática obtenida en la determinación analítica se recogen en la tabla 3.
Resultado de las determinaciones farmacocinéticas
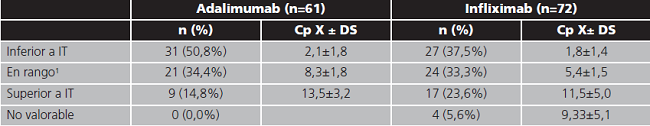
La exposición al fármaco fue subóptima en la mayoría de los casos. Los resultados se recogen en la tabla 4, clasificando la concentración de fármaco obtenida respecto al intervalo terapéutico establecido como objetivo. En cuanto al análisis de AAF, la determinación de los niveles de anticuerpos anti-adalimumab se solicitó de forma complementaria en 8 (13,1%) monitorizaciones correspondientes a 7 pacientes, resultando positiva (AAF detectables) en 5 de ellas (8,1% del total de monitorizaciones de adalimumab). En cuanto a infliximab, en 6 monitorizaciones (8,3% del total de monitorizaciones de infliximab) correspondientes a 6 pacientes distintos, se solicitó la determinación de anticuerpos anti-infliximab complementaria a los niveles plasmáticos de fármaco, resultando positiva en todas ellas.
Recomendación farmacocinética
Los resultados del análisis de las recomendaciones farmacéuticas se recogen en la tabla 5, siendo las sugerencias principalmente la realización de ajustes posológicos. Respecto a la aceptación de la intervención, el especialista responsable siguió el consejo farmacéutico en el 86% (n=115) de las recomendaciones; y en el 14% (n=18) de los casos restantes tomó una decisión clínica que no coincidía con la propuesta desde el Servicio de Farmacia.
Tabla 5. Recomendación farmacocinética segmentada por fármaco y concentración plasmática asociada.
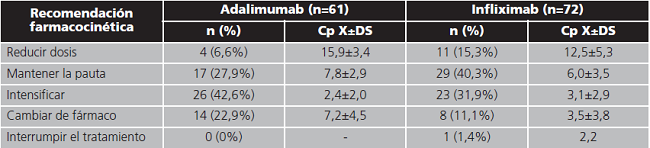
Cp: concentración plasmática (mcg/mL); DS: desviación estándar; X: promedio.
Cuando estudiamos con qué frecuencia se aceptó o rechazó cada una de las intervenciones, observamos que la frecuencia de no aceptación fue mayor en el caso de recomendar cambiar de fármaco (n=5/21; 24%), seguido de intensificar (n=10/49; 20%), desintensificar (n=3/15; 20%), mantener (n=3/46; 7%) y retirar el agente anti-TNF (n=0/1; 0%).
Parámetros inflamatorios
En cuanto al análisis de los marcadores bioquímicos de actividad de la EII, la mediana de calprotectina fecal (CF) (Me (Q1-Q3)) medida antes de la extracción de los niveles sanguíneos de adalimumab fue de 286,0 (106-1160) mg/kg y se redujo a 249,5 (62-585) mg/kg tres meses después. Cuando hacemos el mismo análisis para infliximab, obtenemos una mediana de CF previa a la extracción de los niveles de 455,0 (109-1275) mg/kg y ésta se redujo a 215,0 (82-736,5) mg/kg a los tres meses. Estas diferencias no fueron estadísticamente significativas (p-valor=0,132 y p=0,090 para adalimumab e infliximab respectivamente).
Al analizar la PCR en las personas tratadas con adalimumab se observa estabilidad, siendo la mediana de PCR previa a la monitorización de 3,1 (0,3-12,9) mg/L y de 3,2 (3,1-15,1) mg/L a los tres meses. En cuanto a infliximab se midieron inicialmente unos niveles de PCR de 2,9 (1,4-5,6) mg/L y 1,8 (0,4-3,8) mg/L pasados tres meses desde el control farmacocinético.
En este caso, tampoco se hallaron diferencias estadísticamente significativas entre las medidas realizadas al grupo de adalimumab (p=0,552). Sin embargo, la reducción de la PCR en el caso de infliximab sí alcanzó significación estadística (p=0,045).
Las determinaciones de los reactantes de inflamación antes de la monitorización y 3 meses después de ésta se compararon clasificándolos por el grado de aceptación de la recomendación. Los resultados de este sub-análisis se muestran en la tabla 6.
Tabla 6. Reactantes de inflamación pre y post monitorización según la aceptación de la intervención.
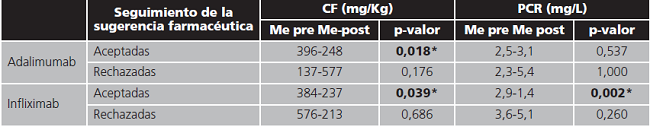
CF: calprotectina fecal; Me-pre: mediana previa a la monitorización; Me-post: mediana 3 meses tras la monitorización;PCR: proteína C reactiva. *Significación estadística; p-valor <0,05 (prueba no paramétrica de Wilcoxon).
DISCUSIÓN
En las recomendaciones más actuales se indica que la TDM de anti-TNF ha de ser un parámetro más a controlar en el seguimiento de pacientes con EII ya que ésta podría minimizar el fracaso terapéutico11,12,13. Sin embargo, los resultados de nuestro estudio revelan que se ha monitorizado únicamente un 52% de la población con EII en tratamiento con fármacos biológicos anti-TNF.
En la mayoría de las monitorizaciones, la determinación se solicitó ante la presencia de síntomas (monitorización reactiva). Esto concuerda con las recomendaciones de la Asociación Estadounidense de Gastroenterología (AGA) en las que se considera que no hay evidencia suficiente que justifique la monitorización en pacientes asintomáticos (monitorización proactiva)13. Sin embargo, algunas recomendaciones de consenso, abogan por el enfoque proactivo como una estrategia para prevenir el fracaso terapéutico que se podría implementar en escenarios concretos12.
Los fracasos terapéuticos experimentados por nuestra población también presentan frecuencias acordes a las publicadas en otros estudios3, puesto que se identificó una baja tasa de FR1 al tratamiento y una mayor tasa de FR2.
En cuanto a la inmunogenicidad, se ha realizado la determinación de AAF de forma complementaria a una pequeña fracción de las monitorizaciones ya que, por protocolo, los AAF se analizan cuando las concentraciones séricas de anti-TNF resultan próximas al límite de detección de la técnica analítica. La determinación resultó positiva en un 8,1% y 8,3% del total de monitorizaciones de adalimumab e infliximab respectivamente. La tasa de inmunogenicidad similar entre ambos fármacos difiere de lo esperado, ya que según la bibliografía disponible se ha visto que el fracaso terapéutico asociado a AAF tiene mayor relevancia en infliximab que en adalimumab, al tratarse el primero de un anticuerpo de origen quimérico14.
En cuanto a los resultados de la monitorización, únicamente un tercio de los pacientes (tanto de adalimumab como infliximab) presentaron exposición al fármaco dentro del intervalo terapéutico. Así pues, las recomendaciones farmacocinéticas, fueron en la mayoría de los casos la realización de modificaciones, sugiriéndose el mantenimiento de la posología previa únicamente en un 35% de los casos. Los cambios de tratamiento efectuados podrían promover mejoras en el estado clínico del paciente como sugieren otros estudios15. Además, algunas de las intervenciones como la reducción o el espaciado de dosis innecesarias o el cambio de fármaco cuando se alcanzan concentraciones óptimas sin respuesta clínica adecuada, podrían traducirse en una optimización de los recursos sanitarios como se ha visto en trabajos previos16.
La aceptación de la intervención sugerida fue superior al 80% tanto para adalimumab como infliximab. El alto porcentaje de seguimiento de la recomendación farmacocinética podría confirmar la utilidad de esta técnica para guiar la toma de decisiones clínicas.
La recomendación con menor porcentaje de aceptación fue el cambio el tratamiento en aquellos casos en los que las Cp de fármaco son adecuadas y persiste la actividad. Sin embargo, este podría ser el escenario en el que la TDM presenta mayor utilidad, puesto que la mayoría de las personas con Cp en rango no responden a una intensificación de la dosis y se podría evitar la prolongación de tratamientos ineficaces e iniciar terapias efectivas de manera temprana17.
Respecto a la evolución de los reactantes de fase aguda, tanto la PCR como la CF se reducen a los 3 meses de la monitorización. Aunque estas diferencias no alcanzan en todos los casos la significación estadística, la reducción observada podría sugerir una mejora del estado de la enfermedad promovido por la decisión clínica tomada tras la monitorización. Esta observación se refuerza por el hecho de que, al estratificar estos datos en función del grado de seguimiento de la intervención en la toma de decisiones clínicas, la reducción es mayor en el grupo de aceptación, alcanzando significancia estadística en el caso de la CF con ambos fármacos y PCR con infliximab.
En cuanto a las limitaciones, en nuestro proyecto la actividad de la enfermedad se evaluó mediante la valoración subjetiva del especialista en Medicina Digestiva recogida en la historia clínica. Una posible limitación fue no considerar datos clínicos y endoscópicos que pudieran ser indicadores objetivos de la actividad y estar relacionados con las concentraciones plasmáticas obtenidas en la monitorización, por no estar disponibles en todos los pacientes en los tiempos adecuados para el trabajo.
Finalmente, el rango de concentraciones objetivo actualmente no está bien definido en la literatura y varía en función del objetivo terapéutico (curación mucosa, remisión clínica, etc.)10,18. La elección de uno u otro afectará a nuestros resultados ya que implica una distinta clasificación del estado de las concentraciones plasmáticas en relación al intervalo terapéutico.
CONCLUSIONES
El estudio muestra que solo la mitad de los pacientes con EII tratados con adalimumab o infliximab están monitorizados. La determinación analítica de anti-TNF se solicitó en la mayoría de casos de forma reactiva, evidenciándose un porcentaje considerable de pacientes que presentan concentraciones tanto de adalimumab como de infliximab fuera del intervalo terapéutico óptimo.
La TDM promovió numerosos cambios de tratamiento. Adicionalmente, se observó un alto grado de aceptación de la recomendación farmacocinética por parte del médico solicitante de la prueba, siendo en estos casos en los que los parámetros clínicos (CF para ambos fármacos y PCR para el grupo de infliximab) alcanzaron una mejoría estadísticamente significativa a los 3 meses de la intervención.
Nuestros resultados refuerzan el beneficio de la TDM como herramienta de apoyo para guiar la terapia con anti-TNF en pacientes con EII.