1. Introducción
El uso de animales criados, suministrados o usados para fines científicos, incluyendo la docencia, está regulado desde la década de los 80. La normativa en experimentación animal se ha ido modificando y adaptando a los nuevos conocimientos surgidos principalmente en el ámbito del bienestar animal. En la actualidad y en España, la principal normativa de aplicación la constituyen la Directiva Europea 2010/63/UE relativa a la protección de los animales utilizados para fines científicos y el Real Decreto 53/2013 que la traspone a nivel nacional. Estas normas se complementan con una serie de tratados, leyes, órdenes y decretos, tanto europeos y estatales como de las diferentes comunidades autónomas en las materias establecidas de su competencia, conformando el conjunto normativo que regula el uso de animales en investigación y docencia.
A grandes rasgos, el marco legislativo regula: el ámbito de aplicación (que define las especies y las etapas de desarrollo a las que debe aplicarse la normativa); las instalaciones y las condiciones generales en las que se deben mantener los animales; el personal y la formación requerida para trabajar con animales de experimentación (que en España viene definida en la Orden Ministerial ECC/566/2015); y la autorización de proyectos y procedimientos.
La autorización de un proyecto con animales requiere de una valoración positiva por el Comité Ético de Experimentación Animal del centro en el que se llevará a cabo y por un Órgano Habilitado para la evaluación de proyectos u organismo competente en materia de experimentación animal.
Estos órganos deben realizar una evaluación ética de los proyectos y verificar que cumplan los siguientes requisitos:
Que esté justificado desde el punto de vista científico o educativo, o deba realizarse por imposición legal o reglamentaria;
Que su finalidad justifique la utilización de animales; y
Que esté diseñado de manera que los procedimientos se realicen de la forma más humanitaria que sea posible.
La investigación con animales debe regirse por los principios establecidos internacionalmente de reemplazo, reducción y refinamiento (Russell y Burch, 1959). El principio de reemplazo establece la obligatoriedad de utilizar materiales no sensibles en lugar de animales vivos siempre que sea posible. Se entiende por material no sensible, desde los modelos computacionales hasta los ensayos in vitro con modelos celulares, o los ensayos con organismos menos evolucionados como microorganismos, plantas e invertebrados, con menor capacidad para sentir dolor, debido, en unos casos, a la carencia de sistema nervioso y, en otros, al menor desarrollo de sus sistemas sensoriales. El principio de reducción se consigue aplicando tanto estrategias secuenciales que minimicen el número de animales empleados como realizando un correcto diseño estadístico que permita utilizar solo el número de animales necesario para obtener una información fiable y válida. El principio de refinamiento se refiere a cualquier procedimiento que permita mejorar el bienestar y disminuir la severidad del daño producido a los animales.
Una correcta aplicación de los principios de las 3 Rs es crucial para el balance ético de un proyecto. Una valoración eficaz de los daños y beneficios requiere un buen conocimiento de la naturaleza y la repercusión de los beneficios potenciales, de todos los daños previstos a los animales tras tomar en consideración todas las medidas de refinamiento, y de la probabilidad de que se alcancen los beneficios previstos. Sin embargo y como trataremos en este artículo, con frecuencia ni el investigador que propone el proyecto ni los órganos que deben realizar la valoración ética disponen de la información completa y transparente de los estudios científicos previos sobre los que deberían fundamentarse los nuevos proyectos propuestos.
Uno de los aspectos éticos importantes en la investigación con animales es evitar la repetición injustificada de procedimientos. Para ello es necesario realizar una búsqueda pormenorizada en las bases de datos disponibles y asegurarse de que no se trata de una repetición de un estudio ya realizado anteriormente. Esto no sería un inconveniente si realmente se publicaran todos los estudios realizados en los que se ha aplicado el método científico de manera adecuada. Pero como veremos a continuación, existe un porcentaje muy elevado de estudios con resultados negativos que no se publican, lo que implica que no es posible acceder a la totalidad de los estudios correctamente realizados. Este hecho, denominado "sesgo de publicación", dificulta en gran medida la valoración ética de los proyectos con animales.
Otro de los problemas con los que se enfrentan los nuevos procedimientos es que a menudo se basan en publicaciones científicas con un diseño similar, que con demasiada frecuencia no consiguen reproducir. Esta problemática ha sido ampliamente reconocida en el ámbito científico y se conoce como "crisis de reproducibilidad", entendida en un sentido amplio (ver Macleod and Mohan, 2019). Como veremos en este artículo, una de las causas del problema de la no reproducibilidad de modelos y resultados de publicaciones anteriores radica en que los estudios no están informados adecuadamente.
2. El sesgo de publicación en los estudios con animales
Aunque el problema que supone el sesgo de publicación afecta a todas las áreas científicas, ha sido en el ámbito de los ensayos clínicos en el que mayor concienciación y discusión ha provocado. Existe evidencia de que los informes de los ensayos clínicos no sólo representan un subconjunto selectivo y sesgado de resultados de los estudios, sino que además con frecuencia son inconsistentes con los protocolos (Chan et al., 2004; 2005).
Los resultados de una revisión sistemática realizada por Schmucker et al. (2014) mostraron que sólo aproximadamente el 50% de los estudios clínicos y preclínicos aprobados por Comités de Ética de Investigación o incluidos en los registros de ensayo fueron publicados. Además, existen evidencias de una asociación entre estudios que informan de resultados positivos (entendidos como estadísticamente significativos) y publicaciones (Scherer et al., 2018; Dwan et al., 2013).
El sesgo de publicación que se produce cuando se publican sólo resultados positivos (por ejemplo, aquellos en los que se demuestra que un tratamiento específico es beneficioso para una patología concreta) y no los resultados negativos (siguiendo el ejemplo, los que demuestran que un tratamiento específico no ha resultado beneficioso) provoca sobrevaloraciones que afectan a las decisiones clínicas. Los profesionales sanitarios no pueden basar sus decisiones en base a todos los resultados existentes si no se han informado, lo que puede conducir a intervenciones ineficaces, o peor aún perjudiciales, con las implicaciones éticas que ello supone en relación con los pacientes.
Dada la generalidad del sesgo de publicación en el ámbito científico, es concebible que también afecte a la investigación con animales de laboratorio. En este sentido, la no publicación de los resultados negativos no solo obstaculiza el progreso en la investigación, sino que puede conllevar a la duplicación innecesaria de experimentos con sus implicaciones éticas.
Sena et al. (2010) llevaron a cabo una revisión sistemática de estudios realizados con animales sobre accidentes cerebrovasculares isquémicos y hallaron que sólo el 2,2% de las publicaciones incluidas en la revisión contenían hallazgos no significativos. Los resultados les llevaron a concluir que el tamaño de los efectos se sobreestimaron alrededor de un tercio, que aproximadamente una sexta parte de los experimentos no se publicaron y que probablemente el sesgo de publicación es altamente prevalente en los estudios con animales en el ámbito biomédico. También Tsilidis et al. (2013) evidenciaron un exceso de resultados estadísticamente significativos en estudios sobre trastornos neurológicos llevados a cabo con animales, lo que sugiere la posibilidad de que la literatura en este campo contenga un sesgo considerable y sea una de las causas de los fallos de la traslación de los resultados obtenidos con animales a los ensayos clínicos en humanos.
Conradi y Joffe (2017) analizaron cuántos de 100 trabajos realizados con animales e incluidos en el libro de resúmenes del 37th Congreso de la Sociedad Internacional de Medicina de Cuidados Críticos de 2008, habían sido publicados con posterioridad. Los resultados de este estudio mostraron que sólo el 62% de los resúmenes habían sido publicados durante el período comprendido entre la fecha del congreso en 2007 hasta junio de 2015. Esto significa que el 38% de los trabajos presentados no se habían publicado.
En 2011, Riet et al. (2012) realizaron una encuesta a investigadores de los Países Bajos que utilizaban animales de laboratorio con objeto de evaluar la magnitud del sesgo de publicación, sus causas, consecuencias y posibles soluciones. La estimación del número de estudios realizados con animales que se habían publicado fue del 50 % para los investigadores que trabajaban en entidades sin ánimo de lucro y sólo del 10 % para los investigadores que trabajaban en entidades con ánimo de lucro. De entre las causas más importantes de las no publicaciones identificaban la falta de significación estadística, problemas técnicos, y las opiniones de los revisores y editores.
Un estudio de Wieschowski, et al. (2019) fue el primero en evaluar las publicaciones de resultados obtenidos a partir de un seguimiento de 210 protocolos aprobados por los organismos competentes de dos centros médicos universitarios alemanes y cuya autorización finalizaba entre 2007 y 2013. Sus resultados mostraron que la tasa de publicación general fue del 67% (58% si se excluían las tesis doctorales), lo que implicaba que el 33% (42% sin tesis doctorales) de los protocolos no fueron publicados.
En base a los resultados de los estudios anteriores, es evidente que la investigación con animales adolece también del sesgo de publicación, contribuyendo al sesgo del conocimiento científico general y a sus efectos negativos (sobreestimación de efectos, gasto inútil de recursos, entre otros). En el ámbito de la experimentación animal también conlleva varios cuestionamientos éticos relacionados con el uso de animales en investigación. Los estudios realizados con animales cuyos resultados no se publican pierden su justificación de ampliar el conocimiento científico, uno de los criterios en los que se basa el análisis costo-beneficio para su aprobación. También puede conllevar a la duplicación innecesaria de experimentos, y por tanto del uso de animales, contradiciendo el principio de reducción.
Que la cantidad de resultados no significativos publicados ha disminuido progresivamente es un hecho. Como argumenta Fanelli (2012), esto no se debe a una calidad creciente de la ciencia, sino más bien a una selectividad de las revistas de alto impacto, que ha inducido a la concepción de una analogía entre los resultados positivos y de alto impacto en la cultura científica actual. A esto hay que añadir que los científicos están cada vez más presionados a publicar en revistas de alto impacto con una alta tasa de citas para acceder a subvenciones competitivas y continuar con su investigación. Esto conlleva a que muchos de ellos escondan los resultados negativos (lo que ya en 1979 Rosenthal acuñó como "The file drawer problem") y se centren sólo en los resultados positivos.
Intentar cambiar esta perspectiva científicamente injustificada no va a ser fácil. El físico y filósofo Thomas Kuhn, cuyo interés se centraba en el proceso de transición entre paradigmas del pensamiento científico, proponía que el cambio de paradigma sólo se realizaría fácilmente cuando la evidencia en apoyo del paradigma nuevo superara a la del establecido (Kuhn, 1970). Pero incluso ante la evidencia, la comunidad científica también debe superar la tendencia humana de apoyar el status quo y la dificultad de anular las creencias preexistentes (Jost y Hunyady, 2003), más aún si se conciben los resultados negativos como asociados a estudios defectuosos o mal diseñados. Esta renuencia se percibe claramente en el artículo de Matosin et al. (2014) cuando exponen la dificultad de algunos investigadores no sólo a la hora de refutar resultados previamente publicados sino también a la hora de retractarse de su propia investigación.
¿Por qué los datos negativos no tienen el mismo valor que los datos positivos? ¿No es acaso un resultado negativo una respuesta válida a una pregunta si ésta ha sido correctamente formulada? Tal y como concluyen Matosin et al. (2014), la noción de un hallazgo negativo parece más filosófico que práctico. Quizás como proponen Riet et al. 2012, la revisión por pares debería realizarse sin aportar resultados y valorando sólo los antecedentes, la hipótesis y los métodos de manera que la aceptación no estuviera condicionada a los resultados.
Ante el sesgo de publicación ya se han puesto en marcha algunas iniciativas, como el surgimiento de revistas que publican específicamente los resultados negativos o revistas que han creado una sección específica para los datos negativos (ver Figura 1).
Sin embargo, estas revistas no resultan demasiado atractivas a los investigadores, fundamentalmente porque tienen un factor de bajo impacto lo que reduce el factor de impacto promedio del investigador, razón por la que muchos de ellos prefieren abstenerse de publicar en las mismas.
En base a los efectos positivos obtenidos desde 2004 cuando el Comité Internacional de Editores de Revistas Médicas estableció el registro previo de estudios clínicos como requisito a cualquier publicación en las revistas (De Angelis et al., 2004), el mantenimiento de un registro centralizado de experimentos realizados con animales similar ha sido otra de las propuestas para aumentar la transparencia. En enero de 2019, el Centro Alemán para la Protección de Animales de Laboratorio lanzó la plataforma ASR (Animal Study Registry, www.animalstuudyregistry.com). A pesar del apoyo positivo recibido a esta iniciativa, el número de registros ha sido bajo y se advierte cierta reserva por parte de los científicos al registro (Bert et al., 2019). Un estudio anterior de Wieschowski et al. (2016) ya evidenció que, si bien los científicos consideraban que un registro centralizado sería positivo para mejorar la rigurosidad de los estudios, la selectividad de las publicaciones, la difusión de la transparencia, la realización de meta-análisis y la aplicación de los principios de las 3Rs, también mostraban reticencias relacionadas con la propiedad intelectual y el aumento de las burocracia. Es por tanto esencial establecer medidas para incentivar a los científicos al uso de estos registros, para lo que parece imprescindible la implicación de las entidades y organismos financiadores de proyectos de investigación. Aunque han surgido algunas iniciativas al respecto (por ejemplo, desde el Wellcome Trust o el programa Horizon 2020 de la Comisión Europea) es necesaria una mayor implicación por parte de estos organismos para asegurar una mejora en la transparencia científica.
Es importante establecer líneas de actuación que conciencien a la comunidad científica de que los resultados negativos proporcionan información relevante y que, por tanto, contribuyen significativamente en el conocimiento científico general. La reversión de la concepción actual de los resultados negativos necesita no sólo un cambio en las políticas editoriales sino también un cambio en la cultura científica. Y para ello se requiere la implicación de todos los participantes. En el ámbito de la experimentación animal, ello contribuirá a la aplicación de las 3Rs y a una adecuada valoración ética de los estudios con animales.
3. La no reproducibilidad de los procedimientos con animales
Como hemos comentado anteriormente, otro de los retos que la comunidad científica debe afrontar es la denominada "crisis de reproducibilidad o de replicación", que ocurre cuando los experimentos científicos no pueden reproducirse o replicarse en investigaciones posteriores. Según una encuesta realizada por Baker en 2016 a 1500 científicos, el 90% reconoció en mayor o menor medida la existencia de esta crisis de reproducibilidad, el 70% confirmaron no haber podido reproducir al menos un experimento de otro científico y el 50% no haber podido reproducir uno de sus propios experimentos.
Aunque existen múltiples causas a la crisis de la reproducibilidad (ver por ejemplo Begley y Ioannidis, 2015), no cabe duda de que una de ellas es la ausencia de la información necesaria y precisa de la que adolecen una gran parte de las publicaciones científicas para permitir una evaluación crítica adecuada y su repetición.
El progreso científico debe avanzar probando nuevas ideas mediante estudios diseñados apropiadamente. Pero no menos importante es que los resultados de estos estudios sean descritos de forma transparente y precisa, de manera que se pueda evaluar la validez e importancia de los hallazgos científicos y que la comunidad científica pueda basar futuras líneas de investigación en una metodología válida y fiable. Una valoración crítica adecuada de estos estudios sólo se puede realizar si la metodología y los resultados están detallados exhaustivamente. Esto es particularmente necesario cuando se trata de investigación con animales. Los experimentos deben contener un nivel de detalle de la metodología y los resultados que permitan un análisis crítico en profundidad de manera que se evite la realización de experimentos redundantes o que no puedan ser replicados cuando se utilizan como base de investigaciones posteriores (Festing y Altman, 2002). El uso de animales en estudios mal diseñados y los esfuerzos para reproducir tales estudios representan un fracaso en la aplicación de las 3Rs y tiene un coste significativo tanto económico como ético (Freedman et al., 2015).
Para afrontar esta problemática, el NC3Rs (National Centre for the Replacement, Refinement and Reduction of Animals in Research, una organización científica patrocinada por el gobierno del Reino Unido) encargó la realización de una revisión sistemática sobre la calidad, el diseño experimental y el análisis estadístico de los estudios realizados con animales. Kilkenny et al. (2009) llevaron a cabo esta revisión en una muestra de 271 artículos científicos con animales de laboratorio, publicados mayoritariamente entre 2003 y 2005. La muestra se limitó a estudios financiados con fondos públicos británicos y/o estadounidenses realizados con distintas especies de animales, y que abarcaban distintos ámbitos de investigación (comportamiento, dietas, medicamentos, pruebas químicas y estudios inmunológicos, entre otros). Sus resultados mostraron que el 60% de las publicaciones revisadas omitían información esencial de algún tipo. El 41% de los estudios no explicitaban la hipótesis u objetivo del estudio, ni el número y características de los animales utilizados. El 30% de las publicaciones cuyas conclusiones se basaban en análisis estadísticos no describían el método utilizado ni presentaban los resultados con medidas de error o variabilidad.
Estos resultados son congruentes con otras revisiones anteriores en las que se hallaron defectos en aproximadamente el 30% de los estudios analizados en relación al diseño experimental (McCance, 1995), al número de animales utilizados (Smith et al., 1997) o a las condiciones experimentales (Granados-Zuniga, 1997).
Parece por tanto clara la necesidad de establecer una estandarización de la información necesaria que todo estudio con animales debe contener y que sirva de pauta tanto a los autores como a los revisores de los manuscritos. Aunque ha habido varias iniciativas en este sentido (ver Alfaro, 2005), el estudio promovido por NC3Rs nos indica que no han alcanzado el grado de implementación deseado.
A raíz de los resultados de Kilkenny et al. (2009), el NC3Rs promovió el desarrollo de las directrices ARRIVE (Animal Research: Reporting of In Vivo Experiments) con objeto de maximizar la información publicada y minimizar los estudios innecesarios (Kilkenny et al., 2010). Estas directrices se fundamentan en las desarrolladas en la Declaración CONSORT para ensayos clínicos (Schulz et al., 2010) y en la mejora evidenciada de su aplicación en la calidad y transparencia de las publicaciones (ver por ejemplo Plint et al., 2006).
Tabla 1. Lista de verificación de los 20 ítems de las directrices
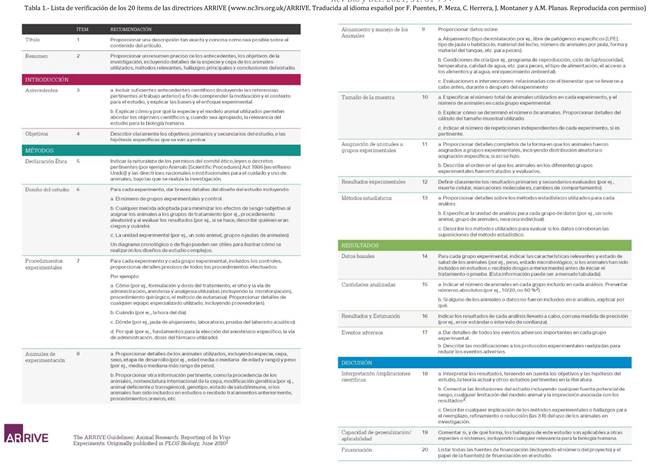
ARRIVE (www.nc3rs.org.uk/ARRIVE. Traducida al idioma español por F. Puentes, P. Meza, C. Herrera, J. Montaner y A.M. Planas. Reproducida con permiso)
Sin embargo, y a pesar del gran respaldo que han tenido las directrices ARRIVE por parte de revistas científicas, sociedades académicas y organismos de financiación, existen números estudios que continúan evidenciando la baja calidad de las publicaciones tras la aparición de las directrices ARRIVE en diferentes áreas de investigación. Por ejemplo, Leung et al. (2018) compararon un total de 236 publicaciones con el objetivo de evaluar el impacto de las directrices ARRIVE en la calidad de las publicaciones científicas. La comparación se realizó entre publicaciones en revistas que respaldaban explícitamente las directrices y las que no, y entre publicaciones anteriores a la publicación de las directrices ARRIVE (concretamente, del 2009) y las publicadas en 2015 (es decir, 5 años después de la aparición de las directrices). Concluyeron que la información aportada en las publicaciones había mejorado del 2009 al 2015 en general, sin que esta mejora fuera más evidente en las revistas que apoyaban explícitamente las directrices de las que no. Sin embargo, y a pesar de la mejora general, el dato negativo fue que todavía aproximadamente el 40% de los ítems de las directrices continuaban sin informarse debidamente en las publicaciones del 2015. Como puede observarse en la Figura 2, información tan imprescindible para la replicación como el diseño del estudio, la asignación de los animales a los distintos grupos experimentales, la información de los animales utilizados, de cómo han sido alojados y manipulados, y del tamaño de la muestra analizada, continúan aportándose deficientemente en más del 60% de las publicaciones.

Reproducida y traducida al español de Leung V, Rousseau-Blass F, Beauchamp G, Pang DSJ (2018). PLoS ONE 13(5): e0197882
Figura 2. Gráfica del porcentaje de artículos que contienen la información completa de cada uno de los ítems de las directrices ARRIVE.
Ante estos decepcionantes resultados, el NC3Rs creó un grupo de trabajo para revisar y facilitar el uso de las directrices ARRIVE (Percie du Sert et al, 2018). Este grupo de trabajo se ha centrado en tres aspectos principales: una priorización de los ítems, la publicación de un documento de Explicación y Elaboración (E&E), y la revisión de ítems específicos. Las directrices ARRIVE 2019 están en proceso de revisión por pares pero pueden consultarse en versión preprint (Percie du Sert et al, 2019a). Para facilitar la implementación de las directrices y la implicación de los editores de las revistas, proponen un total de 21 ítems divididos en dos grupos que representan dos niveles de prioridad. El "Arrive Essential 10" incluye aquellos ítems que conforman la información mínima indispensable que debe contener un artículo para poder evaluarlo con la confiabilidad necesaria y sobre los que se debería incidir inicialmente. El segundo grupo de ítems, el "Recommended SET" agregan contexto a la investigación y aumentan la calidad y la transparencia de las publicaciones. La propuesta es que este segundo grupo de ítems se vayan agregando paulatinamente mediante políticas editoriales específicas hasta que todos los ítems se informen correctamente y de manera rutinaria en los artículos.
Conjuntamente con la revisión de las directrices se ha elaborado un documento de Explicación y Elaboración (E&E) con objeto de alentar a los autores al seguimiento de las directrices y que también está accesible en versión preprint (Percie du Sert et al, 2019b).
Si esta nueva propuesta dará los resultados deseados está por ver, pero es indudable que deben adoptarse medidas que resulten en un aumento de la calidad y la transparencia de las publicaciones. Sin esto, el rigor metodológico de los estudios no puede analizarse adecuadamente, la fiabilidad de los hallazgos no puede evaluarse con fiabilidad y el trabajo no puede ser repetido o replicado por otros.
En el ámbito de la investigación animal, el acceso a todos los resultados y a la información precisa y completa de los experimentos con animales son fundamentales para la aplicación de los principios éticos de las 3Rs. Es obvio que para la mejora de estos aspectos es indispensable reforzar la formación y capacitación en buenas prácticas de investigación e integridad científica de todos los implicados. Por otra parte, la creación de registros centralizados de estudios con animales proporcionaría información más detallada sobre estos estudios, lo que, a su vez, permitiría un seguimiento más efectivo y eficiente de los proyectos por parte de los comités de ética y de las autoridades reguladoras. Además, estos registros permitirían valorar la tasa de publicación de los proyectos finalizados y establecer medidas y medios que incentiven a los investigadores a difundir la totalidad de los resultados válidos obtenidos. Sin embargo, es importante destacar que este cometido no recae únicamente de los investigadores. Las entidades financiadoras, las instituciones y los editores tienen un papel clave en el establecimiento de políticas y en la generación de medios y herramientas que promuevan los cambios de comportamiento necesarios para mejorar la transparencia en la experimentación animal.
4. Conclusión
La aprobación de proyectos de investigación con animales se basa generalmente en un análisis de daños y beneficios, en el que se sopesan los daños a los animales involucrados contra los beneficios de la investigación para la sociedad. Si los resultados de la investigación no se publican o no se publican con el suficiente detalle, incluso habiéndose realizado y obtenido de manera rigurosa, el análisis de daños-beneficios se ve socavado.
El acceso a los resultados negativos y la información precisa y completa de los estudios son imprescindibles para una adecuada implementación de los principios éticos de reemplazo, reducción y refinamiento que rigen la experimentación animal, así como para un adecuado balance ético de los proyectos de investigación con animales. Los problemas de sesgo de publicación y de reproducibilidad existentes en el ámbito experimental deben afrontarse con estrategias compartidas por parte de todos los implicados (científicos, equipos editoriales, organismos gubernamentales y financiadores) de manera que se genere un cambio en la cultura científica que valore los resultados negativos como parte del conocimiento científico general y la calidad de la información aportada en los estudios como esencial para la reproducibilidad de los mismos y el avance del conocimiento.















