1.- INTRODUCCIÓN
La entrada de España en la OTAN en el año 1982, integró a nuestras Fuerzas Armadas en multitud de misiones militares que han supuesto un verdadero desafío para la sanidad militar, generando la transformación de una sanidad eminentemente asistencial para los militares y sus familias, en una sanidad expedicionaria con capacidad de desarrollar sus funciones en zona de operaciones. Entre las capacidades comprometidas se encuentra la existencia de un centro de transfusión propio, cuya función principal es nutrir los bancos de sangre que vayan a ser desplegados al exterior.
Como es bien conocido, la hemorragia exanguinante es la primera causa de muerte prevenible del combatiente en los conflictos armados (1), convirtiendo así la posibilidad de transfundir hemocomponentes de manera precoz en una prestación absolutamente fundamental durante la asistencia sanitaria a las bajas generadas en las operaciones militares (2).
El envío de dichos hemocomponentes a zonas de operaciones es un reto logístico de altísimo nivel, que se complica sobremanera por la exigua fecha de caducidad de los mismos cuando son enviados en fresco (un pool de plaquetas frescas almacenadas a temperatura ambiente tiene una caducidad de siete días y una unidad de concentrados de hematíes frescos almacenados a 4ºC tiene una caducidad de cuarenta y dos días). La cadena logística, en muchos casos, no puede asumir tiempos tan cortos de transporte desde territorio nacional. El caso de los pool de plaquetas frescas almacenadas a temperatura ambiente, es absolutamente crítico, no solo debido a su corta vida de almacenaje, también porque el almacenamiento debe producirse con bandejas dinámicas que mantienen las bolsas en un balanceo constante (3).
En todos los algoritmos de tratamiento del paciente politraumatizado se contempla la transfusión como el tratamiento de elección frente a la hemorragia exanguinante. Normalmente la secuencia propuesta de manera habitual es la de 1:1:1, siendo las unidades concentrado hematíes, pool de plaquetas y plasma fresco congelado (4).
La gran dificultad para trasladar dichos hemocomponentes a las zonas más remotas, ha llevado a diversos grupos de profesionales sanitarios a liderar investigaciones que busquen opciones definitivas a este problema. En la literatura se encuentran diversas propuestas, desde el walking blood bank («banco de sangre andante») con reserva de sangre completa grupo cero positivo con título bajo de aglutininas naturales, hasta la creación de hemocomponentes y hemoderivados liofilizados sin exigencias de temperatura en su almacenamiento (5).
Ante las «aristas» legales de algunas de las opciones y la complejidad técnica de otras, los distintos países se han apoyado en los estudios existentes para los hemoderivados congelados, tanto plaquetas como hematíes, con el objetivo de mantener la capacidad transfusora en zonas remotas. Aunque dichos artículos de investigación médica avalan la seguridad y la durabilidad, la evidencia de su eficacia en la terapia activa frente a la hemorragia es escasa. La principal hipótesis planteada es que el proceso de congelado y descongelado, pudiera impactar en la funcionalidad plaquetar de forma negativa, disminuyendo su capacidad para la formación del coágulo.
Últimamente el empleo de las plaquetas conservadas en frío se ha convertido en una opción terapéutica «muy atractiva» por diversas razones. La principal es la extensión de la vida útil más allá de los siete días con los que contábamos previamente con plaquetas frescas, pero además se ha demostrado que reduce la posibilidad de crecimiento bacteriano aumentando la seguridad transfusional. También se ha demostrado que la exposición al frío (4ºC) de manera prolongada (veintiún días) produce cambios morfológicos y moleculares que favorecen la activación de mecanismos internos que implementan la funcionalidad plaquetar, convirtiéndolas en agentes más activos frente a la hemorragia. Esto tiene un coste de oportunidad: la eliminación precoz de dichas plaquetas en el torrente circulatorio (6).
A lo largo de los numerosos conflictos acontecidos durante el pasado siglo, se han producido importantes cambios en el tratamiento hemoterápico a las bajas junto con una evolución de la doctrina sanitaria respecto a este tema.
Hasta el atentado del 11 de septiembre de 2001 que provocó el comienzo de la guerra contra el terror, las estrategias de resucitación que se empleaban en el Reino Unido, en los Estados Unidos y los demás ejércitos de la coalición, mantenían claramente los fluidos y la hipotensión permisiva como base del soporte vital avanzado en primera línea y el transporte, y reservaban la transfusión para la atención en el hospital de campaña.
Basado en los datos obtenidos entre los años 2003 y 2005, la doctrina del Damage Control Resuscitation comienza a incluir el uso de la transfusión de sangre y hemocomponentes en primera línea, siempre y cuando se detecte una hemorragia potencialmente grave, aunque se sepa que este no es un tratamiento definitivo. La restauración del volumen sanguíneo, el mantenimiento de la temperatura corporal y el uso de hemostáticos minimizan la coagulopatía del politraumatizado (7).
Ya en 2007 se publica un editorial totalmente revolucionario en Journal of Trauma que define la transfusión de sangre como el mejor tratamiento contra la coagulopatía del paciente crítico, y basa sus razonamientos en los datos obtenidos por la experiencia de la sanidad militar en Irak y Afganistán (8).
En ese momento se comienzan a realizar propuestas y a ensayar viejas combinaciones de hemocomponentes con vistas a encontrar la mejor manera de realizar la resucitación. Se propone una escala de factores predictores para transfusión masiva, con la intención de que se pueda identificar qué pacientes la necesitan de manera inmediata, antes de llegar al centro hospitalario o a un segundo escalón sanitario (9).
Uno de los estudios más importantes para definir una secuencia de hemocomponentes es el PROPPR, ya que con un diseño randomizado concluyó que los pacientes que eran sometidos a la secuencia de 1 concentrado de hematíes, 1 unidad de plasma fresco congelado y 1 pool de plaquetas [1:1:1] tenían menos incidencia de muerte en las tres primeras horas que los pacientes que eran sometidos a la secuencia [1:1:2]. Además, era estadísticamente significativo que los pacientes morían menos en las primeras 24h a causa de la hemorragia exanguinante (10). Todos estos avances suponen una mejoría de la práctica clínica, pero no eliminan los problemas logísticos que acarrea el despliegue de la capacidad transfusora a zona de operaciones.
Sin embargo, la resucitación de viejas técnicas, como la transfusión de sangre completa tiene la ventaja de ser per se el fluido que se está perdiendo. Comienza a fraguar la idea en diversos grupos de investigación de que la vuelta a la era del prefraccionamiento puede ser una opción válida y se comienza a investigar en ello (4).
Esta vieja terapia tiene la ventaja de que individuos correctamente «fenotipados» desde territorio nacional podrían donar en zona de operaciones, convirtiéndose de facto en un banco de sangre andante, que pudiera usarse asiduamente o solo en caso de emergencia (5). En 2014, las guías de práctica clínica TCCC Tactical Combat Casualty Care aprueban la sangre completa como el mejor fluido a utilizar ante el shock hemorrágico (11). En los estudios que se realizan, se determina un perfil de seguridad igual que en la terapia fraccionada, sin complicaciones graves en los ensayos clínicos, lo que conduce a introducir la indicación de transfundir sangre completa del tipo cero positivo con títulos bajos de aglutininas naturales antiA y antiB (12).
En condiciones extremadamente difíciles y remotas, como en una intervención de un equipo operativo de operaciones especiales, no existe la capacidad de llevar unidades de sangre almacenada, aunque sí de buddy transfusion, el ejército israelí y el francés han desarrollado su propio plasma congelado liofilizado y se utilizan con éxito hasta el inicio de la transfusión (13).
Durante los últimos conflictos, en algunos protocolos de transfusión masiva se ha empleado la técnica diagnóstica de la tromboelastometría (TE). La TE es una prueba que muestra las propiedades viscoelásticas de la sangre desde la formación del coágulo hasta su fibrinólisis, evalúa la función plaquetaria y se correlaciona con el proceso fisiológico de la hemostasia de una forma rápida. Puede ser una herramienta diagnóstica útil en el paciente en estado crítico, especialmente en aquellas situaciones que cursan con trastornos en la coagulación. En 2008, un estudio del departamento de sanidad británico concluyó, que esta técnica reduce la necesidad de transfusiones y disminuye los requerimientos de hemoderivados, mejorando la relación coste/beneficio (14). Las sanidades militares alemana, británica y estadounidense contaban con dispositivos ROTEM® (Rotational Thromboelastometry, Werfen Pentapharm GmbH) en sus instalaciones sanitarias de campaña desplegadas en Afganistán. El empleo de TE en ambiente militar ha sido descrito en un estudio que concluye que esta prueba detecta más anomalías en la coagulación que los test de TP y TTPA, puede ser una herramienta valiosa en el diagnóstico y tratamiento de la hemorragia masiva y puede predecir a los 5 min del test (A5) un estado de hipocoagulabilidad con sensibilidad/especificidad de 0,98/0,69 (15).
2.- OBJETIVOS
El objetivo principal de este estudio es evaluar in vitro la capacidad hemostática de los diversos concentrados de plaquetas frías, congeladas y frescas mediante pruebas de coagulación estandarizadas y tromboelastometría, esclareciendo si se mejora significativamente la contribución al coágulo con los pool de plaquetas frías (conservadas a 4ºC), en comparación con las plaquetas frescas y congeladas.
El objetivo secundario es determinar qué ventajas supondría la incorporación de las plaquetas frías en la medicina transfusional realizada en el medio militar.
3.- MATERIAL Y MÉTODOS
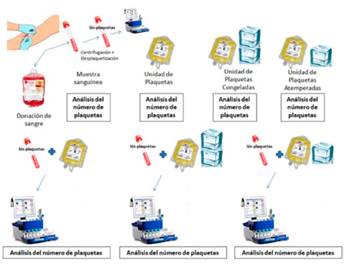
Se diseñó un estudio experimental para comparar in vitro plaquetas frías (refrigeradas), congeladas y frescas (convencionales), analizando su rendimiento y efectividad mediante análisis sistemático de sangre, mecanismos de laboratorio de coagulación rutinarios (Tiempo de Protrombina, Actividad de Protrombina, Tiempo de Cefalina y Fibrinógeno) y Tromboelastometría rotacional (ROTEM).
Se reclutó una muestra de 20 pacientes sanos, tras informarles por escrito y conseguir el preceptivo consentimiento informado (CI) donaron 6 tubos con citrato de 10 mililitros (ml) de sangre por paciente.
Se empleó el siguiente protocolo:
Se realizó hemograma, pruebas de coagulación convencionales para evaluar las vías extrínsecas e intrínsecas de la coagulación, y ROTEM para evaluar la formación de coágulos a través de la vía extrínseca utilizando factor tisular recombinante y fosfolípidos como disparadores (test EXTEM) y con inhibidores de la función plaquetar (test FIBTEM) en uno de los tubos de 10 ml de sangre (INICIAL), con el fin de obtener una medida inicial que sirva de punto de partida y comparador original.
Se agruparon los otros 5 tubos en un macrotubo de 50 ml de manera cuidadosa.
Se centrifugó el tubo de 50 ml en una centrífuga Heraeus Minifuge T con un contrapeso con el mismo volumen de suero fisiológico para posteriormente separar la placa leucoplaquetar mediante pipeteo convencional siempre realizado por el mismo operador con el fin de disminuir cuantitativamente el número de plaquetas en el citado tubo la sangre simulando un consumo debido a una hemorragia masiva.
-
Tras mezclado manual cuidadoso posterior, se rellenan 4 tubos de citrato de 3,5 ml de capacidad con un volumen de 3,3 ml cada uno:
Tubo 1 (BASAL): se realizó hemograma, pruebas de coagulación y ROTEM (EXTEM-FIBTEM) sin ninguna otra manipulación del contenido, para determinar las características basales de la sangre «trombopenizada» in vitro.
Tubo 2 (NORMAL): se extrajeron 300 microlitros (mcL) de volumen y se añadieron 300 mcL de plaquetas frescas conservadas a temperatura ambiente. Se realizó hemograma, pruebas de coagulación y ROTEM (EXTEM-FIBTEM).
Tubo 3 (ATEMPERADA): se extrajeron 300 mcL de volumen y se añadieron 300 mcL de plaquetas conservadas a 4ºC durante un intervalo de 15 a 21 días dependiendo de la unidad. Se realizó hemograma, pruebas de coagulación y ROTEM (EXTEM-FIBTEM).
Tubo 4 (CONGELADA): se extrajeron 300 mcL de volumen y se añadieron 300 mcL de plaquetas conservadas a -22ºC durante 1 año. Se realizó hemograma, pruebas de coagulación y ROTEM (EXTEM-FIBTEM).
El volumen de plaquetas transferidas para simular una transfusión real sobre un paciente (300 mcL) se ha calculado teniendo en cuenta que sería equivalente a una transfusión de 1,3 U/Kg para un individuo con una volemia de 70 ml/kg de peso.
Se utilizaron pool de plaquetas cedidos por el Centro de Transfusión de las Fuerzas Armadas. Dicho organismo está certificado según la normativa ISO y por el Organismo de Certificación de la Calidad en Transfusión, Terapia Celular y Tisular CAT por la normativa procedimientos cumplen estándares con certificaciones en vigor.
Los pool de plaquetas fueron utilizados para este estudio antes de que expirara su fecha de caducidad, establecida según la normativa en 5 días para los pool de plaquetas frescas no inactivados, 7 días para los pool de plaquetas frescas inactivados, 21 días para los pool de plaquetas frescas inactivados refrigerados y un año para los pool de plaquetas congeladas en el etiquetado del envase. Dicha fecha de caducidad se genera de manera automática por el sistema informático Delphy del centro de transfusión y se refleja claramente en el etiquetado de los pool tras su envasado.
Los pool de plaquetas frescas y refrigeradas se encuentran suspendidas en plasma y están inactivadas con riboflavina. A los pool de plaquetas congeladas se le añade Dimetil Sulfóxido (DMSO) previo al proceso de congelación, posteriormente se extrae parte del sobrenadante y no se emplea ningún conservante.
Los hemogramas se realizaron en un analizador SISMEX XN 1000V del laboratorio del centro de transfusión. Se eligieron estos analizadores porque al realizar dichas mediciones mediante tecnología óptica, se evita cualquier tipo de error en la medición de la impedancia causados por eritrocitos fragmentados o claramente microcíticos.
Las coagulaciones rutinarias (Tiempo de Protrombina, Actividad de Protrombina, Tiempo de Cefalina y Fibrinógeno) se realizaron en analizadores Werfen ACL TOP 50 Series del laboratorio de hemostasia del Servicio Hematología y Transfusión del centro hospitalario.
El análisis EXTEM y FIBTEM se realizó en un analizador Werfen ROTEM Sigma en cesión al Centro de Transfusión de las Fuerzas Armadas. Los reactivos se financiaron con una beca de investigación. Teniendo en cuenta la poca flexibilidad que permite el procedimiento y para disminuir la variabilidad interoperador, todas las mediciones fueron efectuadas siempre por el mismo personal experimentado que en todo momento siguió escrupulosamente las indicaciones del fabricante.
Para determinar de manera lo más precisa posible la aportación de las plaquetas a la cinética de la coagulación, se realizó el test FIBTEM que lleva adosado un inhibidor de la función plaquetar, de esta manera se ha podido comparar con el test EXTEM en todos los parámetros recopilados.
Se registraron las variables Tiempo de Coagulación (Clotting Time [CT] que refleja el tiempo hasta alcanzar 2 mm de amplitud desde el inicio de la prueba, en s), Tiempo de Formación del Coágulo (Clot Formation Time [CFT] tiempo que tarde en alcanzar los 20 mm de amplitud desde el CT, en s, y que refleja la dinámica del proceso de coagulación), y la Máxima Firmeza del Coágulo (Maximum Clot Firmness [MCF] longitud en mm).
La elasticidad máxima del coágulo (Maximum Clot Elasticity [MCE]) se calculó a partir de la MCF de EXTEM y FIBTEM para adaptarse a la ley de Hooke. La MCE, que es un parámetro calculado a partir de los valores de MCF, está destinado a reflejar la resistencia del coágulo y a facilitar la interpretación parámetro en caso de altas amplitudes MCF. La fórmula de cálculo es la siguiente MCE = (100 x MCF) / (100-MCF) dyne cm -2.
Para evaluar la contribución plaquetaria a la fuerza del coágulo se puede deducir mediante la siguiente fórmula: MCE plaquetar (MCEp) = MCE EXTEM - MCE FIBTEM.
La contribución de las plaquetas transfundidas a la fuerza del coágulo también puede ser calculada mediante la siguiente fórmula: MCE (frescas / refrigeradas / congeladas) = MCEp (post-transfusión) - MCEp plaquetar (basal).
Las MCE se ajustaron al recuento de plaquetas en el cálculo con una ratio llamada Índice de Plaquetas (Platelets Index [IP]): PI = MCEp / Recuento de plaquetas (x10e9/L).
Se agruparon los resultados en hojas de recogida de datos prediseñadas y posteriormente se trasladaron a una tabla de Microsoft Excel (Versión 16.50) de cara a su exportación posterior a SPSS (Versión 24) para su análisis estadístico.
Para la comparativa, los datos recogidos de la realización del ROTEM entre muestras basales y experimentales (tras transfusión de plaquetas) se distribuyeron normalmente y se analizaron utilizando la prueba T de Student pareado y fueron analizadas por regresión lineal múltiple, ajustando y no ajustando según el recuento de plaquetas.
La significación estadística se estableció en p <0,05. Los datos se presentan como medias más/menos desviaciones estándar, con números o porcentajes, según corresponda.
Los cálculos del tamaño de la muestra mostraron que una prueba con un error de tipo I (de dos caras) de 0,05, tendría un 87,5 % de potencia para detectar una diferencia del 10 % en valores de MCF EXTEM (después de una transfusión de plaquetas frescas vs refrigeradas vs congeladas, en comparación con el valor basal) con un tamaño de muestra de veinte en cada grupo.
Se consiguió la aprobación por parte del Comité de ética de investigación con medicamentos (número CEIm 57/16) y del Comité de investigación del hospital (46/2016).
4.- RESULTADOS
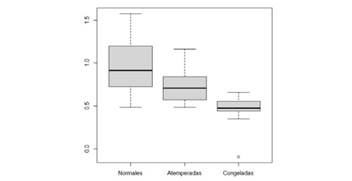
La media del recuento de plaquetas de muestras con plaquetas congeladas es superior de forma significativa al de plaquetas atemperadas y normales. Se sigue el siguiente orden decreciente: congeladas, normales y atemperadas ((figura 1 y (2).
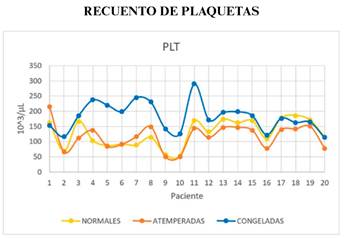
Figura 1. Gráfico en el que se describe el recuento de plaquetas dependiendo del tipo de unidad de plaquetas (normales, atemperadas y congeladas).
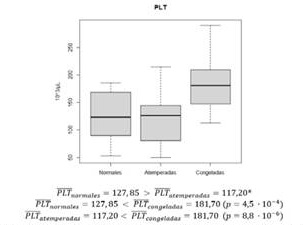
Figura 2. Gráfico en el que se describe la media e intervalo del recuento de plaquetas dependiendo del tipo de unidad de plaquetas (normales, atemperadas y congeladas).
La media de los tiempos de protrombina es más alargada en la muestra con plaquetas congeladas que en las muestras con plaquetas atemperadas y normales.
La media del parámetro EXTEM CT es inferior de forma significativa en la muestra con plaquetas congeladas respecto al de plaquetas atemperadas y normales (figura 3 y 4).
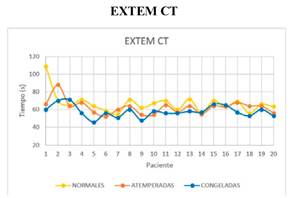
Figura 3. Gráfico en el que se describe el parámetro EXTEM CT de las muestras a las que se han transfundido plaquetas normales, atemperadas y congeladas.
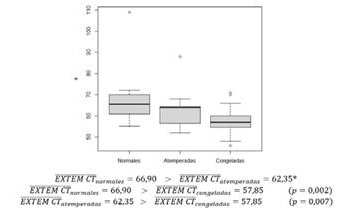
Figura 4. Gráfico en el que se describe la media e intervalos del parámetro EXTEM CT de las muestras a las que se han transfundido plaquetas normales, atemperadas y congeladas.
La media del parámetro EXTEM CFT es inferior de forma significativa en la muestra con plaquetas normales respecto al de plaquetas congeladas. La media del parámetro EXTEM CFT es inferior de forma significativa en la muestra con plaquetas congeladas respecto al de plaquetas atemperadas (figura 5 y 6).
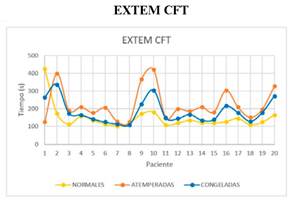
Figura 5. Gráfico en el que se describe el parámetro EXTEM CFT de las muestras a las que se han transfundido plaquetas normales, atemperadas y congeladas.
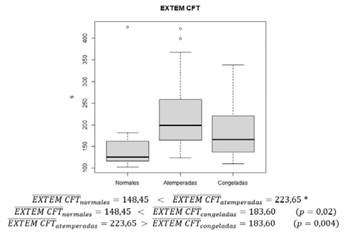
Figura 6. Gráfico en el que se describe la media e intervalos del parámetro EXTEM CFT de las muestras a las que se han transfundido plaquetas normales, atemperadas y congeladas.
La media del parámetro EXTEM A20 es superior de forma significativa en la muestra con plaquetas normales respecto al de plaquetas atemperadas. La media del parámetro EXTEM A20 es superior de forma significativa en la muestra con plaquetas congeladas respecto al de plaquetas atemperadas.
La media del parámetro EXTEM MCF es superior de forma significativa en la muestra con plaquetas normales respecto al de plaquetas congeladas. La media del parámetro EXTEM MCF es superior de forma significativa en la muestra con plaquetas normales respecto al de plaquetas atemperadas.
La media del parámetro EXTEM LM es superior de forma no significativa en la muestra con plaquetas congeladas respecto al de plaquetas atemperada. La media del parámetro EXTEM MCF es superior de forma significativa en la muestra con plaquetas atemperadas respecto al de plaquetas normales.
La media del parámetro FIBTEM A20 es superior de forma no significativa en la muestra con plaquetas congeladas respecto al de plaquetas normales y atemperadas.
La media del parámetro FIBTEM MCF es superior de forma no significativa en la muestra con plaquetas atemperadas respecto al de plaquetas normales. La media del parámetro FIBTEM MCF es superior de forma no significativa en la muestra con plaquetas congeladas respecto al de plaquetas atemperadas.
La media del parámetro MCE plaquetar es superior de forma significativa en la muestra con plaquetas normales respecto al de plaquetas atemperadas. La media del parámetro MCE plaquetar es superior de forma significativa en la muestra con plaquetas normales respecto al de plaquetas congeladas.
La media del parámetro MCE P AT es superior de forma significativa en la muestra con plaquetas normales respecto al de plaquetas atemperadas. La media del parámetro MCE P AT es superior de forma significativa en la muestra con plaquetas normales respecto al de plaquetas congeladas (figura 7 y 8).
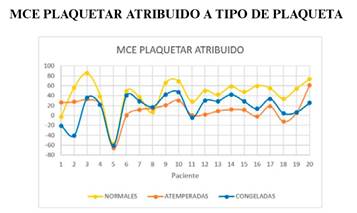
Figura 7. Gráfico en el que se describe el parámetro MCE plaquetar atribuido de las muestras a las que se han transfundido plaquetas normales, atemperadas y congeladas.
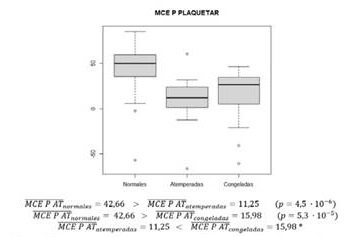
Figura 8. Gráfico en el que se describe la media e intervalos del parámetro MCE plaquetar atribuido de las muestras a las que se han transfundido plaquetas normales, atemperadas y congeladas.
La media del parámetro PI es superior de forma significativa en la muestra con plaquetas normales respecto al de plaquetas atemperadas. La media del parámetro MCE PI es superior de forma significativa en la muestra con plaquetas atemperadas respecto al de plaquetas congeladas (figura 9 y 10).
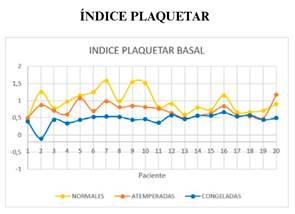
Figura 9. Gráfico en el que se describe el parámetro índice plaquetar de las muestras a las que se han transfundido plaquetas normales, atemperadas y congeladas.
5.- DISCUSIÓN
Los pool de plaquetas se obtienen mediante aféresis de un mismo paciente o combinando plaquetas fraccionadas de unidades de sangre completa de varios pacientes. En el ámbito hospitalario, lo habitual es encontrar plaquetas estándar conservadas a temperatura ambiente en un armario con bandejas móviles que las mantienen en permanente agitación. El talón de Aquiles de esta forma de almacenamiento es el crecimiento bacteriano potencial (16).
A pesar de estrategias para evitarla, la caducidad máxima que nos podemos permitir con este sistema es de siete días y esto supone, en muchos casos una inadecuada eficiencia por necesidad de mantener un stock permanente de emergencia. Además, en áreas aisladas o zonas de operaciones, mantener el suministro se convierte en un verdadero milagro logístico (17).
Ante la evidencia científica existente, mantener esta capacidad a expensas de un único producto plaquetar almacenado a temperatura ambiente para todo tipo de pacientes y circunstancias, se está volviendo tremendamente controvertido. Quizá sea el momento de potenciar las plaquetas congeladas y las atemperadas, ya que estudios recientes han demostrado que ambas poseen un perfil procoagulante que proporciona una hemostasia más rápida en pacientes con sangrado activo (18).
La sanidad militar holandesa fue pionera en la administración de hemocomponentes congelados en zona de operaciones tanto en ambiente terrestre como marítimo. En el año 2001, consiguió disponer de unidades de plasma fresco congelado y de plaquetas congeladas a -80ºC y tres años más tarde también hematíes congelados. Desde 2002, se han empleado estos componentes sanguíneos en sus unidades sanitarias desplegadas en Bosnia-Hercegovina, Liberia, Irak, Pakistán, Somalia y Afganistán. En este último conflicto Holanda envió a zona de operaciones cuatro bancos de sangre en contenedores, tres de ellos para suministrar hemocomponentes congelados a diferentes unidades médicas de tratamiento aliadas (canadienses, estadounidenses, británicas y alemanas) y el cuarto para consumo propio en el Role 2 Enhanced holandés desplegado en Tarin Kown.
El número de pacientes que han sido transfundidos con hemocomponentes congelados hasta 2014 asciende a 1.035. Concretamente se han empleado 2.194 unidades de concentrados de hematíes congelados, 3.072 de plasma fresco congelado y 1.143 de plaquetas congeladas. Asimismo, se han utilizado 871 unidades de concentrado de hematíes estándar durante el mismo periodo de tiempo. Más del 95 % de las transfusiones se realizaron en pacientes que presentaban traumatismos. El 14 % de ellos fueron subsidiarios de recibir una transfusión masiva. La supervivencia en este grupo mejoró del 47 % al 80 % tras introducir en 2007 un protocolo de hemorragia masiva basado en la terapia 1:1:1.
Su banco de sangre depende fundamentalmente de las donaciones realizadas por voluntarios civiles. Este centro militar es responsable del procesamiento, congelación, almacenamiento, dispensación y administración de los citados hemocomponentes congelados. Asimismo, otras de las funciones encomendadas son mantener el control de calidad, el aprovisionamiento y la investigación médica. Finalmente, también se desarrollan en él labores docentes para entrenar a médicos y técnicos de laboratorio en el proceso de congelamiento de los hemocomponentes y su empleo en situaciones de hemorragia masiva.
El procedimiento militar holandés para la congelación de plaquetas comienza en un centro de transfusión civil con la donación por aféresis de concentrados de plaquetas frescas leucodeplecionadas y almacenadas a 22ºC con agitación durante menos de 18 horas. En un segundo paso, estas unidades son enviadas al banco de sangre militar. Allí las plaquetas son procesadas empleando DMSO como crioprotector para prevenir la muerte celular durante el congelado. Posteriormente y antes de las 24 horas de la donación, los concentrados de plaquetas con DMSO se centrifugan y son congelados a -80ºC empleando un congelador mecánico equipado con un sistema de alarma y con capacidad de administración de CO2 para minimizar de forma temporal una posible rotura térmica en el dispositivo. Las unidades son transportadas con hielo seco en contenedores que permiten albergar un máximo de diez unidades durante un periodo de 5 a 7 días. La temperatura durante el transporte está monitorizada mediante un termómetro. Cuando se llega a zona de operaciones, las unidades son depositadas en un congelador a -80ºC, también con su correspondiente alarma y capacidad de aportar CO2.
Cuando se solicita el empleo de plaquetas congeladas para la transfusión de un paciente, el hemocomponente se atempera mediante un baño de agua con una temperatura de 30-32ºC durante cinco minutos, pudiendo ser administradas a continuación. Cada unidad de plaquetas contiene menos de 1 gramo de DSMO, siendo la dosis máxima recomendada de DMSO de 1 gramo por unidad de plaquetas. Una cantidad superior de DMSO podría ocasionar en el paciente cefalea, náuseas y vasoconstricción.
La disponibilidad de plaquetas congeladas puede generar un inicio y formación del trombo satisfactorio en el lugar de la hemorragia. Un estudio empleando tromboelastometría y flujocitometría ha demostrado cambios en el fenotipo plaquetario que generan un inicio más rápido de la trombogénesis y una reducción de la fortaleza del coágulo, posiblemente relacionada con un alto contenido de plaquetas activadas y micropartículas en los hemoderivados congelados.
El control de calidad recae en ambos centros, el civil y el militar. El primero es responsable del control de calidad del donante, de la donación y depleción leucocitaria. Mientras, el segundo vigila la producción, almacenamiento, transporte, descongelado y administración de los hemocomponentes congelados. La sanidad militar holandesa emplea entre el 1 y 10 % de las unidades para el control de calidad (19).
El número de reacciones transfusionales encontradas tras la administración de hemocomponentes congelados es escasa. Algunos autores consideran que este hecho puede ser debido a la realización de una depleción leucocitaria, a que todos los productos celulares son congelados en menos de 24 horas tras la donación y a que la aféresis plaquetaria está monitorizada para evitar la contaminación bacteriana (20).
Noorman (21) analiza el empleo de hemocomponentes congelados transfundidos a 262 bajas en combate atendidas en el Role 2 Enhanced holandés entre agosto de 2006 y octubre de 2010. Del total de la muestra, el 91,2 % eran varones, el 73,9 % tenían más de 16 años y el 90,8 % eran afganos. El mecanismo lesional más prevalente fue la explosión (43,4 %), seguido de las heridas por arma de fuego (41,2 %). De 3.060 unidades transfundidas (2.400 congeladas), únicamente se notificó una reacción alérgica transfusional moderada que cursó con urticaria y según el autor, probablemente fue debida a la transfusión de plaquetas. La media de tiempo tras la donación y la administración fue de un año. A lo largo del estudio, el tiempo desde la llegada de la baja al Role 2E hasta la transfusión de la primera unidad de plaquetas congeladas fue disminuyendo. Tras la introducción del protocolo de hemorragia masiva, el consumo de plaquetas congeladas se incrementó y la supervivencia de los heridos mejoró posiblemente debido a la corrección de la coagulopatía dilucional y/o de consumo.
La sanidad militar checa también emplea hemocomponentes congelados. Bohonek (22) describe que en el centro de transfusión de este país, las plaquetas son obtenidas por aféresis de un único donante, leucodeplecionadas, criopreservadas con DMSO al 4-6 % y almacenadas a -65ºC. Cada unidad contiene aproximadamente 300 x 109 plaquetas. Asume que el proceso de congelación induce algunos cambios morfológicos y funcionales respecto a las plaquetas estándar que provocan una creación del coágulo más rápida. Bajo sus estándares de calidad, la unidad de plaquetas congeladas tiene una caducidad de 4 años. Las plaquetas proceden de un donante del grupo 0 y se reconstituyen con plasma del grupo AB. Este proceso de reconstitución no excede los 30 minutos y no es necesario la retirada del DSMO. Una vez preparadas, el inicio de la transfusión de las plaquetas debe ser menor a 6 horas.
Es interesante conocer que la sanidad militar de este país diseñó en 2014 una unidad de hemoterapia desplegable que la capacita para suministrar hemocomponentes congelados en zona de operaciones para minimizar la dependencia del abastecimiento por vía aérea. El autor considera que el coste del vuelo es elevado, se pueden generar problemas por el almacenamiento de estos productos, es posible que las aeronaves sufran averías que retrasen la llegada de los hemocomponentes, los requerimientos legislativos y burocráticos pueden ser elevados y, finalmente, en situaciones de emergencia, el transporte aéreo, aunque flexible y efectivo, puede ser insuficiente.
La unidad desplegable permite la donación de hemocomponentes en zona de operaciones, el almacenamiento y reconstitución de todos los hemocomponentes congelados y la posibilidad de que allí se realice la donación para sangre completa. Esta unidad se ubica en un contenedor ISO-1C con fuente de energía propia y con aislamiento térmico y a polvo. Su perfil operativo permite su empleo en un rango de temperaturas desde -32ºC a 49ºC. Tiene una capacidad para albergar 150 unidades de sangre completa y entre 150 y 250 unidades de hemocomponentes congelados (23).
Las fuerzas armadas de la República Checa han desplegado unidades sanitarias en misiones en Croacia, Albania, Turquía, Afganistán e Irak suministrando más de 1.600 unidades de concentrado de hematíes y 500 unidades de plasma fresco congelado, pudiendo también realizar la donación de emergencia si la situación clínica hubiese sido requerida (24).
Un grupo de investigación médico militar checo, analizó el empleo de plaquetas congeladas en un estudio observacional, no randomizado y comparativo en pacientes politraumatizados y hemorragia exanguinante, con sangrado gastrointestinal o con otro motivo de sangrado subsidiario de ser tratado mediante terapia transfusional. Los criterios de exclusión fueron presentar comorbilidad que afectase a la hemostasis, como hemofilia, trombocitopenia, trombocitopatía o en tratamiento anticoagulante.
A todos los pacientes se les evaluó mediante parámetros como frecuencia cardiaca, presión arterial media, temperatura corporal. Asimismo, se completó el estudio con analítica sanguínea (hemograma, tiempo de protrombina, tiempo parcial de tromboplastina activada y fibrinógeno). Por último, en los pacientes politraumatizados también se estudió su gravedad mediante el índice ISS (international severity score).
Los objetivos del estudio eran analizar la supervivencia a los 30 días, la aparición de eventos adversos, la cantidad de hemocomponentes, fibrinógeno y ácido tranexámico administrados y los parámetros de laboratorio tras la transfusión.
Las unidades de plaquetas congeladas empleadas contenían más de 2.80x109 plaquetas por unidad, eran del grupo 0 y se había empleado DMSO como crioprotector retirando el sobrenadante antes del proceso de congelado. Al principio del proceso, se añadió 75 ml de DMSO al 27 %, quedando al final entre 5 y 6 % dependiendo del volumen. Las plaquetas fueron transferidas a una bolsa de criopreservación empleando un dispositivo de conexión estéril. Junto con la bolsa original de plaquetas, fueron centrifugadas durante 12 minutos a 1250g. Se empleó un extractor manual para retirar el sobrenadante de la bolsa original consiguiendo un volumen de entre 12 y 14 ml. La bolsa final fue sellada, etiquetada y congelada a -80ºC con una vida media de dos años.
Antes de la transfusión al paciente, las plaquetas congeladas fueron reconstituidas en plasma del grupo AB y atemperadas a una temperatura de 30ºC. Para la reconstitución se empleó un dispositivo de conexión estéril. Este proceso duró 30 minutos. El tiempo para que esta unidad pudiera ser transfundida fue de 6 horas.
Se seleccionaron 21 pacientes pertenecientes al grupo control, que recibieron 67 unidades de plaquetas frescas y 25 pacientes del grupo de estudio que fueron transfundidos con 81 unidades de plaquetas congeladas.
No se encontraron diferencias significativas de las características de los pacientes entre ambos grupos. Los dos grupos fueron comparables respecto a la supervivencia a los 30 días, a la administración de hemocomponentes, fibrinógeno, ácido tranexámico y eventos adversos. Respecto a los resultados analíticos tras la transfusión, se evidenció que el número de plaquetas fue superior en los pacientes transfundidos con plaquetas frescas respecto a los que habían recibido plaquetas congeladas.
Los autores concluyeron que el empleo de plaquetas congeladas era tolerable y puede ser una alternativa a las plaquetas frescas (25).
El mismo grupo de investigación (26) publicó un estudio que comparaba a 10 pacientes transfundidos con plaquetas frescas frente a 14 pacientes transfundidos con plaquetas congeladas empleando por primera vez un test viscoelástico como es el tromboelastograma (TEG). Se emplearon un total de 53 unidades de plaquetas congeladas sin encontrarse ningún efecto adverso y con el efecto clínico esperado. Las plaquetas congeladas generaron un tiempo de coágulo más breve respecto a las plaquetas frescas por lo que se infiere que presentaban una actividad procoagulante mayor, un ángulo alfa mayor y una firmeza del coágulo reducida, pero suficiente desde el punto de vista de la efectividad de la curva del TEG. No hubo diferencias estadísticamente significativas entre ambos grupos de pacientes.
En un segundo estudio (27), comparan plaquetas frescas procedentes de aféresis y plaquetas congeladas. En este caso, la muestra es algo superior ya que transfunden 81 unidades de plaquetas congeladas a 25 pacientes y 61 unidades de plaquetas frescas a 19 pacientes. Se evalúa entre otras variables, los valores analíticos del paciente antes y después de la transfusión (hemograma y coagulación), y los resultados del TEG. Entre los resultados destaca que el número postransfusional de plaquetas era superior en los pacientes que recibieron unidades de plaquetas frescas y los parámetros obtenidos en el TEG mostraban una actividad procoagulante mayor, un ángulo alfa mayor y una firmeza del coágulo reducida, todos estos resultados eran similares al estudio previo.
Neuhaus (28) describe la experiencia de la sanidad militar australiana con hemocomponentes congelados durante su despliegue en el conflicto de Afganistán. En un estudio prospectivo 158 pacientes fueron intervenidos quirúrgicamente por el equipo médico militar australiano, 17 bajas fueron transfundidas durante la intervención empleando 132 unidades de concentrado de hematíes, 75 de plasma fresco congelado y 22 de plaquetas congeladas. El mecanismo lesional prevalente fue el explosivo y el 90 % de los heridos eran afganos. La ventaja logística y los resultados clínicos obtenidos propiciaron que se iniciara el estudio para valorar la viabilidad de emplear estos hemocomponentes congelados también en el medio civil.
Hospitales civiles y militares turcos producen plaquetas congeladas como recurso estratégico bajo mandato gubernamental para mantener unos niveles mínimos de este hemocomponente. El almacenaje lo realizan a una temperatura entre -65 y -80ºC, durante un máximo de dos años y lo reconstituyen con plasma y suero salino (29).
El instituto naval de investigación de la Marina estadounidense ha desarrollado la capacidad de que en algunos buques de esa armada se disponga de plaquetas congeladas minimizando los requerimientos logísticos (30).
El Cuerpo Militar de Sanidad español ha pretendido desarrollar importantes avances en el área de la medicina transfusional en el campo de batalla. Al igual que otras sanidades militares aliadas, propuso un protocolo de hemorragia masiva intrahospitalario con terapia 1:1:1, administración precoz de ácido tranexámico, fibrinógeno y cloruro de calcio (31). Como tratamientos de segundo escalón se recomendó el empleo de complejo protrombínico y Factor VII recombinante con el objetivo de alcanzar unos objetivos fisiológicos, hematológicos y bioquímicos, y esta terapia ha sido satisfactoriamente empleada en bajas con hemorragia masiva en zona de operaciones y enfermos o heridos en territorio nacional (32).
Además, se impulsó una mejora logística que permitió el envío de plasma fresco congelado y plaquetas congeladas a zona de operaciones (33). Asimismo, se diseñó un paquete de coagulación (ácido tranexámico, fibrinógeno, complejo protrombínico y cloruro de calcio) para facilitar la administración precoz de estos componentes sanguíneos, auditándose el empleo del ácido tranexámico en bajas atendidas en la citada instalación sanitaria, encontrando una administración en el 100 % de los casos antes de las tres horas (34).
La trazabilidad de los hemocomponentes en zona de operaciones es transcendental. En un estudio se analizó el empleo de hemoderivados procedentes del Centro de Transfusión de las Fuerzas Armadas de Madrid y enviados al Role 2 español en Herat (Afganistán) desde 2008 a 2014. El 15,7 %, el 66,1 % y el 31 % de las unidades de concentrados de hematíes, plasma fresco congelado y plaquetas congeladas respectivamente, fueron empleados en el citado Role 2, mientras que el resto fue destruido. Durante este periodo de tiempo no se ha descubierto ninguna reacción transfusional según datos del CTFAS (35).
Por último, se está valorando el empleo de unidades de concentrado de hematíes congelados para futuros despliegues en zona de operaciones (36).
El almacenamiento refrigerado de plaquetas no es algo novedoso, aunque no se ha encontrado evidencia de su empleo en el medio militar. Se realizó de manera bastante frecuente como mecanismo antiinfeccioso e incluso se demostró que las plaquetas atemperadas se eliminan de la circulación mucho más rápido que las plaquetas estándar (vida útil de 2 a 4 frente a 7 a 9 días) (37).
La supervivencia de las plaquetas ha sido ampliamente investigada, y parece que la causa de su rápida eliminación es multicausal. Se ha demostrado el gran papel que juegan el frío induciendo cambios moleculares en la GPIbα, que conducen a la exposición de residuos de galactosa y N-acetilglucosamina (N-GlcNAc) en superficies plaquetarias. Estos residuos son reconocidos por el Receptor de Ashwell Morel (RAM) en los hepatocitos y macrófagos que las retiran precozmente de la circulación (38).
Varios autores apuntan a nuevas estrategias farmacológicas para prevenirlas, como los inhibidores de la sialidasa, reducir la exposición a la fosfatidilserina, introducción de agentes bloqueadores de RAM, inhibidores de caspasa o agotamiento del ácido araquidónico para ralentizar la apoptosis (39). Otros grupos han centrado su investigación en estudiar si cambios previos a la transfusión mejoran el rendimiento y la vida media de la PA, encontrando que ciclos de temperatura, ciclos combinados de 11 h a 4-6°C con 1 h de calentamiento a 37°C mejora estos aspectos secundarios a la exposición prolongada al frío (40).
Los cambios moleculares comentados anteriormente inducen en las plaquetas atemperadas modificaciones estructurales que se han denominado «lesiones por almacenamiento en frío». Se produce una modificación morfológica irreversible que conduce a formas discoides o esféricas por la pérdida del anillo de microtúbulos y la alteración de filamentos de actina. Se enlentece el metabolismo glicolítico, la reducción de gránulos y la liberación de citoquinas y la disminución de especies reactivas de oxígeno producidas por mitocondrias. Aumenta la expresión de los marcadores de activación plaquetaria (fundamentalmente CD62), lo que mejora sustancialmente la generación de MVP (41).
Estos cambios estructurales se asocian a hiperreactividad plaquetar, mejor agregación y adhesión en condiciones fisiológicas de cizallamiento, así como mayor resistencia a la lisis del coágulo, confirmándose mediante test visco-elásticos una formación del coágulo más rápida para las plaquetas atemperadas (42).
El grupo del Dr. Nair analizó la arquitectura de coágulos frescos mediante microscopía electrónica concluyendo que los procedentes de las plaquetas atemperadas son más densos, tienen fibras más delgadas que poseen en más puntos de ramificación y propiedades mecánicas superiores (43).
Wagner ha demostrado recientemente el beneficio de la refrigeración temprana constatando que las plaquetas sometidas a solo 1-2 h de temperatura ambiente antes del almacenamiento en frío, muestran niveles más bajos de lactato, niveles más altos de glucosa y pH, y mejor perfil de agregación (44).
Por otra parte, las nuevas soluciones de aditivos plaquetarios (PAS) favorecen una mejor conservación del recuento, sin perjuicio metabólico y funcional de las plaquetas, evitando también una potencial infusión de plasma incompatible, por lo que parecen los sustitutos más adecuados para plasma con vistas al almacenamiento (45).
El almacenamiento en frío reduce la vida media de las plaquetas, pero favorece su capacidad hemostática. Parece claro entonces que los pacientes sangrantes con coagulopatía de consumo, sobre todo los que padecen una hemorragia masiva, pueden beneficiarse de la formación de coágulos más fuertes, más rápido y con más resistencia a la fibrinólisis (46).
Filip y Aster descubrieron que el rendimiento de las plaquetas atemperadas era inferior al de las plaquetas estándar en una serie de 22 pacientes trombocitopénicos. Estos autores concluyeron que debe restringirse el uso de plaquetas atemperadas cuando se van a enviar plaquetas a zonas remotas (47).
Cabe destacar que la FDA ya ha concedido indicación a las plaquetas atemperadas. Concretamente en 2015, se aprueban las plaquetas atemperadas de aféresis (3 días, 1-6°C sin agitación) para la reanimación de pacientes politraumatizados con sangrado activo. En 2019 (a petición del Army Blood Program) se permite el empleo de plaquetas atemperadas almacenadas durante 14 días cuando no haya plaquetas estándar disponibles o su uso sea poco práctico; en 2020 también se otorgó al Texas Blood & Tissue Center autorización para producir y distribuir plaquetas atemperadas con una vida útil de 14 días.
Impulsado por la escasez de plaquetas causada por la pandemia de COVID-19, en abril de 2020 el Mayo Clinic Donor Center optimizó su inventario de plaquetas al permitir que las plaquetas estándar que se habían almacenado durante 5 días, fueran guardadas en frío por un periodo adicional de hasta 9 días (plaquetas atemperadas convertidas). Un total de 61 pool de plaquetas atemperadas convertidas se transfundieron a 40 pacientes sometidos a cirugía cardíaca, vascular o general, o trasplante de órgano sólido. No se registraron reacciones adversas. La hemostasia quirúrgica se consideró adecuada en todos los casos y ningún paciente requirió reintervención por sangrado en los 2 días posteriores a la transfusión (48).
Estos resultados avalan el uso de las plaquetas atemperadas retardadas para pacientes con sangrado en la práctica clínica habitual. De hecho, Wood y colaboradores habían explorado previamente esta estrategia y demostraron que los perfiles metabólicos y de activación fueron similares para plaquetas atemperadas retardadas y plaquetas atemperadas estándar (49).
Un ensayo clínico noruego comparó plaquetas estándar frente a plaquetas atemperadas durante siete días en pacientes sometidos a cirugía torácica, sin encontrar en principio diferencias significativas entre el drenaje torácico de ambos grupos. En una segunda fase aumentaron el periodo de almacenamiento de las plaquetas estándar hasta los catorce días sin que el recuento de plaquetas, el número de transfusiones, la aparición de tromboembolismo, la duración de la estancia en cuidados intensivos, y la mortalidad fueran diferentes en ambos grupos. Estos datos respaldaron la viabilidad de las plaquetas frías conservadas durante 14 días (50).
El equipo del Dr. Stolla ha evaluado recientemente el efecto del tiempo de almacenamiento en las propiedades in vitro e in vivo de las plaquetas atemperadas y de las plaquetas normales en individuos sanos, confirmando que hay una disminución progresiva en el mantenimiento del recuento plaquetar a medida que aumenta el tiempo de almacenamiento en frío. Así, mientras que la reactividad plaquetaria in vitro parece bien conservada después de un almacenamiento prolongado, se necesitan más datos para determinar que la duración del almacenamiento en frío conserva intacta la capacidad hemostática de las plaquetas atemperadas en pacientes con hemorragia activa (51).
El equipo del Dr. Braathen comparó plaquetas atemperadas en solución de aditivo de plaquetas almacenada durante 21 días en frío sin agitación, y otro grupo de plaquetas almacenadas inicialmente a 20-24°C bajo agitación durante siete días y luego otros catorce días sin agitación a 4ºC. Se cumplieron las directrices europeas stricto senso, salvo por la agitación. Las pruebas in vitro mostraron función plaquetar mejorada en plaquetas atemperadas frente a plaquetas de frío retardado, posiblemente debido a un metabolismo acelerado y un mayor consumo de glucosa inducido por el almacenamiento inicial a temperatura ambiente de 7 días (52).
Finalmente, tal como se ha expuesto, los hallazgos obtenidos en este estudio confirman una parte de los resultados conseguidos por diferentes autores en cuanto a las alteraciones tromboelastrométricas en las plaquetas atemperadas y congeladas.
En cuanto al recuento plaquetar postransfusional, se confirma que el rendimiento de las plaquetas atemperadas es el menor de todos. Las plaquetas congeladas tienen un rendimiento muy generoso y estadísticamente significativo con respecto a los otros dos tipos, probablemente influido por una concentración mayor de plaquetas por mL transfundido.
En cuanto a las pruebas de coagulación estándar, se confirma que no se encuentran influidas por la transfusión de distintos tipos de plaqueta, de hecho los tiempos de protrombina no presentan variaciones importantes, solamente la comparación entre la muestra con plaquetas congeladas y plaquetas normales es significativa, pudiendo ser debido a la menor aportación de plasma y, por consiguiente, menor aportación de factores de coagulación en las congeladas.
En cuanto al Clotting Time o tiempo hasta el inicio del coágulo, se comprueba que está acortado en las plaquetas frías y congeladas, debido al aumento de la actividad hemostática plaquetar a bajas temperaturas, sin embargo, solo resulta significativo estadísticamente al comparar la muestra con plaquetas congeladas con las otras dos.
En cuanto a la máxima firmeza del coágulo, que depende de la actividad de las plaquetas activadas con el fibrinógeno, se confirma que en las muestras con plaquetas atemperadas y congeladas se encuentra levemente reducida de manera estadísticamente significativa, aunque presenta cifras razonables en el entorno cercano a los 50 mm. No se encuentran diferencias significativas al comparar este parámetro entre las dos.
En cuanto a la máxima elasticidad del coágulo, que es un valor calculado a partir de la máxima firmeza del coágulo para facilitar la interpretación de su fortaleza, se confirma que en las muestras con plaquetas atemperadas y congeladas se encuentra levemente reducida de manera estadísticamente significativa, aunque presenta cifras razonables. No se encuentran diferencias significativas al comparar este parámetro entre las dos.
En cuanto a la máxima elasticidad del coágulo atribuída a cada tipo de plaquetas, se confirma que en las muestras con plaquetas atemperadas y congeladas se encuentra levemente reducida de manera estadísticamente significativa al comprarlas con las plaquetas estándar. No se encuentran diferencias significativas al comparar este parámetro entre las dos.
El índice plaquetar es un valor calculado para poner en relación la máxima elasticidad del coágulo con el recuento plaquetar, aquí nuestro estudio aporta una novedad muy importante: las plaquetas atemperadas mejoran significativamente esta elasticidad del coágulo por plaqueta aportada en la transfusión en comparación con las plaquetas congeladas, aunque no respecto a las plaquetas frescas.
Sin embargo, todas estas comparaciones con la bibliografía consultada son indirectas, ya que no se ha encontrado ningún estudio que compare los tres tipos de plaquetas con este medio diagnóstico.
Las principales limitaciones de este estudio es que es in vitro, con un número limitado de muestras y donde se ha empleado un único test viscoelástico.
6.- CONCLUSIÓN
Tras evaluar in vitro la capacidad hemostática mediante pruebas de coagulación estándar y tromboelastometría, las plaquetas atemperadas mejoran significativamente la máxima elasticidad del coágulo en relación al recuento plaquetar en comparación con las plaquetas congeladas pero no respecto a las plaquetas frescas.
La incorporación de las plaquetas atemperadas en la medicina transfusional en el medio militar supondría una alternativa más de tratamiento para la baja con hemorragia exanguinante y aportaría ventajas logísticas al incrementar la caducidad de las plaquetas estándar de siete a veintiún días y simplificar el procesamiento, transporte y reconstitución al medio líquido del hemocomponente al no ser necesario su congelación.