INTRODUCCIÓN
En las últimas décadas, la globalización ha modificado e influenciado muchas conductas y costumbres humanas, entre ellas, la alimentación. En los últimos años, la oferta en España de alimentos típicos de otros países y culturas ha aumentado considerablemente, tanto en número de productos como en disponibilidad. Uno de los alimentos en cuestión son las semillas de amapola (SA), que podemos encontrar fácilmente en tiendas de alimentación, herbolarios, supermercados y a través de plataformas genéricas de envío a domicilio. Es común encontrarlas solas o junto con otras semillas en productos de panadería y/o bollería, aunque también se pueden encontrar a granel, preparados para infusión o extractos, como aceite de SA.
Las SA se obtienen de la adormidera (Papaver somníferum L.). Los alcaloides opiáceos, responsables de los efectos narcóticos, se encuentran de forma natural en el látex de la cápsula de adormidera y por sí solas las semillas no los contienen, sin embargo, es muy habitual que se contaminen fácilmente con los mismos en la recolección, principalmente durante el proceso de cosecha1. Esto hace que dichos alcaloides puedan ser ingeridos por los consumidores de productos que contienen o están elaborados a base de SA.
A nivel toxicológico, el Panel de la Agencia Europea de Seguridad Alimentaria sobre contaminantes en la cadena alimentaria (EFSA Panel Contam) publicó en 2018 un informe científico evaluando los riesgos para la salud pública, relacionados con la presencia de alcaloides opiáceos en SA, en el que estableció una dosis aguda de referencia (ARfD) de 10 µg morfina/Kg de peso corporal1. El informe destacó que en grupos de población con niveles medios-altos de exposición alimentaria a SA consideradas de alto nivel de alcaloides se superaba la ARfD en la mayoría de grupos de edad estudiados, principalmente a causa de los alcaloides morfina y codeína. Además, consideraba de gran importancia por parte de las empresas comercializadoras seguir las recomendaciones de la Comisión Europea, sobre buenas prácticas para prevenir y reducir la cantidad de alcaloides opiáceos en SA y productos a base de las mismas2, para cumplir con el máximo de referencia acordado por los Estados miembros de la UE de 10 mg/kg de morfina en SA para consumo humano directo3. Asimismo, destacaba la necesidad de recopilar datos toxicocinéticos de alcaloides opiáceos poco estudiados como la tebaína y la oripavina.
En España, la Agencia Española de Consumo, Seguridad Alimentaria y Nutrición (AECOSAN) emitió en 2016 un informe de su comité científico en el que se evaluó la exposición a morfina de la población española por consumo de semillas de amapola4. Este informe concluyó que, con los datos utilizados, la estimación de consumo en la población española se encontraba en ese momento por debajo de la ARfD, considerándolo por tanto seguro. El propio informe, sin embargo, hizo hincapié en la gran dificultad de obtención de datos precisos acerca del modo de consumo de estos productos, lo que generó cierta incertidumbre a las conclusiones realizadas.
En el ámbito del Ministerio de Defensa -de acuerdo al Plan General de Drogas de las Fuerzas Armadas5 y a la Instrucción Técnica de 03/2019 de la Inspección General de Sanidad de la Defensa6- se considera, entre otras drogas, a los opiáceos, como drogas de abuso a investigar de forma rutinaria en muestras biológicas del personal de las Fuerzas Armadas, estableciendo un punto de corte en muestras de orina de 300 ng/ml, basado éste en las recomendaciones de la European Workplace Drug Testing Society (EWDTS)7. Los análisis presuntivos son realizados por los laboratorios de cribado de la red de farmacias militares de los Ejércitos, Armada, Órgano Central, Unidad Militar de Emergencias y Guardia Real y deben ser confirmados posteriormente en el laboratorio de referencia de drogas del Instituto de Toxicología de la Defensa (ITOXDEF).
A nivel de interacción con las analíticas de drogas de abuso en muestras biológicas, numerosas citas bibliográficas avalan el hecho de que puedan obtenerse resultados falsos positivos a opiáceos tras el consumo de SA, tanto mediante técnicas de cribado basadas en enzimoinmunoensayos como en técnicas de confirmación basadas en cromatografía-espectrometría de masas. Por ello, es importante destacar que el consumo de estos productos puede suponer un desafío analítico a la hora de interpretar un resultado positivo a opiáceos.
El objetivo principal de este artículo está orientado a profundizar sobre el consumo de semillas de amapola y su interferencia en la detección de opiáceos en muestras de orina, con el fin de dimensionar el problema en el personal de las Fuerzas Armadas, planteando un caso clínico registrado en el ITOXDEF, con la premisa de buscar soluciones analíticas, a fin de resolver la interferencia causada por el consumo de las mismas y poder discriminar su ingesta respecto a un consumidor de sustancias opioides ilícitas.
MATERIAL Y MÉTODOS
Caso clínico
Mujer militar que, en dos análisis en orina rutinarios realizados de forma consecutiva por el laboratorio de cribado correspondiente mediante la técnica de enzimoinmunoensayo, obtiene resultados positivos a opiáceos. En el análisis de confirmación realizado en el ITOXDEF mediante cromatografía de líquidos-espectrometría de masas (HPLC-HRMS) se detecta en ambas muestras codeína por encima del límite de detección (LD). La interesada reporta el consumo de medicamentos que no suponen ninguna interacción en la técnica analítica realizada y, asimismo, indica que es consumidora habitual de un pan de molde de una marca comercial concreta que contiene SA. Tras dos días sin consumir dicho pan se le recolecta una nueva muestra, y tras 12 días sin consumir dicho pan se le recolecta una última muestra. Ambas muestras manifiestan resultados negativos en el análisis de cribado. En la tabla 1 se recogen los resultados obtenidos en todos los análisis realizados.
Tabla 1. Resultados obtenidos por EMIT y HPLC-MS e interpretación de las muestras analizadas del caso clínico descrito.
| Muestra | Laboratorio | Fecha análisis | Técnica analítica y resultado (ng/ml opiáceos) | Interpretación | |
|---|---|---|---|---|---|
| I | Cribado | 22-11-2019 | EMIT | 393 | Presunto positivo |
| ITOXDEF | 25-11-2019 | EMIT | 361 | Positivo | |
| HPLC-HRMS | 62,51 (codeína) | ||||
| II | Cribado | 6-02-2020 | EMIT | 593 | Presunto positivo |
| ITOXDEF | 7-02-2020 | EMIT | 790 | Positivo | |
| HPLC-HRMS | 129,33 (codeína) | ||||
| III | Cribado | 18-02-2020 | EMIT | 259 | Negativo |
| ITOXDEF | 02-03-2020 | EMIT | 268 | Negativo | |
| HPLC-HRMS | 14,6 (codeína) | ||||
| IV | Cribado | 28-02-2020 | EMIT | <LD | Negativo |
| ITOXDEF | 2-03-2020 | EMIT | <50 | Negativo | |
| HPLC-HRMS | <LD | ||||
Estudio
A la vista de los resultados obtenidos en este caso se realizó una revisión bibliográfica acerca de esta problemática y se diseñó un estudio para comprobar si el consumo del mismo pan reportado en el caso real es susceptible de arrojar similares resultados en análisis rutinarios. De entre el personal de este centro se eligieron dos voluntarios sanos, un varón de 29 años y una mujer de 40 años. Éstos consumieron una y dos rebanadas de dicho pan durante cinco y siete días respectivamente. De cada uno de ellos se recogió una muestra de orina diaria entre las 9:00 y las 10:00 horas y se analizó por la técnica de cribado (enzimoinmunoensayo). Las muestras que resultaron presuntamente positivas se analizaron también por la técnica de confirmación (HPLC-HRMS). Para cada voluntario se analizó una muestra de orina el día previo al inicio del consumo, así como varios días después del último día de consumo.
Métodos
Para el estudio realizado se empleaó la siguiente metodología:
-
Enzimoinmunoensayo: se emplea como técnica analítica de cribado. Permite determinar semicuantitativamente diferentes drogas de abuso en muestras de orina. Es una técnica fácilmente automatizable, relativamente rápida, con un coste asequible y que no requiere manipulación o pretratamiento de las muestras de orina. Al emitir resultados presuntivos, aquellos que resulten positivos deben ser confirmados posteriormente por otra técnica de referencia, habitualmente basada en cromatografía-espectrometría de masas.
En este caso, se empleó un Autoanalizador Siemens Dimension Xpand Plus®, que utiliza para el ensayo de drogas de abuso la tecnología de inmunoensayo por multiplicación enzimática (EMIT), basada en la competencia por los puntos de unión a anticuerpos de la droga presente en la muestra y droga añadida marcada con la enzima glucosa-6-fosfato deshidrogenasa, y que expresa el resultado semicuantitativo de opiáceos en unidades de ng/ml de opiáceos en orina. La especificidad del ensayo viene marcada por los reactivos comerciales de Siemens. El equipo se calibró utilizando tres niveles de concentración (300, 1000 y 2000 ng/ml) y para el control de calidad se utilizó un control negativo de 200 ng/ml y un control positivo de 2500 ng/ml. El método utilizado está validado y se estimó el límite de detección (LD) en 50 ng/ml.
-
Cromatografía Líquida de Alta Eficacia acoplada a un Espectrómetro de Masas (HPLC-HRMS): Se emplea como técnica de confirmación y de referencia. Permite identificar cualitativa y cuantitativamente diferentes drogas de abuso en muestras de orina. Entre ellas se estudian los alcaloides opiáceos morfina, codeína y sus metabolitos 6-monoacetilmorfina (marcador del consumo de heroína) y 6-monoacetilcodeína. Esta técnica incrementa la fiabilidad de los resultados, ya que permite separar compuestos de gran peso molecular a través del HPLC y detectar de manera selectiva fragmentos en función de su relación masa/carga (m/z), facilitando así su identificación inequívoca.
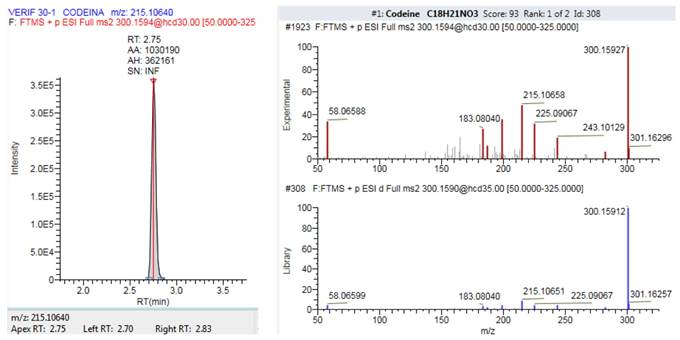
Para la detección de alcaloides opiáceos se empleó un equipo HPLC Dionex Ultimate 3000 acoplado a un espectrómetro de masas Thermo Q Exactive (Orbitrap®) en modo de trabajo Full Scan-Parallel reacting monitoring (FS-PRM). La columna utilizada fue una ACE Excel 2 µm C18-PFP 100 x 2,1 mm a una temperatura fija de 40 ºC. La separación cromatográfica se realizó con un flujo en gradiente utilizando como solventes agua y acetonitrilo en una relación inicial de 95:5. En estas condiciones los alcaloides opiáceos eluyen y una vez incorporados al espectrómetro de masas son identificados a partir de la masa exacta del ion precursor, cuantificados a partir de un fragmento (ión cuantificador) y la cualificación espectral se realiza a partir de otro fragmento iónico. En la tabla 2 se recogen el tiempo de retención y los iones de interés para cada uno de los compuestos. En la figura 1 se observa, como ejemplo, el cromatograma resuelto y el espectro de masas de la codeína. Se emplearon patrones internos deuterados para confirmar la presencia de los alcaloides opiáceos en las muestras de orina aplicando un criterio de desviación inferior al 30%. Como criterio de aceptación/rechazo para las verificaciones se aplicó un response ratio con un coeficiente de variación ≤20%, excepto para la 6-monoacetilmorfina que se aceptó ≤25%. Para la confirmación de los iones se aplicó un criterio de aceptación/rechazo de error de masa inferior a cinco partes por millón (ppm). Para cada uno de los alcaloides y metabolitos se establecieron LD a partir de los cuales se consideró positiva su identificación cualitativa. El ensayo está acreditado por la Entidad Nacional de Acreditación (ENAC) en la UNE-EN ISO/IEC 17025:2017, por la que se establecen los requisitos generales para la competencia de los laboratorios de ensayo y calibración, con n.º de expediente 610/LE1261.
Apoyo a través de una revisión de literatura científica. Para ello, se consultaron bases de datos especializadas como: MedLine, ScienceDirect, ClinicalKey, y el empleo de términos MeSH como palabras clave -«poppy seed», «urine drug testing», «opiates», «thebaine» y «false positive»-. Se utilizó como criterio de inclusión aquellos artículos de acceso libre o a través de la biblioteca virtual del Hospital Central de la Defensa Gómez Ulla, y que estuviesen disponibles en idioma inglés o español. Se excluyeron aquellos artículos en los que se estudió la interacción únicamente en muestras de fluido oral o plasma, y no en orina.
Tabla 2. Tiempo de retención cromatográfico y fragmentos de interés para la identificación de alcaloides opiáceos por la técnica de HPLC-HRMS (OrbiTrap®).
| Alcaloide/metabolito | Tiempo de retención (minutos) | Precursor (m/z) | Ion cuantificador (m/z) | Ion cualificador (m/z) |
|---|---|---|---|---|
| Morfina | 1,41-1,62 | 286,14377 | 201,09050 | 185,05960 |
| Codeína | 2,70-2,83 | 300,15942 | 215,10640 | 199,07490 |
| 6-monoacetilcodeína | 3,79-4,00 | 342,16998 | 225,09050 | 58,06580 |
| 6-monoacetilmorfina | 3,01-3,11 | 328,15433 | 211,07480 | 193,06420 |
RESULTADOS
Los resultados obtenidos para los voluntarios del estudio se muestran en la tabla 3. En el voluntario que consumió dos rebanadas diarias se obtuvieron concentraciones por la técnica de cribado (EMIT) muy superiores al punto de corte (300 ng/ml), detectándose por la técnica de confirmación (HPLC-HRMS) dos muestras positivas a codeína. En el voluntario que consumió una rebanada diaria se obtuvieron resultados tanto negativos como presuntamente positivos por EMIT, mientras que por HPLC-HRMS se detectó codeína en todas las muestras pero siempre por debajo del LD. En este segundo voluntario se destacó un resultado por EMIT superior al punto corte incluso el primer día tras finalizar el consumo.
Tabla 3. Resultados obtenidos por EMIT y HPLC-MS en muestras de orina de dos voluntarios que consumieron pan con semillas de amapola.
| Voluntario | Consumo | Fecha análisis | Resultado (ng/ml codeína) | Interpretación | |
|---|---|---|---|---|---|
| Mujer 40 años | Antes del inicio del consumo | 24/02/2020 | EMIT | 21 | Negativo |
| 2 rebanadas (4º día consumo) | 28/02/2020 | EMIT | 544 | Presunto positivo | |
| HPLC-MS | 36,77 | Negativo | |||
| 2 rebanadas (5º día consumo) | 02/03/2020 | EMIT | 542 | Presunto positivo | |
| HPLC-MS | 69,73 | Positivo | |||
| 2 rebanadas (7º día consumo) | 05/03/2020 | EMIT | 528 | Presunto positivo | |
| HPLC-MS | 54,68 | Positivo | |||
| Sin consumo | 06/03/2020 | EMIT | 159 | Negativo | |
| HPLC-MS | <LD | Negativo | |||
| Sin consumo | 08/03/2020 | EMIT | <50 | Negativo | |
| HPLC-MS | <LD | Negativo | |||
| Varón 29 años | Antes del inicio del consumo | 04/03/2020 | EMIT | 19 | Negativo |
| 1 rebanada | 05/03/2020 | EMIT | 188 | Negativo | |
| HPLC-MS | 10,39 | Negativo | |||
| 1 rebanada | 06/03/2020 | EMIT | 287 | Negativo | |
| HPLC-MS | 10,26 | Negativo | |||
| 1 rebanada | 07/03/2020 | EMIT | 509 | Presunto positivo | |
| HPLC-MS | 29,15 | Negativo | |||
| 1 rebanada | 08/03/2020 | EMIT | 217 | Negativo | |
| HPLC-MS | 11,8 | Negativo | |||
| 1 rebanada | 09/03/2020 | EMIT | 349 | Presunto positivo | |
| HPLC-MS | 19,32 | Negativo | |||
| Sin consumo | 10/03/2020 | EMIT | 357 | Presunto positivo | |
| HPLC-MS | 18,24 | Negativo | |||
| Sin consumo | 11/03/2020 | EMIT | <50 | Negativo | |
| HPLC-MS | <LD | Negativo | |||
En la revisión bibliográfica, la búsqueda con los MeSH «poppy seed» y «urine drug testing» con el operador booleano AND arrojó un total de 17 resultados desde el año 2000. La búsqueda con los Mesh «poppy seed» y «thebaine» con el operador booleano AND arrojó un total de 27 resultados desde el año 1997. Se revisaron los resúmenes y en algunos casos, el trabajo completo. Finalmente, fueron seleccionados 10 artículos que hacían alusión a la interferencia que genera el consumo de SA o alimentos que las contienen con la determinación de opiáceos en orina en análisis de drogas de abuso en orina, la problemática interpretación de resultados en estos casos o a la posibilidad de encontrar un biomarcador específico del consumo de semillas.
DISCUSIÓN
Tras los datos obtenidos en el caso clínico descrito como con los resultados de los dos voluntarios estudiados se evidencia que el consumo de productos a base de SA puede arrojar resultados «falsos positivos» a opiáceos en análisis de drogas de abuso en muestras de orina, principalmente cuando se aplica el punto de corte de 300 ng/ml propuesto por la EDTWS. En esta línea, la autoridad americana Substance Abuse and Mental Service Administration (SAMHSA)(8) sitúa el punto de corte en 2000 ng/ml de morfina/codeína en orina debido a un contexto sociocultural en el que el consumo de opiáceos tanto ilícitos como por prescripción médica está más extendido.
La técnica analítica más afectada en este caso es el enzimoinmunoanálisis empleado en los análisis de cribado, debido a la menor especificidad respecto a técnicas cromatográficas y la mayor susceptibilidad a interferencias9. Además, como se ha comprobado en los análisis de confirmación, el hecho de emitir el resultado positivo mediante la identificación cualitativa del compuesto a partir de un LD establecido, hace que exista la posibilidad de confirmar como consumo de drogas de abuso un consumo de SA o productos que las contienen.
Este hecho se describe en diferentes referencias bibliográficas y refuerza nuestros hallazgos10-12. En una revisión realizada por Lachemeier y colaboradores10 se recopilaron las evidencias acumuladas hasta 2010 de estudios que evaluaban la influencia de la ingesta de SA o productos que las contienen en la determinación de opiáceos en muestras de orina mediante técnicas cromatográficas-espectrometría de masas. Se recogieron un total de 29 estudios en los que se determinaron concentraciones máximas de morfina superiores a 300 ng/ml e incluso varios por encima de 2000 ng/ml (véase tabla 4).
Tabla 4. Evidencia revisada desde 1982 a 2006 acerca de la ingesta de semillas de amapola y/o productos que las contienen y la mayor concentración observada de morfina en muestras de orina mediante cromatografía de gases-espectrometría de masas y/o cromatografía de líquidos-espectrometría de masas.
| Year of Study, First author, Reference | Ingested Product | Morphine Dosage* | Highest Observed Morphine Concentration (ng/mL; at Time After Ingestion if Available) |
|---|---|---|---|
| 1982, Bjerver50 | Seeds, cake | Different amounts (5 mg per portion) | Peak conc. at 3 hours |
| 1985, Fritschi6 | Poppy seeds | Unknown | 18,000 |
| 1987, Hayes16 | Seeds | Unknown | 2635 at 3 hours |
| 1987, Pettit22 | Cake filling | 1302 µg in 70 g cake filling | 4500 at 5 hours (100% recovery of excreted morphine) |
| 1987, Struempler24 | Poppy seed bagles | Unknown | 2797 at 3 hours |
| 1988, ElSohly14 | Poppy seed cake | Unknown | 860 at 12 hours |
| 1990, Beck12 | Bread | Unknown | >300 |
| 1990, ElSohly15 | Poppy seed rolls & cake | Unknown | 2010 at 9 hours |
| 1990, Ketchum26 | Bagels | Unknown | >1000 |
| 1990, Salerno27 | Croissant | Unknown | 753 |
| 1991, Selavka23 | Different foods | Unknown | 11,571 |
| 1992, Lo17 | Curry meal | Unknown | 1270 |
| 1992, Meneely18 | Poppy seed cake | Unknown | 8940 at 6 hours |
| 1994, Beer94 | Poppy seed cake | Unknown | >4000 ng/mL |
| 1994, Nihira64 | Bean-jam buns, poppy seeds | Unknown | 7.5 at 5 hours |
| 1995, McCutcheon28 | Snack crackers | 256 µg (in 115 g of cracker) | 320 at 5 hours |
| 1996, Pelders21 | Seeds | Unknown | 1180 at 3.5 hours |
| 1997, Cassella13 | Poppy seed muffins | Unknown | 4776 at 2 hours |
| 1997, Narcessian29 | Poppy seed bagel | Unknown | 446 at 2 hours |
| 1998, Meadway51 | Bread rolls, cake | Unknown | 832 ng/mL |
| 2003, Rohrig35 | Bagels | Unknown | Pos. Up to 8 hours |
| 2003, Thevis61 | Cake | Unknown | 10,040 at 6 hours |
| 2003, Van Thuyne95 | Herbal tea | Prepared tea: 10.4 or 31.5 µg/mL | 7400 at 6 hours |
| 2004, Andresen11 | Cake, poppy seed | Unknown | Pos. |
| 2004, Moeller19 | Rolls, cake | Unknown | 2079 |
| 2004, Rochholz31 | Different foods | Unknown | Pos. |
| 2005, Hill37 | Poppy seeds | Unknown | 13,857 |
| 2005, Trafkowski25 | Cake | Unknown | 772 at 4 hours† |
| 2006, Trafkowski36 | Cake | Unknown | Pos.† |
Fuente: Lachenmeier y colaboradores10.
*The actual ingested morphine dosage is unknown in most cases because the ingested food was either not analyzed at all or only the poppy seed before food preparation was analyzed without considering the losses during processing (own judgment according to criteria outlined in Sproll and Lachenmeier10).
†Liquid chromatography coupled with tandem mass spectrometry.
En otros estudios más recientes se ha estudiado cómo afecta el consumo de SA o diferentes productos que las contienen en la determinación de opiáceos en muestras de orina y en función del punto de corte aplicado13-15. Como es de esperar, se encontraron porcentajes más elevados de resultados positivos y con una ventana de detección más amplia cuando se aplicó el punto de corte de 300 ng/ml respecto a cuando se aplicó el punto de corte de 2000 ng/ml.
Otros estudios se centraron principalmente en la búsqueda de un biomarcador que permita discriminar un consumo de semillas respecto de otros opiáceos ilícitos. En el artículo de Casella y colaboradores16, de entre varios consumidores de diferentes productos de forma independiente, se detectó el alcaloide tebaína únicamente en el grupo que había consumido SA. En el estudio de Özbunar y colaboradores14 se detectó tebaína mediante cromatografía de gases-espectrometría de masas en todos los sujetos que consumieron una pasta hecha a base de SA. En el artículo de Pearson y colaboradores17 se expone que en un consumo abusivo de morfina, codeína o heroína no aparecería tebaína como metabolito en orina. Por lo tanto, se podría proponer este alcaloide como potencial biomarcador específico del consumo de SA. No obstante, debido a que la concentración de alcaloides en las semillas es variable en función de distintos factores1, la no detección de tebaína en orina no puede interpretarse como indicador fiable de que no haya existido un consumo de SA.
Con base en lo expuesto anteriormente, dado que los resultados conflictivos tanto del caso clínico como del estudio realizado cursaron con una concentración de codeína por HPLC-HRMS de 54,68-129,33 ng/ml, y con el objetivo de minimizar esta problemática, el ITOXDEF ha estudiado la posibilidad de instaurar un punto de corte de confirmación para morfina y codeína al nivel recomendado por la EWDTS (300 ng/ml), de manera que la identificación de estos alcaloides opiáceos sea siempre a partir de dicho nivel y no existan casos dudosos como los descritos anteriormente. Dado que los consumidores habituales de opiáceos ilícitos cursan normalmente con concentraciones mucho más elevadas de opiáceos en orina, esta medida no supondría una disminución de la capacidad de detectar a estos consumidores.
Ante un potencial incremento de consumo de SA y productos que los contienen, podría considerarse incrementar el punto de corte a los niveles propuestos por la SAMHSA (2000 ng/ml). Recurrir a esto reduciría enormemente la problemática de interferencias, pero en el caso de consumidores reales de opiáceos ilícitos se reduciría drásticamente la ventana de detección, siendo detectados únicamente consumos abusivos que cursasen con concentraciones elevadas. A día de hoy, parece que esta medida únicamente estaría justificada en países en los que existe un modelo sociocultural de amplio uso de fármacos opioides, como por ejemplo Estados Unidos, o con una cultura gastronómica de gran consumo de SA y alimentos que las contienen, como por ejemplo Turquía.
CONCLUSIONES
En España el consumo de SA y alimentos que las contienen se considera actualmente seguro desde un punto de vista toxicológico. Sin embargo, la presencia de alcaloides opiáceos en estas semillas puede generar problemas a la hora de interpretar resultados positivos en analíticas de drogas en muestras de orina, como puede ser el contexto de los análisis rutinarios de drogas de abuso realizados al personal de las Fuerzas Armadas.
Para minimizar estas posibles interferencias se podría contemplar varias posibilidades desde el punto de vista analítico: instaurar un punto de corte de confirmación para morfina y codeína de 300 ng/ml basado en las recomendaciones de la EWDTS e incluir la tebaína como compuesto a detectar en el análisis de confirmación, por ser un potencial biomarcador específico del consumo de SA y productos que las contienen. Asimismo, otra posibilidad sería incrementar el punto de corte a los niveles propuestos por la SAMHSA (2000 ng/ml), lo que supondría minimizar las interferencias causadas por el consumo de SA, pero también un impedimento a la hora de detectar consumos reales de opiáceos ilícitos.