Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Andaluza de Medicina del Deporte
versión On-line ISSN 2172-5063versión impresa ISSN 1888-7546
Rev Andal Med Deporte vol.9 no.1 Sevilla mar. 2016
https://dx.doi.org/10.1016/j.ramd.2015.02.003
REVISIÓN
Efectos del ejercicio físico y pautas básicas para su prescripción en la enfermedad de Alzheimer
Effects of physical exercise and basically orientations for prescription in Alzheimer's disease
Efeitos do exercício físico e diretrizes básicas para sua prescrição na doença de Alzheimer
C.M.C. Nascimentoa,b, S. Varelab, C. Ayanb y J.M. Cancelab
a Laboratorio de Envejecimiento y Actividad Física (LAFE), Instituto de Biociencias, Departamento de Educación Física, Universidade Estadual Paulista (UNESP), Câmpus de Rio Claro, Rio Claro, São Paulo, Brasil
b Grupo HealthyFyt, Facultad de Ciencias de la Educación y del Deporte, Universidad de Vigo, Vigo, Pontevedra, España
Dirección para correspondencia
RESUMEN
El presente estudio tiene como objetivo actualizar el estado del arte con respecto a los beneficios potenciales que el ejercicio físico tiene sobre la enfermedad de Alzheimer. En primer lugar, se presentan los motivos por los que el ejercicio podría ser beneficioso, a través de la descripción de los efectos que su práctica tiene sobre aspectos metabólicos y neuropatológicos relacionados con esta enfermedad. En segundo lugar, se analizan las diferentes respuestas orgánicas que podrían ser moduladas a través del ejercicio y los cambios que este provoca en los marcadores biológicos de la enfermedad de Alzheimer. En tercer lugar, se muestran los hallazgos de los principales estudios que han propuesto la realización de programas de ejercicio en personas diagnosticadas de enfermedad de Alzheimer, a través de la descripción de los resultados obtenidos en los mismos. Finalmente, se presentan recomendaciones prácticas y propuestas de actuación para prescribir ejercicio físico en esta población.
Palabras clave: Enfermedad de Alzheimer. Cognición. Ejercicio físico. Personas mayores.
ABSTRACT
The aim of this study is to update the state of the art regarding the potential benefits of physical exercise on Alzheimer's disease. Firstly, the reasons why physical exercise may be beneficial are discussed through the impact that its performance has on the metabolic and neuropathological aspects related to this disease. Secondly, the different organic adaptations that could be modulated by means of exercising as well as the changes that could be induced through its practice on Alzheimer's disease biomarkers are analyzed. Thirdly, the findings of the main studies that have proposed the performance of exercise programs on people diagnosed with Alzheimer's disease are discussed trough the description of the obtained results. Finally, some practical recommendations and guidelines for prescribing physical exercise on this population are shown.
Keywords: Alzheimer's disease. Cognition. Physical exercise. Elderly.
RESUMO
O presente estudo tem como objetivo atualizar o estado da arte sobre os potenciais benefícios do exercício físico na doença de Alzheimer. Em primeiro lugar, as razães pelas quais o exercício pode ser benéfico, são apresentadas através da descrição dos efeitos de sua prática nos aspectos metabólicos e neuropatológicos da doença. Em segundo lugar, são analisadas as diferentes respostas orgânicas que podem ser moduladas através dos exercícios e as mudanças provocadas em marcadores biológicos da doença de Alzheimer. Em terceiro lugar, são mostrados os achados dos principais estudos que propuseram a realização de programas de exercício para pessoas diagnosticadas com doença de Alzheimer, por meio da descrição dos resultados obtidos da mesma. Finalmente, são apresentadas recomendaçães práticas e propostas de ação para prescrever exercício nesta população.
Palavras-chave: Doença de Alzheimer. Cognição. Exercício físico. Idosos.
Introducción
Se estima que hoy en día más de 30 millones de personas en el mundo tienen algún tipo de demencia1, y se espera que esta cifra se eleve hasta los 80 millones en el año 20402. Según la Fundación Alzheimer España cerca de 700.000 personas padecen la enfermedad de Alzheimer (EA) en nuestro país, y cada año esta cifra puede verse incrementada en 100.000 personas. La Organización Mundial de la Salud define la EA como «una enfermedad cerebral primaria, de etiología desconocida, que presenta rasgos neuropatológicos y neuroquímicos característicos. El trastorno se inicia por lo general de manera insidiosa y lenta, evolucionando progresivamente durante un periodo de años». La EA se considera el tipo de demencia más común, cuyo proceso neurodegenerativo es, además de progresivo, irreversible, y se caracteriza por déficit cognitivos como amnesia, apraxia, agnosia, afasia y disfunción ejecutiva, siendo una de las causas principales de muerte entre las personas mayores3.
Actualmente se han realizado un buen número de investigaciones centradas en los beneficios de las terapias de tipo no farmacológico cuyos objetivos principales se basan en paliar y ralentizar el declive cognitivo y físico, así como mantener o mejorar la calidad de vida del paciente con EA4-6. Como consecuencia de las mismas, se ha señalado al ejercicio físico como una de las terapias no farmacológicas más importantes. Diversos estudios han mostrado los efectos beneficiosos que la práctica de ejercicio físico provoca en las personas mayores, tales como aumento de la salud en general, mejora de la función cognitiva o disminución de los niveles de depresión7. A pesar del aumento de la evidencia respecto a los beneficios del ejercicio en la salud y funcionalidad de las personas mayores con desórdenes cognitivos, los efectos del mismo en la EA, así como la concreción de los parámetros relativos a su prescripción son todavía poco conocidos, sobre todo para los profesionales de la actividad física y la salud. Por ello, esta revisión tiene como objetivo exponer los principales motivos por los que la práctica de ejercicio físico puede ayudar a ralentizar el proceso degenerativo de la EA, así como proponer una serie de pautas básicas que puedan servir como guía a la hora de prescribir ejercicio físico a este tipo de poblaciones.
Método
Se llevó a cabo una revisión de la literatura desde enero de 1990 hasta septiembre de 2014. Las bases de datos consultadas en este periodo fueron: PsycINFO, Medline, Web of Science y SPORTDiscus. Las palabras clave empleadas para el desarrollo de la búsqueda bibliográfica fueron: («Physical Activity» OR «Physical Therapy» OR «Physical Exercises» OR «Motor Intervention») AND («Elder» OR «Elderly» OR «Older» OR «Aging» OR «Aged») AND («Cognition» OR «Cognitive Function» OR «Cognitive Performance») AND («Alzheimer's Disease» OR «Alzheimer»).
La selección de los artículos se efectuó teniendo en cuenta los siguientes criterios de inclusión: 1) estudios longitudinales (caso-control y abiertos) que evaluaran el efecto de un programa de ejercicios físicos regulares; 2) estudios con personas mayores (> 65 años); 3) estudios que evaluaran alguna de las funciones cognitivas, y 4) muestras aleatorizadas y no aleatorizadas. Los criterios tenidos en cuenta para la exclusión de los estudios fueron los siguientes: 1) estudios que no evaluaran los efectos del ejercicios regular; 2) estudios con jóvenes, y 3) estudios que tuvieran otra variable dependiente que no fueran las funciones cognitivas.
Dos revisores analizaron los abstracts y clasificaron los estudios con base en los criterios previamente definidos. En caso de duda o dificultad un tercer revisor participaba en la decisión de incluir o no el estudio analizado.
Beneficios del ejercicio en personas con enfermedad de Alzheimer
El ejercicio puede tener efectos beneficiosos en la EA, retrasando el comienzo y ralentizando la progresión de la enfermedad, existiendo diversas razones que podrían explicar este hecho. Primero, algunos cambios metabólicos y neuropatológicos, centrados en las causas subyacentes de la enfermedad, pueden ser modificados mediante el ejercicio. Segundo, algunas anomalías psicológicas y orgánicas, las cuales acompañan el curso de la enfermedad, pueden ser mejoradas por diversas prácticas deportivas, tales como el aeróbic o el entrenamiento de la flexibilidad. A todo esto hay que añadir, como es lógico, que las personas con EA también se pueden beneficiar de los efectos saludables del ejercicio encontrados en personas mayores sanas.
Efectos metabólicos y neuropatológicos
β-amiloide y proteína Tau
La β-amiloide es una proteína anormal que está fuertemente relacionada con la formación de placas neuríticas, las cuales se caracterizan por el acúmulo de esta proteína en el medio extracelular, delineando el proceso degenerativo de la EA.
Existen evidencias biológicas que muestran que el ejercicio podría reducir dicha proteína. Así, algunos estudios testaron la hipótesis de que el ejercicio voluntario a largo plazo afectaría a la progresión normal de la enfermedad como neuropatología, usando ratones transgénicos modificados genéticamente para exhibir cambios neuropatológicos8-11. Todos estos estudios encontraron que la práctica de ejercicio crónico puede promover la disminución del acúmulo de las placas amiloideas y reducir la formación de ovillos neurofibrilares.
Además de estos efectos histopatológicos, en los estudios clínicos, el ejercicio aparece como una estrategia comportamental sencilla, capaz de promover cierta resistencia al desarrollo de la neuropatología de la EA debido al estímulo que su práctica provoca en el manejo de variables neuropsicológicas y en el rendimiento cognitivo. Aunque el mecanismo por el que el ejercicio obtiene dichos efectos sigue sin estar claro, se barajan como posibles opciones ciertos cambios anatómicos, neuroquímicos y electrofisiológicos que se encuentran relacionados con la plasticidad neuronal.
Flujo sanguíneo cerebral
La disminución de la circulación sanguínea cerebral en el rendimiento cognitivo en personas mayores es un hecho conocido12. En personas con EA, frecuentemente se ha observado una reducción de este factor en mayor medida13. A este respecto, conviene señalar que se ha confirmado que la práctica de ejercicio físico aeróbico incrementa el flujo sanguíneo cerebral como consecuencia del aumento de la actividad neuronal y del metabolismo, favoreciendo el correcto funcionamiento de este mecanismo, que garantiza el aporte adecuado de oxígeno al cerebro14,15.
Ante esta situación, podemos entonces considerar que uno de los mecanismos de prevención o tratamiento coadyuvante en las enfermedades neurodegenerativas, capaz de estimular el rendimiento cognitivo de las personas mayores, puede ser la práctica regular de ejercicio físico, con la finalidad de mejorar la perfusión cerebral, así como promover una mayor activación neuronal. De este modo, Lucas et al.16 encontraron ciertos beneficios de la práctica de ejercicio aeróbico en personas tanto jóvenes como ancianas que presentaban amplias alteraciones en los perfiles metabólicos y cambios en la estructura vascular de las vías antioxidantes. Dichos beneficios se concretaron en el crecimiento de nuevas redes de vascularización, el aumento del número y la mejora de la estructura de los capilares, y el incremento de las sinapsis.
Hipometabolismo y acetilcolina
Aunque no existe acuerdo sobre la cuestión de si el metabolismo cerebral reducido en la EA precede a la hipoperfusión o viceversa17, ciertos indicios apuntan a una disminución en la ratio metabólica cerebral responsable de la concentración de glucosa en dicha dolencia. Se han encontrado evidencias que apoyan el concepto de que la EA está fundamentalmente relacionada con alteraciones metabólicas que surgen de una reducción progresiva de la capacidad del cerebro para utilizar glucosa y un incremento en su resistencia a la acción de la insulina18,19. Las alteraciones en la captación de insulina por parte del cerebro contribuyen a la neurodegeneración debido a los mecanismos de aceleración de la fosforilación de la proteína Tau y a las mayores expresiones y acumulación de proteína β-amiloide. Como consecuencia se intensifica la formación de placas neuríticas y se generan especies reactivas de oxígeno y nitrógeno, de modo que los niveles de estrés oxidativo intensifican todavía más el proceso degenerativo neuronal20.
Por otra parte, el proceso neuropatológico de la EA indica una pérdida específica de las neuronas colinérgicas en el núcleo basal de Meynert, tal y como lo demuestra la reducción en el contenido de acetilcolina encontrada en este tipo de pacientes21. La acetilcolina es un neurotransmisor involucrado en la regulación de muchas de las actividades cognitivas y de comportamiento22, por lo que es importante presentar adecuados niveles de concentración de la misma. Dado que el metabolismo de los hidratos de carbono es importante en la síntesis de la acetilcolina23, presumiblemente el mejorar la oxidación de los hidratos de carbono podría ser un método apropiado para conseguir esta meta. En este sentido, el ejercicio físico puede ejercer una doble función. Primero, porque hay evidencia clínica de que el ejercicio aeróbico mejora los niveles de glucosa en sangre y contribuye a la regulación de la homeostasis de la glucosa24, y segundo, porque estimula la expresión génica de factores de crecimiento neurales directamente ligados al fenómeno de la neurogénesis, a la producción y función de los neurotransmisores, y a la sinaptogénesis, especialmente en la región del hipocampo, donde el proceso degenerativo de la EA es más severo4. A este respecto conviene señalar que las vías de regulación de muchos neurotransmisores mejoran su función de aferencia en el hipocampo, aumentando la eficiencia del sistema colinérgico, que se traduce en un incremento significativo de la liberación de acetilcolina25.
Efectos sobre los biomarcadores
Además de los cambios en la cognición, la atención de los estudios se ha dirigido hacia los procesos y cambios histológicos y neuroquímicos inducidos por la práctica de ejercicio físico26,27. Como consecuencia, las últimas investigaciones sobre los efectos potenciales del ejercicio físico en la EA se han venido centrado en el estudio del comportamiento de los marcadores neurotróficos e inflamatorios ante la práctica de ejercicio, como modo definitivo de confirmar los beneficios de su práctica en esta afección.
Marcadores neurotróficos
Entre los probables mecanismos que pudieran explicar los efectos del ejercicio físico en la EA se encuentran los factores neurotróficos, especialmente el factor neurotrófico derivado del cerebro (FNDC; en inglés: brain-derived neurotrophic factor, BDNF), objeto de estudio de las investigaciones más recientes a este respecto. El FNDC es una proteína de la familia de las neurotrofinas que puede incidir de modo positivo en la funcionalidad cerebral por medio del desarrollo neuronal y del mantenimiento de la plasticidad cerebral y sináptica28. Actualmente se sabe que las personas mayores, con o sin demencia, tienden a presentar concentraciones más bajas de FNDC como consecuencia de la pérdida de neuronas que acompaña al proceso de envejecimiento29, y que afectan a su rendimiento cognitivo30. En las personas con EA, la concentración de FNDC se encuentra mucho más reducida31, lo que puede ser un indicativo más de la implicación de esta neurotrofina en el desarrollo de la enfermedad.
La práctica de actividad física ha sido asociada con mejoras significativas en las funciones cognitivas32. Muchas evidencias consistentes señalan como responsable al aumento en la síntesis de FNDC, que parece ser consecuencia directa de la práctica de ejercicio físico33,34. De este modo, algunos estudios experimentales han postulado que la práctica de actividades aeróbicas genera una elevación en las concentraciones circulantes y centrales de FNDC, que se reflejan en una mejor función neuronal, plasticidad sináptica y creación de nuevas celdas en el sistema nervioso35,36, sobre todo en la región del hipocampo37, especialmente afectada en la EA. Así, muchas evidencias señalan una asociación entre los beneficios del ejercicio físico a intensidad moderada con la producción del FNDC en el funcionamiento cognitivo, en la prevención y en el tratamiento de la EA en personas mayores38-40. Recientemente un estudio41 ha demostrado que los ejercicios multimodales tienen un efecto positivo, al aumentar las concentraciones de FNDC en ancianos con deterioro cognitivo, y estos cambios fueron independientes del genotipo para la producción del FNDC (val66met). Así que, aunque tengamos un factor genético de riesgo para baja producción de FNDC, el ejercicio puede ayudar a mejorar la cognición y los niveles de FNDC.
Los mecanismos por los cuales el ejercicio genera la respuesta de síntesis de FNDC no han sido definitivamente aclarados. Una posible explicación radica en el aumento de la producción de plaquetas, ya que contienen el micro-ARN para la producción de FNDC que parece ocurrir tras la práctica de actividad física42. En definitiva, parece confirmado que la práctica de ejercicio físico es una alternativa eficiente, que promueve la elevación de las concentraciones de FNDC y, por lo tanto, mejora el rendimiento cognitivo y la funcionalidad cerebral.
Marcadores inflamatorios
Los procesos histopatológicos de la EA, especialmente en relación con la formación de las placas seniles y los ovillos neurofibrilares, están fuertemente relacionados con las vías inflamatorias y con la activación de las células de la glía43. De manera general se acepta que el ejercicio provoca una elevación de la citocina conocida como interleucina 6, que sirve de estímulo para elevar la producción de otros factores antiinflamatorios y reducir las concentraciones de factores proinflamatorios como la citocina denominada factor de necrosis tumoral alfa (TNF-α)44. A este respecto, existen estudios de diversa naturaleza que han confirmado la reducción en la concentración de citocinas proinflamatorias tras la realización de ejercicio físico en poblaciones sanas45,46. En una reciente investigación, en la que se analizó el papel de los marcadores inflamatorios, en personas con deterioro cognitivo, se pudo demostrar que estos ancianos presentaban niveles más altos de interleucina 6 y TNF-α, en comparación con personas mayores cognitivamente saludables. Además, tras realizar 16 semanas de ejercicios multimodales, los individuos con deterioro cognitivo bajaron los niveles de estos marcadores de inflamación y mejoraron su cognición, en comparación con los individuos cognitivamente preservados47.
En lo referente a las enfermedades asociadas a inflamaciones crónicas de bajo grado y que se encuentran mediadas por la producción de sustancias que promueven la disminución de factores proinflamatorios, especialmente el TNF-α y la interleucina 1 beta, también se ha especulado con la existencia de un efecto protector inherente a la práctica de ejercicio físico, aunque la evidencia proviene de estudios en animales de laboratorio. Así, Belarbi et al.48 verificaron que el ejercicio físico fue capaz de modular las concentraciones de dichos marcadores en modelos de la EA. Igualmente, Nichol et al.49 demostraron que el ejercicio físico fue efectivo en la reducción de la respuesta crónica proinflamatoria, con disminución de los niveles de TNF-α y especialmente de interleucina 1 beta (que se mostró relacionada con la mejora en la resolución de tareas cognitivas), en una región específica y clave para la EA como es el hipocampo. Este proceso constituye una posible explicación para las mejoras cognitivas obtenidas por personas con EA tras iniciarse en la práctica regular de ejercicio físico.
Efectos del ejercicio en la enfermedad de Alzheimer: evidencia científica
Las evidencias que demuestran que el ejercicio físico es una herramienta útil como estrategia no farmacológica en el tratamiento de la EA están creciendo, pero todavía muchos de los estudios realizados muestran debilidades metodológicas. En este apartado se presentan las características de las principales investigaciones de relevancia publicadas hasta el momento. Uno de los primeros estudios sobre los efectos del ejercicio en la EA fue desarrollado por Palleschi et al.50, quienes mostraron que los pacientes que se encontraban en fase leve o moderada de la enfermedad mejoraban su atención y sus capacidades verbal y cognitiva tras participar en un entrenamiento de 3 meses de duración, basado en la realización de 20 min de trabajo en bicicleta estática, 3 veces por semana. Sin embargo, los resultados obtenidos están directamente afectados por 2 grandes debilidades metodológicas en el diseño de la investigación, tales como el reducido tamaño de la muestra y la ausencia de un grupo control. Similares problemas metodológicos están presentes en el trabajo de Arkin51, quien, empleando un programa de entrenamiento más complejo (basado en sesiones de entrenamiento aeróbico y de fuerza), encontró mejoras en la condición física y el estado de ánimo de los pacientes. Un estudio un poco más complejo (pero sin grupo control) fue el realizado por Rolland et al.52, en el que un grupo de 23 personas, en estadio de moderado a severo de EA, realizaron actividad aeróbica (caminar o montar en bicicleta) durante una media de 7 semanas. Se obtuvieron mejoras a nivel cognitivo y se redujeron los riesgos de caída y los problemas de comportamiento. A pesar de estos resultados, no hubo cambios significativos en la autonomía funcional de los pacientes.
Otro asunto controvertido, que refleja la dificultad de llevar a cabo este tipo de estudios, es intentar clarificar el rol de la estimulación cognitiva, bien sea sola, bien combinada con el entrenamiento físico. A este respecto, Friedman y Tappen53 distribuyeron 30 pacientes con EA en 2 grupos, uno de ellos caminaba de forma individual durante 30 min, 3 veces por semana durante 10 semanas; el otro, se dedicó a conversar la misma cantidad de tiempo. Después del periodo de intervención, las habilidades verbales y no verbales mejoraron significativamente en el grupo que caminaba sobre el grupo que solo conversaba, lo que evidencia que el ejercicio físico es la mejor manera de enriquecer la comunicación y no solo la estimulación cognitiva. Sin embargo, una sesión de 20 min de actividad física (caminar para los pacientes más capaces o flexoextensión de brazos y piernas para los menos capacitados) no presentó diferencias significativas en el lenguaje o el reconocimiento verbal en un grupo de 25 pacientes con EA, mientras que una sola sesión de 20 min de actividades combinadas de estimulación cognitiva y de comunicación indujo mejoras significativas en los mismos indicadores. Estos resultados muestran que la estimulación física no es tan útil en el aumento de la función cognitiva en los pacientes con EA, mientras que actividades de estimulación cognitiva pueden ser más específicas para inducir cambios en estos dominios.
En la misma línea, Tappen et al.54 compararon la eficacia de 3 intervenciones diferentes (caminar con ayuda, hablar o caminar mientras se habla) en 65 pacientes con EA. La intervención consistía en sesiones de 30 min, 3 veces por semana durante un periodo de 16 semanas. Los resultados indicaron que los pacientes con EA que participaban en la terapia combinada mejoraron la adherencia al ejercicio y mostraron menos deterioro funcional que los demás. Sin embargo, en una intervención similar, los pacientes que recibieron la terapia combinada (hablar y caminar) no mostraron diferencias significativas al caminar ni a nivel comunicativo ni funcional, cuando se compararon con pacientes que solo hablaban, o aquellos que no recibían ningún tipo de intervención55. Similares resultados se encontraron tras el desarrollo de un tipo de entrenamiento combinado compuesto de ejercicio aeróbico, de flexibilidad y de musculación, simultaneado con estimulación cognitiva (atención) y sensorial (tacto, audición y visión)56. Esta ausencia de resultados significativos podría deberse a la falta de potencia estadística (n = 13) y a la corta duración del programa (8 semanas). Por el contrario, Christofoletti et al.57 sí encontraron mejoras a nivel cognitivo en personas con EA tras la práctica de ejercicio físico combinada con técnicas de fisioterapia y terapia cognitiva.
Los estudios recientes aportan resultados más prometedores. Así, el ejercicio predominantemente aeróbico ha mostrado tener efectos positivos en la capacidad de equilibrio y en el rendimiento cognitivo de personas con EA58. En esta línea, la combinación de ejercicio físico con tareas cognitivas se mostró igualmente efectivo59.
En lo que respecta al efecto del ejercicio en otros síntomas de la EA, un programa comunitario diseñado para mejorar la condición física de los pacientes, y destinado a formar a sus cuidadores en la planificación y prescripción de las cargas de entrenamiento, resultó ser eficaz a la hora de mejorar el estado de ánimo de los enfermos. Tras 3 meses de intervención, los investigadores concluyeron que los pacientes con EA que entrenaban con sus cuidadores fueron más activos, mejoraron tanto su estado físico como afectivo, y tuvieron menos síntomas depresivos60. Estos resultados se confirmaron en una investigación más completa que implicó a un mayor número de pacientes61.
En un estudio más reciente Stella et al.62 observaron una reducción en las alteraciones de tipo neuropsiquiátrico y en los síntomas depresivos de los pacientes que participaron en un programa de ejercicio aeróbico de 6 meses de duración. Dichos beneficios se tradujeron en una reducción de la sobrecarga y del estrés del cuidador. Del mismo modo, Nascimento et al.63 verificaron una reducción en la irritabilidad de pacientes con EA que participaron en un programa de ejercicio físico, frente a aquellos que fueron incluidos en un grupo control. Vaughan et al.64 recientemente han demostrado que un programa de 16 semanas de ejercicios multimodales ha mejorado las funciones cognitivas y físicas, además de aumentar los niveles de FNDC. Nascimento et al.65, en otra investigación, también evaluaron los efectos de intervenciones multimodales en personas con EA leve y moderada. Sus resultados verificaron que los participantes mejoraron sus quejas de sueño y su desempeño en las actividades instrumentales y la funcionalidad. Otro estudio reciente de Andrade et al.66 ha demostrado que 16 semanas de kinesioterapia multimodal pueden promover mejoras significativas en el control postural y en las funciones frontales de personas con EA.
Considerando los efectos del entrenamiento de ejercicios con pesas, Martins Vital et al.67 y Garuffi et al.68 aplicaron un mismo protocolo de 16 semanas en pacientes con EA leve y moderada. Los 2 análisis demostraron que este tipo de entrenamiento fue eficaz para la mejora de los aspectos físicos y funcionales, como la fuerza, la agilidad, la flexibilidad y el equilibrio, pero no mejoró la cognición en personas con EA.
Con una propuesta un poco diferenciada, Suttanon et al.69 verificaron los efectos de 2 intervenciones realizadas en el hogar de los pacientes. Un grupo realizaba actividades de fortalecimiento y caminadas (fisioterapeuta), mientras otro llevaba a cabo un programa de 6 meses en el hogar solo con actividades educacionales (terapeuta ocupacional). El grupo de personas con EA que practicó ejercicios ha presentado mejoras en el equilibrio y la movilidad, y reducción del riesgo de caídas (tabla 1).
Tabla 1. Características de los estudios clínicos acerca de los efectos del ejercicio físico
en la cognición de personas mayores 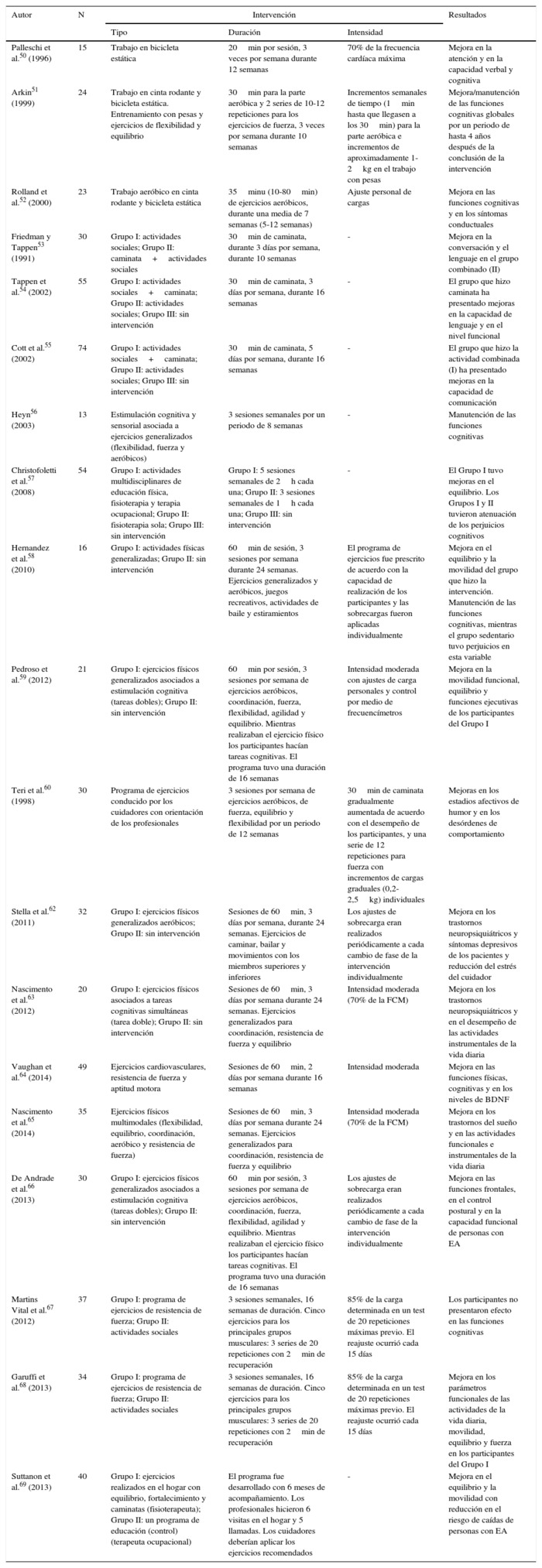
Recomendaciones sobre la práctica de ejercicio para personas con EA
Todas las personas con algún tipo de deterioro cognitivo pueden beneficiarse del ejercicio. Sin embargo, hay una serie de puntos básicos que deben tenerse en cuenta antes de desarrollar un programa específico:
- En algunos casos, los pacientes con EA pueden encontrar las tareas difíciles de entender. Por ello, es importante darse cuenta de que habrá personas que sean capaces de seguir instrucciones escritas, mientras que otras podrán imitar movimientos. Los ejercicios deberían ser seguidos por el paciente, así como por el responsable de la actividad.
- En personas con demencia una importante dificultad es aprender a hacer nuevas actividades. Una vez que una habilidad está olvidada, normalmente no se vuelve a conseguir. Pueden enfatizarse ejercicios estructurados que le resulten familiares al paciente. También puede ser útil identificar en los enfermos patrones pasados de ejercicio.
- Algunos factores, tales como las situaciones sociales, la hora del día o el entorno físico, entre otros, pueden traer problemas de comportamiento. En este caso, podría ser necesario cambiar alguno de esos patrones durante la sesión de entrenamiento.
- El compromiso con la práctica de actividad física puede ser un problema para personas con EA. La adherencia podría mejorar si se emplea música durante la sesión70.
- La presencia de factores de riesgo cardiovascular podría atenuar o incluso anular los efectos positivos del ejercicio físico. Debido a ello, las personas con EA deberían someterse a un examen físico antes de entrar en un programa de entrenamiento17.
- El entrenamiento de los «cuidadores» para facilitar la correcta supervisión del ejercicio realizado parece ser una estrategia de éxito comprobado muy a tener en cuenta71.
- Según la bibliografía previamente revisada en otros trabajos72, la intervención que muestra una mayor eficacia en el tratamiento de la EA estaría compuesta por una combinación de ejercicio aeróbico, fuerza, equilibrio y flexibilidad. En nuestra revisión, los ejercicios multimodales (combinación de múltiples componentes de la capacidad física) también han demostrado ser efectivos. Con relación a la frecuencia semanal, 2 y 3 sesiones a la semana, con una duración de una hora de intervención, se han presentado como una buena opción para promover mejoras en personas mayores con EA. En gran parte, los estudios han demostrado que de 16 a 24 semanas de intervención ya son suficientes para obtener una respuesta significativa a la intervención que se ha propuesto.
- El entrenamiento físico con pesas no ha demostrado tener efectividad sobre los parámetros cognitivos, mientras que los entrenamientos físicos aeróbicos y multimodales han demostrado los resultados más expresivos con relación a una integración de los parámetros funcionales, físicos, afectivos y cognitivos.
- El ejercicio físico puede que sea adoptado como una terapia complementaria no farmacológica para ayudar en el tratamiento de la EA, pues sus efectos provocan una reducción de la actividad inflamatoria y un aumento de las concentraciones de factores neurotróficos. Pero estos resultados solo fueron observados en intervenciones aeróbicas y multimodales (tabla 2).
Tabla 2. Estructura de una sesión 
EEII: extremidades inferiores; EESS: extremidades superiores.
Conclusiones
En resumen, nuestros hallazgos respaldan el empleo del ejercicio físico regular como parte importante del tratamiento para las personas con EA. A pesar de que las diferencias metodológicas en cuanto al protocolo de ejercicio (intensidad, frecuencia, duración y tipo) dificultan la comparación entre las muestras, los estudios señalan que las intervenciones de tipo aeróbico, con contenidos multimodales y realizadas a una intensidad media, son adecuadas para los pacientes con enfermedad leve o moderada. Teniendo en cuenta los potenciales beneficios que los programas de actividad física pueden ofrecer tanto a nivel físico como cognitivo, se detecta la necesidad de realizar nuevas investigaciones con un metodología bien estructurada, un protocolo definido y con diferentes tipos de intervención, que proporcionen una información más detallada sobre los efectos del ejercicio, pudiendo así definir el programa más adecuado para su tratamiento.
Conflicto de intereses
Los autores declaran que no tienen ningún conflicto de intereses.
Bibliografía
1. Brookmeyer R., Johnson E., Ziegler-Graham K., Arrighi H.M. Forecasting the global burden of Alzheimer's disease. Alzheimers Dement. 2007;3:186-91. [ Links ]
2. Ferri C.P., Prince M., Brayne C., Brodaty H., Fratiglioni L., Ganguli M., et al. Global prevalence of dementia: A Delphi consensus study. Lancet. 2005;366:2112-7. [ Links ]
3. Lyketsos C.G. Neuropsychiatric symptoms (behavioral and psychological symptoms of dementia) and the development of dementia treatments. Int Psychogeriatr. 2007;19:409-20. [ Links ]
4. Yu F., Kolanowski A.M., Strumpf N.E., Eslinger P.J. Improving cognition and function through exercise intervention in Alzheimer's disease. J Nurs Scholarsh. 2006;38:358-65. [ Links ]
5. Scarmeas N., Luchsinger J.A., Brickman A.M., Cosentino S., Schupf N., Xin-Tang M., et al. Physical activity and Alzheimer disease course. Am J Geriatr Psychiatry. 2011;19:471-81. [ Links ]
6. Roach K.E., Tappen R.M., Kirk-Sanchez N., Williams C.L., Loewenstein D. A randomized controlled trial of an activity specific exercise program for individuals with Alzheimer disease in long-term care settings. J Geriatr Phys Ther. 2011;34:50-6. [ Links ]
7. Vance D.E., Wadley V.G., Ball K.K., Roenker D.L., Rizzo M. The effects of physical activity and sedentary behavior on cognitive health in older adults. J Aging Phys Act. 2005;13:294-313. [ Links ]
8. Stranahan A.M., Martin B., Maudsley S. Anti-inflammatory effects of physical activity in relationship to improved cognitive status in humans and mouse models of Alzheimer's disease. Curr Alzheimer Res. 2012;9:86-92. [ Links ]
9. Wolf S.A., Kronenberg G., Lehmann K., Blankenship A., Overall R., Staufenbiel M., et al. Cognitive and physical activity differently modulate disease progression in the amyloid precursor protein (APP)-23 model of Alzheimer's disease. Biol Psychiatry. 2006;60:1314-23. [ Links ]
10. Adlard P.A., Perreau V.M., Pop V., Cotman C.W. Voluntary exercise decreases amyloid load in a transgenic model of Alzheimer's disease. J Neurosci. 2005;25:4217-21. [ Links ]
11. Leem Y.H., Lim H.J., Shim S.B., Cho J.Y., Kim B.S., Han P.L. Repression of tau hyperphosphorylation by chronic endurance exercise in aged transgenic mouse model of tauopathies. J Neurosci Res. 2009;87:2561-70. [ Links ]
12. Bertsch K., Hagemann D., Hermes M., Walter C., Khan R., Naumann E. Resting cerebral blood flow, attention, and aging. Brain Res. 2009;1267:77-88. [ Links ]
13. Heo S., Prakash R.S., Voss M.W., Erickson K.I., Ouyang C., Sutton B.P., et al. Resting hippocampal blood flow, spatial memory and aging. Brain Res. 2010;1315:119-27. [ Links ]
14. Ogoh S., Ainslie P.N. Regulatory mechanisms of cerebral blood flow during exercise: New concepts. Exerc Sport Sci Rev. 2009;37:123-9. [ Links ]
15. Secher N.H., Seifert T., van J.J. Cerebral blood flow and metabolism during exercise: Implications for fatigue. J Appl Physiol. 2008;104:306-14. [ Links ]
16. Lucas S.J., Ainslie P.N., Murrell C.J., Thomas K.N., Franz E.A., Cotter J.D. Effect of age on exercise-induced alterations in cognitive executive function: Relationship to cerebral perfusion. Exp Gerontol. 2012;47:541-51. [ Links ]
17. Eggermont L., Swaab D., Luiten P., Scherder E. Exercise, cognition and Alzheimer's disease: More is not necessarily better. Neurosci Biobehav Rev. 2006;30:562-75. [ Links ]
18. Steen E., Terry B.M., Rivera E.J., Cannon J.L., Neely T.R., Tavares R., et al. Impaired insulin and insulin-like growth factor expression and signaling mechanisms in Alzheimer's disease--Is this type 3 diabetes?. J Alzheimers Dis. 2005;7:63-80. [ Links ]
19. Hoyer S. Glucose metabolism and insulin receptor signal transduction in Alzheimer disease. Eur J Pharmacol. 2004;490:115-25. [ Links ]
20. De S.M. Contributions of brain insulin resistance and deficiency in amyloid-related neurodegeneration in Alzheimer's disease. Drugs. 2012;72:49-66. [ Links ]
21. Teipel S.J., Flatz W.H., Heinsen H., Bokde A.L., Schoenberg S.O., Stöckel S., et al. Measurement of basal forebrain atrophy in Alzheimer's disease using MRI. Brain. 2005;128: Pt 1126:26-44. [ Links ]
22. Pinto T., Lanctot K.L., Herrmann N. Revisiting the cholinergic hypothesis of behavioral and psychological symptoms in dementia of the Alzheimer's type. Ageing Res Rev. 2011;10:404-12. [ Links ]
23. Bucht G., Sandman P.O. Nutritional aspects of dementia, especially Alzheimer's disease. Age Ageing. 1990;19:S32-6. [ Links ]
24. Park S., Jang J.S., Jun D.W., Hong S.M. Exercise enhances insulin and leptin signaling in the cerebral cortex and hypothalamus during dexamethasone-induced stress in diabetic rats. Neuroendocrinology. 2005;82:282-93. [ Links ]
25. Grandys M., Majerczak J., Duda K., Zapart-Bukowska J., Sztefko K., Zoladz J.A. The effect of endurance training on muscle strength in young, healthy men in relation to hormonal status. J Physiol Pharmacol. 2008;59: Suppl 7:89-103. [ Links ]
26. Podewils L.J., Guallar E., Kuller L.H., Fried L.P., Lopez O.L., Carlson M., et al. Physical activity, APOE genotype, and dementia risk: Findings from the Cardiovascular Health Cognition Study. Am J Epidemiol. 2005;161:639-51. [ Links ]
27. Rockwood K., Middleton L. Physical activity and the maintenance of cognitive function. Alzheimers Dement. 2007;3: 2 Suppl:S38-44. [ Links ]
28. Huang E.J., Reichardt L.F. Neurotrophins: Roles in neuronal development and function. Annu Rev Neurosci. 2001;24:677-736. [ Links ]
29. Foster P.P., Rosenblatt K.P., Kuljis R.O. Exercise-induced cognitive plasticity, implications for mild cognitive impairment and Alzheimer's disease. Front Neurol. 2011;2:28. [ Links ]
30. Gunstad J., Benitez A., Smith J., Glickman E., Spitznagel M.B., Alexander T., et al. Serum brain-derived neurotrophic factor is associated with cognitive function in healthy older adults. J Geriatr Psychiatry Neurol. 2008;21:166-70. [ Links ]
31. Li G., Peskind E.R., Millard S.P., Chi P., Sokal I., Yu C.E., et al. Cerebrospinal fluid concentration of brain-derived neurotrophic factor and cognitive function in non-demented subjects. PLoS One. 2009;4:e5424. [ Links ]
32. Colcombe S., Kramer A.F. Fitness effects on the cognitive function of older adults: A meta-analytic study. Psychol Sci. 2003;14:125-30. [ Links ]
33. Ferris L.T., Williams J.S., Shen C.L. The effect of acute exercise on serum brain-derived neurotrophic factor levels and cognitive function. Med Sci Sports Exerc. 2007;39:728-34. [ Links ]
34. Seifert T., Brassard P., Wissenberg M., Rasmussen P., Nordby P., Stallknecht B., et al. Endurance training enhances BDNF release from the human brain. Am J Physiol Regul Integr Comp Physiol. 2010;298:R372-7. [ Links ]
35. Cotman C.W., Engesser-Cesar C. Exercise enhances and protects brain function. Exerc Sport Sci Rev. 2002;30:75-9. [ Links ]
36. Berchtold N.C., Chinn G., Chou M., Kesslak J.P., Cotman C.W. Exercise primes a molecular memory for brain-derived neurotrophic factor protein induction in the rat hippocampus. Neuroscience. 2005;133:853-61. [ Links ]
37. Berchtold N.C., Kesslak J.P., Cotman C.W. Hippocampal brain-derived neurotrophic factor gene regulation by exercise and the medial septum. J Neurosci Res. 2002;68:511-21. [ Links ]
38. Coelho F.G., Gobbi S., Andreatto C.A., Corazza D.I., Pedroso R.V., Santos-Galduroz R.F. Physical exercise modulates peripheral levels of brain-derived neurotrophic factor (BDNF): A systematic review of experimental studies in the elderly. Arch Gerontol Geriatr. 2013;56:10-5. [ Links ]
39. Erickson K.I., Voss M.W., Prakash R.S., Basak C., Szabo A., Chaddock L., et al. Exercise training increases size of hippocampus and improves memory. Proc Natl Acad Sci U S A. 2011;108:3017-22. [ Links ]
40. Ruscheweyh R., Willemer C., Krüger K., Duning T., Warnecke T., Sommer J., et al. Physical activity and memory functions: An interventional study. Neurobiol Aging. 2011;32:1304-19. [ Links ]
41. Nascimento C.M., Pereira J.R., Pires L., Garuffi M., Ayan C., Kerr D.S., et al. Physical exercise improves peripheral BDNF levels and cognitive functions in mild cognitive impairment elderly with different BDNF Val66Met genotypes. J Alzheimers Dis. 2015;43:81-91. [ Links ]
42. Yamamoto H., Gurney M.E. Human platelets contain brain-derived neurotrophic factor. J Neurosci. 1990;10:3469-78. [ Links ]
43. Selkoe D. Alzheimer's disease: Genes, proteins, and therapy. Physiol Rev. 2001;81:741-66. [ Links ]
44. Ostrowski K., Schjerling P., Pedersen B.K. Physical activity and plasma interleukin-6 in humans--Effect of intensity of exercise. Eur J Appl Physiol. 2000;83:512-5. [ Links ]
45. Kasapis C., Thompson P.D. The effects of physical activity on serum C-reactive protein and inflammatory markers: A systematic review. J Am Coll Cardiol. 2005;45:1563-9. [ Links ]
46. Starkie R., Ostrowski S.R., Jauffred S., Febbraio M., Pedersen B.K. Exercise and IL-6 infusion inhibit endotoxin-induced TNF-alpha production in humans. FASEB J. 2003;17:884-6. [ Links ]
47. Nascimento C.M., Pereira J.R., de L.P., Garuffi M., Talib L.L., Forlenza O.V., et al. Physical exercise in MCI elderly promotes reduction of pro-inflammatory cytokines and improvements on cognition and BDNF peripheral levels. Curr Alzheimer Res. 2014;11:799-805. [ Links ]
48. Belarbi K., Burnouf S., Fernandez-Gomez F.J., Laurent C., Lestavel S., Figeac M., et al. Beneficial effects of exercise in a transgenic mouse model of Alzheimer's disease-like Tau pathology. Neurobiol Dis. 2011;43:486-94. [ Links ]
49. Nichol K.E., Poon W.W., Parachikova A.I., Cribbs D.H., Glabe C.G., Cotman C.W. Exercise alters the immune profile in Tg2576 Alzheimer mice toward a response coincident with improved cognitive performance and decreased amyloid. J Neuroinflammation. 2008;5:13. [ Links ]
50. Palleschi L., Vetta F., de E., Idone G., Sottosanti G., Gianni W., et al. Effect of aerobic training on the cognitive performance of elderly patients with senile dementia of Alzheimer type. Arch Gerontol Geriatr. 1996;22: Suppl 1:47-50. [ Links ]
51. Arkin S.M. Elder rehab: A student-supervised exercise program for Alzheimer's patients. Gerontologist. 1999;39:729-35. [ Links ]
52. Rolland Y., Rival L., Pillard F., Lafont C., Rivere D., Albarede J., et al. Feasibility of regular physical exercise for patients with moderate to severe Alzheimer disease. J Nutr Health Aging. 2000;4:109-13. [ Links ]
53. Friedman R., Tappen R.M. The effect of planned walking on communication in Alzheimer's disease. J Am Geriatr Soc. 1991;39:650-4. [ Links ]
54. Tappen R.M., Williams C.L., Barry C., Disesa D. Conversation intervention with Alzheimer's patients: Increasing the relevance of communication. Clin Gerontol. 2002;24:63-75. [ Links ]
55. Cott C.A., Dawson P., Sidani S., Wells D. The effects of a walking/talking program on communication, ambulation, and functional status in residents with Alzheimer disease. Alzheimer Dis Assoc Disord. 2002;16:81-7. [ Links ]
56. Heyn P. The effect of a multisensory exercise program on engagement, behavior, and selected physiological indexes in persons with dementia. Am J Alzheimers Dis Other Demen. 2003;18:247-51. [ Links ]
57. Christofoletti G., Oliani M.M., Gobbi S., Stella F., Bucken L.T., Renato P. A controlled clinical trial on the effects of motor intervention on balance and cognition in institutionalized elderly patients with dementia. Clin Rehabil. 2008;22:618-26. [ Links ]
58. Hernandez S.S., Coelho F.G., Gobbi S., Stella F. Effects of physical activity on cognitive functions, balance and risk of falls in elderly patients with Alzheimer's dementia. Rev Bras Fisioter. 2010;14:68-74. [ Links ]
59. Pedroso R.V., Coelho F.G., Santos-Galduroz R.F., Costa J.L., Gobbi S., Stella F. Balance, executive functions and falls in elderly with Alzheimer's disease (AD): A longitudinal study. Arch Gerontol Geriatr. 2012;54:348-51. [ Links ]
60. Teri L., McCurry S.M., Buchner D.M., Logsdon R.G., LaCroix A.Z., Kukull W.A., et al. Exercise and activity level in Alzheimer's disease: A potential treatment focus. J Rehabil Res Dev. 1998;35:411-9. [ Links ]
61. Teri L., Gibbons L.E., McCurry S.M., Logsdon R.G., Buchner D.M., Barlow W.E., et al. Exercise plus behavioral management in patients with Alzheimer disease: A randomized controlled trial. JAMA. 2003;290:2015-22. [ Links ]
62. Stella F., Canonici A.P., Gobbi S., Galduroz R.F., Cação C., Gobbi L.T. Attenuation of neuropsychiatric symptoms and caregiver burden in Alzheimer's disease by motor intervention: A controlled trial. Clinics (Sao Paulo). 2011;66:1353-60. [ Links ]
63. Nascimento C.M., Teixeira C.V., Gobbi L.T., Gobbi S., Stella F. A controlled clinical trial on the effects of exercise on neuropsychiatric disorders and instrumental activities in women with Alzheimer's disease. Rev Bras Fisioter. 2012;16:197-204. [ Links ]
64. Vaughan S., Wallis M., Polit D., Steele M., Shum D., Morris N. The effects of multimodal exercise on cognitive and physical functioning and brain-derived neurotrophic factor in older women: A randomised controlled trial. Age Ageing. 2014;43:623-9. [ Links ]
65. Nascimento C.M., Ayan C., Cancela J.M., Gobbi L.T., Gobbi S., Stella F. Effect of a multimodal exercise program on sleep disturbances and instrumental activities of daily living performance on Parkinson's and Alzheimer's disease patients. Geriatr Gerontol Int. 2014;14:259-66. [ Links ]
66. De L.P., Gobbi L.T., Coelho F.G., Christofoletti G., Costa J.L., Stella F. Benefits of multimodal exercise intervention for postural control and frontal cognitive functions in individuals with Alzheimer's disease: A controlled trial. J Am Geriatr Soc. 2013;61:1919-26. [ Links ]
67. Martins T., Soleman S.S., Valle R., Ligo C.V., Garuffi M., Stein A.M., et al. Effects of weight training on cognitive functions in elderly with Alzheimer's disease. Dement Neuropsychol. 2012;6:253-9. [ Links ]
68. Garuffi M., Costa J.L., Hernandez S.S., Vital T.M., Stein A.M., dos J.G., et al. Effects of resistance training on the performance of activities of daily living in patients with Alzheimer's disease. Geriatr Gerontol Int. 2013;13:322-8. [ Links ]
69. Suttanon P., Hill K.D., Said C.M., Williams S.B., Byrne K.N., LoGiudice D., et al. Feasibility, safety and preliminary evidence of the effectiveness of a home-based exercise programme for older people with Alzheimer's disease: A pilot randomized controlled trial. Clin Rehabil. 2013;27:427-38. [ Links ]
70. Mathews R.M., Clair A.A., Kosloski K. Keeping the beat: Use of rhythmic music during exercise activities for the elderly with dementia. Am J Alzheimers Dis Other Demen. 2001;16:377-80. [ Links ]
71. Logsdon R.G., McCurry S.M., Teri L. A home health care approach to exercise for persons with Alzheimer's disease. Care Manag J. 2005;6:90-7. [ Links ]
72. Cejudo J., Gómez-Conesa A. Ejercicio físico en el tratamiento de la enfermedad de Alzheimer. Fisioterapia. 2011;33:111-22. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
C.M.C. Nascimento
carla_unesp@yahoo.com.br
Recibido el 20 de mayo de 2013
Aceptado el 16 de febrero de 2015














