Puntos clave
El trabajo expone algunos mecanismos moleculares de resistencia, tanto intrínseca como adquirida, reportados por diferentes investigadores, que pueden estar involucrados en la reducción de la eficacia de los anticuerpos monoclonales específicamente dirigidos al receptor del factor de crecimiento epidérmico, aspecto que limita el beneficio clínico de estas terapias en el tratamiento del carcinoma de células escamosas de cabeza y cuello en estadios avanzados y que constituye a su vez uno de los mayores desafíos en la lucha contra esta enfermedad en la actualidad.
El estudio de la resistencia a estas terapias se ha focalizado al cetuximab, que es el anticuerpo monoclonal de referencia, el de mayor desarrollo clínico y el único aprobado por la FDA en el tratamiento de estos tumores, sin embargo, muy poco se ha publicado en este sentido en la literatura científica con respecto al nimotuzumab, anticuerpo monoclonal aprobado en Cuba desde el 2002 y ampliamente utilizado en el tratamiento de este tipo de cáncer y además registrado en otros 28 países. Su aporte a la literatura es presentar un artículo donde se aborda al nimotuzumab, pero con un nuevo enfoque, el de la resistencia. Se presentan los resultados positivos obtenidos con su empleo, pero también se demuestra la falta de respuesta clínica en algunos pacientes, que evidencian la necesidad de acrecentar las investigaciones en este sentido.
Las implicaciones para la práctica son comunicar a la comunidad científica la existencia de un área del conocimiento que precisa una mayor investigación, cuyos resultados pueden permitir el estudio e identificación de nuevos mecanismos moleculares de resistencia o la validación de mecanismos ya reportados para el cetuximab y que pueden estar presentes en el nimotuzumab.
Introducción
Los carcinomas de cabeza y cuello (CCC) constituyen un grupo heterogéneo de tumores que se localizan en los senos paranasales y cavidad nasal, nasofaringe, orofaringe (amígdala, paladar blando y base de la lengua), hipofaringe, laringe (glotis, subglotis y supraglotis), cavidad oral (mucosa oral, encía, paladar duro, lengua móvil y suelo de boca), labio y glándulas salivares1,2. Se clasifican histológicamente de acuerdo con el tipo celular afectado. De esta manera, se observa que la mayor frecuencia de tumores es de etiología epitelial (>90 %) y la minoría son tumores mesenquimales o de estirpe hematolinfoide. El carcinoma escamoso es el tipo histológico más frecuente y representa prácticamente el 100 % de los tumores epiteliales de cabeza y cuello1.
El CCC tiene una incidencia de alrededor un 4-5 %; representa la quinta neoplasia en la población mundial y séptima en cuanto a mortalidad. Cada año se diagnostican unos 650.000 casos nuevos y ocurren aproximadamente 350.000 fallecimientos anuales por esta causa. La falta de terapias efectivas contribuye a la mortalidad de los pacientes2,3. Estos tumores se presentan notablemente más en hombres que en mujeres, con una relación que oscila de 2:1 a 4:11.
Cuba, según el último registro de incidencia que data del año 2016, reportó una incidencia de 2.906 casos nuevos. El cáncer de labio, cavidad bucal y faringe y el cáncer de laringe ocupaban el cuarto y el sexto lugar en incidencia para el sexo masculino, con una tasa bruta de 25,0 y 19,8 por 100.000 habitantes, respectivamente4.
De acuerdo a los datos del Anuario Estadístico de Salud de Cuba, durante el 2019 se produjeron 893 defunciones por tumores de labio, cavidad bucal y faringe y 891 defunciones por cáncer de laringe, lo cual representó tasas de 8,0 y 7,9 por cada 100.000 habitantes, respectivamente5.
Los clásicos factores de riesgo asociados al desarrollo de CCC son el consumo de tabaco y alcohol. Investigaciones más recientes han relacionado el CCC con la posible exposición a otros factores contribuyentes como el virus del papiloma humano (VPH) subtipo 16 y el Virus de Epstein-Barr (VEB)6-8.
El pronóstico de los pacientes es variable y depende del estadio del tumor en el momento del diagnóstico. La supervivencia relativa a los cinco años está entre el 76-83 % en pacientes con tumores localizados (estadio I-II), del 45-63 % en pacientes con tumores locorregionales avanzados (III, IVA y IVB) y 35-38 % con tumores en estadio metastásico (IVC)9.
La cirugía y la radioterapia (RT) son los métodos terapéuticos clásicos en el tratamiento locorregional del CCC. En general, las lesiones de pequeño tamaño sin afectación cervical importante, estadios I y II, se tratan indistintamente con cirugía o con RT. Ambas modalidades de tratamiento pueden considerarse igualmente efectivas, optando por una u otra en función de diferentes factores. En tumores de mayor volumen, suele ser necesario la combinación de ambas modalidades. En los pacientes en estadios localmente avanzados se realiza una terapia multimodal secuencial que engloba cirugía, RT y quimioterapia (QT)8,10. Para tumores inoperables, la alternativa que se prefiere es la quimio-radioterapia (QRT) o RT más anticuerpos monoclonales (AcM)11.
Más del 80 % de los casos de CCC se diagnostican con enfermedad locorregional avanzada. A pesar de los avances en el tratamiento multimodal, más de la mitad de los pacientes no son curados y recaen localmente o en sitios distantes en algún momento de su evolución. De estos sólo un número muy limitado de pacientes son candidatos para cirugía o re-irradiación. Los pacientes no aptos para dicho tratamiento suelen recibir QT. El pronóstico es desfavorable, pues la supervivencia global (SG) esperada en pacientes con cáncer epidermoide recurrente o metastásico se encuentra en torno a los 6-12 meses9,12,13.
La incorporación de AcM anti-EGFR, como el cetuximab y nimotuzumab, al tratamiento del carcinoma de células escamosas de cabeza y cuello (CCECC) en estadios avanzados, en combinación con los citotóxicos clásicos y/o RT, son la única estrategia hasta la fecha que ha demostrado una mejoría significativa en el control locorregional (CLR) y la supervivencia de los pacientes, por esta razón constituye una opción terapéutica muy valiosa11,14,15.
El objetivo del presente trabajo es exponer algunos mecanismos de resistencia, tanto intrínseca como adquirida, reportados por diferentes investigadores, que pueden estar involucrados en la reducción de la eficacia de los AcM anti-EGFR, aspecto que limita el beneficio clínico de estas terapias en el tratamiento del CCECC en estadios avanzados y que constituye a su vez uno de los mayores desafíos en la lucha contra esta enfermedad.
Métodos
Se realizó una revisión de la bibliografía científica en las fuentes especializadas Medline (vía Pubmed), Cochrane Library y Google académico, en el período de 2005-2020. Para definir los términos de búsqueda se empleó el Medical Subject Headings (MeSH). Se consideraron adecuados los descriptores siguientes: “cetuximab”, “nimotuzumab”, “head and neck squamous cell carcinoma”, “mechanism of resistance”, “biomarker”. Para la identificación de los artículos se verificó que los términos buscados se encontraran en el título o en el resumen. Se incluyeron los estudios originales realizados in vitro, en animales o en humanos cuyos resultados estuvieran relacionados directamente con el objetivo de la revisión, con acceso a texto completo y la selección de estos realizó en base a su mayor actualización y claridad. Se excluyeron las revisiones, los comentarios, cartas, los trabajos duplicados y los artículos publicados en un idioma diferente al inglés o español.
Resultados
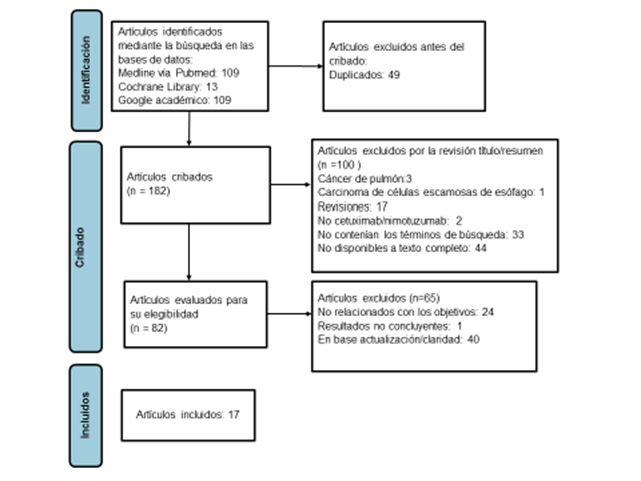
La selección de los estudios se realizó según el diagrama de flujo PRISMA (Figura 1). La estrategia de búsqueda en las bases de datos permitió identificar inicialmente 231 artículos, de estos, 225 correspondieron al cetuximab y 6 al nimotuzumab. Se evaluaron 82 artículos en texto completo para su elegibilidad y finalmente 17 cumplieron con los criterios de inclusión. De los 17 trabajos evaluados, 7 estudios fueron realizados in vitro, 6 se ejecutaron in vitro y en animales, 1 fue desarrollado in vitro, en animales y humanos y 3 fueron en humanos.
Cetuximab en el tratamiento del CCECC
El cetuximab es un AcM quimérico de inmunoglobulina G1 (IgG1), específicamente dirigido al EGFR16. El EGFR también conocido como ErbB-1 o HER1, es un miembro de la familia de receptores ErbB. Es una glicoproteína transmembranal con un peso molecular de 170 kDa, que pertenece a una familia de receptores con actividad tirosina quinasa, que inician una cascada de señalización intracelular a partir de la unión de los factores de crecimiento, que incluye las vías RAS/RAF/MAPK, PI3K/AKT/mTOR y de JAK/STAT. Esto se relaciona con un aumento de la proliferación celular, diferenciación, angiogénesis, metástasis, así como con disminución de la apoptosis. El EGFR se encuentra sobreexpresado en el 90 % o más de los casos de CCC y está asociado con un mal pronóstico y resistencia a los tratamientos oncológicos convencionales como la RT y QT. En base a esto, esta molécula se propuso como una buena diana para el tratamiento del cáncer17-20.
El cetuximab se une con alta especificidad al dominio extracelular del EGFR y bloquea competitivamente la unión de los dos principales ligandos endógenos: el factor de crecimiento epidérmico (EGF) y el factor transformante de crecimiento alfa (TGFa). Su unión al EGFR impide la estimulación del receptor y como resultado de ello, se inhibe la cascada de reacciones en la vía molecular correspondiente, cuya consecuencia es la inhibición de la proliferación celular, el incremento de la apoptosis, así como una reducción de la angiogénesis, la invasividad y metástasis. La unión del cetuximab al EGFR también promueve la internalización y posterior degradación del receptor en los compartimentos endosomales, esto a su vez incrementa la velocidad de degradación de esta molécula y disminuye el número de receptores disponibles en la superficie para señalizar14,21-23.
Además, el cetuximab es un potente inductor de la citotoxicidad celular dependiente de anticuerpos (CCDA) y algunos estudios han demostrado que el AcM produce una marcada sinergia en combinación con la QT en una variedad de tipos y modelos de células tumorales y también mejora la sensibilidad a la RT21-23.
El cetuximab es el primer AcM antagonista del EGFR aprobado por la Agencia Reguladora de Drogas y Alimentos de los Estados Unidos (FDA, siglas en inglés) para su aplicación en pacientes y se considera el AcM anti-EGFR de referencia24,25.
Desde el año 1994, se han ejecutado múltiples ensayos clínicos (EC) con el cetuximab, en los que se han tratado miles de pacientes con tumores de origen epitelial. Este AcM ha sido utilizado tanto en monoterapia como en combinación con RT o QT25.
Bonner y col. realizaron y publicaron un ensayo de fase III. En el estudio, 424 pacientes con CCC locorregional avanzado, fueron asignados aleatoriamente a un tratamiento con elevadas dosis de RT o a elevadas dosis de RT más cetuximab semanal. El grupo experimental mejoró significativamente el CLR y la mediana de supervivencia: 24,4 meses frente a 14,9 (p= 0,005) y 49,0 frente a 29,3 meses (p = 0,03) respectivamente, en comparación con la RT sola26.
En un estudio de fase III conducido por Eastern Cooperative Oncology Group, en el cual se inscribieron 117 pacientes con CCECC recurrente o metastásico y que fueron asignados aleatoriamente para recibir cisplatino cada 4 semanas, con cetuximab semanal (grupo A) o placebo (grupo B). Se observó una tendencia al incremento tanto en la supervivencia libre de progresión (SLP) 4,2 meses frente a 2,7 meses, como en la SG, 9,2 meses frente a 8,0 meses, en el grupo A en comparación con el grupo B27.
Merlano y col. evaluaron la terapia combinada de cetuximab con cisplatino, 5-fluorouracilo (5-FU) y RT en 45 pacientes, de ellos 38 presentaban enfermedad en estadio IV y 40 con afectación ganglionar. El criterio de valoración principal del estudio fue la tasa de respuesta completa (RC). La RC ocurrió en 32 pacientes (71 %)28.
El cetuximab está aprobado por la FDA desde el 2006 para el tratamiento de pacientes con CCECC localmente avanzado, de forma concomitante con RT y desde el 2011 en pacientes con enfermedad recurrente y/o metastásica en combinación con QT basada en compuestos de platino teniendo en cuenta los resultados positivos de los EC y este esquema es considerado hasta la actualidad como el “estándar de oro” en el tratamiento de primera línea de estos pacientes29,30,31.
Sin embargo, a pesar de los prometedores resultados expuestos anteriormente, también se ha constatado que sólo una minoría de los pacientes tratados se beneficia de la terapia con cetuximab y que el CCECC exhibe resistencia al tratamiento con este AcM, aspecto que plantea un desafío para su manejo clínico eficaz32-34.
La literatura refiere que la eficacia del tratamiento con cetuximab es baja, con una tasa de respuesta objetiva de un 13 % en monoterapia y un 36 % en combinación con QT. El tiempo hasta el fracaso del tratamiento, oscila alrededor de cinco meses en pacientes tratados con el régimen EXTREME (cetuximab/cisplatino/5-FU) aunque se mantenga la terapia con cetuximab32.
Estos datos sugieren que el mecanismo de resistencia intrínseca y adquirida ha limitado considerablemente el beneficio clínico del cetuximab en el CCECC, por tal razón, la comprensión de los mecanismos moleculares de resistencia reviste enorme interés clínico en la actualidad y representa uno de los mayores desafíos en el tratamiento de esta enfermedad. Su conocimiento puede proporcionar indicaciones valiosas para la identificación de biomarcadores que pueden utilizarse en la práctica clínica para predecir la respuesta a estas terapias y de este modo seleccionar adecuadamente a los pacientes con mayor probabilidad de beneficiarse con los AcM anti-EGFR, así como establecer nuevas opciones de tratamiento para reducir la resistencia32,33.
Mecanismos moleculares de resistencia al cetuximab en pacientes con CCECC
Braig y col. refieren un mecanismo específico de resistencia basado en la presencia de un polimorfismo de nucleótido simple (SNP) codificado como EGFR-K521 o alelo K, que tiene un cambio de un aminoácido (arginina por lisina), en la posición 521 del dominio extracelular del receptor. Este polimorfismo es expresado en más del 40 % de los casos de CCECC y previamente había sido reportada su asociación con la respuesta reducida al cetuximab en una pequeña serie clínica de CCECC. En el estudio, los investigadores confirmaron este dato clínico en una cohorte de 59 pacientes VPH negativo con CCECC, en tratamiento paliativo con cetuximab en combinación con QT o RT, de los cuales, el 55,9 % fueron homo o heterocigotos para el alelo K y mostraron una SLP más reducida (mediana 4,93 meses; 95 % CI, 3,52-6,34) en comparación con los pacientes que no expresaron el alelo K (mediana 8,25 meses; 95 % CI, 3,25-13,26; P = 0,049)32.
Además, se realizaron estudios en 12 líneas celulares de CCECC y detectaron que el cetuximab no inhibió significativamente la formación de colonias en las líneas celulares con una alta frecuencia de alelo K, lo que sugiere insensibilidad al cetuximab bajo condiciones in vitro, la cual fue también confirmada in vivo utilizando ratones con xenoinjertos de CCECC con expresión de EGFR-K521. Los investigadores proponen que el polimorfismo EGFR-K521 puede ser un potencial biomarcador predictivo de respuesta en el CCECC, pero que precisa de validación en estudios clínicos prospectivos32.
Otro polimorfismo del cual se ha estudiado su posible asociación con la respuesta reducida al cetuximab en el CCECC es el AURKA (aurora quinasa A) Phe31-Ile. La AURKA es una proteína oncogénica y su función es participar en la división celular en los mamíferos. Este SNP implica la sustitución de timina por adenina en el codón 91 del gen STK15, lo que causa a su vez el cambio del aminoácido fenilalanina por isoleucina. Se ha demostrado que la variante 31Ile se amplifica preferentemente y está asociada con el grado de aneuploidía en tumores humanos35.
Pickhard y col. desarrollaron un estudio donde comprobaron que las líneas celulares de CCECC homocigotas de tipo silvestre (Phe/Phe) respondieron al tratamiento en monoterapia con cetuximab, al mostrar una disminución significativa de la supervivencia clonogénica cuando eran tratadas con el AcM, mientras que las líneas celulares heterocigotas (Phe/Ile) no respondieron al tratamiento y demostraron ser resistentes al mismo. Los investigadores consideran que el estudio proporciona una evidencia in vitro del valor predictivo del polimorfismo AURKA Phe31-Ile en la eficacia del tratamiento con cetuximab35.
Leblanc y col. realizaron una investigación en la cual fueron analizados 115 pacientes con CCECC tratados con cetuximab. De ellos, 77 con enfermedad recurrente y/o metastásica, tratados con cetuximab en primera línea (grupo 1) y 38 con tumores localmente avanzados, tratados con cetuximab y RT (grupo 2). La media de seguimiento fue de 54,1 meses (rango: 3,2-92,5 meses). En el grupo 1 la activación de puntos calientes de mutación en PIK3CA y KRAS/HRAS se correlacionó con una pobre SLP [mutaciones de PIK3CA (P=0,04), mutaciones en los genes RAS (P < 0,001), y todas las mutaciones juntas (PIK3CA o KRAS o HRAS; P = 0,002)]. En el grupo 2, se identificó que la pérdida de expresión de la proteína homóloga de fosfatasa y tensina (PTEN) tendía a tener un impacto negativo en el pronóstico de los pacientes. Los investigadores también proponen que estos resultados deben ser validados adicionalmente en cohortes independientes teniendo en cuenta los regímenes de tratamiento33.
Nair y col. encontraron que las mutaciones en el dominio extracelular del EGFR pueden causar señalización independiente del EGF, que conduce a una señalización sostenida de la proteína quinasa B (AKT) y resistencia al cetuximab36. Por otro lado, Yonesaka y col. realizaron un estudio donde se examinó que la heregulina, ligando del receptor del factor de crecimiento epidémico 3 (HER3) de la misma familia que EGFR, estaba regulada en ascenso en las células con CCECC con resistencia adquirida al cetuximab, confiriéndoles supervivencia celular a través de la vía de señalización de AKT. Además, comprobaron que la eliminación de la heregulina en las células resistentes inhibía la fosforilación de HER3 y AKT y recuperaba la eficacia anticancerosa del cetuximab37.
Wang y col. encontraron que el cetuximab indujo la activación de HER3 y la dimerización de HER2/HER3 en líneas celulares de CCECC y que el tratamiento combinado con cetuximab y MM-121 (seribantumab) bloqueaba las actividades de EGFR y HER3 e inhibía las vías de señalización de PI3K/AKT y ERK y el crecimiento celular de manera más eficaz que cuando se empleaba cada anticuerpo de manera individual38.
Daly y col. demostraron que las proteínas de fusión FGFR3-TACC3 promueven la resistencia adquirida cuando se combinan bloqueadores de EGFR y HER3, por activación de la vía RAS/RAF/MEK/ERK en células de CCECC39. En otro estudio se demostró que las mutaciones de HRAS son bastante comunes en CCECC (9,44 %) y se asocian con una menor respuesta a la terapia con cetuximab40.
Novoplansky y col. estudiaron un caso clínico de una paciente de 72 años con CCECC tratada con cetuximab en monoterapia, que desarrolló una respuesta inicial casi completa, seguida del desarrollo de resistencia adquirida. Los investigadores encontraron una amplificación y sobreexpresión sustancial de una proteína tirosina quinasa receptora, denominada MET y de su ligando, el factor de crecimiento de hepatocitos (HGF) en las células resistentes al cetuximab. También comprobaron que la estimulación de MET en líneas celulares de CCECC fue suficiente para reactivar la vía de la proteína quinasa activada por mitógenos (MAPK) y conferir resistencia al cetuximab tanto in vitro como in vivo y que además la activación de la vía MET/MAPK elimina la regulación positiva de HER2/HER3 inducida por cetuximab41.
Brand y col. encontraron que AXL, un receptor tirosina quinasa, media la resistencia adquirida al cetuximab en CCECC a través de la señalización de MAPK y la activación posterior del EGFR y el factor de transcripción c-Jun42. McDaniel y col. encontraron que la tirosina 821 de AXL media la resistencia al cetuximab mediante la activación de la proteína quinasa c-ABL en el CCECC y que la inhibición de la señalización de c-ABL resensibilizó a las células tumorales al AcM43.
Boeckx y col. observaron que las células resistentes al cetuximab regulan positivamente varios genes, incluidos los de la interleucina-8 (IL-8), HB-EGF (factor de crecimiento similar a EGF de unión a heparina) y la metaloproteinasa ADAM19. Comprobaron además que estas células mostraron rasgos de transición epitelial a mesenquimal (EMT), al presentar mayor capacidad migratoria e invasiva, aumento de la expresión de la proteína mesenquimatosa, vimentina; así como la expresión de genes involucrados en la EMT44. Hsu y col. corrobaron el papel de la EMT en la resistencia adquirida al cetuximab y encontraron que esta era inducida por la proteína SNAIL, un marcador mesenquimal34.
Sen y col. identificaron una mayor activación del transductor de señal y activador de la transcripción 3 (STAT3) en los tumores que reaparecieron después del tratamiento con cetuximab, en comparación con los que no recibieron tratamiento y que la inhibición de STAT3 disminuye el crecimiento de las líneas celulares con resistencia intrínseca o adquirida a la terapia anti-EGFR45. En otro estudio, Wheeler y col. encontraron que EGFRvIII, una forma mutante de EGFR que confiere resistencia al cetuximab al presentar un dominio de unión al ligando truncado, indujo la migración e invasión de células de CCECC junto con un aumento de la activación de STAT346.
Nimotuzumab: el AcM anti-EGFR desarrollado en Cuba para el tratamiento del CCECC
En Cuba se emplea el nimotuzumab para el tratamiento del CCECC en estadios avanzados, en combinación con QRT o RT sola 47. El nimotuzumab es un AcM humanizado, inmunoglobulina de isotipo IgG1, desarrollado por el Centro de Inmunología Molecular de Cuba. Reconoce el EGFR con una afinidad intermedia al presentar una constante de disociación (KD) de 2,1 × 10 -8 mol / L47,48,49.
El nimotuzumab, al igual que el cetuximab, se une al dominio extracelular del EGFR y bloquea la interacción de sus dos principales ligandos endógenos. De esta forma inhibe la actividad tirosina quinasa del receptor y se detiene el ciclo celular en la fase G1-S, con un marcado efecto anti-proliferativo. Además, ejerce un efecto antiangiogénico y proapoptótico en aquellos tumores que sobreexpresan el EGFR y reduce el número de células CD133+: células madre tumorales, responsables de la radiorresistencia48. En estudios recientes se ha demostrado que el nimotuzumab activa las células asesinas naturales (NK), estimula la maduración de las células dendríticas e induce células T citotóxicas específicas contra EGFR. También, el AcM restaura la expresión del complejo principal de histocompatibilidad I (CMH-I) en las células tumorales, lo que dificulta una de las vías de escape inmunológico del EGFR11,49.
Desde 1998, se han concluido más de 50 EC en todo el mundo con nimotuzumab11. El primer ensayo controlado inscribió a 106 pacientes con CCECC locorregionalmente avanzado, no aptos para recibir QRT concurrente. Los pacientes fueron aleatorizados para recibir RT más nimotuzumab o placebo. El criterio de valoración del ensayo fue la evaluación de la tasa de respuesta en ambos grupos. La tasa de RC fue de 59,5 % en la cohorte de nimotuzumab más RT frente al ٣٤,٢ % en el grupo control, diferencias estadísticamente significativas. La mediana de SG fue de 12,50 frente a 9,47 meses en el grupo experimental y control, respectivamente50.
En un estudio controlado realizado en la India, 92 pacientes en estadio III/IVA fueron asignados aleatoriamente a dos grupos: grupo A (RT frente a RT + nimotuzumab) y grupo B (QRT frente a QRT + nimotuzumab). Los sujetos recibieron 60-66 Gy en combinación con seis dosis de nimotuzumab semanales. La QT consistió en cisplatino, 50 mg /semanales durante seis semanas. En el grupo A, la respuesta antitumoral objetiva fue del 76 % en los sujetos que recibieron RT y nimotuzumab frente al 37 %, en los pacientes que solo recibieron RT. En el grupo B, la tasa de CLR fue del 100 % en los pacientes que recibieron nimotuzumab más QRT frente al ٧٠ % en los pacientes tratados con QRT51.
Después de un seguimiento a largo plazo, la tasa de supervivencia a cinco años fue del 39 % con RT + nimotuzumab frente al 26 % con RT sola (p>0,05). La tasa de supervivencia fue del 57 % para el grupo de QRT+ nimotuzumab frente al 26 % para QRT sola (p = 0,03). El riesgo de muerte fue un 24 % menor si los pacientes recibieron RT + nimotuzumab en comparación con la RT sola, mientras que el riesgo de muerte fue 64 % menor con QRT + nimotuzumab en comparación con QRT52.
Un estudio de fase III fue realizado en Mumbai (India), para evaluar el impacto de nimotuzumab más cisplatino/RT en la SLP, CLR, supervivencia libre de enfermedad (SLE) y SG. Fueron incluidos ٥٣٦ sujetos, con confirmación de CCE de la cavidad oral, orofaringe, hipofaringe o laringe, estadio III-IV y sin metástasis a distancia. Los pacientes fueron asignados a QT (cisplatino semanal ٣٠ mg/m٢, ٧ semanas) + RT (dosis total de ٦.٦٠٠-٧.٠٠٠ cGy) o al mismo tratamiento más nimotuzumab semanal (200 mg / dosis) para completar 7 dosis. En los sujetos que recibieron nimotuzumab + cisplatino/RT se apreció una SLP de 60,3 meses frente a 21 meses (grupo control) (HR 0,69; p = 0,004). La tasa de SLP a los 2 años fue de 61,8 % (grupo de nimotuzumab) frente a 50,1 % (grupo control). La SLE a dos años fue de 60,2 % (grupo de nimotuzumab) frente a 48,5 % (grupo control) (HR 0,71; p =0,008). El CLR a dos años fue del 67,5 % (grupo de nimotuzumab) frente a 57,6 % (grupo control) (HR 0,67; p = 0,006). La SG a dos años fue de 63,8 % (grupo de nimotuzumab) frente a 57,7 % (grupo control)53.
Los datos de los EC presentados anteriormente demuestran los resultados positivos obtenidos con el nimotuzumab en el tratamiento de los pacientes con CCECC, sin embargo, también evidencian que hay un grupo de pacientes que no responden a esta terapia y por consiguiente no reciben sus beneficios clínicos, razón por la cual, resulta imprescindible investigar por qué algunos pacientes responden bien a la terapia con nimotuzumab y en otros la tasa de respuesta no es la esperada y si este comportamiento puede estar relacionado con la existencia de mecanismos moleculares de resistencia a la terapia con este AcM.
Roca y col. publicaron un estudio en el cual se incluyeron 36 pacientes con CCECC en estadios avanzados inscritos en un EC fase IV. De estos, 14 recibieron tratamiento con nimotuzumab y RT, 14 fueron tratados con nimotuzumab combinado con RT y QT y a ocho se les aplicó el nimotuzumab solo. Al finalizar el estudio (tres años), el 100 % de los pacientes tratados con nimotuzumab en monoterapia o con nimotuzumab combinado con RT y QT estaban vivos, mientras que en el grupo de nimotuzumab con RT, de los 14 pacientes iniciales, solamente sobrevivieron cuatro. Los investigadores observaron que tanto la media de los parámetros hematológicos y de función hepática como la de otras variables del metabolismo se encontraron en el rango de referencia para cada una de las determinaciones antes del tratamiento y durante este y que, por tanto, no existieron diferencias significativas para los parámetros de laboratorio54. Los resultados antes expuestos animan a plantear la siguiente interrogante: ¿Por qué los pacientes tratados con la combinación de nimotuzumab y RT tuvieron una menor supervivencia en comparación con el resto de los pacientes incluidos en el estudio que recibieron otros esquemas de tratamiento?
En este sentido la literatura refiere que las evidencias apuntan hacia la asociación entre la sobreexpresión del EGFR en células tumorales y el beneficio clínico de nimotuzumab en pacientes tratados, pues los estudios clínicos han demostrado que existe una correlación directa entre la elevada expresión del EGFR y la SG11,47.
Se ha planteado que los AcM con afinidades intermedias como el nimotuzumab pueden acumularse preferentemente en los tumores que muestran mayor expresión del EGFR, mientras que los anticuerpos con alta afinidad como es el caso del cetuximab reconocen tumores con menor expresión de la diana, pero también tejidos normales11. Akashi y col. demostraron que la unión del nimotuzumab y la posterior inhibición de la fosforilación del EGFR solamente se detectaron en líneas de células tumorales con media o alta expresión del EGFR (104 receptores por célula o más)55, por otro lado, Garrido y col. observaron que la unión de los fragmentos Fab del nimotuzumab únicamente se detectó en la línea celular A431 (106 receptores por célula), mientras que los fragmentos Fab del cetuximab también fueron identificados en las células tumorales con bajos niveles del EGFR56.
En el EC de fase II realizado en pacientes con CCECC considerados no aptos para recibir QRT, la eficacia de nimotuzumab combinado con RT se comparó con RT más placebo. En un subconjunto de pacientes, la expresión del EGFR se evaluó mediante inmunohistoquímica. Los pacientes con tumores que expresaron altos niveles del EGFR y que recibieron nimotuzumab tuvieron una mejoría significativa en el tiempo medio de supervivencia en comparación con los pacientes del grupo placebo (16,5 frente a 7,2 meses, p = 0,0038) mientras que en aquellos pacientes cuyos tumores eran EGFR negativo no se observó una ventaja significativa del tratamiento con el AcM en comparación con el grupo placebo50. Se observaron hallazgos similares en un EC de fase IIB en pacientes con CCECC sin tratamiento previo, que recibieron terapia estándar con o sin nimotuzumab. La expresión del EGFR tuvo una correlación significativa con la supervivencia en pacientes tratados con nimotuzumab y QRT (p = 0,02)57.
Teniendo en cuenta estos resultados, se ha considerado que para el nimotuzumab los pacientes con alta expresión del EGFR pueden obtener un mayor beneficio clínico y que esta característica puede ser un posible biomarcador predictivo de eficacia, pero que precisa de validación en EC prospectivos11,47. Paradójicamente para el cetuximab, que tiene la capacidad de conservar su eficacia incluso en aquellos tumores con baja expresión del EGFR11, los niveles de expresión del receptor no parecen influir en la respuesta clínica diferencial mostrada por los pacientes, es por ello que la sobreexpresión tumoral del EGFR, al parecer, no es un biomarcador predictivo clínicamente útil en el CCECC. Los análisis realizados en grandes ensayos aleatorizados han revelado que no hay asociación entre el estado del EGFR determinado por inmunohistoquímica y el beneficio del cetuximab en estos tumores58. Estas observaciones parecen indicar que, además de los niveles de expresión del EGFR, los resultados clínicos con la terapia anti-EGFR en el CCECC, pueden involucrar otros mecanismos moleculares y genéticos de extraordinaria complejidad y heterogeneidad que precisan ser investigados para el nimotuzumab.
Discusión
Los resultados de la revisión bibliográfica confirman el enorme interés que ha despertado la comprensión de la resistencia al tratamiento con cetuximab en el CCECC, al reportarse varios mecanismos moleculares de resistencia tanto intrínseca como adquirida al AcM.
Un mecanismo al cual se le ha prestado gran atención es la influencia del polimorfismo genético en la respuesta clínica diferencial mostrada por los pacientes tratados con cetuximab, tanto en el EGFR como a nivel de proteínas oncogénicas como la AURKA. La sobreexpresión de MET e inducción de la EMT por marcadores mesenquimales como SNAIL y la regulación positiva de varios genes como IL-8, HB-EGF y ADAM19, también han depertado gran interés. Las mutaciones en el dominio extracelular del EGFR, aunque han sido intensamente estudiadas, fueron las que arrojaron el menor número de publicaciones en la búsqueda realizada. Prevalecieron los estudios en los que se asoció la reducción de la eficacia del tratamiento con cetuximab con vías alternativas, que pueden incluir señales compensatorias de otros receptores de la familia EGFR, como HER3, así como otros mecanismos de resistencia relacionados con alteraciones moleculares en las vías de señalización: AKT/PI3K, RAS/RAF/MEK/ERK y JAK/STAT, particularmente las que involucran a las proteínas de la familia Ras, PIK3CA, PTEN y STAT3, así como el receptor tirosina quinasa AXL.
Con respecto al nimotuzumab, aparte de los hallazgos anteriormente expuestos, en la literatura disponible consultada no se encontraron otros estudios que aborden los posibles mecanismos que subyacen en la variabilidad de la respuesta clínica a la terapia con nimotuzumab en los pacientes con CCECC y si este comportamiento puede involucrar la presencia de mecanismos moleculares de resistencia, resultado que sugiere la necesidad de realizar más investigaciones en este sentido.
Conclusiones
La incorporación de terapias dirigidas al EGFR, como el cetuximab y nimotuzumab, han demostrado beneficio clínico en combinación con los tratamientos oncológicos clásicos. Sin embargo, los estudios clínicos evidencian que hay pacientes que presentan tasas de respuesta pobres o nulas con su uso. En el caso del cetuximab la eficacia clínica ha sido considerada limitada; debido a que pueden estar implicados los mecanismos de resistencia intrínseca y adquirida tales como: la presencia de los polimorfismos, EGFR-K521 y AURKA Phe31-Ile, la activación de puntos calientes de mutaciones en PIK3CA y KRAS/HRAS y la pérdida de expresión de PTEN, entre otros. Aunque son múltiples las propuestas de biomarcadores que se publican, requieren su validación en EC prospectivos para que sean introducidos en la práctica clínica habitual y de este modo seleccionar a los pacientes con mayor probabilidad de beneficiarse con estas terapias. Se sugiere la necesidad de incrementar los estudios sobre los mecanismos de resistencia al nimotuzumab.