Puntos clave
Secreted Frizzled - Related Protein 4 es un glicoproteína que interviene como modulador negativo en las vías de señalización del Wnt, relacionada con el inicio y progresión del cáncer en aquellos tejidos donde se expresa, entre los que se considera el tejido mamario.
El estudio recoge y actualiza la información disponible acerca de la síntesis, estructura y función de sFRP4, así como su relación con el cáncer de mama.
Secreted Frizzled - Related Protein 4 está implicada en la génesis y progresión del cáncer de mama, aunque los estudios realizados sobre ello no permiten definirla como biomarcador de la enfermedad. Asimismo, nuevas líneas de investigación deben realizarse, dirigidas a elucidar las implicaciones de la glicoproteína en la patología.
Introducción
La familia de proteínas sFRP está compuesta por un total de cinco miembros, dentro de los cuales podemos considerar a secreted Frizzled - Related Protein 4 (sFRP4). Dichas glicoproteínas se expresan en una amplia variedad de tejidos humanos tanto a nivel embrionario como adulto1.
El crecimiento celular, la proliferación, la migración, la diferenciación y la apoptosis son procesos fundamentales que tienen lugar en el ciclo vital de la célula para su correcto desarrollo natural. De esta forma, la ejecución errática de alguno de estos mecanismos puede desencadenar la carcinogénesis celular2,3,4. Es por ello, que las diversas rutas metabólicas implicadas en dichos procesos serán claves, así como las moléculas que intervengan en su control. De esta forma, tanto la cascada de señalización del Wnt como las proteínas de la familia sFRP desempeñarán un papel crítico en la patología del cáncer. Inicialmente, dichas glicoproteínas fueron definidas como "supresores tumorales" debido a su actividad como antagonistas de las vías de señalización mencionadas. Esto se debe a la actuación de las proteínas sFRPs como moduladores de las vías del Wnt, mediante la competición con el receptor Frizzled (FZD) por los ligandos Wnt4,5.
Métodos
En el período de marzo-junio de 2021 se hizo una búsqueda en las bases de datos Medline, Scopus y Web of Science, utilizando las palabras clave: "sFRP4", "breast cancer", "treatment" y "Wnt pathways", utilizando el operador booleano "AND". De la totalidad de los artículos encontrados se seleccionaron aquellos de interés en el tema de revisión, redactados en inglés y en los que se tuvo acceso al texto completo como criterios de exclusión o inclusión.
Resultados
Esta parte del artículo se estructuró en los siguientes apartados: familia de Secreted Frizzled - Related Proteins, vías de señalización del Wnt y sFRP4, sFRP4 en el cáncer de mama y sFRP4 y el tratamiento del cáncer de mama
Familia de Secreted Frizzled - Related Proteins
La familia de glicoproteínas sFRP está conformada por un total de cinco miembros (sFRP1 - sFRP5), dentro de la cual se puede realizar una subdivisión atendiendo a la homología entre ellos. Por un lado, se encuentra la subfamilia 1Sarp, constituida por sFRP1, sFRP2 y sFRP5. Por otro lado, son sFRP3 y sFRP4 quienes conforman la subfamilia 2FrzB5,6. Con respecto a su actividad, esta familia se ve encuadrada dentro de los "antagonistas de la vía de señalización del Wnt"7.
El silenciamiento del gen 8p11.21 en pacientes diagnosticados de cáncer de mama y de colon permitió la determinación del primer miembro de esta familia, sFRP14,5. Dicho gen codifica para una glicoproteína de 314 aminoácidos (aa) capaz de establecer puentes disulfuro con el receptor FZD8,9. Comparando con el resto de miembros, ésta presenta una mayor homología con sFRP54,10. El segundo miembro, sFRP2, viene codificado por el gen 4q31.3, que da lugar a una proteína de 300 aa aproximadamente5,11. La expresión de esta suele ocurrir a nivel del estroma tumoral en la mayoría de tipos de cáncer, al igual que sucede con su hermana sFRP44,12. Por su parte, sFRP3 viene codificada por el gen 2q32.15. Esta glicoproteína fue uno de los primeros miembros de la familia en determinarse, que inicialmente se denominó FRZB debido a su actividad como antagonista de la vía de señalización del Wnt13. sFRP3 actúa regulando la polaridad epitelial, además de presentar un papel fundamental en la homeostasis del hueso y del cartílago14,15. El último miembro de la familia, sFRP5, viene codificado por el gen 10q24.25. La inhibición de la expresión de esta glicoproteína se encuentra relacionada con una gran variedad de patologías cancerígenas, como son el cáncer de próstata, el cáncer ovárico epitelial16 o el cáncer de mama, siendo incierto el papel de ésta en el melanoma17. La expresión de ésta se ve disminuida en la mayoría de tumores primarios, al igual que ocurre con su hermana sFRP14,18.
Estructura y localización genética y celular de sFRP4
sFRP4 se determinó por primera vez en 1997 de manos de Wolf y su equipo. En la literatura científica se pueden encontrar otras referencias a esta glicoproteína como FRP - 4, frpHE (FRP Human Endometrium), LOC6426, MGC26498 y FRZB2. Esta última denominación se debe a su homología (48,6%) con sFRP3 (FRZB1). Asimismo, sFRP4 es el miembro más conocido de la familia, la cual presenta diferencias fundamentales con el resto basadas en la presencia de seis residuos de cisteína unida mediante puentes disulfuro5,19.
Estructuralmente, la proteína se caracteriza por estar conformada por un total de 364 aa y presentar un peso molecular aproximado de 39,9 kDa5,19. Los plegamientos conformacionales posteriores a la síntesis de la proteína dan como resultado dos dominios independientes. Por un lado, encontramos el CRD, constituido por 110 - 120 aa y cuya fracción terminal guarda un 30% de homología con el dominio localizado en los receptores FZD. Ello se debe a la presencia de 10 residuos de cisteína en ambos dominios5,19,20. Por otro lado, en el dominio NTR o NDL se aprecia una región de elevado contenido en serina y treonina. Este dominio es la diana perfecta para la acción de serina o treonina quinasas, al componerse de varios lugares de fosforilación serina/treonina (9 en el caso de los humanos). Además, los seis residuos de cisteína presentes en el dominio permiten el establecimiento de tres puentes disulfuro5,6,21, ver figura 1.
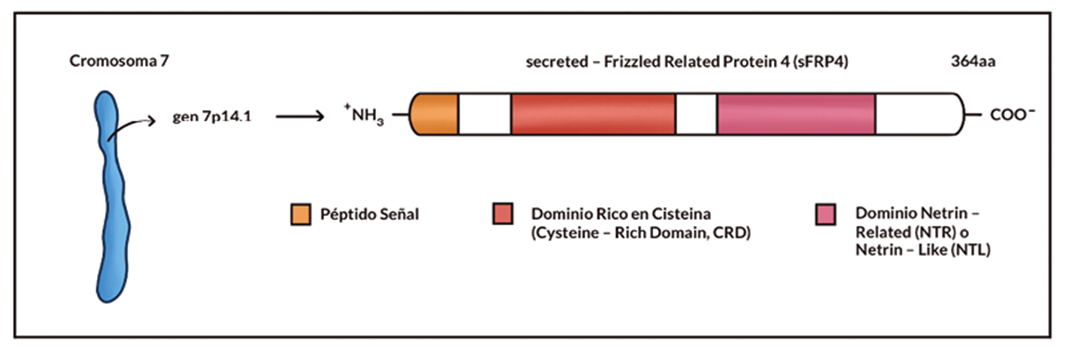
Figura 1. Representación de la localización genética del gen 7p14.1 y la estructura de la proteína sFRP4. En ella se aprecian dos dominios independientes y un péptido señal, que indica que ésta es una proteína secretada.
Este gen codificante para sFRP4 presenta tres transcritos y se asocia con 29 fenotipos5,19,22. Además, cuenta con la presencia de seis exones y una longitud de 10,99 kb, siendo dentro del primer exón donde se localiza el codón de iniciación para la traducción. Por otro lado, la transcripción del gen ocurre desde el telómero hacia el centrómero, es decir, en sentido opuesto 5,19,22,23. Como producto de dicho proceso se obtiene un transcrito primario que cuenta con 2974 pares de bases (pb), de las cuales, 1041 pb conforman la secuencia codificante o mRNA maduro5,19,22, ver figura 1.
La expresión de sFRP4 viene regulada mediante estrógenos y progesterona, de manera que podría intervenir en la morfología y función uterina24. Por su parte, dicha proteína cuenta con una amplia presencia a nivel de tejidos humanos, destacando principalmente el estroma endometrial (existe una mayor expresión de la misma en la fase proliferativa del ciclo menstrual), ovario, riñón, cerebro, glándulas mamarias, cérvix, páncreas, estómago, colon y pulmón5,24. A nivel celular, la síntesis de sFRP4 ocurre en el núcleo, mientras que las modificaciones posteriores y su almacenamiento se suceden en el retículo endoplasmático perinuclear. Con respecto a la secreción de la proteína, ésta tiene lugar mediante vesículas procedentes del retículo y dirigidas hacia la membrana celular. Tanto la localización celular como la secreción de sFRP4 están mediadas por el ligando Wnt3a. La presencia de éste se traduce en la formación de agregados oligoméricos entre sFRP4 y CRD en la región perinuclear y, por ende, se da una redistribución intracelular de la proteína19,25.
Vías de señalización del Wnt y sFRP4
Desde el descubrimiento del primer gen codificante para Wnt (Wnt1) hasta hoy, se ha logrado identificar un total de 19 genes que codifican para estas glicoproteínas. La familia de proteínas Wnt presenta un alto grado de conservación a través de la evolución, desde el género Drosophila, hasta los vertebrados. Estas proteínas son fundamentales para el correcto desarrollo embrionario y el mantenimiento de la homeostasis en el adulto7,26. La familia de ligandos Wnt hace referencia a un conjunto de glicoproteínas solubles que se caracterizan por unirse con receptores FZD, principalmente, y correceptores LRP5/6 (proteínas relacionadas con el receptor de lipoproteínas de baja densidad, LDL)7. Su actividad se centra en el inicio de una cascada de señalización donde la β - catenina juega un papel clave, diferenciando entre la vía canónica (dependiente de la β - catenina) y la vía no canónica (independiente de la β - catenina)27.
Por su parte, los receptores FZD se integran dentro de una familia de proteínas constituidas por siete dominios transmembrana (7TM), los cuales se caracterizan por presentar CRDs en su fracción extracelular (N - terminal). Estos dominios son, de hecho, el lugar de unión de los ligandos Wnt a este receptor6,28.
Vía Canónica
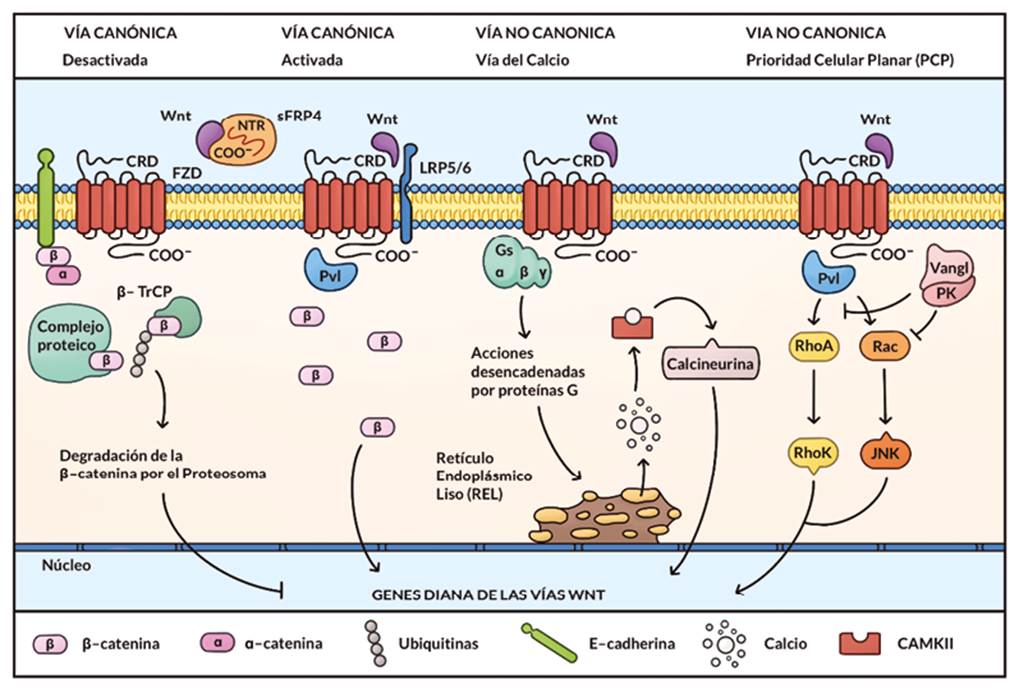
En la vía canónica, cuando el ligando Wnt no inicia la cascada, la β - catenina es objeto de fosforilación por acción del complejo proteico de destrucción. Este está constituido por la unión de las proteínas de andamiaje APC y Axina; las proteínas quinasas CK1 y GSK3β, y la E-3 ubiquitina ligasa β - TrCP29,30,31. Ello permite actuar a la ubiquitina ligasa β - TrCP sobre la β - catenina, de manera que podrá ser degradada por el proteasoma32,33. De esta forma, los factores de transcripción TCF/LEF reprimen los genes diana de la β - catenina mediante el reclutamiento de correpresores Groucho34. Por otro lado, cuando el ligando Wnt se une al FZD y su correceptor LRP5/6, la vía se activa. Así, la proteína citoplasmática de andamiaje Dishevelled (Dvl) recluta a la Axina y permite la fosforilación del extremo citoplasmático del correceptor LRP5/629,35,36,37,38. Como resultado de ello se da la acumulación citoplasmática de la β - catenina y la translocación al núcleo de la misma, uniéndose a TCF/LEF y desplazando a los represores Groucho29,34,29. Todo ello, junto con el reclutamiento de coactivadores transcripcionales como BCP y Pygo/Bcl - 940, permite la expresión de genes relacionados con la carcinogénesis como CCND1, MYC, axina2, DKK1 o LEF130,33, ver figura 2.
Vía no canònica
La vía no canónica suele iniciarse mediante los ligandos Wnt5a y Wnt117. Dentro de ella, podemos diferenciar entre la vía del Calcio (Ca2+) y la vía de la Prioridad Celular Planar (PCP)32,40. La primera de ellas se puede activar por unión del Wnt a FZD o bien al receptor ROR2 (tyrosine kinase - like orphan receptor - 2)41. Ello se traduce en una activación de las proteínas G, que actúan sobre la PLC, aumentando los niveles citoplasmáticos de DAGs (diacilglicéridos) e IP3 (inositol trifosfato). Por su parte, el IP3 difunde hasta el retículo endoplasmático liso (smooth endoplasmic reticulum, SER), permitiendo la liberación del Ca2+ contenido en éste42,43,44. Cabe destacar que, el aumento del Ca2+ puede darse como resultado de la inhibición de la proteína quinasa G (PKG) mediante la acción de la proteína p3833,45. El Ca2+ activa a la calcio/calmodulina dependiente de quinasa II (CaMKII) y, por ende, a la calcineurina, la cual interviene en la activación del NFAT (nuclear factor of activated T cells)44,46. Por su parte, la actuación de los DAGs activa a la proteína quinasa C (PKC) a nivel de la membrana y como resultado de ello, el IκB actúa sobre el factor nuclear κB (NF - κB). Este último migrará al núcleo, de manera que, junto con el NFAT, intenvendrán como factores de transcripción32,43, ver figura 2.
Por otro lado, la vía PCP se inicia cuando la unión de Wnt al FZD activa a las proteínas de unión a GTP RhoA y Rac, así como a sus quinasas efectoras: Rho - quinasa y JNK, promoviendo su translocación al núcleo40,47. La vía se ve interrumpida por la acción las proteínas Van Gohg (Vangl) y Prickle (Pk)35,48, ver figura 2. Esta vía se asocia con la reordenación del citoesqueleto y adhesión celular, regulando los movimientos de la célula y su disposición35,40. Es importante mencionar que la cascada no tiene porqué ser estrictamente a nivel epitelial28.
Mecanismos de acción de sFRP4
Las modificaciones conformacionales posteriores a la síntesis de sFRP4 dan lugar a una homología del 30% entre los sitios de unión de los receptores FZD para los ligandos Wnt y los CRD de la proteína19,20,24. En la actividad de sFRP4 se requieren la presencia tanto del dominio CRD como del NTR. Con respecto al papel del primero, es el lugar por el cual se establece la unión entre los ligandos Wnt y la glicoproteína mediante la formación de puentes disulfuro. Por otro lado, la importancia del domino NTR radica en que éste es el encargado de conferir estabilidad a la estructura proteica, permitiendo así una unión eficaz5,6.
La homología existente entre el CRD de los receptores FZD y sFRP4 permite a los ligandos Wnt la capacidad de unirse tanto al receptor como a la proteína. De esta forma, en caso de que se establezca la unión con ésta última, no se desencadenará el inicio de la cascada de señalización del Wnt. Todo ello hace que se le atribuya a sFRP4 la función de inhibidor o modulador negativo de la vía, principalmente5,37,49,50,51. Así mismo, se afirma que sFRP4 interviene como regulador competitivo en la vía de señalización del Wnt52. Por otro lado, existen estudios que sugieren que sFRP4 se puede comportar como un complejo proteico4. Atendiendo a dicha afirmación, se apunta que la actividad de la proteína va más allá de la inhibición de dicha vía, pudiendo actuar del mismo modo como transportador de proteínas o de ligandos Wnt de amplio rango. Es decir, llevando los ligandos de zonas con menor densidad de receptores, a aquellas donde existe una mayor concentración de los mismos4,5.
Según los trabajos de Pawar & Rao y Claudel et al., se pueden resumir los diversos mecanismos de acción de sFRP4 como modulador de la vía de señalización del Wnt en los siguientes puntos.
a.La interacción de sFRP4 con el ligando Wnt a través de cualquiera de los dos dominios se conoce como antagonismo clásico.
b.A bajas concentraciones de sFRP4 se ha apreciado un aumento de la actividad de la cascada de señalización del Wnt. Dicho fenómeno tiene lugar mediante un mecanismo todavía desconocido.
c.La inhibición del inicio de la cascada de señalización del Wnt se puede llevar a cabo por la formación de complejos inactivos entre los receptores FZD y sFRP4.
d.La unión simultánea del ligando Wnt a sFRP4 y el receptor FZD favorece la señal de transducción.
De esta forma, se puede apreciar que sFRP4 interviene en la regulación de tres vías metabólicas relacionadas con el Wnt, como son la vía canónica, la vía no canónica del calcio y la vía no canónica PCP. Por otro lado, se ha observado que las proteínas sFRP son capaces de interaccionar con otras moléculas diferentes a las que intervienen en las vías del Wnt, como es el caso de la BMP (bone morphogenetic protein)5.
sFRP4 en el cáncer de mama
La génesis tumoral requiere de multitud de procesos celulares como son el desarrollo, la proliferación, la migración y la apoptosis; en los cuales las vías de señalización del Wnt presentan un papel clave2,3,7. Por ello, se puede afirmar la existencia de una correlación entre la cascada de señalización del Wnt y el cáncer de mama en humanos7,53. Además, se ha descrito que sFRP4 es una pieza clave para el inicio de la apoptosis en el cáncer de mama a través de la inhibición de la vía de señalización Akt/PKB, la cual bloquea la apoptosis2,3.
El medio condicionante tumoral (tumour conditioned medium, TCM) que conforma el microambiente es necesario para que se den los cambios adecuados en la morfología y la función de aquellos componentes celulares no cancerígenos que rodean al tumor, como es el caso de las células madre mesenquimales, macrófagos, células endoteliales, células epiteliales y fibroblastos. Como resultado de la presencia de este TCM, se originan fibroblastos asociados al tumor (tumour - associated fibroblasts, TAFs), los cuales contribuyen a la progresión y metástasis tumoral54. Debido a las diversas propiedades que presenta sFRP4 (antitumorales, antiangiogénicas y propoapoptóticas) se ha demostrado que la proteína juega diferentes papeles en el desarrollo del cáncer de mama55. Como ejemplo de dicha intervención, se ha observado que sFRP4 interfiere en la diferenciación de las células madre adiposas derivadas del tejido mesenquimal (adipose derived mesenchymal stem cells, ADMSCs), evitando que éstas muestren un fenotipo carcinogénico y favoreciendo la respuesta al tratamiento54,55.
El desencadenamiento de la carcinogénesis se asocia con eventos erráticos ocurridos a nivel genético y epigenético24,56. El mecanismo por el que los niveles de sFRP4 se ven disminuidos en el cáncer de mama es la hipermetilación del promotor, debido a un fallo en la actividad del enzima DNA metiltransferasa 1 (DNMT1). Como consecuencia de ello, la pérdida de las funciones contribuye a la activación de la vía del Wnt en la génesis tumoral mamaria1,24,57. En resumen, se afirma que la metilación del promotor conlleva una disminución en la expresión de sFRP4.
Por su parte, la complejidad etiológica que presenta el cáncer de mama, donde intervienen multitud de procesos, hace que sFRP4 presente varios frentes de actuación en los que su papel puede ser clave6,58. Atendiendo a diversos estudios in vitro realizados sobre tejidos cancerígenos de diverso tipo, entre ellos el tejido mamario; existe una disminución en la expresión de sFRP4 en dicha enfermedad. De esta forma, un aumento en los niveles de la proteína se tradujo en una reversión de la patología6,7,55. Sin embargo, se ha podido determinar que, en ciertos casos, un aumento en la expresión no se corresponde necesariamente con la apoptosis celular o con una disminución de los mecanismos anteriores. Esto puede deberse a la implicación de sFRP4 en otras vías de señalización55. Todo ello lleva a pensar que una disminución en la expresión de sFRP4 se asocia con la aparición del cáncer de mama.
Finalmente, se ha observado que en concentraciones crecientes de glucosa sFRP4 interviene de forma negativa tanto en la adhesión, como en la capacidad de renovación de las células madre cancerosas (CSCs). Esto indica que la acción antiproliferativa de sFRP4 es independiente de aquellos nutrientes exógenos que son clave para el microambiente. Por otro lado, la acción de la proteína disminuye el ratio NAD+/NADH, haciendo a las CSCs más susceptibles al estrés inducido por las especies reactivas de oxígenos (EROs). Así mismo, sFRP4 es capaz de intervenir en el metabolismo de la glutamina, disminuyendo por tanto la secreción de glutamato55. Todos estos mecanismos permiten afirmar que sFRP4 altera el metabolismo de las células madre cancerosas.
sFRP4 y el tratamiento del cáncer de mama
En el tratamiento del cáncer de mama se pueden seguir diversas estrategias. La principal de ellas es la cirugía, la cual se suele combinar con quimioterapia, radioterapia u hormonoterapia. Sin embargo, los numerosos efectos adversos y la posibilidad de desarrollar resistencia al tratamiento, hacen que los esfuerzos científicos se dirijan a buscar tratamientos que aborden la patología de una forma más específica44,59,60.
Desde el descubrimiento de sFRP4, esta proteína se ha asociado con el inicio y el desarrollo del cáncer55. De acuerdo con dicha afirmación, existen estudios que se han focalizado en dicha proteína y el tratamiento del cáncer de mama. Siguiendo esta línea, se ha descrito un aumento de la apoptosis como resultado de la intervención de sFRP4 en el ciclo celular de las células cancerosas2,3,61. Dicha actividad se ve incrementada cuando la proteína se asocia con tratamiento quimioterápico. Ello se debe a un aumento en la actividad de la caspasa3, de manera que se aprecia un deterioro importante en las membranas mitocondriales de las CSCs. Todo ello indica que las células se encuentran próximas a la muerte. Además, sFRP4 actúa promoviendo la expresión de genes proapoptóticos (Bax) y disminuyendo la de genes antiapoptóticos (Bcl - x1), así como la de genes procarcinogénicos (ABCG2, CNDD1)61.
Por su parte, el uso de los ligandos Wnt y sus receptores como diana terapéutica demostró eficacia en modelos humanos y animales, aunque sus efectos en la metástasis del cáncer de mama no son contundentes7. Así mismo, se ha llegado a establecer una correlación entre el papel que desempeñan las CSCs en el inicio y desarrollo de la enfermedad con la vía de señalización del Wnt44,61,62. Las CSCs se caracterizan por encontrarse formando agregados, que dan lugar a estructuras esferoides. De esta forma, se ha visto que el tratamiento de sFRP4 en combinación con los quimioterápicos doxorrubicina y cis - platino da como resultado la segregación de dichas estructuras y una disminución en el número de receptores en la membrana. Por lo tanto, se puede afirmar que sFRP4 permite a los agentes quimioterápicos que actúen inhibiendo la proliferación61.
Anteriormente se ha apuntado que la disminución de la expresión de sFRP4 se debe a la hipermetilación del promotor por acción errática de la DNMT11,24,57. De este modo, se ha obtenido una disminución de la supervivencia de las CSCs tumorales y una menor progresión de la enfermedad a través del aumento de la expresión de sFRP4 mediante el uso de agentes desmetilantes, como la 5 - azacitidina1.
Finalmente, la diosgenina (DG) es una saponina esteroídica que se encuentra de forma natural en plantas como el ñame o el fenogreco y que se caracteriza por presentar propiedades antitumorales en determinados tipos de cáncer. Este fenómeno tiene su explicación en la activación de la proteína p53 y la vía de las caspasas. Por su parte, el tratamiento de CSCs procedentes de tumores mamarios, mediante la combinación de sFRP4 y DG como agentes terapéuticos, se tradujo en una disminución de la supervivencia de las células y una menor progresión de la enfermedad63.
Conclusión
La etiología del cáncer de mama es muy compleja debido a su perfil multifactorial, en el que convergen multitud de procesos. Todo ello, junto con los diversos efectos adversos que presenta el tratamiento de la enfermedad; justifica que los esfuerzos científicos se dirijan en el avance hacia una medicina cada vez más personalizada y menos invasiva. Dichos avances se basan en el conocimiento de las bases moleculares de las distintas patologías. En relación al cáncer, uno de los mecanismos celulares que desempeña un papel fundamental en el inicio y desarrollo de la patología es la cascada de señalización del Wnt, Dentro de los inhibidores de dicha vía se localiza la glicoproteína sFRP4, aunque el mecanismo de acción de ésta no está definido por completo. De esta forma, apreciamos que un mayor estudio de las bases moleculares del cáncer de mama y la vía del Wnt, así como del mecanismo de acción de sFRP4; supondrá un gran avance en aras de alcanzar un tratamiento médico más personalizado.
Con objeto de conocer las bases moléculas de las enfermedades y las posibles alternativas para su tratamiento, tanto la genética como la epigenética están adquiriendo una relevancia destacable en la actualidad. Se ha observado que la disminución en la expresión de sFRP4 se debe a la hipermetilación del promotor como resultado de la actividad errónea de la DNMT1. Así mismo, se ha observado que sFRP4 es un elemento crítico para el inicio y la progresión de la enfermedad a nivel del tejido mamario. De igual forma, la asociación de la proteína con los agentes quimioterápicos destinados al tratamiento del cáncer de mama ha supuesto una sinergia en los efectos, obteniendo resultados notables. Sin embargo, el número de investigaciones en las que se relaciona a sFRP4 con el cáncer de mama no son suficientes para considerar a dicha proteína como biomarcador de la enfermedad. Debido al gran potencial de sFRP4, futuras líneas de investigación dirigidas hacia la determinación de sFRP4 como biomarcador, realizadas en tejidos humanos, cultivos celulares o líneas celulares humanas; así como la modificación epigenética de su expresión, serán de gran aporte científico para el avance en el tratamiento, diagnóstico y pronóstico del cáncer de mama.