INTRODUCCIÓN
El cáncer de tiroides, en la actualidad, es el tumor endocrino más frecuente, constituye del 1-1,5% de todos los canceres. En la mayoría de las ocasiones se trata de carcinomas papilares y foliculares diferenciados de tiroides (CDT) y el 90% de éstos son de estirpe papilar (CPT). La incidencia de estos tumores está aumentando, aunque, en parte, es debido a la mejora en las técnicas de imagen y a la mayor utilización de la ecografía cervical sobre todo en pacientes asintomáticos [1-3].
El tratamiento inicial de estos tumores es la cirugía, tanto del tiroides como de los ganglios linfáticos cervicales. Las técnicas de elección, lobectomía o tiroidectomía total dependen del tamaño y características del tumor mientras que la realización de linfadenectomías del compartimento central y/o lateral viene marcada bien por la presencia de metástasis ganglionares y otros factores añadidos como el riesgo de recidiva, tamaño tumoral, existencia de extensión extratiroidea y la afectación del compartimento lateral [1].
El pronóstico del CPT respecto a la mortalidad es excelente, con tasas de supervivencia del 96-98 % a los 5 años. Sin embargo, hasta un tercio de los pacientes (20-50%) presentarán una recurrencia durante su seguimiento. La mayoría de estas recurrencias (75-80%) serán loco-regionales y suelen detectarse durante los primeros 10 años después de la cirugía inicial [4-7].
El tratamiento de estas recurrencias, así como de la persistencia de enfermedad cervical abarca desde la vigilancia activa, tratamientos con radio yodo, terapias mínimamente invasivas, cirugía y, más raramente, tratamientos sistémicos y radioterápicos, idealmente, indicados de forma individualizada dentro de equipos multidisciplinares y consensuados con el paciente [8-10].
Cuando contemplamos, específicamente, el tratamiento quirúrgico de las recidivas cervicales es necesario considerar que la cirugía de cuello previamente intervenido (cirugía de revisión) es difícil y laboriosa. La mayoría de las metástasis no son palpables, por lo que resulta difícil su identificación en el quirófano, bien por la localización ortotópica o no de las mismas, por su pequeño tamaño o por la distorsión del campo quirúrgico originada por intervenciones previas, radioterapia, fibrosis, infección y otras condiciones propias del paciente.
Todas estas circunstancias incrementan el tiempo quirúrgico necesario para su realización, un mayor porcentaje de cirugías incompletas o incluso fallidas y un aumento de efectos secundarios y secuelas para el paciente, sobre todo, cuando se actúa sobre el compartimento central, tales como la parálisis recurrencial (1-12%), el hipoparatiroidismo definitivo (1-4%) y otras complicaciones como el síndrome de Horner (0,7-1%), la lesión del nervio espinal (0,2-1%), hematomas y roturas vasculares y linfáticas [1-3,11-13].
Todos estos motivos han llevado al diseño y la implementación de estrategias y herramientas para localizar estas tumoraciones durante la cirugía, mejorando la facilidad y seguridad de estas y disminuyendo la tasa de intervenciones ineficaces. Para la utilización de estas técnicas de localización es fundamental la formación de un equipo multidisciplinar que integre y coordine la participación de distintas especialidades.
TECNICAS DE LOCALIZACION QUIRURGICA CERVICAL
Revisaremos brevemente las técnicas más empleadas en la cirugía de la recurrencia cervical del cáncer de tiroides. Entre las mismas, las técnicas de tatuaje, ecografía intraoperatoria, guías metálicas y la cirugía radioguiada en sus distintas modalidades, profundizando más en el uso de semillas radioactivas marcadas con 125I.
Ecografía intraoperatoria (EIO)
La ecografía preoperatoria es el método de imagen más sensible para detectar adenopatías metastásicas no palpables en el cáncer de tiroides, ayudando a planificar la cirugía para su extirpación [14-16]. Incluso las metástasis que no son detectadas con la ecografía preoperatoria pueden detectarse realizando el estudio dentro del mismo quirófano [17,18], reduciendo la permanencia de tumor residual tras la cirugía [19] y acortando el tiempo de la intervención [17]. Requiere la presencia de un aparato de ecografía en el quirófano y de un experimentado radiólogo o cirujano entrenado, para identificar los tumores, comprobando, posteriormente, su correcta extirpación. En no pocas ocasiones no es posible practicar un examen completo de los tumores o su pequeño tamaño una vez expuesta la herida quirúrgica [20]; además, su utilidad es muy limitada en tumores localizadas en las porciones bajas del cuello o por detrás de la clavícula [20].
Tatuajes con carbón vegetal
La utilización de colorante (azul de metileno) administrado dentro del tumor durante la ecografía preoperatoria mejora la localización de tumores durante la cirugía, pero suelen difundir rápidamente y pueden ser potencialmente tóxicos [21]. Una alternativa a la utilización de colorantes sería el uso de carbón vegetal para marcar la tumoración durante la ecografía preoperatoria. En esta técnica, se introduce, bajo control ecográfico, una suspensión de carbón vegetal para tatuar el tumor para resecar. Durante su administración se deja un rastro en el recorrido de la aguja hasta la piel, donde persistirá un tatuaje parecido a un pequeño nevus que permanecerá durante algunas semanas. Este procedimiento se puede realizar hasta varias semanas antes de la cirugía, es fácil de implementar, barato, bien tolerado y no muestra complicaciones relacionadas con el procedimiento; sin embargo, el carbón puede dispersarse y emborronar el campo quirúrgico, la piel puede quedar tatuada de forma permanente y puede haber un compromiso del examen histológico cuando se inyecta dentro del tumor [22,23].
Arpones o guías metálicas.
Se trata de la colocación de una guía metálica transcutánea o arpón en las tumoraciones visualizadas en la ecografía, horas previas a la intervención. Esta técnica es ampliamente usada en los tumores no palpables de la mama, con muy buenos resultados y posteriormente se ha extendido a la cirugía de cabeza y cuello, con un amplio rango de aplicaciones (quistes del tirogloso, ganglios cervicales y tumores parotídeos [24-26]. Las ventajas con las que cuenta incluyen: la posibilidad de visualizar ecográficamente si el tumor está correctamente marcado, proporciona una vía de abordaje quirúrgico y reduce el tiempo de la intervención a un bajo coste económico, suele estar disponible en la mayoría de los hospitales y no utiliza sustancias radiactivas [27].
Es necesaria una estrecha colaboración entre el radiólogo y el cirujano, ya que es preciso disponer de un ecógrafo cerca del quirófano. También, es operador dependiente y la colocación del arpón tiene que realizarse en las horas previas a la cirugía, por lo que disminuye la flexibilidad en la programación del quirófano. Está descrito en la patología mamaría la posibilidad de movilización o migración del arpón, así como de hemorragias y hematomas [26].
Semillas magnéticas
En este procedimiento novedoso se utilizan pequeñas semillas magnéticamente sensibles, de aproximadamente 5 mm x 1 mm, que se implantan bajo control ecográfico en el tumor y se localizan en el quirófano utilizando una sonda ferromagnética que emite señales acústicas cuando se sostiene sobre el tumor para extirpar, aunque su capacidad de detección en profundidad es de pocos milímetros. Permite su implantación hasta cuatro semanas antes de la cirugía. En tiroides solo se ha publicado su utilidad en la técnica del ganglio centinela [28].
Cirugía radioguiada con131I
Dentro del ámbito de la cirugía radioguiada, la más elemental es la cirugía radioguiada utilizando trazadores sistémicos y una sonda gamma. Se administra en los días previos a la cirugía por vía sistémica un radiofármaco. En el caso del tejido tiroideo, se administra 131I (a dosis terapéutica o diagnóstica) [29] o bien 123I (con mejores características dosimétricas) [30].
En tumores refractarios a yodo, se ha utilizado otro isotopo como el MIBI-99mTc, también con una buena dosimetría. Sin embargo, tiene el inconveniente de un periodo de lavado rápido que dificulta su localización en el quirófano, por lo que no ha tenido gran expansión [31-32].
Los principales inconvenientes de esta técnica van a venir derivados de las dosis de radiación que recibe el equipo sanitario y el paciente, de la presencia de falsos positivos debido a la fijación fisiológica del radioyodo en otras estructuras, de los falsos negativos en las tumoraciones yodo refractarias y de la dificultad en la búsqueda de tumores en el quirófano debido a la alta actividad circulante, que determina una relación señal/fondo desfavorable [25,29,33].
ROLL (Radioguided Ocult Lesión Localization)
La técnica de ROLL se introdujo para la detección de tumores no palpables de mama en 2011, pero en estos últimos años se han ido ampliando sus indicaciones a otros tumores, como son los de cabeza cuello; habiéndose comunicado su utilidad en recurrencia/persistencia cervical de cáncer de tiroides por diversos grupos con buenos resultados [9,17,34-36]. Esta técnica de cirugía radioguiada ha sustituido a la realizada con trazadores sistémicos. El radiofármaco se administra dentro del tumor, horas previas a la cirugía (la vida media del 99mTc es de 6 horas), bajo control ecográfico. Se trata de partículas de gran tamaño (MAA-99mTc), con mínima difusión a tejidos circundantes, lo que proporciona una reducida irradiación del paciente y del personal sanitario [37]. También, posibilita extirpar tumores sin avidez por el radioyodo y proporciona un alto contraste señal/fondo durante la cirugía [38,39]. Por el contrario, existe la posibilidad de contaminación del trazador en el trayecto de la aguja y de su difusión fuera del tumor. También, puede ser difícil comprobar su correcta administración ya que los MAA-99mTc utilizados en la técnica ROLL son radiológicamente invisibles y difíciles de visualizar ecográficamente. Por otra parte, cuando el radiofármaco difunde fuera del tumor o hay una rotura capsular del ganglio se enmascara la ubicación real de la tumoración, lo que provoca resecciones más extensas del tejido no afecto con el consiguiente riesgo de complicaciones.
RSL (Radiactive Seed Location)
En la última década, se ha extendido la utilización de semillas radiactivas en la cirugía de la mama, tanto para localización de tumores no palpables en la mama con gran éxito [40], como para marcar ganglios [41] metastásicos en la axila tras neoadyuvancia (MARI, TAC y RISAS) [41-44]. Algunos grupos han publicado su utilidad en la localización de otros tumores, como masas no palpables de partes blandas, adenomas de paratiroides, tumores únicos en pulmón [45-47] y, recientemente, se ha ampliado su utilidad en la localización de metástasis cervicales en el cáncer de tiroides de distinto origen [48-53]. Ver Tabla 1.
Tabla 1. Experiencia publicada con RSL.
|
autor |
n |
edad (años) |
histología |
éxito |
complicación |
tiempo CIA (min) |
tiempo ECO (min) |
tamaño ECO (cm) |
tiempo de semilla (días) |
|---|---|---|---|---|---|---|---|---|---|
|
Garner et al. (50) |
3 |
55 (51-57) |
CDT |
3 |
NO |
109 (75-109) |
-- |
0,8-2,0 |
0-3 |
|
Cambil et al. (51) |
10 |
54,8 (34-69) |
CDT |
10 |
1 HPPT |
44 (15-120) |
>12,5 (7-21) |
0,8-2,5 |
4 (1-7) |
|
Beniey et al.(49) |
1 |
-- |
CDT |
1 |
NO |
-- |
-- |
1.7 |
3 |
|
Vilar et al.(53) |
3 |
51 (33-64) |
CDT |
3 |
NO |
-- |
-- |
0,7-1,2 |
-- |
|
Pérez et al. (48) |
1 |
60 |
CMT |
1 |
NO |
-- |
-- |
-- |
-- |
|
Bortz et al. (52) |
6 |
59 (37-74) |
CDT |
5 |
2 PCVT |
140 |
-- |
-- |
0-3 |
|
Bortz et al. (52) |
2 |
69 (59-79) |
PTH(A) |
2 |
NO |
125 |
-- |
-- |
0-3 |
Tiempo CIA: tiempo del procedimiento quirúrgico en minutos. Tiempo ECO: tiempo de la inserción de la semilla mediante ecografía en su correcta localización. Tamaño ECO: diámetro máximo del tumor en cm. Tiempo de semilla: días desde la implantación a la cirugía.
Esta técnica consiste en la implantación de una semilla de 125I en el tumor para extirpar, bajo control ecográfico, para su posterior retirada en el quirófano. Esta semilla no está destinada a proporcionar una dosis terapéutica al tejido, sólo se trata de un marcador que proporciona una fuente de radiactividad puntual estable que permite la ubicación precisa del tumor.
Este tipo de cirugía radioguiada es fácil de realizar, con buena aceptación tanto por el paciente como por el cirujano; aunque al tratarse de una fuente radiactiva, la implantación de esta técnica puede parecer compleja. En primer lugar, es necesario un equipo multidisciplinar en el que estará incluido el radiólogo, endocrinólogo, cirujano, patólogo, médico nuclear y el servicio de Radiofísica perfectamente coordinados y organizados; así como una autorización del Consejo de Seguridad Nuclear con una serie de recomendaciones de seguridad para su implantación [54-56]. La ventaja es que dada la gran expansión que ha tenido esta técnica en el cáncer de mama, cada vez hay más hospitales que ya la tienen autorizada y están familiarizados con el procedimiento.
La semilla consiste en una capsula de titanio, de 4 mm. de largo, que contiene 125I en su interior y se encuentra herméticamente cerrada, lo que impide el riesgo de contaminación durante su manipulación y de difusión del radiofármaco fuera del tumor. Tiene una vida media larga (59 días), lo que permite su colocación días previos a la cirugía, es ecorrefrigente permitiendo comprobar en la ecografía su correcta colocación y tiene una energía favorable para nuestra instrumentación y para el paciente.
Bajo control ecográfico, en condiciones de esterilidad, y tras anestesia local esta semilla se deposita dentro del tumor, mediante una aguja espinal de punta tipo Quincke de 18G, con cera ósea en su bisel para evitar su migración (Figura 1). Una vez depositada se comprueba su correcta localización dentro del tumor con el ecógrafo (Figura 2) y con un contador Geiger-Müller.
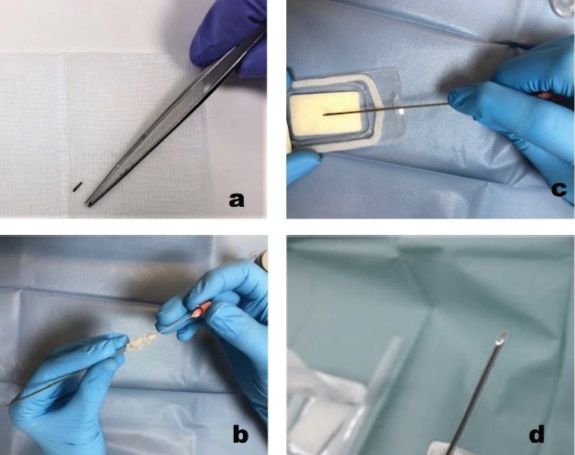
Figura 1. Preparación de la semilla para su implantación. Inserción de la semilla en una aguja espinal 18G (a, b). Colocación de cera ósea en bisel de la aguja para evitar su migración durante el procedimiento (c) e Imagen de la aguja con la semilla en su interior lista para la implantación (d).
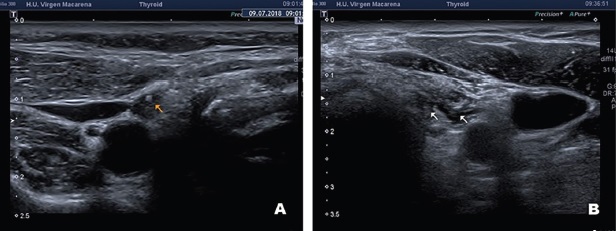
Figura 2. Imágenes ecográficas de la semilla una vez colocada dentro del tumor. Paciente intervenido hace 4 años de tiroidectomía y vaciamiento central y derecho, que presenta un ganglio metastásico en área III derecha al que se le coloca una semilla (flecha amarilla) (A). Paciente intervenido en 5 ocasiones, que presenta dos tumoraciones metastásicas paratraqueales izquierdas (flechas blancas) (B).
Hasta ahora la única opción era utilizar las semillas sobrantes de braquiterapia, sin actividad terapéutica, esterilizándolas e introduciéndolas en una aguja espinal [57], pero en la actualidad, se han comercializado estas semillas, ya cargadas y estériles, listas para su utilización.
Durante la maniobra de implantación debemos evitar entrada y salidas bruscas de la aguja. Al paciente se le recomienda que no realice movimientos bruscos con el cuello hasta su intervención, para evitar su migración. Al paciente se le suministra información sobre el procedimiento, a través de un consentimiento informado, una tarjeta con las características y número de registro de la semilla y unas mínimas normas de radio protección.
Las semillas se pueden colocar hasta siete días antes de la intervención, permitiendo mayor flexibilidad en la planificación quirúrgica. En caso de tratarse de varias tumoraciones, podemos utilizar hasta tres semillas. Esta circunstancia permite una gran flexibilidad en la programación de la cirugía y elimina, a diferencia del ROLL, el tener que contar con el ecografista y con el médico nuclear las horas previas a la misma, evitando conflictos en la programación y actividad de los quirófanos.
Con respecto a la cirugía, utilizaremos, como en todas las cirugías radioguiadas, una sonda gamma y una gammacámara portátil.
En el quirófano, previamente a la intervención, realizaremos rastreos e imágenes del cuello para localizar el punto de máxima actividad y con ello localizar el área de proyección de la semilla, buscando el acceso óptimo, con objeto de realizar una cirugía mínimamente invasiva. Posteriormente, seguiremos rastreando y obteniendo imágenes del campo quirúrgico durante la intervención, tratando de localizar ese punto de máxima actividad, hasta señalizar el tumor con la semilla en su interior (Figura 3). Una vez extirpada ésta, realizaremos contajes e imagen de la pieza quirúrgica y del lecho quirúrgico para comprobar que la semilla se encuentra en la pieza quirúrgica extirpada (Figura 4).
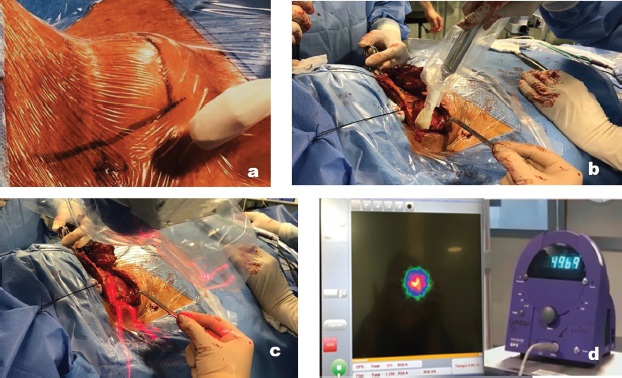
Figura 3. Secuencia de la intervención. Búsqueda con sonda gamma de la zona de máxima actividad para elegir la zona de la mejor incisión (a). Rastreo con sonda en el campo quirúrgico, buscando el punto de máxima actividad que es donde estará la semilla y el tumor (b). Rastreo con gammacámara portátil (c). Imagen del monitor de la gammacámara y del monitor de la sonda gamma (muestra un alto contaje de actividad) del ganglio con la semilla en su interior (d).
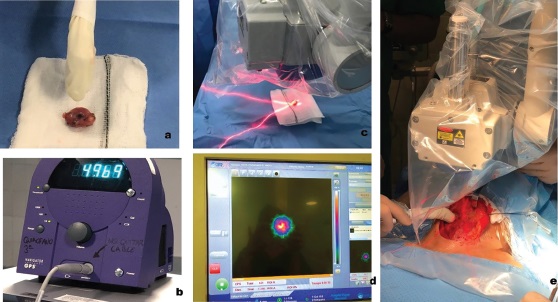
Figura 4. Secuencia final de la intervención. Comprobación con la sonda gamma que la semilla está en la adenopatía extirpada (a y b) y con la gammacámara (c y d). Comprobación de que no queda actividad en el lecho quirúrgico (e).
La pieza es enviada a radiología para comprobar que la semilla se encuentra dentro del ganglio o tumor y posteriormente al departamento de anatomía patológica, donde un técnico o el médico nuclear retirará la semilla para su correcto almacenaje [51].
El principal problema en relación con esta técnica radica en la colocación incorrecta de la semilla o en su desplazamiento fuera del tumor, aunque en la bibliografía actual se ha referido como algo anecdótico [51]. La duración del procedimiento de inserción no es muy larga, en torno de 10 a 15 minutos, aunque a veces es mayor cuando se hace necesario separar las estructuras nerviosas y vasculares adyacentes mediante la instilación de suero fisiológico o glucosado [51].
En general, los tiempos quirúrgicos recogidos en la literatura son similares o inferiores a los publicados con la técnica ROLL [35,45,51,52] y la satisfacción de los equipos quirúrgicos ha resultado muy positiva en todas las series publicadas [45,51-53], principalmente por ser una técnica bien tolerada por el paciente, conseguir mejores resultados estéticos y evitar la morbilidad, especialmente en el compartimento central. Permite incisiones más pequeñas y resulta cómoda y segura para el cirujano. Las precauciones habituales en este procedimiento pasan por conocer en todo momento dónde está la semilla (en la sala de ecografías, quirófano y anatomía patológica), no tocarla directamente con las manos, limitar el uso del sistema de aspiración y evitar maniobras bruscas que puedan provocar la pérdida o daño de la semilla dentro del campo quirúrgico.
Con respecto a la exposición a emisiones radioactivas asociadas al procedimiento, se ha comprobado que tanto los pacientes como los profesionales están expuestos a niveles mínimos de radiación [51,54,58], por lo que, el paciente no tiene que mantener normas de protección radiológica en su domicilio ni el personal médico tiene que limitar sus actividades. En cuanto a las complicaciones asociadas al procedimiento, se han informado de un hipoparatiroidismo transitorio [51] y dos parálisis de cuerdas vocales también transitorias [52].
CONCLUSIONES
En la actualidad, dentro de las diversas técnicas de localización empleadas en la cirugía de revisión cervical del cáncer de tiroides, la RSL es una técnica emergente que está demostrando excelentes resultados en el tratamiento de las recidivas no palpables de CDT. Su incorporación a las unidades de cáncer tiroides es relativamente fácil en aquellos centros con experiencia previa en otras patologías (fundamentalmente la mama) y que disponen de equipos multidisciplinares formados por endocrinólogos, radiólogos, cirujanos, médicos nucleares y patólogos. La RSL ha demostrado en estos centros beneficios tanto para los pacientes como para los equipos sanitarios con una excelente aceptación por ambos.














