INTRODUCCIÓN
La otitis externa maligna (OEM) o necrotizante, es una infección agresiva, de los tejidos blandos del oído externo y estructuras circundantes, que puede diseminarse e involucrar a la base del cráneo (por lo que también se denomina “osteomielitis de la base del cráneo”) [1]. A pesar de los avances terapéuticos la mortalidad de esta enfermedad sigue siendo importante [1-3].
Categorizada en 1838 por Toulmouche, no fue hasta 1963 cuando Hahn y Chandler denominan a este proceso como “otitis externa maligna” [4] que, en 1973, Evans y Richards sustituyen por el de necrotizante, al no tratarse de una afección neoplásica [5]. Aunque quizá menos preciso, dado que el término vernáculo es el de OEM, será el que emplearemos en este artículo [6].
Siendo una enfermedad infrecuente, hay pocos estudios sobre su incidencia a nivel mundial [7-8]. La estimada en España es de 1,30 por 106 personas y año [9].
Afecta fundamentalmente a mayores de 65 años, especialmente diabéticos e inmunodeprimidos, aunque se ha descrito sin asociarse a otras comorbilidades [7, 10]. Con frecuencia se registra un antecedente traumático del CAE, relacionado con irrigación, limpieza, irritación de prótesis auditiva, cirugía reciente de oído, etc. [6, 10-11].
Suele estar producida por Pseudomonas aeruginosa, pero puede ser causada por otras bacterias y hongos. El diagnóstico debe sospecharse en pacientes con los antecedentes mencionados y una clínica que se caracteriza por la presencia de otalgia (predominantemente nocturna) y otorrea, que no remiten en 2 semanas, pese al tratamiento convencional de la otitis externa aguda (OE aguda). En la exploración se suele detectar inflamación del conducto y/o preauricular, con tejido de granulación en el interior del CAE y una prueba de imagen compatible (tomografía computarizada -TC-, resonancia magnética -RM- gammagrafía u otras) [10]. Las complicaciones más habituales son la osteomielitis y la parálisis de los nervios craneales [7].
Los avances en la antibioterapia antipseudomona han reducido drásticamente la mortalidad; pero el abuso de las fluoroquinolonas, en el tratamiento de la OE aguda, ha incrementado la negatividad de los cultivos y ha contribuido a un aumento de las resistencias frente a P. aeruginosa [2, 10].
En el momento actual sólo conocemos algunos indicadores pronóstico y carecemos de un consenso diagnóstico-terapéutico [1-2, 12-20], por lo que, dada su escasa incidencia, hemos considerado conveniente revisar nuestra experiencia en un hospital de tercer nivel (HCUV) y elaborar un protocolo de diagnóstico y tratamiento, basado en los resultados obtenidos y en las recomendaciones publicadas.
MATERIAL Y MÉTODO
Se realizó un estudio descriptivo, observacional y retrospectivo, de los pacientes ingresados en el HCUV por OEM entre los años 1996 y 2021. Para ello fue de especial importancia la colaboración del Servicio de Estadística, que proporcionó los números de historia clínica de aquellos pacientes cuyo diagnóstico se codificó, de acuerdo con la Clasificación Internacional de Enfermedades (CIE 9-MC), como 380.14 (otitis externa maligna) hasta el año 2015 y como H60.20/H60.23 desde el 2016. El estudio fue aprobado por el Comité de Ética (CEIm) del área de salud de Valladolid Este (PI 22-2547).
Los criterios diagnósticos se basaron en el juicio clínico del equipo médico durante el proceso del paciente, referido a la infección necrotizante del oído externo (síntomas, exploración física, estudio analítico, diagnóstico microbiológico, y anatomo-patológico mediante biopsia) y a su confirmación mediante pruebas de imagen (TC, gammagrafía con tecnecio 99 o leucocitos marcados con galio 67).
El análisis de los datos se realizó utilizando una hoja de cálculo de Microsoft™ Excel, donde se fueron incluyendo las siguientes variables: edad, sexo, inmunodepresión, oído afecto, presencia de otalgia y otorrea, existencia de tejido de granulación en CAE, afectación de pares craneales y articulación temporomandibular, germen aislado en cultivo, elevación de velocidad de sedimentación globular (VSG) y/o proteína C reactiva (PCR), prueba/s de imagen realizadas y estadificación de la TC, tratamiento antibiótico y/o quirúrgico, y evolución del paciente.
Junto a la evaluación de los resultados, realizamos una revisión narrativa, recopilando los conceptos más actualizados de la literatura sobre la OEM, para terminar con un protocolo diagnóstico-terapéutico adaptado a nuestro medio.
RESULTADOS
En los últimos 25 años se ingresaron diez pacientes por OEM, que aparecen recogidos en la Tabla 1 (Anexo 1). Se excluyó a uno de ellos porque el resultado del estudio anatomopatológico fue de carcinoma epidermoide del CAE. Si consideramos aleatoriamente el periodo de 10 años, comprendido entre 2010 y 2019, en el que conocemos la población adscrita a nuestro área de salud (2.659.029 individuos), hemos diagnosticado de OEM a 5 pacientes, lo que ofrece una incidencia anual de 1,8 OEM x 106 habitantes/año. Basándonos en los criterios diagnósticos de Hodgson et al. (2022) [11] (Tabla 2), todos nuestros casos fueron definitivos, al presentar un síndrome clínico definido (determinado por la presencia de otalgia y tejido de granulación en CAE) y cambios radiológicos consistentes con OEM (Tabla 1 (Anexo 1)).
Tabla 2: Clasificación OEM.
|
Síndrome clínico |
Definición |
|---|---|
|
OEM definitiva |
Síndrome clínico definido Y cambios radiológicos consistentes con OEM O Síndrome clínico definido, con parálisis de nervios craneales en ausencia de cambios radiológicos consistentes con OEM. |
|
OEM probable |
Síndrome clínico definido, sin parálisis de nervios craneales Y con factores de riesgo, en ausencia de cambios radiológicos consistentes con OEM. |
|
OEM posible |
Síndrome clínico definido, sin parálisis de nervios craneales, sin factores de riesgo y sin signos radiológicos consistentes con OEM. |
Síndrome clínico definido = otalgia y presencia de tejido de granulación en el CAE del oído afecto. Modificado de Hodgson et al. (2022) [11]. Se consideran factores de riesgo: diabetes, edad > 80 años, alcoholismo crónico, malnutrición severa, uso de medicación inmunosupresora, SIDA/VIH y quimioterapia reciente [11].
La edad media de nuestros pacientes fue de 76,88±10,92 años (56-93 años), con un 78% de varones. Cinco de los cuales (55%) tenían diabetes mellitus tipo 2, con o sin complicaciones asociadas, como enfermedad renal crónica (ERC) y leucemia linfática crónica. Dos padecían ERC aislada, estadio 5, en hemodiálisis, y los dos pacientes restantes no presentaban factores de riesgo relevantes (22%) (Tabla 1 (Anexo 1)).
Las manifestaciones más precoces de la enfermedad fueron la otalgia con otorrea y la presencia de tejido de granulación en el CAE, cuya biopsia se remitió al Servicio de Anatomía Patológica, con resultado concordante con la sospecha clínica (tejido de granulación en todos los casos, Tabla 1 (Anexo 1)). Ninguno tuvo afectación de pares craneales, pero cuatro sufrieron invasión de la ATM, evidenciada en las pruebas de imagen (Figura 1).
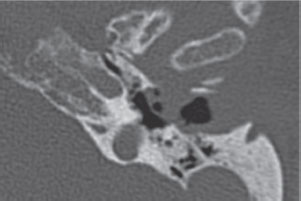
Figura 1. TC axial, oído izquierdo: Evidencia de destrucción de pared anterior de CAE y comunicación directa con ATM.
Para el diagnóstico inicial se llevó a cabo una toma de exudado del CAE para cultivo y se solicitó TC en todos los pacientes, complementándolo en cinco casos con una gammagrafía con Tc99m y en cuatro, con una gammagrafía con leucocitos marcados con Ga67.
En cuanto a los microorganismos aislados en la muestra para cultivo, cabe destacar la gran variabilidad encontrada. Sólo en tres el cultivo fue positivo para Pseudomonas aeruginosa (33%), aislada o con otros gérmenes como Staphiloccocus aureus resistente a meticilina (SAMR) o Candida orthopsilosis (Tabla 1 (Anexo 1)).
En cuatro de los seis pacientes en los que se solicitaron niveles de VSG y PCR, al menos uno de ellos se encontraba elevado, aunque en algunos casos la petición se realizó una vez iniciado el tratamiento antibiótico intravenoso, pudiendo justificar la normalización de la prueba.
Respecto al tratamiento, todos los pacientes recibieron antibióticos antipseudomona con o sin antifúngico, por vía intravenosa, durante 10 semanas de media. Solo en uno de los casos se realizó cirugía de la ATM por no responder al tratamiento antibiótico parenteral.
De los nueve individuos de la muestra, dos fallecieron (22%), uno por ERC multifactorial (entre los que se incluye el tratamiento con aminoglucósidos) y otro por neumonía nosocomial sin haber remitido la OEM.
DISCUSIÓN
En 1968 Chandler describe la OEM como una infección del oído externo que no responde a los tratamientos habituales, ocurriendo casi exclusivamente en pacientes ancianos y diabéticos, cuya exploración otoscópica ponía de manifiesto la presencia de tejido de granulación en la unión osteo-cartilaginosa del CAE [4]. La granulación, causada por la osteítis subyacente [16], se considera patognomónica de OEM, sin embargo, este hallazgo puede estar ausente en casos atípicos (VIH/SIDA y niños) [10, 14]. En todos nuestros pacientes detectamos y biopsiamos este tejido de granulación.
Algunos consideran que la OEM es sinónimo de osteomielitis de la base del cráneo, [16, 19], pero hay que tener en cuenta que las pruebas de imagen no tienen una sensibilidad del 100% para detectarla, pudiendo ser negativas en presencia de OEM, por lo que, de acuerdo con otros, consideramos que la constatación de la osteomielitis representa un estadio más avanzado de la OEM [21-22].
Epidemiología: dado el escaso número, los datos de incidencia de los pacientes ingresados con OEM en nuestro área de salud son poco significativos (1,8x106/año). No obstante, son comparables con los existentes a nivel nacional (1,3x106/año) [9], aunque inferiores a los publicados en otros países [3, 11, 15, 22-25]. Dada la escasa frecuencia de este proceso, pequeñas diferencias son importantes y no podemos descartar que algunos pacientes hubieran sido atendidos ambulatoriamente o que, a lo largo de todo este tiempo, haya habido algún error en la codificación de la OEM por OE aguda. Pero también cabe la posibilidad de que la incidencia sea diferente dependiendo del país.
Puede aparecer a cualquier edad, predominando en mayores de 60 años (76,8 años de edad media en nuestra población), siendo muy infrecuente en la edad pediátrica, donde suele asociarse a inmunodepresión, con afectación más general (fiebre, leucocitosis) y con mejor pronóstico que en adultos [6, 8, 10, 13, 18, 25]. Aunque se desconocen las causas del predominio de la OEM en el anciano, podrían ser factores influyentes, la disminución de la migración epitelial en el CAE y el daño microvascular, que impediría una apropiada respuesta inmunológica [10]. Los hombres se afectan con más frecuencia que las mujeres (78% en nuestros resultados) [11, 26], y las tasas de incidencia son más elevadas en áreas de humedad.
Factores de riesgo: la mayor predisposición de la OEM en diabéticos (60-95% y 55% en nuestra población) [2, 10-11, 25, 27] se intenta explicar por la microangiopatía del CAE, que se incrementa con la edad; el aumento del pH en el cerumen; la alteración de los mecanismos inmunológicos y por una mayor proliferación de los microorganismos en un ambiente rico en glucosa [10, 27]. La insuficiencia vascular también favorece la aparición de osteomielitis.
Siendo la diabetes uno de los criterios diagnósticos que contribuyen a la OEM según Cohen D y Friedman P, (1987) [28], hay otras situaciones que pueden influir, como un estado de inmunodepresión (quimioterapia, trasplante, VIH/SIDA [29], radioterapia de cabeza [30], cáncer [3], desnutrición en la infancia [31]) o dermatitis [32], aunque también se describen, hasta en un 20% de casos, sin factores de riesgo adicionales (22% en nuestro estudio) [7, 33].
Así mismo, se debate la importancia de otros factores, como el retraso diagnóstico, el escaso control de la glucemia, la duración de la diabetes o la presencia de complicaciones, los marcadores inflamatorios o la extensión del proceso, pero los resultados son controvertidos, no habiendo sido posible identificar factores pronósticos definitivos [2, 13, 18].
Fisiopatología: la infección se inicia en la piel y el cartílago del CAE, propagándose rápidamente hacia el hueso temporal y la base del cráneo (causando osteomielitis). Atravesando las fisuras de Santorini (pequeñas hendiduras en la porción cartilaginosa de la base del CAE) y la sutura tímpanomastoidea [14, 21], se extiende en distintas direcciones (anterior, hacia el espacio masticador, glándula parótida, ATM y nervio facial; posterior, hacia la mastoides; medial, con infiltración de la pared nasofaríngea, los tejidos blandos preclivales y el foramen yugular, alcanzando los nervios IX-X-XI y XII; inferior, hacia los espacios cervicales profundos; contralateral, afectándose estos espacios en el lado opuesto e intracraneal, con invasión del seno sigmoide, la vena yugular y/o la carótida interna, hasta la duramadre) [34]. La progresión es a través de los planos fasciales y por invasión intravascular directa de los microorganismos (pseudomona y hongos), causando vasculitis, trombosis y necrosis de los tejidos blandos [3, 16, 35]. Las complicaciones más importantes son la osteomielitis del hueso temporal y de la base del cráneo, la parálisis de pares craneales (causada por necrosis, neurotoxinas o compresión) [16], especialmente del nervio facial (por su proximidad al CAE y por tanto más frecuente en niños) [6, 10], la meningitis y el absceso cerebral [7]. En el grupo estudiado no hemos tenido daño neuropático, pero en 4 pacientes (44%) hubo afectación de la ATM, lo que representa una frecuencia inusualmente elevada [36], aunque similar a la de otros [15].
Clínica: La sospecha de OEM se debería establecer con prontitud, ante una OE aguda que no mejora en 2-3 días con los tratamientos habituales [37] o que no se resuelve en 2-3 semanas [38], pero no habiendo un criterio patognomónico, el diagnóstico definitivo es más complejo y requiere de estudios complementarios [6, 10, 14]. La similitud de síntomas entre la OE aguda, muy frecuente, y la OEM, de aparición excepcional, favorece el que en atención primaria se utilicen distintos tratamientos, que promueven la aparición de resistencias, dificultan el diagnóstico y retrasan su curación [23].
Aunque la mortalidad de la OEM mejoró considerablemente a partir de los años 90, con la introducción del ciprofloxacino y otros antibióticos antipseudomona, pasando del 50% a un 15-20%, variable en función de la severidad del proceso (22% en nuestro estudio, no atribuible directamente a la OEM), la evolución sigue siendo difícil de predecir [2-3, 6, 9, 39].
El índice de recaídas es de un 20% a los 6 meses (22% en nuestra población) [6, 40-41] y se recomienda mantener el seguimiento durante 1 año [16].
Diagnóstico: En 1987 y tras una revisión de la literatura, Cohen D y Friedman P, (1987) [28] enumeraron un conjunto de criterios mayores y menores para definir la OEM (Tabla 3), sugiriendo que el diagnóstico sería seguro si se cumplían todos estos criterios mayores: otalgia intensa persistente, otorrea purulenta, inflamación de la piel del CAE/preauricular, tejido de granulación y/o zonas de necrosis cutánea, microabscesos en la cirugía y gammagrafía ósea positiva con Tc99m. Los criterios menores serían complementarios, pero no suficientes para establecer el diagnóstico [28]. Las pruebas de imagen deben interpretarse en un contexto clínico, porque no siempre se puede verificar la erosión ósea, por lo que, dadas estas circunstancias y para evaluar la evolución, hemos clasificado a nuestros pacientes utilizando la escala de Hodgson et al. (2022) [11], que establece una diferencia entre el caso definitivo, el probable y el posible, estadificando los criterios de Cohen D y Friedman P [28] (Tabla 2).
Tabla 3. Criterios de Cohen y Friedman para el diagnóstico de OEM.
|
CRITERIOS MAYORES |
CRITERIOS MENORES |
|---|---|
|
Otalgia intensa persistente |
Aislamiento de Pseudomona aeruginosa |
|
Otorrea purulenta |
Imagen radiológica de necrosis ósea u opacificación de cavidades neumáticas |
|
Inflamación de la piel del CAE |
Afectación de pares craneales |
|
Tejido de granulación y/o zonas de necrosis cutánea |
Paciente inmunocomprometido |
|
Microabscesos en cirugía |
Edad avanzada |
|
Gammagrafía ósea positiva con Tc99m |
Diabetes |
Actualmente, el diagnóstico de la OEM se complementa con:
Niveles de PCR (polymerasa chain reaction) / VSG (velocidad de sedimentación globular). Se ha demostrado que, especialmente la VSG, es un buen marcador de respuesta al tratamiento antibiótico [2, 10, 15, 18, 39], comenzando a descender a las 2 semanas de iniciado el mismo [26]. En lo que respecta a nuestro estudio, los cuatro pacientes a quienes se solicitó la VSG antes del tratamiento mostraban valores elevados, pero no se realizó una monitorización seriada. La PCR expresa la presencia y severidad de la inflamación [18]. Zannour et al., (2023) [13] encuentran una relación significativa entre niveles muy elevados e infección micótica, añadiendo en estos casos tratamiento antifúngico. Desconocemos, no obstante, si la VSG y la PCR son los mejores marcadores de la evolución [15].
Cultivo positivo. El cultivo microbiológico se obtiene mediante la toma de exudado del CAE, dada su accesibilidad. La tasa de P. aeruginosa ha descendido desde finales de los años 90 (27-90%; nosotros 33%), incrementándose la de cultivos negativos. Esta tendencia parece deberse al uso indebido de antibióticos antipseudomona, más que a un cambio en la epidemiología microbiológica [3, 20, 42-43]. En caso de cultivo negativo, se aconseja iniciar un tratamiento empírico antipseudomona (con ciprofloxacino o en terapia combinada si la evolución no es adecuada) y realizar una biopsia del CAE o de la mastoides, con anestesia general si se precisa, para estudiar en microbiología y en anatomía-patológica bajo microscopio y con tinciones específicas, el tipo de germen causal [2, 6, 8, 20, 26, 42]. Pueden intervenir otros microorganismos, con más frecuencia en pacientes no diabéticos, como el SAMR [20], Proteus spp, Klebsiella oxitoca (en un 5-20%) y hongos como Candida albicans o Aspergillus fumigatus o niger (en un 5-35%), entre otros [6, 24, 44-45], que propician la ineficacia del tratamiento, la progresión de la enfermedad y la aparición de complicaciones [39]. Además, hay un incremento de resistencias de la P. aeruginosa al ciprofloxacino de hasta en un 35%, resultando inadecuado el tratamiento monoterápico hasta en un tercio de los casos [2-3, 10, 20, 24, 43]. Si el cultivo sigue siendo negativo, en el paciente que no responde al tratamiento antibiótico o que sufre recaída durante o después del mismo, se sugiere añadir de forma empírica un tratamiento antifúngico, a la espera de conocer el microorganismo responsable [28, 46-47]. En nuestra población, se observa una gran variabilidad microbiológica y un 33% de cultivos negativos o con flora saprófita (Tabla 1 (Anexo 1)), que, en parte puede explicarse, porque la muestra para cultivo se tomó una vez iniciado el tratamiento por una sospecha previa de OE aguda [2, 6, 43].
Pruebas de imagen. Los estudios de imagen son fundamentales para el diagnóstico y seguimiento de los pacientes con OEM, porque la sintomatología y la exploración clínica no la diferencian de la OE aguda [19, 23]. El reto diagnóstico de la osteomielitis se debe a que no hay una modalidad de imagen que ofrezca una visión completa del proceso y no hay consenso sobre el mejor uso de las técnicas de imagen [14]. Para valorar la extensión y las complicaciones asociadas, se precisa una combinación de imágenes funcionales y anatómicas [1, 16, 19]. La TC ha demostrado ser una herramienta útil, por su rápida disponibilidad y porque permite demostrar la afectación ósea [6, 20]; teniendo en cuenta que sólo se evidencia, cuando la desmineralización supera el 30% [1, 6] y que, por tanto, una ausencia de erosión ósea en la TC no excluye la osteomielitis [21]. A partir de la TC de alta resolución hemos definido la extensión del proceso en nuestros pacientes, aplicando la estadificación utilizada por Kamalden et al., (2021) [22] (Tablas 1 y 4). La RM, aunque delimita mejor la progresión hacia los tejidos blandos, los espacios medulares óseos y la penetración intracraneal, resulta costosa y no se considera como estudio de imagen de primera línea en el diagnóstico [6, 25]. Una limitación añadida de la TC y de la RM es su incapacidad de diferenciar la inflamación activa del proceso en resolución [3]. Durante décadas, el protocolo diagnóstico de la OEM ha incluido la gammagrafía con Tecnecio-99m y Galio-67. La realizada con Tc99m es muy sensible para el diagnóstico de OEM, pero menos específica, dado que también es positiva para tumores malignos y traumatismos y es de escasa rentabilidad en la determinación de la fase evolutiva, porque tarda en normalizarse [6]. La gammagrafía con Ga67, de menor sensibilidad diagnóstica, es de elección para el seguimiento, ya que vuelve a la normalidad una vez que desaparece la inflamación; aunque puede ser normal en caso de recaída [10]. Sin embargo, la sensibilidad y especificidad de estas pruebas son más limitadas de lo que se suponía en los años 80 [48] y, además, no muestran los detalles anatómicos, tienen un alto coste y exposición a la radiación; y no son de uso general [1, 19]. Varios estudios han demostrado que las técnicas híbridas de tomografía por emisión de positrones (PET) con 18- fluordesoxiglucosa y TC y más recientemente PET-RM, adquiridas simultáneamente y combinadas en una sola imagen, son herramientas prometedoras, al compaginar marcadores anatómicos y funcionales [1, 16, 19]). Actualmente se considera que las técnicas híbridas, son de elección para el diagnóstico inicial y el seguimiento de la OEM, por su alta sensibilidad, coste y exposición a la radiación [1, 16, 19]. Pueden no diferenciar la presencia de un carcinoma y, por tanto, sus resultados deben considerarse en un contexto clínico e histopatológico compatibles [19].
Tabla 4: Estratificación radiológica de la OEM, propuesta por Tengku. Modificado de Kamalden TMIT y Misron K, (2022) [22].
|
Fases evolutivas |
Hallazgos en TC |
|---|---|
|
I |
Inflamación limitada a tejidos blandos del CAE, sin afectación ósea. |
|
II |
Inflamación de tejidos blandos con afectación ósea, limitada a la mastoides. |
|
III |
Extensión medial de la inflamación, afectando el peñasco del hueso temporal o ATM, con o sin afectación del espacio parafaríngeo. |
|
IV |
Extensión medial de la inflamación hasta el espacio nasofaríngeo, con o sin formación de absceso. |
|
V |
Inflamación extendida al lado contralateral. |
Anatomía patológica. La biopsia es necesaria para realizar el diagnóstico diferencial entre OEM y carcinoma escamoso de CAE, que, además, podrían darse concurrentemente [10, 16] y que también cursa con otalgia y supuración de larga evolución, como en uno de nuestros pacientes. Dado que los estudios radiográficos no tienen suficiente especificidad, la biopsia es el único método definitivo para excluir otras causas, como malignidad o colesteatoma [10, 16, 26]. Pero puesto que el carcinoma es muy poco frecuente, hay quien reserva la biopsia para los casos con mala evolución [10]. Tratamiento: Ante la sospecha diagnóstica de OEM se debe iniciar un tratamiento antibiótico sistémico (Tabla 3). Utilizaremos fármacos antipseudomona, en función del antibiograma, determinando la concentración mínima inhibitoria. Aunque una revisión de la Cochrane del 2013 [49] expresa, que no se puede precisar un tiempo de tratamiento en la osteomielitis crónica, considerando la experiencia general, se sugiere una duración inicial de al menos 6 semanas, evaluando su prolongación en función de que haya evidencia clínica o radiológica de persistencia o progresión [10, 20, 42, 44]. El tratamiento con ciprofloxacino es igual de efectivo VO que parenteral [49] y la dosis no requiere ajustarse en pacientes ancianos con disfunción renal, aunque deberán tenerse en cuenta los efectos secundarios [10].
Enfermedad no complicada / baja tasa de resistencia a antipseudomonas. Administraremos ciprofloxacino en monoterapia a dosis de 400mg/8h IV, pasando a vía oral (750 mg/12h) cuando se evidencie mejoría clínica y/o descenso de la VSG/PCR. Si no hay mejoría clínica o de VSG/PCR, se aconseja biopsia para cultivo y estudio anatomopatológico.
Enfermedad complicada / inmunodeprimidos / alta tasa de resistencia a antipseudomonas. Se sugiere combinar el tratamiento anterior con un betalactámico de actividad antipseudomonas (Piperacilina-tazobactam (4,5 g IV/6 horas), Ceftazidima (2 g IV/8horas), Cefepime (2 g IV/12 horas), Meropenem (2 g IV/8 horas), pasando a ciprofloxacino VO si mejoría [10, 43]. Y si la causa es por Aspergillus: se aconseja un tratamiento prolongado (> 12 semanas) con voriconazol o anfotericina B liposomal [10]. Aunque es habitual que el tratamiento sistémico se acompañe de otro local, con la limpieza diaria de secreciones y la aplicación de gotas de ciprofloxacino o aminoglucósido, no todos lo emplean, al considerar que disminuye la posibilidad de obtener cultivos positivos y facilitar un potencial incremento de la resistencia antibacteriana [6, 10, 20, 39]. Nosotros lo hemos utilizado (ciprofloxacino + corticoide) para el control de la inflamación del CAE [8, 43-44]. Hay quien recomienda soluciones acidificantes (ácido bórico o acético), como alternativa [6].
El tratamiento debe ser multidisciplinar en colaboración con el servicio de Endocrinología, estableciendo el control más adecuado en los pacientes diabéticos, con el equipo de Enfermedades Infecciosas para determinar la mejor pauta antimicrobiana y con Medicina Nuclear y Radiología en la elección de las técnicas de imagen.
Cuando la clínica y los marcadores de laboratorio se normalizan, el ORL se enfrenta al dilema de decidir la retirada del tratamiento, con un riesgo mínimo de recurrencia [15]. Para estar seguros, se podría solicitar una prueba de imagen híbrida de 18F-FDG-PET/TC (o PET/RM) y, si no se dispone de dicha tecnología, una gammagrafía con Ga67 [42]. Si persiste en la imagen, la afectación ósea, se continúa el tratamiento, repitiendo el estudio radiológico cada 2-4 semanas, hasta que se normalice [43]. Dada la tasa de recurrencia (15-20%) se aconseja mantener revisiones periódicas en 4-6 semanas los 6 primeros meses y cada 8 semanas hasta completar el año [7, 15]. La imagen se debe repetir si reaparecen los síntomas y cada 6 meses el primer año [50]. Tras la resolución del proceso indicaremos al paciente que evite factores de riesgo (ambiente húmedo, lavado de oídos y pequeños traumatismos) [35].
No tenemos evidencia de la eficacia del oxígeno hiperbárico en la OEM [51] y dada la escasez de centros y el coste adicional, su uso es limitado en nuestro medio hospitalario.
En el pasado, el tratamiento era fundamentalmente quirúrgico [6], pero actualmente su indicación principal es la biopsia, para diferenciar la OEM del carcinoma [16]. No están definidas en la literatura ni las indicaciones, ni el momento, ni la extensión de una posible cirugía, que habitualmente va desde el desbridamiento local, hasta una mastoidectomía radical [20, 24, 52]. En la población de estudio, sólo se intervino quirúrgicamente a un paciente con severa afectación de la ATM, mediante fresado de la pared anterior del CAE (Tabla 1 (Anexo 1)). Según Peled et al., (2020) [52], la cirugía se puede plantear en casos de otitis refractaria (sin mejoría clínica tras 6 semanas de tratamiento convencional), enfermedad agresiva, enfermedad bilateral, destrucción de la ATM o en casos de cultivos estériles con mala respuesta al antibiótico.
Protocolo de diagnóstico y tratamiento de la OEM
Diagnóstico
Se deberá sospechar OEM en cualquier paciente mayor de 65 años con o sin factores de riesgo, o bien en menores de dicha edad con factores de riesgo de inmunosupresión o diabetes, que presenten una OE aguda con mala respuesta al tratamiento tópico (ciprofloxacino con o sin corticoide), con intenso dolor y material de granulación en CAE.
Aconsejamos el ingreso hospitalario del paciente, para completar el diagnóstico e iniciar el tratamiento.
Efectuaremos una toma de la secreción del CAE para estudio microbiológico.
Se obtendrá una muestra del tejido de granulación para su análisis anatomo-patológico.
Pediremos un sistemático de sangre con VSG y PCR, para su monitorización.
Se solicitará una TC de peñascos de manera urgente. Si es negativa se requerirá una gammagrafía con Tc99m.
Cuando desaparezca la clínica y se normalicen la VSG y/o la PCR, se realizará una gammagrafía con Ga67 para monitorizar la respuesta al tratamiento antibiótico intravenoso. Si es posible, se podrá solicitar un estudio 18F-FDG-PET/TC (o PET/RM).
Tratamiento (Tabla 5)
Tabla 5. Pautas de tratamiento antibiótico recomendadas.
|
Inmunocompetentes / enfermedad no complicada |
Inmunodeprimidos /enfermedad complicada / elevada resistencia |
|---|---|
|
Monoterapia con ciprofloxacino 400mg/8h IV hasta disminución de PCR/VSG o mejoría clínica; después pauta oral a 750mg/12h |
Combinación de ciprofloxacino con un betalactámico antipseudomónico, 6-8 semanas Piperacilina 4g/6h Ceftazidima 2g/8h / Cefepime 2g/12h Meropenem 2g/8h |
Basado en Ciprofloxacino IV, adaptando el tratamiento al antibiograma obtenido en la toma de cultivo una vez esté disponible. Este tratamiento intravenoso podrá ser administrado por vía oral cuando el paciente presente mejoría clínica y normalización de VSG. Siempre de acuerdo con el equipo de Enfermedades Infecciosas.
CONCLUSIONES
La OEM continúa siendo una enfermedad potencialmente mortal, principalmente en pacientes ancianos y con otras comorbilidades. El diagnóstico de OEM se establece a partir de un conjunto de hallazgos clínicos, de laboratorio y radiográficos. Una OE aguda que no se resuelve en 2 semanas, con tratamiento habitual, debe hacer sospechar una OEM, sobre todo si asocia factores de riesgo.














