INTRODUCCIÓN
Según la literatura, varias especies bacterianas (gram negativas y gram positivas), dominadas por anaerobios obligados, han estado involucradas en la etiología de las infecciones endodónticas.(1) No obstante, la presencia de especies fúngicas es evidente en el sistema del conducto radicular, hasta en un 36% (2,3), siendo el género Candidaspp. Y en especial consideración la especie Candidaalbicans, quien está más involucradas en las infecciones de este tipo,(4,5) con una prevalencia del 8,20% en infecciones endodónticas primarias; (6) y 20% en infecciones endodónticas secundarias, (7) pudiendo estar relacionados con el fracaso del tratamiento endodóntico. (8)
El hipoclorito de sodio (NaOCl) es considerado el irrigante con más frecuencia de uso en tratamientos de conductos en concentraciones de 0,5% a 6%.(9-12) Así mismo, según varios estudios, la eficacia del NaOCl depende de su forma de cloro libre, influenciada por factores como: su concentración, tiempo de exposición, pH, y temperatura,(13) que influyen en su potencial para disolver el tejido pulpar necrótico y desechos orgánicos del conducto radicular.(11, 13) Sin embargo, existe una preocupación por su efecto tóxico en los tejidos periapicales a concentraciones más altas.(14)
Otro irrigante utilizado es elgluconato de clorhexidina (CHX), que tiene un espectro antimicrobiano muy amplio(15), con efectos bacteriostáticos(16); y característico por su ventaja de sustantividad, es decir, la capacidad de unirse a los tejidos orales blandos y duros, resultando un efecto duradero después de su administración.(17,18)
Por otro lado, el uso simultáneo entre NaOCl y CHX, también es reportado; sin embargo, conduce a la formación de un precipitado naranja-marrón (para-cloroanilina), que puede obliterar los túbulos dentinariose interferir con el sellado del relleno del conducto radicular.(19-21) En consecuencia, a lo antes mencionado, además de tener en cuenta que las biopelículas endodónticas son un cúmulo de comunidades polimicrobianas (bacterias-hongos) resistentes a los irrigantes habituales, a la medicación intraconducto y a la inmunidad del huésped; es de suma importancia reconocer la diferencia en el potencial antifúgico de dos de las sustancias consideradas de primera elección en el tratamiento del conducto radicular; como terapia conservadora odontológica, por lo cual el objetivo de esta investigación fue comparar la actividad antifúngica del gluconato de clorhexidina 2% e hipoclorito de sodio al 5,25% contra Candida albicans.
MÉTODOS
ESTUDIO EXPERIMENTAL IN VITRO
Se tomaron 90 muestras mediante hisopado de la mucosa bucal de pacientes con diagnóstico de estomatitis subprotésica. Los participantes aceptaron voluntariamente participar de la investigación; además, se contó con la aprobación del Comité de Etica de la Universidad de San Martín de Porres. De las muestras tomadas se procedió a aislar la Candidaalbicans, mediante cultivo denominado CHRO Magar™ Candida (CA220), el cual es considerado un medio con alta especificidad y sensibilidad para Candidaalbicans, preparándose según las indicaciones del fabricante, el cual recomendó 47,7 g/L para 1000 mL de agua purificada, además de según lo indicado por el Clinical and Laboratory Standard Institute. 22
CULTIVO DE LAS MUESTRAS
Las muestras fueron sembradas directamente en el medio de cultivo mencionado CHRO Magar™ Candida (CA220), e incubadas a 37°C 48h; se determinó la presencia o ausencia de crecimiento de colonias de Candida albicans, según los parámetros establecidos. Se realizó la prueba de tubo germinativo para confirmar la presencia de Candida albican sutilizando como medio de cultivo suero humano e incubándose a 37 ºC 3 horas, observándose, al término del tiempo el crecimiento de una pseudo hifa, confirmado la presencia de la especie fúngica a estudiar.
PREPARACIÓN DE LOS DISCOS
Confirmada la presencia de Candida albicans, las 90muestras fueron distribuidas en placas distintas incubadas mediante diseminación con agar Müeller Hinton (Difusión en agar con discos como método). Se procedió a separar las muestras en dos grupos experimentales: 45 con discos esterilizados Whatman de 5 mm de diámetro, embebidos previamente con 15 mL de NaOCl 5,25% y los otros 45 discos con 15 mL de CHX 2%.Las placas se incubaron a 37°C por 24h, realizándose la lectura de los halos de inhibición antifúngica midiéndola longitud de su diámetro. El registro de los diámetros fue en mm con una regla milimetrada digital, registrando los resultados en la ficha de trabajo correspondiente.
ANÁLISIS
Se aplicó paquete estadístico Stata 14.0 para Windows Corporation (Stata, Texas, EE.UU.) Se cumplió con los supuestos de normalidad (Prueba de Shapiro Wilk, p > 0,05) y de homogeneidad de varianzas (prueba Levene, p > 0,05), y se aplicó la prueba estadística de T de Student, para establecer y estimar la comparación, que fue el objetivo de la investigación. Las Zonas de inhibición del crecimiento antifúngico se describieron en medias y error estándar (Tabla 1).
Tabla 1. Comparación de actividad antifúngica del gluconato de clorhexidina 2% e hipoclorito de sodio al 5,25% contra Candida albicans
| Halo de inhibición (mm) | ||||
|---|---|---|---|---|
|
| ||||
| Grupos experimentales | n | Media ± error estándar | Intervalo de confianza 95% | Valor p |
| Hipoclorito de sodio 5,25% | 45 | 25,22 ± 0,91 | [23,39 27,05] | 0,56* |
| Gluconato de clorhexidina 2% | 45 | 24,6 ± 0,55 | [23,49 25,71] | |
*Prueba t de student para dos grupos independientes.
p> 0,05; no significativo.
Fuente: elaboración propia
RESULTADOS
De los 90 cultivos de Candida albicans, se asignaron equitativamente 45 cultivos a cada uno de los grupos experimentales: hipoclorito de sodio al 5,25% y gluconato de clorhexidina al 2%, respectivamente.
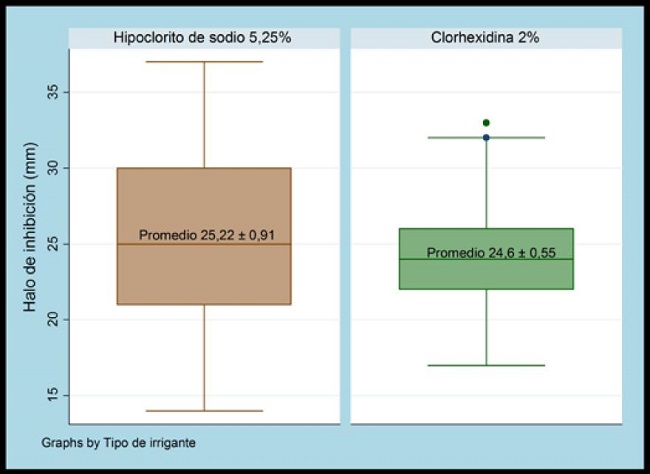
Posterior a la comparación de la actividad antifúngicade hipoclorito de sodio 5,25% y gluconato de clorhexidina 2% sobre la Candidaalbicans, mediante la Prueba t de Student (p> 0,05 no significativo) resultó un valor p 0,56* entre los grupos independientes experimentales (figura 1).
Fuente: elaboración propia.
Fig. 1. Comparación de actividad antifúngica del gluconato de clorhexidina 2% e hipoclorito de sodio al 5,25% contra Candida albicans
Al evaluar el halo de inhibición, según la actividad antifúngica del hipoclorito de sodio al 5,25% contra clorhexidina al 2% se encontró medias ± error estándar de 25,22 ± 0,91 y 24,6 ± 0,55 e intervalos de confianza al 95% de [23,3927,05] y [23,4925,71], respectivamente. Se cumplió con los supuestos de normalidad (Prueba de Shapiro Wilk, p > 0,05) y de homogeneidad de varianzas (prueba Levene, p > 0,05).
DISCUSIÓN
En nuestro estudio evaluamos la actividad antifúngica de NaOCl 5,25% y CHX 2% contra la Candida albicans, además, de someterlas a comparación, con la finalidad de optar por nuevas opciones de irrigación endodóntica frente a microorganismos presentes en enfermedades endodónticas persistentes.
Según la literatura, el Na OCl y CHX, son los irrigantescon mayor potencial antifúngico utilizados durante la terapia endodóntica,(2, 4, 11, 14, 23, 24) dependiendo de su concentración y del tiempo de exposición se puede observar una mayor o menor actividad antifúngica; como por ejemplo, en el trabajo de Awawdehet al. (14), se evidenció un halo de inhibición de 81 mm contra cepas de Candida albicans utilizando Na OCl 3%,siendo muy distinto al estudio de Ndiaye et al.(4), quienes obtuvieron un halo de inhibición de 33 mm utilizando NaOCl 2,5%, y en la investigación de Noushad, et al. (25), utilizando NaOCl5,25% dieron como resultado un diámetro medio de 20 mm para Candida albicans.
Nuestro estudio coincide considerablemente con lo demostrado por Noushad et al. (25), evidenciando un halo de inhibición promedio de 25,2 mm; no teniendo coincidencia con el de Awawdeh et al.(14) y Ndiayeet al.(4), pues las concentraciones utilizadas en estos últimos difieren considerablemente con los utilizados en esta presente investigación.
Revisando la activad antifúngica de CHX 2% contra Candida albicans, Awawdeh et al. (14), evidenciaron un halo de inhibición de 50 mm, a diferencia de la investigación de Shino et al. (23), quienes demostraron una efectividad significativa, con una zona media de inhibición de 21,8 mm utilizando CHX 0,2%; sin embargo, en la investigación de Ndiaye et al. (26), utilizando una concentración de CHX 0,5%, se obtuvo un diámetro de inhibición promedio de 11 mm. Nuestro trabajo de investigación utilizó CHX 2% y obtuvo un halo de inhibición promedio de 24,6 mm, siendo coincidente con los resultados obtenidos por Shino et al. (23), y distinto a los antes mencionados. (14, 26)
Candida albicans es considerada como un comensal inofensivo, con el potencial de convertirse en patógeno oportunista y causar infecciones. (27) Por lo que, al haber obtenido los resultados plasmados en esta investigación con halos de inhibición promedio de 25,22 ± 0,91 y 24,6 ± 0,55, para Hipoclorito de sodio 5,25% y Gluconato de clorhexidina 2%; respectivamente, recomendamos se realicen estudios con una muestra mayor a la estudiada, y con una evaluación del potencial antifúngico, en diferentes concentraciones (10%, 15% para Na OCl; y 4%, 5% para CHX), considerando las concentraciones mínimas y máximas inhibitorias fungicidas; además, mediante un diseño longitudinal, (1 hora, 6 horas en inclusive a la semana) pues su comportamiento como patógeno fúngico a nivel radicular es impredecible, teniendo en cuenta que las sustancias estudiadas pueden utilizarse como medicamentos intraconductos sinérgicos a otros, durante el tratamiento endodóntico;(12-14) con la finalidad de contribuir con estrategias de mínima intervención, durante los procedimientos odontológicos invasivos, como es el tratamiento del conducto radicular, y de esa manera prevalecer la filosofía de una odontología de mínima intervención, basada en evidencia científica.














