SESIÓN 1
1. Un patrón inflamatorio anormal asociado a la no progresión a largo plazo de la infección por VIH impacta negativamente en la calidad ósea
Soldado Folgado J1, Chillarón JJ2, Cañas Ruano E3, Arrieta Aldea I3, González Mena A3, Blasco Hernando F3, Knobel H3, Güerri Fernández R3, García Giralt N4
1 Servicio de Medicina Interna. Hospital del Mar. IMIM. Barcelona; 2 Servicio de Endocrinologia. Hospital del Mar. IMIM. Barcelona; 3 Servicio de Enfermedades Infecciosas. IMIM. Barcelona; 4 Grupo de Investigación Musculoesquelética, IMIM. Centro de Investigación Biomédica en Red en Fragilidad y Envejecimiento Saludable (CIBERFES), ISCIII. Barcelona
La terminología de no progresores a largo plazo (LTNP) se atribuye a un grupo muy raro de individuos infectados por el VIH (VIH+) que controlan la replicación viral. Sin embargo, estos individuos experimentan complicaciones asociadas al VIH, entre ellas, alteración del remodelado óseo. Se pretende realizar una evaluación integral de la salud ósea y su asociación con el estado inflamatorio en los LTNP VIH+. Se llevó a cabo un estudio transversal que comparó los componentes de la resistencia ósea (densidad mineral ósea y calidad del tejido óseo) entre grupos emparejados por edad, género y comorbilidades de personas VIH+LTNP, VIH+progresoras y VIH negativas. Se analizó mediante ELISA un panel de biomarcadores de recambio óseo e inflamatorios en plasma. La calidad del tejido óseo se evaluó mediante microindentación ósea, una técnica que da un parámetro cuantificable adimensional (BMSi) que mide la resistencia del material óseo. Treinta individuos fueron incluidos: 10 LTNP, 10 progresores VIH+ y 10 individuos VIH negativos. El grupo LTNP mostró un patrón anormal de activación inmune con niveles significativamente más bajos de citoquina antiinflamatoria IL-10 (p=0,03), citoquina proinflamatoria IL-8 (p=0,01) y TNF-α (p<0,001) respecto a los demás grupos. Con respecto a la salud ósea, el grupo LTNP presentó una BMSi más baja y, por lo tanto, una peor calidad del tejido óseo que los individuos VIH negativos [83 (78-85) vs 90 (89-93), respectivamente]; p=0,003, y también más baja que los progresores VIH+ [83 (78-85) vs 86 (85-89), respectivamente]; p=0,022. Los progresores VIH+ mostraron una BMSi menor que los VIH negativos [86 (85-89) vs 90 (89-93), respectivamente]; p=0,083. No se detectaron diferencias en la densidad mineral ósea entre los grupos. Al comparar diferentes marcadores de recambio óseo, DKK1 fue significativamente menor en los individuos VIH+ con el peor valor en el grupo LTNP (p=0,018). No se encontraron diferencias entre los grupos VIH+ (progresores VIH+ vs LTNP; p=0,475). Por el contrario, la PTH se incrementó en los LTNP con respecto al grupo VIH negativo (p=0,029) y respecto a los progresores VIH+ (p=0,039). En conclusión, el grupo LTNP mostró un perfil inflamatorio alterado junto con una peor calidad del tejido óseo en comparación con los progresores VIH+ y los individuos VIH negativos. Esto indicaría que la infección por VIH en sí misma tiene un efecto nocivo en el tejido óseo, probablemente a través de un estado de inflamación persistente.
2. Factores relacionados con la osteoporosis inducida por glucocorticoides y fracturas por fragilidad en individuos jóvenes
Flórez H1, Carrasco JL2, Barberá M3, Hernández Rodríguez J4, Muxi A5, Cid MC4, Monegal A1, Cajiao K1, Guañabens N1, Peris P1
1 Unidad de Patología Metabólica Ósea. Servicio de Reumatología. Hospital Clínic. Universitat de Barcelona; 2 Bioestadística. Departamento de Fundamentos Clínicos. Universitat de Barcelona; 3 Universitat de Barcelona; 4 Unidad de Vasculitis. Servicio de Enfermedades Autoinmunes. Hospital Clínic. Universitat de Barcelona; 5 Servicio de Medicina Nuclear. Hospital Clínic. Universitat de Barcelona
Introducción: El tratamiento con GC es una causa frecuente de osteoporosis (OP) y fracturas (FF). Sin embargo, el diagnóstico y tratamiento de este proceso [OPIG] es deficiente, especialmente en individuos jóvenes. El objetivo de este estudio fue analizar la prevalencia de OP y FF en pacientes tratados con GC, así como las caracteristicas diferenciales y factores relacionados con su desarrollo en función de la edad (< y ≥50 años).
Material y método: Se incluyeron 127 pacientes (62±18 años) en tratamiento crónico con GC. Se analizaron factores de riesgo de OP y fracturas, dosis y duración del tratamiento con GC, antecedentes de FF, actividad de la enfermedad, datos antropométricos, parámetros del metabolismo óseo (incluyendo marcadores de recambio óseo y eje gonadal), densidad mineral ósea (DXA; OP densitométrica: T-score ≤-2,5 o Z-score ≤-2, según la edad), tabecular bone score (TBS) (DXA) y presencia de fracturas vertebrales (RX). Se definió OPIG por la presencia de OP densitométrica y/o FF. Se compararon los resultados entre los sujetos <50 y ≥50 años.
Resultados: La prevalencia de OPIG fue similar en pacientes <50 (n=36) y ≥50 años (n=91): 44,4% vs 46,1%. Cinco pacientes jóvenes (13,8%) y 30 ≥50 años (33%) presentaron FF (p=0,05). Los sujetos jóvenes con FF solían tener >40 años, mayor índice de masa corporal (IMC) (25,4 vs 23,3, p=n.s.) y actividad inflamatoria de la enfermedad (PCR 0,90 vs 0,06 mg/dL, p=0,06). Al analizar los factores de riesgo diferenciales asociados a FF, los sujetos jóvenes tenían mayor IMC (29,63 vs 26,95, p=0,048) y actividad inflamatoria (PCR -0,87 vs -2,51 [log scale], p=0,03), y los ≥50 años menor T-score lumbar (-1,08 vs -0,06 DE, p=0,003) y dosis acumuladas de GC más altas (9,11 vs 8,56 g, p=0,03). El hipogonadismo fue un factor de riesgo independiente de la edad (OR 4,89; IC95% 1,36-17,59), es decir, asociado a la presencia de FF en ambos grupos de población.
Conclusiones: Más del 40% de individuos que siguen tratamiento crónico con GC desarrollan OPIG, siendo este porcentaje similar en ambos grupos de edad (< y ≥50 años); sin embargo, la FF es un evento menos frecuente en sujetos jóvenes. La presencia de hipogonadismo constituye un factor de riesgo fundamental en el desarrollo de fracturas, independientemente de la edad. Además, los sujetos jóvenes con FF suelen tener mayor edad, IMC y actividad de la enfermedad. Factores, que pueden mejorar la identificación de los sujetos jóvenes con un mayor riesgo de fractura.
3. Mutaciones activadoras en HRAS en el hueso, pero no en la piel, provocan un exceso de FGF23 y osteomalacia en modelos de ratón del síndrome cutáneo esquelético hipofosfatémico
Ovejero Crespo D1, Michel Z2, Cataisson C3, Saikali A2, Galisteo R2, Yuspa S3, Collins MT2, Fernández de Castro L2
1 Grupo de Investigación Musculo-Esquelética. Institut Hospital del Mar d’Investigacions Mèdiques. Barcelona; 2 Skeletal Disorders and Mineral Homeostasis Section. National Institute of Dental and Craniofacial Research NIH. Bethesda. Maryland (USA); 3 Laboratory of Cancer Biology and Genetics. National Cancer Institute NIH. Bethesda. Maryland (USA)
Introducción: El síndrome cutáneo esquelético hipofosfatémico (SCEH) es una enfermedad mosaica secundaria a mutaciones activadoras en genes RAS, caracterizada por raquitismo hipofosfatémico por hiperproducción de FGF23, nevus cutáneos, y lesiones óseas. Los nevus han sido tradicionalmente señalados como los productores del exceso de FGF23, llevando a muchos pacientes a someterse a extensas resecciones cutáneas con resultados cuestionables. Y dado que el hueso es la fuente fisiológica de FGF23, nosotros postulamos que las lesiones óseas son el origen de esta alteración hormonal.
Métodos: Para investigar el origen de FGF23 en el SCEH, usamos dos modelos de ratón: uno “oseo” con expresión inducible de HRAS p.G12D en el esqueleto apendicular, y otro “cutáneo” basado en la generación de papilomas creados a través del injerto de keratinocitos que expresan Hras p.G12R. En ambos modelos se determinó la expresión de Fgf23 en tejidos afectados vs control, y se midieron los niveles séricos de fosfato, FGF23 intacto (iFGF23) y total (cFGF23), además del componente P amiloide sérico (SAP). Asimismo, se estudiaron los efectos sobre la microarquitectura y mineralización en vértebras mediante microCT y tinción de Von Kossa. En el modelo óseo también se midió la DMO por DXA y la fosfaturia.
Resultados: Los ratones “óseos” exhibieron incrementos dramáticos de cFGF23 y iFGF23, así como hipofosfatemia e hiperfosfaturia. También, se observaron pérdidas generalizadas de DMO y graves alteraciones microestructurales y bandas de osteoide en las vértebras. Asimismo, estos ratones desarrollaron unas neoplasias derivadas del periostio mutado. Los ratones “cutáneos” mostraron un incremento leve de cFGF23 sin elevación concomitante de iFGF23 ni afectación del fosfato sérico. También se apreció adelgazamiento trabecular vertebral, pero sin alteración de la mineralización ni depósitos de osteoide. La expresión de Fgf23 fue muy superior en las tibias de los ratones “óseos” vs controles. Asimismo, se detectaron niveles bajos de expresión de Fgf23 en 4/6 papilomas y en 1/10 muestras cutáneas control.
Los niveles de SAP fueron más altos en ambos modelos vs controles, indicando inflamación sistémica.
Conclusiones: En los modelos estudiados, las mutaciones HRAS en el hueso, pero no en la piel, se asociaron a una marcada elevación en la expresión de Fgf23 y del iFGF23 sérico, a hipofosfatemia y osteomalacia. Estos datos sugieren que las lesiones óseas son el origen del exceso de FGF23 en el SCHE.
4. Machine Learning de los niveles de vitamina D en pacientes con espondiloartritis
Castro Corredor D1, Calvo Pascual LA2, Seoane Romero J1, Garrido Merchán EC2
1 Servicio de Reumatología. Hospital General Universitario de Ciudad Real; 2 ICADE. Universidad Pontificia de Comillas. Madrid
Introducción: El Machine Learning (ML) se usa para predecir o clasificar variables dependientes u objetivos de otras variables independientes o explicativas. En base a este modelo se quiere valorar la relación entre los niveles de 25-hidroxivitamina D y la actividad inflamatoria en pacientes con espondiloartritis, tratando de minimizar la estimación del error generalizado en las matrices de confusión.
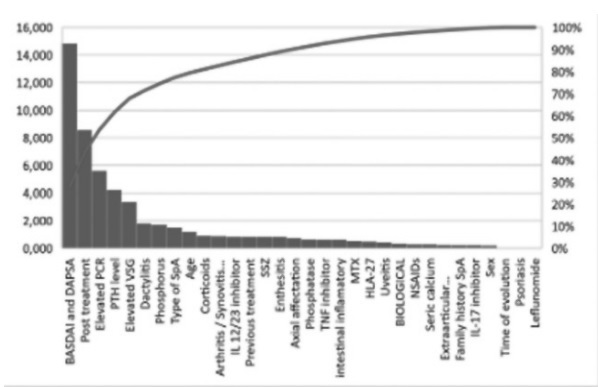
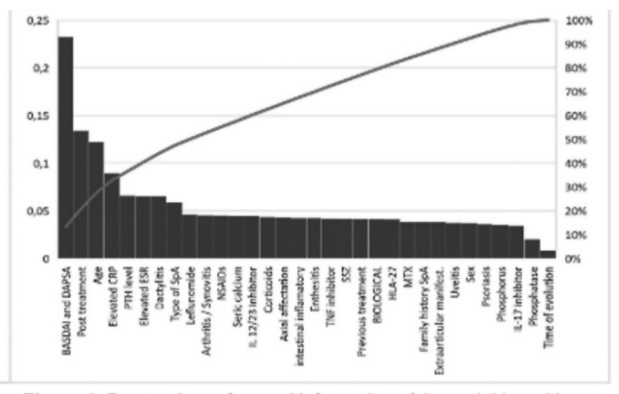
Material y métodos: Estudio observacional, descriptivo y transversal. Se seleccionaron las variables que más influyen en los niveles de vitamina D en ML: actividad BASDAI-DAPSA, nivel PCR, tratamiento posterior de vitamina D y nivel PTH. Se calcula información mutua y estadísticos chicuadrado usando la librería scikit-learn (python) y el programa Matlab, respectivamente. Con el paquete Classification Learner de matlab, se obtiene el mejor modelo clasificatorio con el mejor ajuste para una validación de 10 fold cross, que resulta ser un método de Ensemble. Por otro lado, el árbol de decisión se computa con el programa R.
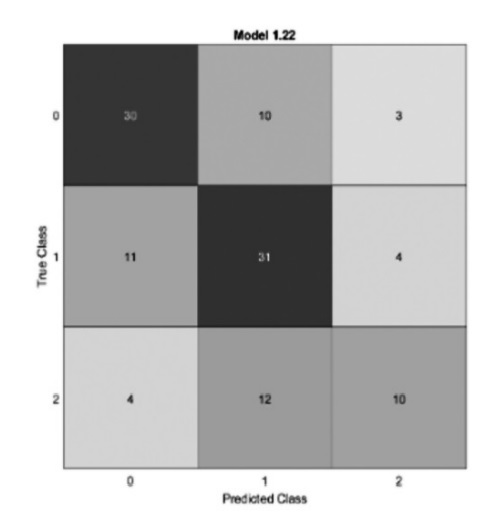
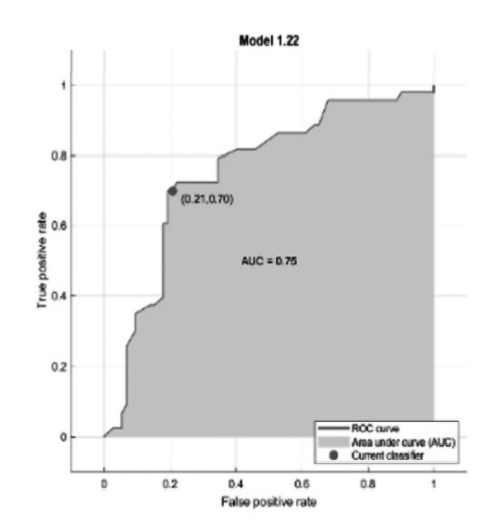
Resultados: Tras la selección de variables con información mutua y los test chi-cuadrado (fig. 1 y 2) de 116 pacientes, se calcula un árbol de decisión (fig. 3) y se obtiene el mejor modelo modelo clasificatorio para los niveles de vitamina D, que ha resultado ser un método Ensemble (fig. 6). Para este modelo se obtiene la matriz de confusión (fig. 4) y su curva Roc (fig. 5), que muestra que es un modelo equilibrado con bastante área en su interior.
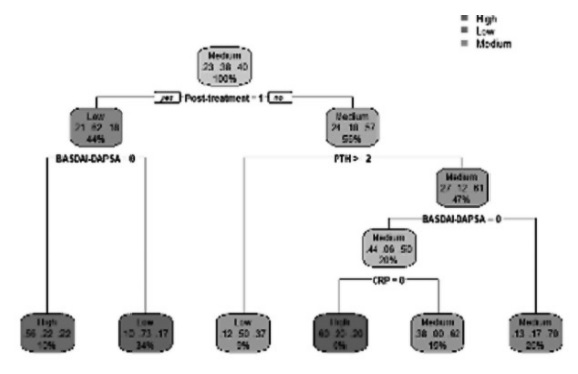
Figure 3. Decision tree computed by a random search that minimizes the generalization error estimated via reapeated 10 folds cross validation.
Conclusiones: Con las variables más relevantes de clasificación de vitamina D en pacientes con EspA, se observa que nuestra investigación coincide con estudios anteriores. Lo mismo ocurre, con respecto a la relación inversa entre los niveles inflamatorios por BASDAI-DAPSA y los niveles de vitamina D. Esa relación se explica gracias a nuestro árbol de decisión. Nuestro modelo Ensemble, aunque no es explicativo, ofrece la mejor clasificación de los niveles de vitamina D en pacientes con EspA.
5. Efecto de la suspensión del tratamiento con bisfosfonatos en la evolución de la masa ósea y en el desarrollo de fracturas en pacientes con osteoporosis
Salmoral Chamizo A1, Peris Bernal P2, Flórez Enrich H2, Guañabens Gay N2, Barceló Bru M3, Pascual Pastor M3, Ros Vilamajó I4, Grados Canovas D5, Aguado Acín P6, García Carazo S6, López Vives L7, Gifre Sala L8, Cerdá Gabaroi D9, Aguilar del Rey J10, Panero Lamothe B10, Casado Burgos E11
1 Hospital Universitario Reina Sofía. Córdoba; 2 Hospital Clínic. Barcelona; 3 Hospital Universitario Vall d'Hebron. Barcelona; 4 Hospital Universitario Son Llàtzer. Mallorca; 5 Hospital d'Igualada; 6 Hospital Universitario La Paz. Madrid; 7 Hospital Sant Rafael. Barcelona; 8 Hospital Universitario Germans Trias. Badalona; 9 Hospital de Sant Joan Despí Moisès Broggi; 10 Hospital Universitario Virgen de la Victoria. Málaga; 11 Hospital Parc Taulí. Sabadell
Objetivos: Analizar la evolución de la densidad mineral ósea (DMO), marcadores de recambio óseo (MRO) e incidencia de fracturas (Fx) y factores asociados tras la suspensión del tratamiento (Tto) con bisfosfonatos (BF).
Pacientes y métodos: Estudio multicéntrico observacional y retrospectivo de una cohorte de pacientes (PAC) con osteoporosis posmenopáusica o del varón (≥50) años (a), tratados con BF orales (alendronato, risedronato) durante ≥5a y con BF intravenoso (i.v) (zoledronato) ≥3a, que hubiesen suspendido el Tto ≥1a (≥2a para BF i.v) en el periodo 01/01/2013-31/12/2019 excluyendo PAC en Tto con corticoides y/o con patología metabólica ósea.
El descenso de DMO (dDMO) se consideró significativo si >3% en cadera total (CT) y/o cuello femoral (CF) y >5% en columna lumbar (CL). Se estimó el tiempo (TP) hasta el dDMO y aparición de Fx mediante una curva Kaplan-Meier y se realizo un Test de Log-Rank.
Se evaluó la evolución de los MRO y el cambio de éstos asociados al dDMO y en función del tipo de BF.
Se analizaron los factores asociados al dDMO y desarrollo de Fx mediante una regresión de Cox multivariante.
Resultados: Se incluyeron 264 PAC, 89,4% mujeres con una edad media de 67,9 (8,6)a, 43,2% con antecedente de Fx. La mayoría (50,1%) en Tto con alendronato, con un TP medio en descanso terapéutico (DT) de 2,7 (6,7)a.
Durante el DT un 12,3% desarrollaron Fx, especialmente vertebral (VER) (50%) presentando mayor probabilidad los PAC de riesgo alto (Tscore <-2,5 en CF y/o Fxs basales múltiples) (HR :8,80; 2,45-31,56). El dDMO >3% en CT y CF fue del 18,6% (IC95% 14,3-23,7) y 27,7% (IC95% 22,6-33,3) respectivamente, asociadas ambas al TP en DT [2,72 (1,24) vs 2,82 (1,28)a]. La pérdida de DMO en CF se asocio a una DMO en CL basal más baja [0,892 (0,112) gr/cm2, Tscore:-2,26 (0,86)] y al desarrollo de Fx VER (HR: 3,49; 1,25- 9,76) durante el TP en DT. El 24,6% (IC95% 19,8-30,2) presentaron un dDMO >5% en CL que se asoció a una menor edad [65,3 (8,3)a] y DMO basal inferior [0,881 (0,106) gr/cm2].
Los MRO se elevaron de forma significativa tras 12 meses en DT, especialmente P1NP (+16,17). Dicho aumento se asoció al dDMO en CT y al Tto con BF oral.
Conclusiones: Alrededor del 25% presentan dDMO significativo y el 12,3% desarrollan Fx por fragilidad en un TP de DT superior a 2a.
El PAC con riesgo de Fx alto y/o dDMO significativo en CF presenta mayor riesgo de Fx VER durante el periodo en DT.
El aumento de P1NP y CTX asociado al dDMO en CT podrían predecir el reinicio más precoz del Tto con BF.
6. Efectos de una combinación de estímulo mecánico e hipóxico sobre la expresión de osteocalcina en células madre mesenquimales diferenciadas a osteoblastos: resultados de un estudio piloto
Camacho Cardenosa M, Torrecillas Baena B, Ruiz Reyes S, Mesa Morillo C, Gálvez Moreno MA, Casado Díaz A
Instituto Maimónides de Investigación Biomédica. Córdoba
Los osteoblastos son células endocrinas que regulan la expresión de insulina a través de la acción de la osteocalcina, siendo por tanto fundamental para la homeostasis de glucosa en el organismo. Así, niveles de osteocalcina se correlacionan negativamente con la glucosa en sangre, la resistencia a la insulina, la obesidad o marcadores de síndrome metabólico. En el tratamiento de la osteoporosis, los bifosfonatos descienden los niveles de osteocalcina, lo que se correlaciona positivamente con marcadores de resorción ósea en humanos. Además, estos cambios en los niveles de osteocalcina se asocian con cambios en la masa y grasa corporal. En este sentido, el desarrollo de estrategias terapéuticas que favorezcan o frenen la reabsorción ósea, al mismo tiempo que favorezcan los niveles de osteocalcina, podría ser de gran relevancia en el tratamiento de las enfermedades asociadas a la edad. Diferentes estudios desarrollados en modelos animales y ensayos clínicos, han mostrado como el estímulo mecánico inducido por el ejercicio físico, aumenta la ratio OPG/RANKL, frenando así la reabsorción ósea, al tiempo que aumento los niveles de osteocalcina. Por otro lado, la exposición a hipoxia, la cual, ante la falta de oxígeno, requiere de vías metabólicas glucolíticas, podría favorecer los niveles de osteocalcina. En este sentido, exposiciones hipóxicas intermitentes han sido relacionadas con mejoras en la resistencia a la insulina. Así, el objetivo de este estudio es evaluar si la agitación del medio de cultivo en un ambiente hipóxico puede afectar in vitro a la diferenciación a osteoblastos de MSC humanas derivadas de médula ósea y a la expresión de osteocalcina.
Cultivos de MSC humanas de médula ósea inducidas a diferenciarse a osteoblastos, fueron expuestas 4 días a la semana a 2 horas de hipoxia o vibración en un agitador en un ambiente hipóxico (3% O2) o normóxico (21% O2). La expresión de genes OPG, RANKL y osteocalcina, así como la mineralización fueron estudiados.
La mineralización fue aumentada en todos los tratamientos. La expresión OPG/RANKL aumentó en todos los grupos. La expresión de osteocalcina fue aumentada a los 14 días, sobre todo en los grupos sometidos a hipoxia.
La combinación de un estímulo mecánico e hipóxico podría ser un tratamiento favorable para aumentar la formación ósea frente a la reabsorción, al tiempo que consigue aumentar los niveles de osteocalcina.
7. La proporción de pacientes que alcanzan el efecto umbral sustitutivo de DMO con romosozumab: análisis post hoc de los ensayos aleatorizados fase 3 FRAME y ARCH
Libanati C1, Chapurlat R2, Van den Bergh J3, Ralston SH4, Ferrari S5, McClung M6, Lorentzon M6, Lewiecki M7, Matsumoto T8, Timoshanko J9, Wang Z10
1 UCB Pharma. Bruselas (Bélgica); 2 INSERM UMR 1033. Universidad Claude Bernard (Francia); 3 VieCuri Medisch Centrum (Holanda); 4 Centro de Medicina Genómica y Experimental, Instituto MRC de Genética y Cáncer, Universidad de Edimburgo (Reino Unido); 5 Hospital Universitario de Ginebra (Suiza); 6 Instituto de Investigación Sanitaria Mary MacKillop. Universidad Católica Australiana. Melbourne (Australia); 7 Centro para la Investigación Clínica y la Osteoporosis de Nuevo México. Albuquerque. NM (EE.UU.); 8 Universidad de Tokushima. Tokushima (Japón); 9 UCB Pharma, Slough (Reino Unido); 10 Amgen Inc. Thousand Oaks. CA (EE. UU.)
Introducción: El proyecto FNIH-ASBMR SABRE1 definió el efecto umbral sustitutivo (EUS) de la densidad mineral ósea (DMO) necesario para predecir una reducción significativa de la fractura (fx) al nivel del estudio. Los EUS en el proyecto FNIH-ASBMR SABRE se calcularon utilizando la diferencia en el cambio de porcentaje de DMO a los 24 meses (M) entre activo y placebo (PBO).1 En la práctica clínica, una medida más relevante es si la DMO de las pacientes (pts) ha mejorado con el tratamiento desde sus propios valores del periodo basal (BL). Este análisis post hoc de FRAME (NCT01575834) yARCH (NCT01631214) se evaluó el porcentaje de pts que lograron los umbrales de EUS de FNIH1 con romosozumab (Romo) o alendronato (ALN) a los 12 M y 24 M en comparación con sus propios valores de DMO en el BL.
Materiales y métodos: Mujeres posmenopáusicas con osteoporosis fueron aleatorizadas para recibir 210 mg de Romo al mes o el comparador (FRAME: PBO mensual; ARCH: ALN 70 mg semanales) durante 12 M. Después de 12 M, todas las pts recibieron ALN en ARCH o denosumab en FRAME. Aquí informamos de la proporción de pts que lograron cambios porcentuales totales de DMO de la cadera a los 12 M y 24 M que cumplen los EUS de reducción de riesgo de fx vertebral, no vertebral, de cadera y de cualquier tipo (caso observado), sin comparación con el PBO.
Resultados: La tabla muestra el porcentaje de pts que lograron cambios de DMO desde el BL correspondiente a los EUS para cada categoría de fx.
Tabla Proporción de pacientes con cambio porcentual total de DMO de cadera desde el periodo inicial ≥EUS a los 12 y 24 meses.
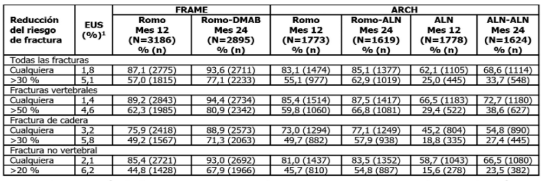
Para cada categoría de fractura, se muestran los EUS necesarios para cualquier reducción y para reducciones máximas en el riesgo de fractura (entre >20 % y >50 %) referidos por Eastell et al1.
ALN: alendronato; DMAB: denosumab; EUS: efecto umbral sustitutivo; PBO: placebo; Romo: romosozumab.
Conclusiones: En un plazo de 12 M de tratamiento con Romo, la mayoría de las pts lograron los EUS de FNIH-SABRE para cualquier reducción de riesgo de fx. Y tanto a los 12 como a los 24 M, una mayor proporción de pts alcanzaron los EUS con Romo en comparación con ALN en todos los tipos de fx.
1. Eastell, R. JBMR 2022;37:29-35.