INTRODUCCIÓN
Los carbohidratos (CHO) son esenciales para la práctica deportiva. La depleción del glucógeno puede conducir a hipoglucemia y, por ende, a una disminución del rendimiento (1). Las pruebas de numerosos estudios indican que la alimentación con CHO durante el ejercicio de unos 45 minutos o más puede mejorar la capacidad de resistencia y el rendimiento (2). Los mecanismos por los que la alimentación con CHO antes y durante el ejercicio mejora el rendimiento incluyen el mantenimiento de los niveles de glucosa en sangre, el mantenimiento de niveles elevados de oxidación de CHO y el ahorro de glucógeno hepático y, posiblemente, muscular esquelético (3). Por ello, es común realizar una ingesta previa y durante el ejercicio para evitar la depleción de glucógeno, especialmente en deportes intermitentes o de larga duración (4). No obstante, una carga previa y durante el ejercicio con comida rica en CHO puede resultar poco digestiva, causando malestar intestinal durante la actividad física. Los atletas suelen tomar bebidas con un 6-8 % de CHO, lo que favorece la digestión y el vaciado gástrico (5). Además, la ingesta en bebida de reposición ayuda a la rehidratación. En este aspecto, las bebidas energéticas (BE) suelen postularse como una de las opciones para los atletas (6).
Las BE aparecieron por primera vez en Europa y Asia en la década de los 60. Este tipo de bebida ha ganado especial protagonismo, como demuestra su consumo por parte de diversos grupos demográficos, como jóvenes, trabajadores, estudiantes, deportistas profesionales y deportistas aficionados (7). Las BE suelen contener cafeína y taurina, lo que potencia el rendimiento físico (8). Otro ingrediente común en la mayoría de las BE es algún tipo de fuente de CHO (glucosa, sacarosa o maltodextrina), importantes para la reposición de glucógeno. La prevalencia del consumo de BE entre los atletas es limitada y varía entre los estudios. Un análisis transversal de los datos de una encuesta en un estudio de cohorte de 2.287 adultos jóvenes demostró que los hombres que dedicaban más tiempo a la actividad física tenían un mayor consumo de BE (9). En atletas jóvenes, Petróczi y cols. (6) mostraron que el 41,7 % de la población examinada consumía BE, las cuales constituían el suplemento elegido con mayor frecuencia.
Un aspecto importante a tener en cuenta en las bebidas deportivas es su composición. Este tipo de bebidas suelen contener principalmente CHO simples, como glucosa y sacarosa. Los CHO simples presentan un índice glucémico (IG) elevado, lo que afecta al estado posprandial. Es conocido que los CHO con alto IG producen un llenado más rápido de los depósitos de glucógeno y un incremento brusco de los niveles de insulina, impidiendo la lipólisis (10). Este hecho podría conducir a una hipoglucemia y producir un efecto rebote (10). Estudios previos han relacionado la hiperinsulinemia con un mayor riesgo de eventos cardiovasculares (11). Se sabe que los niveles elevados crónicos de glucosa e insulina en sangre también pueden desencadenar la formación de productos finales de glicación avanzada, causando estrés oxidativo (12). Por otro lado, otros estudios han analizado la influencia de CHO con menor IG como la fructosa. Numerosos trabajos han reportado la mejora del rendimiento de larga duración tras la ingesta de CHO de bajo IG en comparación con CHO de alto IG (13-15). El consumo de CHO de bajo índice permitiría una mayor lipólisis y oxidación de grasas debido a un menor incremento de la insulina, preservando así el depósito de glucógeno (16). Sin embargo, la reposición del glucógeno es más lenta (10). Un estudio reciente observó que la ingesta de una barra de nutrición deportiva a base de lentejas de bajo IG proporcionaba un beneficio metabólico (menor tasa de oxidación de carbohidratos) y una modesta mejora en la carrera de agilidad y en la altura de salto al final de la prueba (17).
Las proteínas son combinaciones de aminoácidos que actúan como elementos estructurales o de transporte. En el plasma, las proteínas contribuyen principalmente a mantener el volumen del fluido circulante y al transporte. El estudio de las proteínas totales es importante para evaluar el estado nutricional (18). Un estudio previo mostró que, tras la ingesta de cuatro huevos, los valores de proteínas totales ascendieron durante las siguientes tres horas (19).
Se ha sugerido que la miel, debido a su alto contenido en CHO, puede ser una fuente de energía adecuada para atletas o aficionados (20). La miel puede desempeñar dicho papel debido a su composición (38,5 % de fructosa, 31,0 % de glucosa, 17,1 % de agua, 7,2 % de maltosa, 4,2 % de trisacáridos/otros hidratos de carbono, 1,5 % de sacarosa y 0,5 % de proteínas) (21). Sin embargo, no existe demasiada evidencia científica sobre la cuestión. Un estudio reciente indicó la necesidad de investigar los posibles escenarios de los efectos de la miel (22). Debido a los componentes de la miel, la respuesta posprandial podría ser diferente en comparación con el azúcar libre característico de las bebidas deportivas o BE convencionales. Así, sería interesante investigar el comportamiento de la glucemia y la insulina tras su ingesta en un periodo de dos horas posteriores. Por ello, el objetivo de esta investigación fue estudiar el efecto de la ingesta de una BE rica en miel (fructosa y glucosa, principalmente; BeeBad EnegyDrink®, Parodi Group, Italia) y una BE popular con azúcares libres de alto IG (sacarosa y glucosa) sobre la insulina, la glucemia, las proteínas totales y los triglicéridos.
MATERIAL Y MÉTODOS
PARTICIPANTES
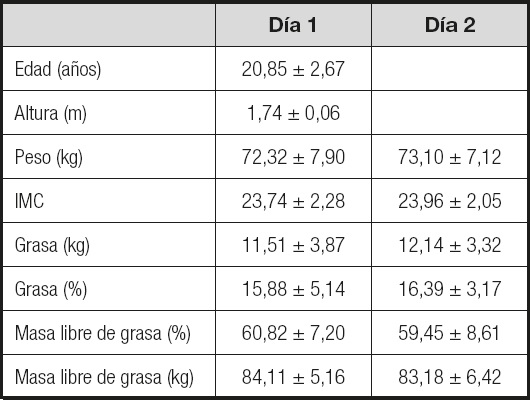
Quince sujetos varones participaron en el presente estudio (Tabla I). Todos los participantes eran estudiantes universitarios del Grado de Ciencias del Deporte y vivían en la ciudad de Cáceres (Extremadura). Los participantes fueron informados del propósito del estudio y firmaron un consentimiento informado. El protocolo fue revisado por el Comité de Bioética de la Universidad de Extremadura siguiendo las directrices de la declaración ética de Helsinki, actualizada en Fortaleza (2013), para la investigación en humanos (código: 31/2020). Un código fue asignado a cada participante para el tratamiento y la recolección de muestras con el objetivo de mantener el anonimato.
Para la participación en el estudio, los sujetos debían cumplir los siguientes requisitos: ser hombre, no tener trastornos metabólicos como diabetes y obesidad, no tomar medicaciones, permanecer en estado de ayuno al menos ocho horas el día de la extracción sanguínea y no tomar frecuentemente BE y cafeína.
Se indicó a todos los participantes que evitaran cualquier tipo de ejercicio extenuante y que se abstuvieran de consumir cafeína y alcohol durante los dos días previos a la extracción. No se permitió comida o bebida después de las 21:00 h del día anterior (Tabla I).
DISEÑO DEL ESTUDIO
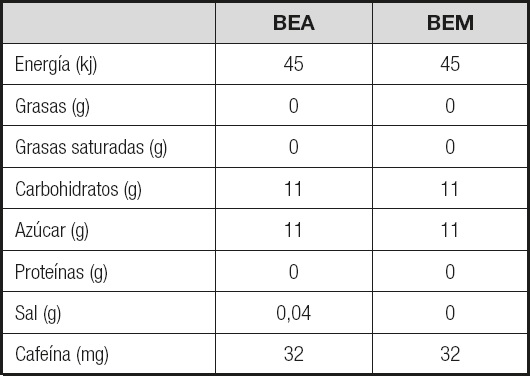
En el presente estudio experimental se utilizaron dos tipos de BE de similar composición (Tabla II). En cada evaluación, separadas en tres días, todos los sujetos ingirieron un envase completo de cada bebida. Durante las evaluaciones se obtuvieron muestras sanguíneas antes de ingerir la bebida en estado de ayuno (inicial), 30 minutos, 60 minutos y 120 minutos después de ingerir las bebidas. El primer día, los participantes ingirieron una BE rica en miel (BEM) (BeeBad EnegyDrink®, Parodi Group, Italia) mientras que, el segundo día, los participantes ingirieron una BE popular con azúcares libres (BEA). Ambos envases tenían el mismo aspecto con el fin de evitar interpretaciones de los sujetos. La cantidad ingerida de cada bebida fue de 250 ml. Los ingredientes de la BEM eran: agua carbonatada, miel (13,8 %), acidificante, ácido cítrico, aromas naturales, jalea real (0,01 %), propóleos (0,01 %), extracto de ginseng (0,01 %), extracto de maca (0,01 %) y vitaminas (niacina, ácido pantoténico, vitamina B6, vitamina B12). Los ingredientes de la BEA eran: agua, sacarosa, glucosa, acidulante (ácido cítrico), dióxido de carbono, taurina (0,4 %), correctores de acidez (carbonatos de sodio, carbonatos de magnesio), vitaminas (niacina, ácido pantoténico, vitamina B6, vitamina B12), aromas y colorantes (caramelo natural, riboflavinas) (Tabla II).
ANTROPOMETRÍA Y COMPOSICIÓN CORPORAL
Las medidas antropométricas y de composición corporal se realizaron por la mañana en ayunas con la menor ropa posible y siempre a la misma hora. Todas las valoraciones se realizaron antes de las extracciones sanguíneas. La altura corporal fue medida con un tallímetro (Seca 220). El peso corporal, la masa grasa y la masa libre de grasa fueron evaluadas mediante bioimpedancia eléctrica utilizando un analizador BF-350 (Tanita Corp., Japón).
EXTRACCIÓN SANGUÍNEA
Las extracciones sanguíneas se realizaron siempre a la misma hora para limitar el impacto de los ritmos circadianos. La primera muestra se extraía a las 8:30 h a.m. Se obtuvieron 10 ml de sangre venosa antecubital de cada participante en cada extracción utilizando una jeringa de plástico con una aguja de acero inoxidable. Se obtuvieron muestras de sangre venosa utilizando ácido etilendiaminotetraacético (EDTA) como anticoagulante. La sangre se centrifugó inmediatamente a 3.000 r.p.m. durante diez minutos (P-selecta®, Meditronic). La muestra de sangre se recogió en un tubo de polipropileno. Luego, la muestra de sangre se centrifugó a 3.000 r.p.m. durante 15 minutos a temperatura ambiente para obtener plasma. El plasma se colocó en tubos estériles y se almacenó a -80 °C hasta su uso.
DETERMINACIÓN DE GLUCOSA, INSULINA, TRIGLICÉRIDOS Y PROTEÍNAS TOTALES
La glucosa, los triglicéridos y las proteínas totales fueron determinados mediante espectrofotometría (Coulter Electronics LTD, Model CPA; Northwell Drive, Luton, Reino Unido). La insulina fue determinada mediante ensayo por inmunoabsorción ligado a enzimas (ELISA) con un ER-500 (Sinnowa, Alemania). Todas las mediciones fueron realizadas por el mismo técnico e instrumento.
ANÁLISIS ESTADÍSTICO
El análisis estadístico se realizó con el software IBM SPSS Statistics versión 21.0 (IBM Co., Armonk, NY, Estados Unidos). Los resultados se expresan como media y desviación estándar. Se estudió la normalidad de las variables a través del test de Shapiro-Wilk. Los datos se analizaron mediante el análisis de varianza (ANOVA) de dos factores (tiempo y bebida). Se utilizó eta cuadrado parcial (η2) como medida del tamaño del efecto de ANOVA. Los rangos para evaluar las magnitudes fueron η2 ≥ 0,01, η2 ≥ 0,06 y η2 ≥ 0,14 para pequeñas, medianas y grandes, respectivamente. Se consideró estadísticamente significativa una p ≤ 0,05. Se realizó la prueba post-hoc Bonferroni para conocer las diferencias en el tiempo.
RESULTADOS
A continuación, se representan los resultados obtenidos en el presente estudio. En la tabla III se muestran las diferencias entre BE en glucosa, insulina, proteínas totales y triglicéridos a lo largo de las extracciones. Se observaron diferencias significativas entre BE en insulina (p < 0,05). En cuanto al efecto del tiempo, se apreciaron diferencias significativas en glucosa e insulina (p < 0,01). Concretamente, hubo diferencias muy significativas entres los valores en 30 minutos y el resto de mediciones en cuanto a la glucosa (p < 0,01), así como entre inicial y 60 minutos en insulina (p < 0,01). No se observaron diferencias en la interacción grupo x tiempo.
Tabla III. Diferencias entre bebidas en la evolución a lo largo del tiempo de glucosa, insulina, proteínas y triglicéridos.
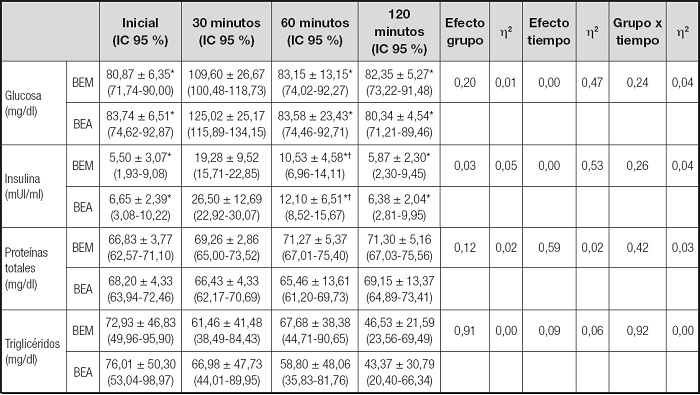
BEM: bebida energética miel; BEA: bebida energética azúcar; IC: intervalo de confianza.
*p < 0,01 30 minutos vs. resto de mediciones.
†p < 0,01 inicial vs. 60 minutos.
En la figura 1 se muestra que los porcentajes de incrementos en los 30 minutos de glucosa e insulina son más elevados en BEA en comparación con BEM.
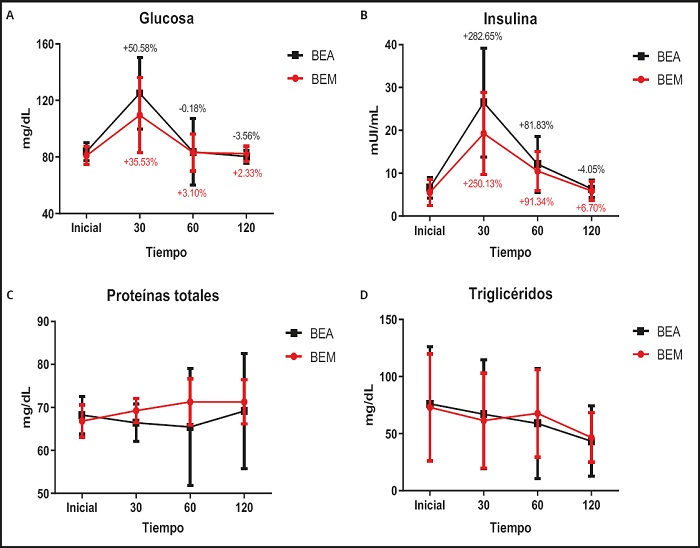
Figura 1. Representación gráfica de la evolución de glucosa, insulina, proteínas totales y triglicéridos en las diferentes bebidas. Los porcentajes fueron establecidos en relación a los valores iniciales. A. Evolución de la glucosa según la BE. B. Evolución de la insulina según BE. C. Evolución de las proteínas según BE. D. Evolución de triglicéridos según BE. BEM: bebida energética miel; BEA: bebida energética azúcar.
DISCUSIÓN
El objetivo de la presente investigación fue estudiar el efecto de la ingesta de BEM (BeeBad EnegyDrink®, Parodi Group, Italia) y una BEA de alto IG sobre la glucosa sanguínea, las proteínas totales y los triglicéridos en condiciones basales. La miel es un alimento con IG glucémico bajo, lo que produce un lento incremento de la glucemia e impide el aumento repentino de glucosa en sangre y carga glucémica media (22). Los beneficios de la miel en la salud y en el rendimiento están siendo cada vez más investigados (22) y se están mostrando beneficios para la recuperación postesfuerzo (23). Es sabido que la miel tiene una amplia gama de beneficios para la salud, como la disminución de los radicales libres y de mediadores inflamatorios (22). Por ello, la miel está cada vez más presente en diversos productos (24).
Los valores basales de glucosa e insulina observados en la presente investigación son similares a los obtenidos en otros estudios (25,26). Aunque no se observaron diferencias significativas ente BEM y BEA en la glucosa sanguínea, se puede apreciar en la figura 1A una menor tendencia al incremento de la glucosa, especialmente a los 30 minutos, en BEM. Los estudios llevados a cabo con alimentos de alto IG vs. bajo IG mostraron diferencias entre la concentración de glucosa sanguínea a lo largo del tiempo (27,28), siendo menor la glucemia en aquellos alimentos/bebidas de bajo IG. Respecto a los niveles de insulina, en el presente estudio se observaron diferencias entre bebidas (p < 0,05) y fueron los 30 minutos el momento de mayor elevación. Estos resultados coinciden con los observados por Hollenbeck y cols. (29) y Alfenas y cols. (30), quienes compararon la respuesta de la insulina y la glucemia entre comidas de diferentes IG. Igualmente, Lee y cols. (31) observaron que la cinética de la insulina difería según el tipo de carbohidrato ingerido, siendo la glucosa el carbohidrato que mayores valores de insulina producía. Respecto a los estudios que analizan la respuesta posprandial de BE, Nowak y cols. (26) observaron incrementos en la glucemia tras la ingesta. Igualmente, González-Domínguez y cols. (32) observaron en refrescos con alto contenido en azúcar incrementos de la glucemia a diferencia de los refrescos bajos en azúcar.
La causa de que no sea significativa la diferencia en la glucosa sanguínea podría tener relación con el contenido similar de cafeína en las BE. Se ha reportado que la cafeína incrementa la glucosa sanguínea incluso cuando la ingesta de CHO es de bajo IG (33,34). El principal efecto fisiológico de la cafeína es el antagonismo del receptor de adenosina (35). La cafeína altera la tolerancia a la glucosa a través del antagonismo de los subtipos A1 y A2 del receptor de adenosina relacionados con la captación de glucosa en los músculos esqueléticos. Se ha observado que la administración de cafeína durante una pinza hiperinsulinémica-euglucémica (prueba utilizada para detectar resistencia a la insulina) da como resultado una disminución del 50 % en la captación de glucosa estimulada por insulina en el músculo esquelético, lo que se traduce en una reducción del 23-30 % en la captación de glucosa en todo el cuerpo (33). También se ha propuesto que la captación de glucosa mediada por insulina se ve afectada por la liberación de epinefrina estimulada por cafeína (36). La cafeína estimula la liberación de epinefrina, que ejerce acciones opuestas a las de la insulina a través de la estimulación β-adrenérgica (37).
La ingesta de BE se acompañó de un estado transitorio de hiperinsulinemia relacionado con el incremento de la glucemia. Es sabido que este estado favorece la captación de glucosa y promueve que el organismo pase del catabolismo al anabolismo. Además, cabe señalar que la coingesta de cafeína puede agudizar el estado de hiperinsulinemia provocado por los CHO mediante la elevación de los niveles de epinefrina en sangre (32,38). La diferencia en los valores de insulina entre BE podría deberse a la miel presente en BEM. El contenido de fructosa de la miel varía del 21 al 43 % y la relación fructosa/glucosa, de 0,4 a 1,6 (39). La fructosa tiene un índice glucémico de 19, en comparación con la glucosa, que tiene 100, o la sacarosa, con 60 (40). Diferentes estudios revelan el efecto hipoglucemiante de la miel. Sin embargo, el mecanismo de este efecto sigue sin estar claro. Se sugirió que la fructosa, los minerales (selenio, zinc, cobre y vanadio), los ácidos fenólicos y los flavonoides podrían tener un importante papel (39).
Existe evidencia de que la fructosa tiende a reducir la glucosa en sangre. Los mecanismos implicados en este proceso pueden incluir la reducción de la tasa de absorción intestinal y la prolongación del tiempo de vaciado gástrico (39). La fructosa estimula la glucoquinasa en los hepatocitos, la cual juega un papel importante en la captación y el almacenamiento de glucosa como glucógeno en el hígado. La glucosa, por otro lado, que está presente junto a la fructosa en la miel, mejora la absorción de la fructosa y promueve sus acciones hepáticas a través de su entrega mejorada al hígado (39,41). Por lo tanto, este menor incremento de la glucemia tras la ingesta de BEM derivaría igualmente en un menor incremento de los niveles de insulina, observado en el presente estudio. El consumo de un carbohidrato de IG bajo da como resultado una respuesta de glucosa plasmática lenta y gradual, mientras que un carbohidrato de IG alto da como resultado un rápido aumento de la concentración de glucosa en sangre, seguido de un rápido retorno a los valores iniciales o por debajo (hipoglucemia de rebote), como se observó en el presente estudio (10).
Por otro lado, se observa una disminución de los triglicéridos a lo largo del tiempo en ambas BE, sin ser significativo. Esta disminución podría deberse, en parte, al incremento de los valores de insulina. Los adipocitos son el lugar principal de almacenamiento de triacilglicerol en los individuos sanos (42). La insulina aumenta el almacenamiento de triglicéridos en los adipocitos. Además, la inhibición de la lipólisis por parte de la insulina no solo favorece el almacenamiento de lípidos, sino que también disminuye los niveles de ácidos grasos circulantes (43). Respecto a las proteínas totales, al igual que con los triglicéridos, no se observaron cambios significativos. Este hecho podría estar relacionado por la ínfima cantidad de proteínas presente en este tipo de bebidas.
Cabe destacar las posibles aplicaciones prácticas de este estudio, pudiendo ser la BEM una alterativa de BE para atletas. Esta bebida podría aplicarse antes y durante el ejercicio debido a que presenta una respuesta glucémica y de la insulina menor que otras bebidas con azúcares libres.
El presente estudio tiene algunas limitaciones: a) ausencia del control de la ingesta nutricional los días previos; b) ausencia del género femenino; c) no se valoró la sensibilidad a la insulina de los participantes, aunque todos eran jóvenes sanos; y d) no se evaluaron los niveles de condición física o de actividad física de los participantes.