Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.98 no.3 Madrid mar. 2006
TRABAJOS ORIGINALES
La resistencia a la insulina en la valoración no invasiva de la fibrosis en pacientes con hepatitis C. Estudio comparativo de métodos bioquímicos
M. Romera, R. Corpas y M. Romero Gómez
Área de Hepatología. Unidad de Gestión Médico-Quirúrgica de Enfermedades Digestivas. Hospital Universitario de Valme. Sevilla
Una parte de este trabajo fue presentado como comunicación oral en el LXIV Congreso de la Sociedad Española de Patología Digestiva, siendo galardonada con el premio a la mejor comunicación Clínica.
Estudio Financiado con los proyectos de investigación 43/03 y 102/04 de la Consejería de Salud de la Junta de Andalucía, así como el Plan Andaluz de Investigación CTS-532.
RESUMEN
Introducción: la resistencia a la insulina (RI) promueve la progresión de la fibrosis y disminuye la respuesta al tratamiento en pacientes con hepatitis C. Recientemente, se ha propuesto el índice de Sidney como método no invasivo de predicción de la fibrosis que incluye la RI.
Objetivo: valorar la utilidad del índice de Sidney en la predicción de fibrosis avanzada (F3-F4) o ausencia de fibrosis significativa (F0-F1) en pacientes con hepatitis C.
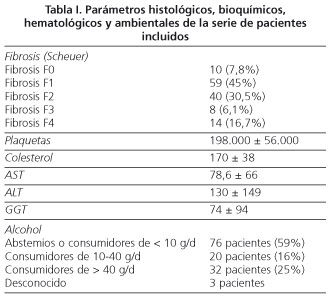
Pacientes y métodos: incluimos 131 pacientes con hepatitis crónica C. Edad media 40 ± 11 años, 78 hombres y 53 mujeres. Estadio de fibrosis leve (F0-F1) 69 pacientes, F2: 40 y avanzado (F3-F4) en 22 pacientes. Determinamos los niveles basales de AST, ALT, GGT, plaquetas, colesterol, alcohol y RI (HOMA-IR). Calculamos el índice de Sidney, de Forns y APRI.
Resultados: el área bajo la curva de la capacidad diagnóstica de ausencia de fibrosis significativa de cada método fue Sidney: 0,80, Forns: 0,71 y APRI: 0,70; p = ns, así también, la capacidad diagnóstica de presencia de fibrosis avanzada fue Sidney: 0,88, Forns: 0,83 y APRI: 0,82; p = ns. El valor predictivo negativo de fibrosis significativa fue del 74, 72 y 67% respectivamente. Debido a la presencia de valores intermedios los índices no fueron aplicables al 36, 44 y 43% respectivamente.
Conclusiones: la inclusión de la resistencia a la insulina en la predicción de fibrosis avanzada o exclusión de fibrosis significativa mejora ligeramente el rendimiento de otros índices. No obstante, los resultados son subóptimos y más de un tercio de los pacientes no podrían ser clasificados correctamente.
Palabras clave: Alanin-aminotransferasa. Aspartato-aminotransferasa. Transaminasas. Plaquetas. Colesterol. Métodos no invasivos. Hepatitis C. Fibrosis. Gamma-glutamil-transpeptidasa.
Abreviaturas
RI: resistencia a la insulina.
HOMA: homeostasis model assessment.
APRI: AST platelet ratio index.
GGT: gammaglutamil-transpeptidasa.
ALT: alanin-aminotransferasa.
AST: aspartato-aminotransferasa.
AUC: área bajo la curva.
VPN: valor predictivo negativo.
Introducción
La hepatitis C es una enfermedad de distribución mundial que afecta a 1-3 de cada 100 personas. No obstante, estas cifras varían dependiendo del área geográfica. En España se estima una prevalencia que oscila en torno al 2% (1). El conocimento del estadio de fibrosis es de gran utilidad en el manejo del paciente con hepatitis C ya que permite valorar la necesidad de tratamiento y establecer el pronóstico. Aunque la biopsia hepática percutánea sigue siendo la única prueba diagnóstica que delimita la fibrosis, se han diseñado modelos no invasivos predictivos de fibrosis hepática tanto bioquímicos como basados en técnicas de imagen. Los modelos bioquímicos se pueden clasificar en cuatro tipos: a) modelos que utilizan parámetros obtenidos en la práctica clínica habitual [índice de Forns: (plaquetas, GGT, colesterol y edad) (2) e índice APRI: (plaquetas y AST)] (3); b) modelos que incluyen parámetros bioquímicos no determinados en la práctica habitual [Fibrotest (alfa-2 macroglobulina, apolipoproteína-A1, haptoglobina, GGT y bilirrubina total)] (4); c) índices que incluyen marcadores de fibrogénesis como el péptido procolágeno III, ácido hialurónico, o el YKL-40 (5,6); y d) modelos que utilizan parámetros obtenidos mediante abordaje proteómico para el estudio de las glicoproteínas (7).
La hepatitis C promueve el desarrollo de resistencia insulínica, probablemente por el efecto directo del virus sobre la señalización intracelular de la insulina (8). Además, se ha constatado el papel de la resistencia a la insulina en la progresión de la enfermedad (9). En pacientes euglucémicos el cálculo del índice de HOMA permite cuantificar la resistencia a la insulina. Se ha demostrado una correlación entre la fibrosis y la resistencia insulínica medida por el índice de HOMA-IR (10). Un grupo de la universidad de Sidney (11) ha propuesto un modelo no invasivo de predicción de la fibrosis que incluye la resistencia a la insulina junto con la edad, AST, colesterol y consumo de alcohol. Este modelo de Sidney ha demostrado una alta capacidad de predicción de fibrosis en pacientes con hepatitis C. Dado el enorme interés que los métodos no invasivos presentan para la práctica clínica habitual, hemos diseñado el presente estudio para validar la utilidad del índice de Sidney en una cohorte de pacientes con hepatitis C atendidos en nuestra Unidad.
Pacientes y métodos
Revisamos las historias clínicas de 131 pacientes con hepatitis crónica C sometidos a biopsia hepática percutánea entre 1999 y 2003 en la Unidad de Hepatología del Hospital Universitario de Valme y de los que disponíamos de datos de plaquetas, AST, colesterol, edad, gamma-glutamil-transpeptidasa (GGT), HOMA-IR y sobre el grado de consumo de alcohol en el momento de la biopsia hepática. Todos presentaban antiVHC y ARN VHC positivos. Ningún paciente era portador de AgHBs ni anti-VIH ni había recibido tratamiento antiviral previo. Se trataba de una serie con 78 hombres y 53 mujeres con una edad media de 40 ± 11 años (22-67). Presentaban genotipo 1: 56 (42,7%), genotipo 2/3: 25 (19,1%) y no se conocía genotipo en 50 (38,2%). El estadio de fibrosis se valoró entre F0 y F4 usando la clasificación de Scheuer (12). Todas las biopsias fueron evaluadas por el mismo patólogo, que seleccionó las biopsias que mostraban un tamaño suficiente para la valoración de la fibrosis. El número de espacios porta fue de 10 ± 2. Denominamos la fibrosis utilizando tres términos: fibrosis leve (F0-F1), fibrosis avanzada (F3-F4) y fibrosis significativa (F2-F3-F4). Calculamos el índice de resistencia a la insulina utilizando el test de HOMA (Homeostasis Model Assessment) = insulina (mU/ml) * glucemia (mmol/L)/22,5. Todos los datos bioquímicos incluidos, histológicos, así como el HOMA-IR y el consumo de alcohol de la muestra de 131 pacientes quedan recogidos en la tabla I. Revisamos las historias clínicas y recogimos los datos de GGT, edad, colesterol y plaquetas para calcular el índice de Forns según la fórmula: [7,811-3,131* ln (n° plaquetas) + 0,781 * ln(GGT) +3,467 * ln(edad) - 0,014 * (colesterol)]. Los pacientes se clasificaron según los puntos de corte indicados por Forns y cols., en tres grupos: < 4,2 puntos [n = 46 (41,4%)], entre 4,2 y 6,9 puntos [(n = 49 (41,1%)] y mayores de 6,9 puntos [n = 16 (14,41%)]. El índice APRI se calculó como el número de veces que superaba la AST la normalidad/cifra de plaquetas: [nº veces valor normal de AST/plaquetas * 109 * 100]. La cifra normal de AST de nuestro laboratorio fue de 37 U/L y de plaquetas de 142.000 plaquetas/microlitro. Los pacientes también se clasificaron según el resultado de acuerdo con los puntos de corte propuestos por Wai y cols.: APRI < 0,50 [n = 37 (33,1%)], entre 0,5 y 1,5 [(n = 48; 42,8%)] y APRI > 1,5 [(n = 27; (24,1%)]. El índice de Sidney se calculó mediante la fórmula [e*/1 + e*], donde el * es [-10,929 + (1,827 * LnAST) + (0,081 * edad) + (0,768 * alcohol graduado de 0-2) + (0,385 * HOMA-IR) - (0,447 * colesterol en mmol)]. Para calcular el índice de HOMA se determina la insulinemia mediante ECLIA en muestras congeladas a -80 ºC y obtenidas en el momento de la biopsia. Los pacientes se clasificaron en tres grupos atendiendo a los puntos de corte indicados por Sud y cols.: Sidney < 0,2 [n = 54 (45%)], entre 0,2 y 0,9 [n = 51 (42,5%)] y Sidney > 0,9 [n = 15 (12,5%)].
Análisis estadístico
Calculamos el índice de Forns, el índice APRI y el índice de Sidney para cada paciente. Analizamos la capacidad de predecir fibrosis leve (F0-F1) y de confirmar fibrosis avanzada (F3-F4) mediante curva ROC. Así también, utilizando el programa Epidat 3.0 (Xunta de Galicia, Santiago de Compostela, España) calculamos la sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo, así como el intervalo de confianza al 95% de cada parámetro para cada punto de corte en la exclusión de fibrosis significativa y la detección de fibrosis avanzada. Utilizando el SPSS 12.0 (SPSS, Chicago, IL) realizamos un estudio multivariante para analizar el papel de cada una de las variables en la predicción de fibrosis leve. Presentamos los datos como la media + la desviación estándar. Consideramos significativa una p < 0,05.
Resultados
Detectamos correlación entre cada uno de los índices y la fibrosis: índice de Forns (r = 0,46; p < 0,001), como el índice APRI (r = 0,48; p < 0,001) y el índice de Sidney (r = 0,59; p < 0,001).
Utilidad de los tres métodos en la predicción de ausencia de fibrosis significativa (F0-F1)
El análisis mediante curva ROC demostró que el área bajo la curva del índice Sidney en cuanto a la capacidad diagnóstica de ausencia de fibrosis significativa es superior a los otros dos modelos (Sidney presenta un AUC 0,80) mientras que los modelos Forns y APRI presentaron una capacidad diagnóstica similar entre sí con AUC 0,71 y 0,70 respectivamente (Fig. 1). El modelo de Sidney alcanzó un valor predictivo negativo de fibrosis significativa del 74% (IC 95%), de forma que en 54 pacientes detectamos un índice de Sidney inferior a 0,2 y de ellos 40 (74%) presentaban fibrosis F0-F1. Así también, el modelo Forns alcanzó un valor predictivo negativo de fibrosis significativa del 72% (IC 95%) ya que de los 46 pacientes con un índice Forns < 4,2 presentaban fibrosis F0-F1 33 casos (72%) y el modelo de APRI alcanzó un valor predictivo negativo de fibrosis significativa del 67%, de tal forma que en 37 pacientes con un índice de APRI < 0,5 presentaban fibrosis no significativa 25 casos.
Utilidad de los tres métodos en la predicción de fibrosis avanzada (F3-F4)
El área bajo la curva ROC para el diagnóstico de fibrosis avanzada fue de 0,88 para el índice de Sidney y 0,83 y 0,82 para los índices de Forns y APRI respectivamente (Fig. 2). Los pacientes con un resultado superior a 0,9 en el índice de Sidney mostraron un valor predictivo positivo de fibrosis avanzada del 73% ya que 10 de 15 pacientes con un resultado Sidney > 0,9 presentaban fibrosis avanzada F3-F4 frente al índice Forns > 6,9 demostró un valor predictivo positivo del 75,2%, ya que de los 16 pacientes con Forns > 6,9, 12 casos mostraban fibrosis F3-F4. Los pacientes que presentaron un resultado en el índice de APRI > 1,5 mostraron un valor predictivo positivo de fibrosis avanzada de sólo el 55%, puesto que de 27 pacientes con índice de APRI > 1,5, sólo 15 presentaban fibrosis F3-F4.
Relación entre la fibrosis y las variables incluidas
Análisis univariante
Para analizar el peso de cada variable realizamos una regresión lineal entre la fibrosis y cada uno de los parámetros estudiados. Encontramos correlación entre la fibrosis y la resistencia a la insulina (r = 0,37; p < 0,001), la edad (r = 0,43; p < 0,001), el consumo de alcohol (r = 0,22; p = 0,013), la cifra de plaquetas (r = -0,45; p < 0,001), AST (r = 0,35; p < 0,001), GGT (r = 0,33; p < 0,001), en cambio no encontramos correlación con los niveles de colesterol (r = 0,06; p = 0,37).
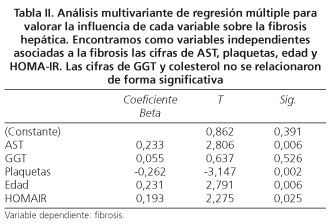
Análisis multivariante
En el análisis multivariante se configuró un modelo de regresión lineal múltiple (r2 = 0,36) en el que se definieron como variables independientes de predicción de fibrosis: la edad (p = 0,006), la cifra de plaquetas (p = 0,001), AST (p = 0,006) y HOMA-IR (p = 0,02) (Tabla II).
Discusión
La determinación del índice de Sidney en pacientes con hepatitis C mejora ligeramente el rendimiento de métodos como el índice de Forns o el índice APRI, aunque la mejoría es muy ligera y queda lejos de la significación clínica y estadística. Los principales problemas de los métodos no invasivos para la predicción de la fibrosis en la hepatitis C persisten sin resolver tras la inclusión de la resistencia a la insulina en el modelo y a pesar de su estrecha asociación con la fibrosis. Las limitaciones más importantes detectadas en los estudios de validación de los diferentes métodos no invasivos de predicción de la fibrosis en la hepatitis C comunicados son: a) por un lado, entre un tercio y la mitad de los pacientes presentan valores intermedios en los que no podemos predecir fibrosis; b) el valor predictivo negativo de fibrosis significativa es claramente inferior al referido por los autores en sus series de validación y quedan lejos de los estándares de calidad exigibles (> 85%). El índice de Forns comunicó un VPN del 96% que descendió al 71,4% en una cohorte posterior. Así también el índice APRI descendió del 86 al 72,4% (13). En el presente estudio el índice de Sidney presentó un VPN de fibrosis significativa del 70% frente al 93% comunicado por sus autores. Estas discrepancias podrían explicarse por el diferente poder estadistico de los estudios publicados, ya que con series inferiores a 200 casos los resultados pueden no ser reproducibles. Por otro lado, la prevalencia pre-prueba de fibrosis puede influir directamente en la capacidad diagnóstica de un método no invasivo. Además, la mayoría de los métodos separan bien la fibrosis avanzada (F3-F4) de la fibrosis estadio < 2, en cambio, la capacidad de diferenciar F1 de F2 sigue siendo subóptima; y c) en los análisis multivariantes que dan pie al diseño de las fórmulas que permiten calcular los índices, siguen incluyendo variables que en nuestra cohorte no se encuentran relacionadas con la fibrosis como el colesterol. Por todo ello, aunque es un área de gran interés para la práctica de la medicina estas limitaciones no parecen subsanarse con la inclusión de marcadores de fibrogénesis (14) o de marcadores relacionados con la fibrosis como la resistencia a la insulina.
La determinación del estadio de fibrosis en pacientes diagnosticados de hepatitis C es de gran relevancia clínica ya que nos permite determinar el pronóstico de la enfermedad, así como la necesidad de instaurar un tratamiento. Actualmente, la biopsia hepática percutánea con control ecográfico sigue siendo la prueba diagnóstica por excelencia para delimitar el estadio de fibrosis. La biopsia hepática presenta una serie de limitaciones entre las que destacan la variabilidad intra- (15) e interobservador (16); el error de muestra que puede impedir el diagnóstico de cirrosis hasta en un 15-20% de los casos (17). En un grupo de 124 pacientes con hepatitis C sometidos a laparoscopia con toma de dos biopsias hepáticas, una de cada lóbulo, se pudo comprobar que en un tercio de los casos se detectaba un estadio de diferencia entre biopsias y que en el 15% de los casos se comprobaba cirrosis hepática en uno sólo de los lóbulos (18). Recientemente se ha constatado que el tamaño de la muestra es muy importante en la reproducibilidad del estadiaje de fibrosis. En biopsias pequeñas el patólogo tiende a subestimar la fibrosis, mientras que en biopsias de más de 25 mm, la valoración de la fibrosis es más reproducible (19,20). No obstante, este aumento del tamaño de la muestra podría aumentar el riesgo de complicaciones. De todas formas, se estima que el riesgo de sufrir un accidente de tráfico en el desplazamiento al hospital es superior a la mortalidad por biopsia hepática (http://www.dgt.es/).
Las posibilidades diagnósticas de estos modelos no invasivos predictivos de fibrosis mejoran con el uso combinado de varios modelos. En pacientes con genotipo 1 el uso conjunto del índice Forns y APRI permite mejorar el valor predictivo negativo de fibrosis significativa hasta el 82% (13). Esta aproximación se ha visto avalada por el hecho de que el Fibrotest y el estudio de la elasticidad hepática medida por ultrasonidos generan mejores resultados que el uso de cada técnica por separado (21). Ante las limitaciones de los métodos bioquímicos se están desarrollando técnicas de imagen para el cálculo de la fibrosis. El uso de la elastografía transitoria es un método prometedor que ha sido validado en cohortes externas (22). Así también, el análisis óptico de imágenes de tomografía computerizada de hígado de pacientes con hepatitis C permite conocer el estadio de fibrosis hepática (23).
El método diagnóstico de fibrosis hepática ideal debe ser simple, barato, seguro y no invasivo. En un estudio de validación incluyendo 1.252 pacientes se comprobó que el valor predictivo positivo de fibrosis avanzada del método de Forns fue del 58,2% en comparación con el 75,2% de nuestro estudio y así también, el valor predictivo positivo de fibrosis avanzada del índice APRI fue del 55% tanto en este estudio como en el trabajo de Iacobellis y cols. (24). Lo que parece confirmar un descenso del rendimiento de estos tests en los estudios de validación.
En conclusión, el desarrollo de modelos simples incluyendo parámetros bioquímicos utilizados en la práctica clínica habitual, permite predecir la fibrosis hepática en pacientes con hepatitis C. No obstante, es necesario seguir trabajando en la mejora de estos métodos ya que los resultados no son óptimos y el conocimiento de la fibrosis tiene un gran impacto en el manejo del paciente con hepatitis crónica C.
Bibliografía
1. Eiras A, Sauleda S, Planelles D, et al. HCV screening in blood donations using RT-PCR in mini-pool: the experience in Spain after routine use for 2 years. Transfusion 2003; 43: 713-20. [ Links ]
2. Forns X, Ampurdanes S, Llovet JM, et al. Identification of chronic hepatitis C patients without hepatic fibrosis by a simple predictive model. Hepatology 2002; 36: 986-92. [ Links ]
3. Wai CT, Greenson JK, Fontana RJ, Kalbfleisch JD, Marrero JA, Conjeevaram HS, et al. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology 2003; 38: 518-26. [ Links ]
4. Imbert-Bismut F, Ratziu V, Pieroni L, Charlotte F, Benhamou Y, Poynard T. Biochemical markers can of liver fibrosis in patients with hepatitis C virus infection: a prospective study. Lancet 2001; 357: 1069-75. [ Links ]
5. Saitou Y, Shiraki K, Yamanaka Y, et al. Noninvasive estimation of liver fibrosis and response to interferon therapy by a serum fibrogenesis marker, YKL-40, in patients with HCV-associated liver disease. World J Gastroenterol 2005; 11: 476-81. [ Links ]
6. Patel K, Gordon SC, Jacobson I, et al. Evaluation of a panel of non-invasive serum markers to differentiate mild from moderate-to-advanced liver fibrosis in chronic hepatitis C patients. J Hepatol 2004; 41: 935-42. [ Links ]
7. Callewaert N, Van Vlierberghe H, Van Hecke A, Laroy W, Delanghe J, Contreras R. Noninvasive diagnosis of liver cirrhosis using DNA sequencer-based total serum protein glycomics. Nat Med 2004; 10: 429-34. [ Links ]
8. Kawaguchi T, Yoshida T, Harada M, et al. Hepatitis C virus down-regulates insulin receptor substrates 1 and 2 through up-regulation of suppressor of cytokine signaling 3. Am J Pathol 2004; 165: 1499-508. [ Links ]
9. Fartoux L, Poujol-Robert A, Guechot J, Wendum D, Poupon R, Serfaty L. Insulin resistance is a cause of steatosis and fibrosis progression in chronic hepatitis C. Gut 2005; 54: 1003-8. [ Links ]
10. Romero-Gomez M, Del Mar Viloria M, Andrade RJ, et al. Insulin resistance impairs sustained response rate to peginterferon plus ribavirin in chronic hepatitis C patients. Gastroenterology 2005; 128: 636-41. [ Links ]
11. Sud A, Hui JM, Farrell GC, et al. Improved prediction of fibrosis in chronic hepatitis C using measures of insulin resistance in a probability index. Hepatology 2004; 39: 1239-47. [ Links ]
12. Romero-Gómez M, Ramírez Martín del Campo M, Otero MA, Vallejo M, Corpas R, Castellano-Megias VM. Comparative study of two models that use biochemical parameters for the non-invasive diagnosis of fibrosis in patients with hepatitis C. Med Clin (Barc) 2005; 124: 761-4. [ Links ]
13. Rosenberg WM, Voelker M, Thiel R, et al. Serum markers detect the presence of liver fibrosis: a cohort study. Gastroenterology 2004; 127: 1704-13. [ Links ]
14. Goldin RD, Goldin JG, Burt AD, Dhillon PA, Hubscher S, Wyatt J, Patel N. Intra-observer and inter-observer variation in the histopathological assessment of chronic viral hepatitis. J Hepatol 1996; 25: 649-54. [ Links ]
15. Westin J, Lagging LM, Wejstal R, Norkrans G, Dhillon AP. Interobserver study of liver histopathology using the Ishak score in patients with chronic hepatitis C Virus infection. Liver 1999; 19: 183-7. [ Links ]
16. Soloway RD, Baggenstoss AH, Schoenfield LJ, Summerskill WH. Observer error and sampling variability tested in evaluation of hepatitis and cirrhosis by liver biopsy. Am J Dig Dis 1971; 16: 1082-6. [ Links ]
17. Regev A, Berho M, Jeffers LJ, et al. Sampling error and intraobserver variation in liver biopsy in patients with chronic HCV infection. Am J Gastroenterol 2002; 97: 2614-8. [ Links ]
18. Bedossa P, Dargere D, Paradis V. Sampling variability of liver fibrosis in chronic hepatitis C. Hepatology 2003; 38: 1449-57. [ Links ]
19. Guido M, Rugge M. Liver biopsy sampling in chronic viral hepatitis. Sem Liver Disease 2004; 24: 89-97. [ Links ]
20. Giannini E, Risso D, Botta F, Chiarbonello B, Fasoli A. Validity and clinical utility of the aspartate aminotransferase - alanine aminotransferase ratio in assessing disease severity and prognosis in patients with hepatitis C Virus - related chronic liver disease. Arch Intern Med 2003; 163: 218-24. [ Links ]
21. Castera L, Vergniol J, Foucher J, et al. Prospective comparison of transient elastography, Fibrotest, APRI, and liver biopsy for the assessment of fibrosis in chronic hepatitis C. Gastroenterology 2005; 128: 343-50. [ Links ]
22. Ziol M, Handra-Luca A, Kettaneh A, Christidis C, et al. Noninvasive assessment of liver fibrosis by measurement of stiffness in patients with chronic hepatitis C. Hepatology 2005; 41: 48-54. [ Links ]
23. Romero-Gómez M, Gómez-González E, Vera-Valencia M, et al. Fibrosis assessment in hepatitis C by computer-performed optical analysis of CT of the liver: A novel non-invasive and useful method. 40th Annual meeting of the European Association for the study of the liver. Paris April 13-17, 2005. p. 599A. [ Links ]
24. Iacobellis A, Mangia A, Leandro G, Clemente R, Festa V, Attino V, et al. External validation of biochemical indices for noninvasive evaluation of liver fibrosis in HCV chronic hepatitis. Am J Gastroenterol 2005; 100: 868-73. [ Links ]











 texto en
texto en