Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.102 no.6 Madrid jun. 2010
Tumores del estroma gastrointestinal (GIST) del colon
Gastrointestinal stromal tumors (GISTs) of the colon
F. Macías García1,4, P. Parada2, L. Martínez-Lesquereux2, E. Pintos3, M. Fraga3 y J. E. Domínguez Muñoz1,4
Servicios de 1Gastroenterología, 2Cirugía General y del Aparato Digestivo, 3Anatomía Patológica y 4Fundación para la Investigación en Enfermedades del Aparato Digestivo (FIENAD). Hospital Universitario de Santiago de Compostela. A Coruña
Dirección para correspondencia
RESUMEN
Los tumores del estroma gastrointestinal (GIST) son los tumores mesenquimales más comunes del tracto gastrointestinal (GI). Aunque pueden aparecer en cualquier localización del tracto GI, el colon no es una ubicación frecuente. Presentamos 2 nuevos casos de GIST de colon localizados en el colon descendente y el sigma. El diagnóstico histológico se obtuvo mediante biopsias endoscópicas. En ambos casos se realizó cirugía resectiva como único tratamiento. No se objetivó afectación metastásica en ningún caso. Tampoco se observó recurrencia durante el período de seguimiento. En esta nota clínica hemos revisado el diagnóstico, manejo y opciones terapéuticas en los GIST de colon. La inmunorreactividad para el c-kit es la clave para el diagnóstico. El riesgo de malignización se basa en el diámetro tumoral y el índice mitótico. La localización anatómica no parece ser un factor pronóstico independiente. La cirugía supone el tratamiento estándar en caso de enfermedad localizada, mientras que el imatinib está indicado en los GIST irresecables o con afectación metastásica.
Palabras clave: Colon. GIST. Tumores del estroma gastrointestinal.
ABSTRACT
Gastrointestinal stromal tumors (GISTs) are the most common mesenchymal tumors of the gastrointestinal (GI) tract. Although they may arise anywhere of GI tract, colonic presentation is infrequent. We report 2 new cases of colonic GISTs localized at descending and sigmoid colon. Endoscopic biopsies were diagnostic for GISTs and no distant metastasis were observed. Both cases underwent resective surgery as the only treatment. No recurrence was observed during the follow-up period. In this clinical note we review the diagnosis, management and therapeutical options in colonic GISTs, according to literature. KIT immunoreactivity is the base for diagnosis. Risk of malignancy is based on the primary tumor diameter and the mitotic count. Anatomic localization is not an independent prognostic factor. Surgery is the standard treatment for localized primary disease and imatinib is indicated if metastatic or unresectable GISTs.
Key words: Colon. GIST. Gastrointestinal stromal tumors.
Introducción
Los tumores del estroma gastrointestinal (GIST) son los tumores mesenquimales más comunes del tracto gastrointestinal (GI). En este artículo, describimos 2 GIST en localizaciones infrecuentes: el colon descendente y el sigma.
Caso clínico 1
Mujer de 81 años, sin antecedentes medicos de interés, que acudió a nuestro centro hospitalario por hematoquecia grave (Hb 7,9 g/dl). No se evidenciaron lesiones en la endoscopia digestiva alta. Sin embargo, tras la estabilización hemodinámica se realizó una colonoscopia donde se objetivó una lesión ulcerada en el colon descendente, de aspecto submucoso, de unos 12 mm de diámetro, localizada en el interior de una formación diverticular de gran tamaño (Fig. 1A). El enema opaco demostró la existencia de una duplicación colónica a dicho nivel, simulando un gran divertículo, con una lesión fija en su borde superior (Fig. 1B). La TC abdominal no demostró otras lesiones. El diagnóstico histológico obtenido por biopsias endoscópicas fue el de GIST de colon.
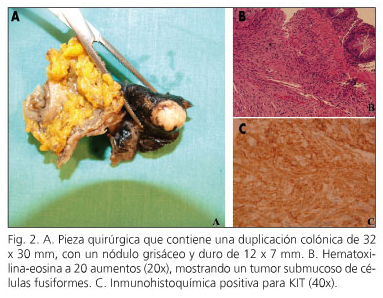
Tras la evaluación quirúrgica se realizó una resección colónica segmentaria por vía laparoscópica. La pieza obtenida contenía una duplicación colónica de 32 x 30 mm, con un nódulo grisáceo en su interior, de consistencia dura, de 12 x 7 mm (Fig. 2A). Histológicamente este nódulo era un GIST de colon calcificado (c-kit +, CD34 +), de tipo fusocelular (Fig. 2B-C), con un índice mitótico < 5/50 campos de gran aumento.
La paciente permanece asintomática 7 meses después de la intervención.
Caso clínico 2
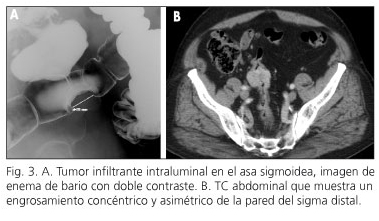
Hombre de 74 años portador de cardiopatía isquémico-hipertensiva que acudió a nuestro centro por rectorragia. En la colonoscopia se observó una masa submucosa ulcerada, parcialmente estenosante, a 20 cm del margen anal. En el enema opaco se visualizó un tumor infiltrante en el sigma (Fig. 3A). La TC toracoabdominal únicamente identificó un engrosamiento concéntrico y asimétrico de la pared del sigma distal (Fig. 3B), sin adenopatías ni afectación metastásica. El diagnóstico histológico obtenido por biopsias endoscópicas fue de GIST de colon.
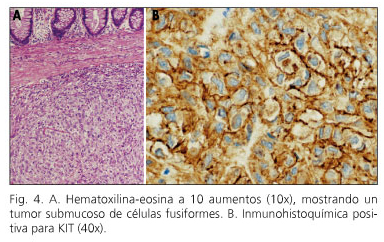
A continuación se realizó una sigmoidectomía laparoscópica. La pieza quirúrgica contenía una lesión ulcerada blanquecina, mal definida, de 45 x 40 mm, con positividad intensa para c-kit (Fig. 4). El diagnóstico histológico definitivo fue el de GIST de colon tipo fusocelular (c-kit +), con un índice mitótico < 5/50 campos de gran aumento. Ningún ganglio linfático aislado fue positivo para malignidad (0/10).
El paciente ha permanecido asintomático durante el periodo de seguimiento posterior de 18 meses.
Discusión
Los GIST son tumores mesenquimales derivados de las células intersticiales de Cajal, que pueden aparecer en cualquier punto del tracto gastrointestinal (GI); son más frecuentes en el estómago (60-70%), seguidos del intestino delgado (20-25%). Los GIST colorrectales son infrecuentes, alrededor del 5% del total (1). Recientemente, se han descrito en otras localizaciones extragastrointestinales, como el mesenterio, omentos y retroperitoneo (2).
Histológicamente, los GIST se subdividen en fusiformes, epitelioides o de células mixtas. Morfológicamente pueden ser lisos o de contorno multinodualr, contener áreas centrales de hemorragia, cambios quísticos, necrosis o calcificación. La dilatación aneurismática circunferencial del segmento colónico afectado también ha sido descrita (3).
Las duplicaciones del tracto GI son anomalías poco habituales del desarrollo, siendo la localización colónica la más infrecuente (6-8%). Dado que se ha descrito previamente la posibilidad de degeneración maligna de estas duplicaciones (4), está indicada la resección quirúrgica de las mismas cuando se diagnostican. En este sentido, se ha publicado recientemente otro caso de GIST colónico asociado a un quiste de duplicación (5).
Los GIST son lesiones de crecimiento habitualmente lento, diagnosticadas normalmente de forma incidental. La presentación sintomática suele asociarse con el tamaño tumoral, la localización y el patrón de crecimiento (6). Los tumores menores de 2 cm suelen ser asintomáticos, normalmente limitados a la pared colónica y visualizándose en la endoscopia como pequeñas masas submucosas. La complicación más habitual es la hemorragia digestiva secundaria a ulceración de la mucosa (7), como ocurrió en nuestros dos casos.
En el estudio inmunohistoquímico destaca habitualmente la positividad de los GIST para KIT (CD117), un receptor transmembrana que se expresa de forma habitual en el plexo mientérico del adulto, entre otros tejidos (8). Aproximadamente el 70% de los GIST coexpresan CD34, pero también pueden ser positivos para la actina de músculo liso y más raramente para desmina y S-100. Sin embargo, el término GIST sólo se aplica a las neoplasias mesenquimales gastrointestinales que son c-kit positivas, con raras excepciones.
El riesgo de malignidad se basa en el diámetro del tumor primario y el recuento mitótico. Un índice mitótico de más de 5/50 campos de gran aumento o el tamaño mayor de 5 cm se consideran como factores de pronóstico desfavorables (9). La localización anatómica fue propuesta como un factor pronóstico independiente del tamaño del tumor o del índice mitótico. En este sentido, los tumores de intestino delgado se han asociado con peor pronóstico (10), mientras que otros autores han considerado a la mayoría de las lesiones del esófago y de colon como malignas (1). Desafortunadamente, la localización del tumor no es un marcador fiable en la actualidad para predecir el comportamiento individual de cada caso.
Debido a que algunos GIST pueden presentar recurrencia o metastatizar a pesar de una histología aparentemente benigna, se ha propuesto una estratificación del riesgo de estas lesiones según los criterios de Fletcher (9) (tamaño tumoral y recuento mitótico), en riesgo muy bajo, bajo, intermedio y alto. Además se ha sugerido un periodo indefinido de seguimiento.
La cirugía es el tratamiento estándar de la enfermedad primaria localizada sin afectación metastásica, con una supervivencia global a los 5 años entre 45-65% (11). La resección endoscópica podría ser una opción si el tamaño y la localización del tumor lo permiten (12).
El hígado y el peritoneo son los lugares de metastatización más frecuentes. Las adenopatías metastásicas son muy infrecuentes. El Imatinib®, un inhibidor de la tirosín quinasa, se ha utilizado con éxito en casos de GIST irresecables o con afectación a distancia (13).
Ambos casos que hemos presentado tenían un buen pronóstico en función de los criterios de Fletcher: en el primer caso había un riesgo muy bajo de conducta agresiva (tamaño < 2 cm y recuento mitótico < 5/50 campos de gran aumento), y en el segundo había un bajo riesgo de comportamiento agresivo (tamaño < 5 cm y el recuento mitótico < 5/50 HPF). La resección quirúrgica se realizó como único tratamiento. Ambos pacientes se han mantenido asintomáticos varios meses después de la cirugía (7 y 18 meses) y en ningún caso se ha observado recurrencia.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Fernando Macías García.
Servicio de Gastroenterología.
Hospital Universitario de Santiago de Compostela.
C/ Choupana, s/n. 15706
Santiago de Compostela, A Coruña. Spain.
e-mail: fmacgar@yahoo.es
Recibido: 27-01-10.
Aceptado: 18-02-10.
Bibliografía
1. Miettinen M, Lasota J. Gastrointestinal stromal tumors-definition, clinical, histological, immunohistochemical and molecular genetic features and differential diagnosis. Virchows Arch 2001; 438: 1-12. [ Links ]
2. Reith JD, Goldblum JR, Lyles RH, Weiss SW. Extragastrointestinal (soft tissue) stromal tumors: an analysis of 48 cases with emphasis on histologic predictors of outcome. Mod Pathol 200; 13: 577-85. [ Links ]
3. Miettinen M, Sarlomo-Rikala M, Sobin LH, Lasota J. Gastrointestinal stromal tumors and leiomyosarcomas in the colon: a clinicopathologic, immunohistochemical, and molecular genetic study of 44 cases. Am J Surg Pathol 2000; 24: 1339-52. [ Links ]
4. Inoue Y, Nakamura H. Adenocarcinoma arising in colonic duplication cysts with calcification: CT findings of two cases. Abdom Imaging 1998; 23: 135-7. [ Links ]
5. Van Rompuy A, Lannoo M, D'hondt M, D'Hoore A, Geboes K. Gastrointestinal stromal tumor (GIST) arising in a colonic duplication cyst: Case report. Colorectal Dis 2009 Oct 30. [Epub ahead of print] [ Links ]
6. DeMatteo RP, Lewis JJ, Leung D, Mudan SS, Woodruff JM, Brennan MF. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg 2000; 231: 51-8. [ Links ]
7. De Francisco R, Díaz G, Cadahía V, Velázquez RF, Giganto F, González O, et al. Lower GI bleeding secondary to a stromal rectal tumor (rectal GIST). Rev Esp Enferm Dig 2006; 98: 387-9. [ Links ]
8. Tsuura Y, Hiraki H, Watanabe K, Igarashi S, Shimamura K, Fukuda T, et al. Preferential localization of c-KIT product in tissue mast cells, basal cells of skin, epithelial cells of breast, small cell lung carcinoma and seminoma/dysgerminoma in humans: immunohistochemical study on formalin-fixed, paraffin-embedded tissues. Virchows Arch 1994; 424: 135-41. [ Links ]
9. Fletcher CD, Berman JJ, Corless C, Gorstein F, Lasota J, Longley BJ, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Hum Pathol 2002; 33: 459-65. [ Links ]
10. Emory TS, Sobin LH, Lukes L, Lee DH, O'Leary TJ. Prognosis of gastrointestinal smooth muscle (stromal) tumors: dependence on anatomic site. Am J Surg Pathol 1999; 23: 82-7. [ Links ]
11. Blay JY, Bonvalot S, Casali P, Choi H, Debiec-Richter M, Dei Tos AP, et al.; GIST consensus meeting panelists. Consensus meeting for the management of gastrointestinal stromal tumors. Report of the GIST Consensus Conference of 20-21 March 2004, under the auspices of ESMO. Ann Oncol 2005; 16: 566-78. [ Links ]
12. Ledo-Rodriguez A, Ulla-Rocha JL, Baltar-Arias R, Vázquez-Rodríguez S, Díaz-Saa W, et al. Endoscopic resection of rectal gastrointestinal stromal tumor (GIST) using band ligation. Rev Esp Enferm Dig 2009; 101: 870-1. [ Links ]
13. Van Oosterom AT, Judson I, Verweij J, Stroobants S, donato di Paola E, Dimitrijevic S, et al.; European Organization for Research and Treatment of Cancer Soft Tissue and Bone Sarcoma Group. Safety and efficacy of imatinib (STI571) in metastatic gastrointestinal stromal tumours: a phase I study. Lancet 2001; 358: 1421-3. [ Links ]











 texto en
texto en