Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Enfermedades Digestivas
versión impresa ISSN 1130-0108
Rev. esp. enferm. dig. vol.104 no.1 Madrid ene. 2012
https://dx.doi.org/10.4321/S1130-01082012000100005
Hepatitis aguda C en España: estudio retrospectivo de 131 casos
Acute hepatitis C in Spain: a retrospective study of 131 cases
Ramón Pérez-Álvarez1, Javier García-Samaniego2, Ricard Solà3, Rosa Pérez-López1, Rafael Bárcena4, Ramón Planas5, Nuria Cañete3, María Luisa Manzano6, María Luisa Gutiérrez7, Luis Morano8 y Luis Rodrigo1
1Hospital Universitario Central de Asturias. Oviedo.
2Hospital Carlos III. CIBERehd. Madrid.
3Hospital del Mar. Barcelona.
4Hospital Ramón y Cajal. Madrid.
5Hospital Germans Trias i Pujol. CIBERehd. Badalona, Barcelona.
6Hospital 12 de Octubre. Madrid.
7Hospital de Alcorcón. Madrid.
8Hospital Meixoeiro. Vigo
Colaboradores: Juan de la Vega, Hospital San Agustín, Avilés, Asturias. Ángeles Castro, Hospital Juan Canalejo, La Coruña. José Antonio Pons. Hospital Virgen de la Arrixaca, Murcia. Xavier Torras, Hospital Sta Creu i San Pau, Barcelona. Genaro San Miguel, Hospital Marqués de Valdecilla, Santander. Isabel Méndez, Hospital Costa del Sol, Marbella, Málaga. Gustavo López, Hospital Clínico San Carlos, Madrid. Isidro García, Hospital Río Carrión, Palencia. Carmen Muñoz, Hospital de Basurto, Bilbao. Pilar Civeira, Clínica Universitaria de Navarra, Pamplona. Miquel Torres, Fundació Hospital de L'Esperit Sant, Sta. Coloma de Gramenet, Barcelona.
Dirección para correspondencia
RESUMEN
Introducción y objetivos: el manejo de la hepatitis aguda C (HAC) es objeto de controversia. Hemos realizado un estudio prospectivo para conocer los aspectos epidemiológicos, bioquímicos, los genotipos, el aclaramiento espontáneo del VHC (SVC) y la respuesta al tratamiento en una serie de pacientes con HAC.
Métodos: hemos analizado los datos retrospectivos de 131 pacientes con HAC de 18 hospitales españoles.
Resultados: la edad media fue de 43 ± 16 años (17-83). El 69% tenían síntomas. Las causas de la infección fueron nosocomial en el 40% y CDVP en el 20%. El genotipo 1 se halló en el 82%. El retraso desde el comienzo de los síntomas hasta la confirmación del ARN-VHC fue de 50 ± 68 días (11-350) y hasta el tratamiento (en el 59% de los casos), de 14 ± 13 semanas (2-58). En el grupo tratado el 80% alcanzaron RVS frente al 57% de SVC en el grupo no tratado (p = 0,004). El 96% de los que recibieron tratamiento dentro de las primeras 12 semanas tuvieron RVS frente al 86% de los que se trataron más tarde (p = 0,04). Los pacientes con RNA-VHC indetectable en la semana 4 resolvieron la infección, con o sin tratamiento, con mayor frecuencia que los que persistían con ARN-VHC + (98 vs. 69%, p = 0,005). El tratamiento no resultó beneficioso en los pacientes con ARN-VHC indetectable en la semana 12. No hubo diferencias en la RVS en los pacientes con Gt 1 tratados 24 ó 48 semanas. Los pacientes con carga viral basal baja lograron mayores RVS y SVC. El SVC en aquellos con bilirrubina > 5 mg/dl fue del 78 vs. 40% en los que tenían valores más bajos (p = 0,004).
Conclusiones: la vía de contagio más frecuente fue la nosocomial. La RVS fue mayor en pacientes tratados que la SVC en no tratados. El tratamiento precoz (antes de la semana 12) logró la mayor tasa de respuestas. El SVC y la RVS fueron más frecuentes en los que tenían una carga viral basal más baja. El ARN-VHC indetectable en la semana 4 se asoció con mayor frecuencia de SVC y de RVS. La ictericia se relacionó con el SVC.
Palabras clave: Hepatitis aguda C. VHC. Tratamiento.
ABSTRACT
Background and aims: the management of acute hepatitis C (AHC) is controversial. We have conducted a retrospective study to determine the epidemiological and biochemical aspects, the genotypes, the spontaneous clearance of HCV (SVC), and the treatment responses in patients with AHC.
Methods: we have retrospectively collected data from 131 patients with AHC from 18 Spanish hospitals.
Results: the mean age was 43 ± 16 years (17-83), 69% were symptomatic. The causes of infection were nosocomial in 40% and intravenous drug users in 20%. Eighty two percent had genotype 1. The delay from symptoms-onset to HCV-RNA confirmation was 50 ± 68 days (range, 11-350 days) and to treatment (in 59%) 14 ±13 weeks (range, 2-58 days). In the treated group, 80% achieved sustained virological response (SVR)
versus 57% SVC in untreated patients (p = 0.004). Up to 96% of those treated within the first 12 weeks had SVR versus 86% of those treated later (p = 0.04). Patients with HCV-RNA(-) at week 4 resolved with or without treatment more frequently than those HCV-RNA(+) (98
versus 69%, p = 0.005). The treatment was not beneficial if HCV-RNA was undetectable at week 12. No differences in SVR were found in genotype 1 patients treated for 24 or 48 weeks. Patients with low baseline viral load achieved higher SVC and SVR. The SVC in patients with bilirubin > 5 mg/dl was 78 versus 40% in those with lower values (p = 0.004).
Conclusions: the most common transmission route was nosocomial. SVR was higher in patients treated than SVC in non-treated. Early treatment (before week 12) achieved the highest response rate. SVC and SVR were more common in patients with a low baseline viral load. Undetectable HCV-RNA at week 4 was associated with high SVR and SVC rates. Jaundice was related with SVC.
Key words: Acute hepatitis C. HCV. Treatment.
Introducción
La hepatitis crónica C es una enfermedad muy común causada por el virus de (VHC). La hepatitis aguda C (HAC) es difícil de diagnosticar porque a menudo cursa de forma silente. La mayoría de los casos son asintomáticos o poco sintomáticos y la clínica pasa desapercibida o se interpreta como un cuadro seudogripal. En estos casos, solo la realización de pruebas hepáticas alerta al clínico hacia la infección por el VHC, si bien el diagnóstico resulta más sencillo si existen síntomas sugestivos de hepatitis aguda, tales como ictericia, coluria y molestias en hipocondrio derecho. La seroconversión a anti-VHC solamente se confirma en una minoría de casos (1), aunque algunos autores han comunicado tasas de seroconversión inusualmente elevadas (2). Los casos de HAC han disminuido notablemente en EE. UU. y Europa occidental desde los años 90 como consecuencia de la investigación rutinaria del anti-VHC en donantes de sangre y de la mejoría en las prácticas higiénicas de los que consumen drogas por vía parenteral (CDVP) (3). En contraste, durante este periodo el porcentaje de infecciones nosocomiales ha aumentado en los países desarrollados y, especialmente, en aquellos en vías de desarrollo (4).
De las pocas publicaciones relacionadas con el diagnóstico y tratamiento de la HAC, la mayoría son series pequeñas. Solo los estudios prospectivos con un estrecho seguimiento de los grupos de alto riesgo pueden lograr series amplias de pacientes (5). Si no se hace así normalmente se necesita un periodo de tiempo muy largo para disponer de un número elevado de pacientes, como sucedió con el estudio del NIH que logró incluir solo 25 casos en un periodo de 13 años (2). Aunque el tratamiento de la HAC con interferón no pegilado (IFN) se ha demostrado eficaz en algunos meta-análisis (6,7), el interferón pegilado (PEG-IFN) con o sin ribavirina (RBV) es actualmente el tratamiento de elección (5).
Hemos estudiado retrospectivamente una cohorte de pacientes con HAC recogidos en 18 hospitales españoles, analizando en ellos los aspectos epidemiológicos y bioquímicos, la distribución de los genotipos, la carga viral, la respuesta al tratamiento y la tasa de resolución espontánea. Esta constituye la segunda mayor serie publicada en España (8).
Métodos
Fueron incluidos los pacientes que cumplían los siguientes criterios: 1) Un perfil clínico de hepatitis aguda, poco sintomática o asintomática, pero con alanina aminotransferasa (ALT) igual o superior a 10 veces el límite superior de la normalidad (LSN). 2) Anti-VHC positivo. En los casos con serología negativa, esta se repitió junto con el ARN-VHC al menos 4 semanas después. 3) ARN-VHC positivo. 4) Ausencia de otros marcadores serológicos de infección aguda debida a los virus A, B, Citomegalovirus, Epstein-Barr y otros virus que pueden simular una hepatitis aguda. 5) Ausencia de tratamiento con fármacos que podrían inducir una hepatitis aguda. 6) Factores de riesgo para contraer una hepatitis viral aguda durante los seis meses previos, incluyendo la hospitalización o los procedimientos quirúrgicos. 7) Seroconversión reciente en aquellos casos en que se disponía de un estudio serológico previo.
Se excluyeron los pacientes con sospecha de hepatitis crónica C o con hepatitis con más de dos años desde la exposición a factores de riesgo, pero en las que no se conocía la fecha de inicio, tanto la selección de los pacientes para su inclusión como el análisis de los datos se centralizaron en el Hospital Universitario Central de Asturias (R P-A).
El anti-VHC se determinó por EIA comercial. La carga viral y el genotipo (Gt) se analizaron por PCR comercial según la forma habitual en cada unos de los hospitales participantes. Los pacientes fueron tratados con IFN α-2b o PEG-IFN con o sin RBV. Las dosis fueron generalmente 3 MU/3 veces por semana para IFN α-2b, 1,5 μg/kg/semana para PEG-IFN α-2b, 180 mg/semana para PEG-IFN α-2a y 10-13 mg/kg/día para RBV. La duración del tratamiento fue de 24 semanas en la mayoría de los casos, aunque en algunos pacientes con Gt 1 fue de 48 semanas. El tipo de tratamiento y la duración fueron decididos por el médico responsable del paciente según su criterio. Los pacientes que recibieron al menos una dosis de IFN o de PEG-IFN fueron incluidos en el análisis.
Se consideró respuesta virológica sostenida (RVS) cuando el ARN-VHC permanecía indetectable al menos seis meses tras la finalización del tratamiento. El aclaramiento viral espontáneo (SVC) fue definido como la existencia de ARN-VHC repetidamente indetectable durante al menos seis meses tras la normalización bioquímica en los pacientes que no recibieron tratamiento.
Los pacientes con SVC o con RVS se consideraron curados; aquellos con respuesta virológica al final del tratamiento pero sin RVS (recidivantes), los no respondedores (NR) y los que no tuvieron SVC se consideraron como no curados. Puesto que el análisis de la respuesta al tratamiento se hizo por intención de tratar (ITT), los recidivantes y los que no tuvieron seguimiento se consideraron como NR.
Análisis estadístico: las variables continuas se expresan como medias y desviación estándar (si la distribución era normal) o como mediana y rango intercuantil en otros casos, y se compararon mediante el test T si eran paramétricas o el test de Mann-Whitney si eran no-paramétricas. Los datos categóricos se expresan como frecuencias absolutas o relativas. La homogeneidad entre datos categóricos se analizó con el test de Chi cuadrado o el test exacto de Fisher. Finalmente, se realizaron varias regresiones logísticas para determinar los factores relacionados con la respuesta en la cohorte completa y en los pacientes tratados o no tratados respectivamente. Se consideró un resultado estadísticamente significativo si el valor de "p" era < 0,05. El estudio se realizó en el CAIBER, Oficina de Investigación Biosanitaria (OIB) de Asturias (Dr. Pablo M. Camblor).
Resultados
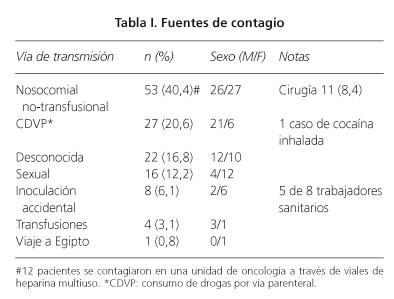
Se incluyeron 131 pacientes de 18 hospitales españoles: el 52% eran varones, con una edad media de 43,0 ± 16,4 (límites 17-83 años). El primer paciente fue diagnosticado en marzo de 1989 y el último en febrero de 2010. La causa más frecuente de infección fue la nosocomial no relacionada con transfusiones, hallada en 53/131 (40%), de los que 11 (21%) habían sido sometidos a una intervención quirúrgica y 12 (23%) se infectaron por el empleo de viales multiuso de heparina en una unidad oncológica (Tabla I). La segunda causa más frecuente (20%) fue el antecedente de CDVP. Estos datos fueron casi idénticos en el subgrupo de 62 pacientes incluidos entre 1989 y 2000 y el de 69 pacientes incluidos desde el año 2000 hasta el 2010.
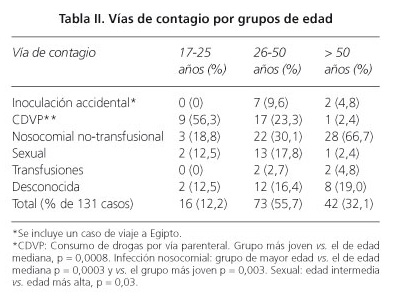
En la tabla II las causas de la infección se dividen según la edad en tres grupos. El 88% estaban comprendidos entre los 26 y los 50 años. El grupo más joven de CDVP comprendía más del doble de pacientes que los demás grupos. La infección nosocomial fue más frecuente en los de mayor edad. La transmisión sexual fue más frecuente en el grupo de edad mediana que en los de más edad. Para los restantes, las diferencias no fueron significativas.
Los anticuerpos anti-VHA se detectaron en 17 de 128 sujetos (13%) y la coinfección con VIH en 5/126 (4%). Los anticuerpos del VHB se encontraron en 15/131 (11,5%), de los que 2 eran portadores del HBsAg con anti-HBe positivo. El anti-HBc como único marcador sérico se halló en 11 pacientes (8,4%) y en dos (1,5%) se asoció con anti-HBs y anti-HBe. El anti-HBs sin anti-HBc estaba presente en 8 pacientes que habían sido vacunados (6%).
En 90 pacientes (69%) los síntomas o los datos clínicos sugerían un diagnóstico de hepatitis aguda. En los restantes el diagnóstico se realizó en pacientes con síntomas inespecíficos que fueron analizados en el contexto de otras enfermedades o que estaban siendo monitorizados tras una inoculación accidental. La seroconversión a anti-VHC se pudo establecer en 18 pacientes (14%). El tiempo transcurrido desde el comienzo de los síntomas hasta el diagnóstico bioquímico (primer análisis con transaminasas elevadas) fue de 18 ± 20 días (límites 2-102 días). El tiempo desde el diagnóstico bioquímico hasta la confirmación virológica definitiva fue de 50 ± 68 días (límites 11-350 días).
Los valores más altos de los enzimas hepáticos expresado como veces que exceden el LSN fueron: AST 26 ± 27 (1,5-251) y ALT 36 ± 32 (4,1-285). El cociente AST/ALT fue 0,77 ± 0,48 (0,14-3,4). En el 81% de los pacientes el valor de ALT era superior al de AST. La Gamma-GT estaba elevada en el 90% (6,4 ± 5,9 x LSN) (0,3-31). El límite de detección del RNA-VHC fue < 50 UI/mL en el 90%. En 109 pacientes se pudo determinar el Gt, hallando Gt 1 en 89 (81,7%), de los que 62 fueron Gt 1b; Gt 2: 2 (1,8%); Gt 3: 11 (10,1%) y Gt 4: 7 (6,4%).
Los datos demográficos, clínicos, bioquímicos y virológicos de los grupos de tratamiento y no tratamiento eran similares (Tabla III).
El tipo de tratamiento (IFN no pegilado, PEG-IFN y RBV) y los resultados obtenidos se resumen en la tabla IV. Recibieron tratamiento 77 pacientes (59%) y 54 no fueron tratados. El tiempo transcurrido entre el comienzo de los síntomas y el tratamiento fue de 4 ± 6 meses (2-14). En 118 pacientes la duración del seguimiento fue de 43 ± 42 meses (8-312). En el grupo tratado se curaron 62 de 77 (80% de RVS), 9 no se curaron o recayeron y en 6 se desconocía la evolución. En el grupo no tratado 31 de 54 lograron SVC (57%), 16 evolucionaron a la cronicidad y 7 carecían de seguimiento. La resolución de la hepatitis fue mayor en el grupo tratado (p = 0,004). No hubo diferencias en la RVS entre la doble terapia con RBV asociada al interferón y la monoterapia con interferón (47 versus 43%).
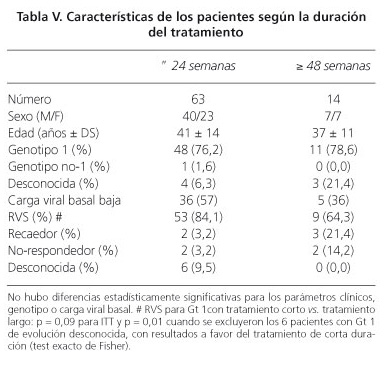
La duración del tratamiento fue de 24 semanas o menos en 63 de los 77 casos (83%) y de 48 semanas en los restantes, incluyendo dos pacientes tratados durante 52 y 58 semanas respectivamente. No hubo diferencias estadísticamente significativas entre estos dos grupos en cuanto a la clínica, bioquímica, genotipos o carga viral basal.
La RVS global fue del 84% en el grupo de 24 semanas y del 64% en el grupo de 48 semanas y en los pacientes con Gt 1 fue del 80% (43/54) y 71% (10/14) (p = 0,09). Si excluimos a los pacientes con Gt 1 con evolución desconocida, se alcanzan diferencias a favor del tratamiento corto (p = 0,01). Estos resultados se detallan en la tabla V.
En 49 de los 77 pacientes tratados (64%) se conocía la fecha del inicio de os síntomas. El tiempo transcurrido hasta el inicio del tratamiento fue de 14 ± 13 semanas (2-58). Cuando el tratamiento se inició antes de las 12 semanas del comienzo de los síntomas, el 96% lograron RVS, frente al 87% en los que el tratamiento se inició después de la semana 12 (p = 0,04). No hubo diferencias en las RVS al comparar los resultados de los tratamientos iniciados en las semanas 4, 8 ó 12.
Con respecto a la cinética viral (Tabla VI), los pacientes con ARN-VHC indetectable en la semana 4 (n = 42), todos menos uno alcanzaron RVS o SVC (98%), frente a 69% de aquellos sin aclaramiento del virus en la semana 4 (p = 0,005). El tratamiento en los pacientes con ARN-VHC positivo en la semana 4 (n = 16) no resultó de utilidad ya que los 5 no tratados aclararon el VHC lo que solo lograron 6 de 11 tratados, en total 11 de 16 (68%). De los pacientes con ARN-VHC indetectable en la semana 12, el 95% (64/67) aclararon el virus: 52/55 (94%) con tratamiento y 12/12 (100%) sin tratamiento. De aquellos con viremia detectable en la semana 12, 4 de 9 (44%) lograron RVS (n = 3) o SVC (n = 1), p = 0,0003 comparados con el grupo de viremia indetectable. Los pacientes con ARN-VHC no detectable en la semana 12 no se beneficiaron del tratamiento puesto que el 91% de los tratados y el 92% de los no tratados lograron el aclaramiento viral.
Cinco pacientes, todos con antecedentes de CDVP, estaban coinfectados con el VIH. Tres no recibieron tratamiento, 2 varones con Gt desconocido y carga viral muy baja lograron SVC y uno con Gt 3a con carga viral elevada evolucionó a la cronicidad. Dos pacientes recibieron tratamiento: una mujer con Gt no determinado recibió IFN no pegilado alfa-2b durante un años que logró RVS y un varón con Gt 1b y carga viral muy alta que fue tratado 24 semanas con PEG-IFN y RBV que también alcanzó RVS.
En 105 pacientes se conocía la carga viral basal. De ellos 35 (33%) tenían carga viral elevada (> 800.000 UI/mL) y la infección se resolvió en 20 (57%): 3/11 no tratados (27%) y 17/24 (71%) tratados (p = 0,02). En 70 pacientes la carga viral basal era baja y la infección se resolvió en 58 (83%), 20 de 30 (67%) con SVC y 38/40 (96%) tras el tratamiento (p = 0,002). No hubo diferencias en relación con el Gt ya que solo 9 y 20 pacientes en cada grupo tenían un Gt distinto del 1.
Tras separar a los pacientes según los niveles de ALT (mayor o igual frente a menor de 20 veces el LSN), no se hallaron diferencias en cuanto a la curación entre los tratados (74 versus 87%) y los no tratados (64 versus 41%). Tanto en el grupo de tratamiento como en el no tratado, no hallamos ninguna relación entre los niveles de GGT y la evolución. El valor de la bilirrubina total fue inferior a 1,5 mg/dl en el 39%, entre 1,5 y 5 mg/dl en el 39% superior a 5 mg/dl en el 22%. En los pacientes no tratados con bilirrubina < 5 mg/dl, 51% lograron SVC frente a 78% en aquellos con niveles > 5 mg/dl (p = 0,004).
Cuando los pacientes fueron agrupados por grupos de edad no hubo diferencias estadísticamente significativas para SVC o RVS: 85% de aquellos con edad inferior a 40 años y 75% de los mayores tuvieron RVS y el SVC se produjo en el 50 y 56%, respectivamente. Tampoco encontramos diferencias en relación al sexo: RVS en 80% de varones y 76% de mujeres y SVC en 65 y 53%, respectivamente. El índice de masa corporal tampoco se relacionó con la evolución.
En el análisis univariante de los datos globales encontramos significación estadística en relación con la RVS para el RNA-VHC indetectable en las semanas 4, 12 y 24 (p = 0,014, 0,005 y < 0,001). Para el grupo no tratado solo la presencia de síntomas y los valores más altos de GGT se relacionaron con el SVC (p = 0,004 y p = 0,002).
En el análisis multivariante de toda la cohorte solo la bilirrubina más alta y el tratamiento estaban relacionados con una buena evolución (p = 0,003, OR 0,756, CI 0,629-0,910 y p = 0,018, OR 2,623, CI 1,181-5,823).
Discusión
Hemos realizado un estudio retrospectivo en el que analizamos los datos de 131 pacientes con HAC atendidos en 18 hospitales de España durante 21 años (1989-2010). Recibieron tratamiento 77 (59%). El Gt 1 estaba presente en el 82% de la cohorte, porcentaje más elevado que el 59% de otra serie de Barcelona, reflejando la variabilidad geográfica (8).
Tras el comienzo de los síntomas, el tiempo medio hasta la confirmación de la replicación del VHC fue de 50 días. En algunos pacientes, los niveles de AST y de ALT estaban muy elevados, hasta 285 veces el LSN y, como era esperable, predominaba la elevación de AST sobre la de ALT en el 81%. La vía de transmisión más frecuente fue la nosocomial no transfusional (40%), seguida del CDVP (20%). En el 17% la fuente de infección no pudo ser identificada. Las infecciones nosocomiales fueron significativamente más frecuentes en pacientes con edad superior a los 50 años, reflejando la mayor demanda de atención médica por parte de este grupo de edad. En una unidad de oncología se produjo un brote de HAC que afectó a 12 pacientes y fue debido al empleo de viales de heparina multiuso contaminados con el VHC Gt 1. Esta tasa tan elevada de infecciones nosocomiales confirma una vez más que la hospitalización o los procedimientos médicos entrañan un riesgo para contraer la infección por el VHC (8-15). Pese al cribado sistemático para la detección del VHC en los donantes de sangre desde 1990, en nuestra serie había cuatro casos relacionados con transfusiones. Los donantes de sangre infectados, aún en el periodo ventana, pueden ser identificados usando test de ácido nucleico (NAT) para el análisis de la sangre o de sus productos (10). Los casos hospitalarios de HAC se han descrito no solamente en las unidades de hemodiálisis, entre otras, sino también en contagios de paciente a paciente (11-14). En un estudio cuyos pacientes procedían en su mayor parte de Barcelona, el 67% habían tenido al menos una hospitalización o habían sido sometidos a un procedimiento invasivo dentro de los seis meses antes del diagnóstico de la HAC (8). Este hallazgo nos hace insistir en el hecho de extremar las medidas de esterilización de los instrumentos, evitar el uso de viales multidosis y destacar el papel del personal hospitalario como vector de la transmisión de esta infección (4,6,15). Los hospitales deberían de revisar sus protocolos e insistir en su cumplimiento, ya que las altas tasas de infección nosocomial que hemos encontrado son inaceptables.
Aunque la eficacia del IFN para el tratamiento de la HAC ha sido confirmada en numerosos estudios (6,7,16) los mayores problemas que se plantean para establecer la eficacia del tratamiento incluyen los siguientes: pequeño número de pacientes, diferencias en las pautas de tratamiento, no determinación de la viremia en las series más antiguas y falta de uniformidad en los criterios de inclusión (17,18). Por otra parte, algunas series incluyen solo pacientes con HAC asociada a transfusiones, mientras que otras los excluyen (19,20).
Como se mencionó anteriormente, el 59% de los pacientes recibieron tratamiento con monoterapia o terapia combinada con RBV. En este grupo la RVS fue del 80% mientras que en los no tratados el SVC fue del 57%, resultados que son muy similares a los hallados en el estudio de Barcelona (82 y 51%) (8), pero superiores a los comunicados en otros estudios, incluyendo el HEP-NET German, en el que el 71% lograron RVS con un tratamiento de 24 semanas de monoterapia con PEG-IFN (21). Además, nuestros resultados son muy similares a los hallados en un metaanálisis que incluyó 1.075 pacientes, con RVS del 78% en los pacientes tratados, frente a solo 55% de SVC en los no tratados; en este estudio los tratados dentro de las primeras 12 semanas alcanzaron 82% de RVS, que bajó a 67% para los que iniciaron el tratamiento entre las semanas 12 y 24, y solo fue del 62% cuando el tratamiento se comenzó después de la semana 24, no habiendo entonces diferencias frente a los no tratados (22%). Por tanto, si después de las primeras 12 semanas no ha habido un aclaramiento espontáneo, el paciente debe ser tratado. Puesto que la HAC tiene un elevado porcentaje de curación espontánea, el tratamiento muy precoz hará que se incluyan pacientes que iban a resolver la infección espontáneamente, con lo que se puede sobreestimar la verdadera eficacia del mismo. La mayoría de los SVC ocurren dentro de los tres meses tras el diagnóstico y cuatro meses tras la infección (22). Después de las primeras 17 semanas en un estudio no hubo ningún caso de SVC (23).
Se ha visto que el tratamiento combinado de PEG-IFN + RBV no logró mejorar sustancialmente los resultados frente a la monoterapia con PEG-IFN (RVS 85 y 80% respectivamente) (24,25). Esto se ha confirmado también en nuestro estudio en el que las RVS con monoterapia fueron aún mayores que las logradas con la doble terapia.
En la HAC la determinación de los anticuerpos anti-VHC puede no ser muy fiable porque es posible que no se detecten hasta en el el 30% de los casos en el momento de la aparición de los síntomas; por el contrario, la determinación del ARN-VHC puede ya ser positiva 1 ó 2 semanas tras la infección, incluso antes de que se eleven las transaminasas (26). Puesto que la fecha de la infección es con frecuencia desconocida, como ha sucedido en el 17% de nuestros pacientes, se debe tomar como referencia para iniciar el tratamiento la fecha de comienzo de los síntomas o bien la fecha del diagnóstico. Se han descrito dos métodos que ayudarían a diferenciar entre la HAC y la hepatitis crónica: uno combina el índice de actividad VHC y el título de anti VHC-IgM pudiendo diferenciar entre la HAC en las fases iniciales tras el diagnóstico y la exacerbación de una hepatitis crónica, con una sensibilidad del 93% y un valor predictivo negativo también del 93% (27). El segundo mide la reactividad a las proteínas del core NS3, NS5 y NS5, clasificando correctamente las muestras de pacientes con HAC y con hepatitis crónica, con una eficiencia superior al 90% (28).
Los pacientes tratados antes de las12 semanas lograron un 96% de RVS, pero la cifra descendió al 87% cuando el tratamiento se inició más tarde. Por el contrario, cuando el tratamiento se comenzó en las semanas 4 u 8 no se vieron diferencias en las RVS cuando se compararon con el inicio en la semana 12. Nuestros resultados coinciden con los de otros autores (5,22). Por tanto, parece aconsejable comenzar el tratamiento nunca después de las 12 semanas. No obstante, en una serie reducida de Santantonio y cols., la RVS se logró en el 94% cuando el tratamiento con PEG-IFN se inició después de la semana 12, sin embargo para valorar adecuadamente estos resultados se deben tener en cuenta dos factores importantes: 10 de los 16 pacientes eran Gt 2 ó 3 y 8 tenían bilirrubina superior a 3 mg/dl (31).
Se ha comunicado que los pacientes en los que la carga viral basal se reduce significativamente y aquellos en los existe ictericia manifiesta tienen las tasas más altas de SVC (18,29,30).
Estos resultados concuerdan con los nuestros, en los que una bilirrubina superior a 5 mg/dl fue un factor que se asoció significativamente con el SVC.
Nuestros datos apoyan un tratamiento de 24 semanas con PEG-IFN en monoterapia, ya que los pacientes con Gt 1no se beneficiaron del tratamiento de 48 semanas. Además, cuando los resultados fueron evaluados por protocolo, el tratamiento corto fue incluso mejor que el largo, probablemente como consecuencia de una mejor adherencia.
Hemos encontrado una carga viral basal baja con una frecuencia doble que la hallada para carga viral alta. Los pacientes con baja carga viral tuvieron mayor frecuencia de SVC. En ambos grupos, la resolución de la infección fue significativamente más alta en el grupo tratado, lo que sugiere que incluso los pacientes con viremia baja también se benefician del tratamiento. En un estudio australiano se observó una mejor evolución para pacientes CDVP con carga viral baja (< 400.000 UI/ml) (32).
En nuestra serie, el SVC fue casi el doble en los pacientes con bilirrubina superior a 5 mg/dl, hallazgo ya comunicado por otros autores. Varios estudios han sugerido que los pacientes sintomáticos y con ictericia tienen una mayor frecuencia de SVC y de SVR (8,9,18,23,25,34-37), posiblemente debido a una mejor respuesta del sistema inmune (29,36).
La monitorización de la cinética viral puede predecir el SVC. En nuestra serie cuando el ARN-VHC era indetectable en la semana 4 la tasa de curaciones fue del 98%. En estos pacientes el tratamiento no es necesario (35). Por el contrario solo el 69% de los pacientes con viremia detectable en la semana 4 se curaron. Los pacientes tratados y con viremia detectable en la semana 4 no tuvieron mejor evolución que los no tratados, lo que implica que si no hay aclaramiento espontáneo del virus es probable una peor evolución y refuerza el valor de la determinación precoz del ARN-VHC (valor predictivo positivo 95%).
Si el ARN-VHC era indetectable en la semana 12 la curación fue del 90% frente a solo el 9% si la viremia persistía. Estos pacientes no se beneficiaron del tratamiento ya que la tasa de curaciones fue idéntica para los tratados y los no tratados (91 y 92%). Por tanto, el tratamiento no sería necesario en pacientes con ARN-VHC no detectable en la semana 12.
Por último, Grebely y cols. han encontrado que la presencia de la homocigosidad TT para el polimorfismo del gen de la IL28B de la región 8099917, pero no la GG/GT, fue el único factor asociado con la SVC en pacientes con infección reciente por el VHC. Además, los pacientes TT tenían ictericia con mayor frecuencia. Estos resultados no se confirmaron en los pacientes tratados. Basados en estos datos, los autores sugieren que el citado polimorfismo del gen de la IL28B debería ser investigado en pacientes con HAC y que el tratamiento debería sr instaurado precozmente en sujetos con genotipo no-TT (38).
En resumen, en España la causa más frecuente de HAC es la transmisión nosocomial seguida a distancia por el CDVP y la transmisión sexual. Casi el 60% de los pacientes con HAC recibieron tratamiento y lograron una tasa de curaciones más elevada que los no tratados. Dada la alta tasa de curación espontánea, especialmente en pacientes ictéricos, el tratamiento no debería ser instaurado demasiado pronto y se podría retrasar hasta la semana 12 tras el inicio de los síntomas. La viremia indetectable en la semana 4 se asoció a una buena evolución y se podría evitar el tratamiento en estos pacientes. La negatividad del ARN-VHC en la semana 12 también se asoció a una tasa elevada de SVC, por el contrario, la persistencia de la replicación viral sugiere una mala evolución de la HAC.
![]() Dirección para correspondencia:
Dirección para correspondencia:
Ramón Pérez-Álvarez.
Hospital Universitario Central de Asturias.
Calle Celestino Villamil s/n.
33006. Oviedo.
e-mail:
peralbar@telefonica.net
Recibido: 11-07-11.
Aceptado: 06-10-11.
Bibliografía
1. Ghany MG, Strader DB, Thomas DL, Seeff LB. Diagnosis, management, and treatment of hepatitis C: An update. Hepatology 2009;49:1335-74. [ Links ]
2. Loomba R, Rivera MM, McBurney R, Park Y, Haynes-Williams V, Rehermann B, et al. The natural history of acute hepatitis C: clinical presentation, laboratory findings and treatment outcomes. Aliment Pharmacol Ther 2011;33:559-65. [ Links ]
3. Alter MJ, Kruszon-Moran D, Nainan OV, McQuillan GM, Gao F, Moyer LA, et al. The prevalence of hepatitis C virus infection in the United States, 1988 through 1994. N Engl J Med 1999;341:556-62. [ Links ]
4. Hutin YJ, Hauri AM, Armstrong GL. Use of injections in healthcare settings worldwide, 2000: literature review and regional estimates. BMJ 2003;327:1075. [ Links ]
5. Kamal SM, Fouly AE, Kamel RR, Hockenjos B, Tawil A, Khalifa KE, et al. Peginterferon alfa-2b therapy in acute hepatitis C: impact of onset of therapy on sustained virologic response. Gastroenterology 2006;130:632-8. [ Links ]
6. Poynard T, Regimbeau C, Myers RP, Thevenot T, Leroy V, Mathurin P, et al. Interferon for acute hepatitis C. Cochrane Database Syst Rev 2002;1:CD000369. [ Links ]
7. Licata A, Di Bona D, Schepis F, Shahied L, Craxí A, Cammà C. When and how to treat acute hepatitis C? J Hepatol 2003;39:1056-62. [ Links ]
8. Martínez-Bauer E, Forns X, Armelles M, Planas R, Solà R, Vergara M, et al. Hospital admission is a relevant source of hepatitis C virus acquisition in Spain. J Hepatol 2008;48:20-7. [ Links ]
9. Kenny-Walsh E, for the Irish Hepatology Research Group. Clinical outcomes after hepatitis C infection from contaminated anti-D immune globulin. N Engl J Med 1999;340:1228-33. [ Links ]
10. Prati D. Transmission of hepatitis C virus by blood transfusions and other medical procedures: a global review. J Hepatol 2006;45:607-16. [ Links ]
11. Forns X, Martinez-Bauer E, Feliu A, Garcia-Retortillo M, Martin M, Gay E, et al. Nosocomial transmission of HCV in the liver unit of a tertiary care center. Hepatology 2005;41:115-22. [ Links ]
12. Forns X, Fernandez-Llama P, Pons M, Costa J, Ampurdanes S, Lopez-Labrador FX, et al. Incidence and risk factors of hepatitis C virus infection in a haemodialysis unit. Nephrol Dial Transplant 1997;12:736-40. [ Links ]
13. Bruguera M, Saiz JC, Franco S, Gimenez-Barcons M, Sanchez-Tapias JM, Fabregas S, et al. Outbreak of nosocomial hepatitis C virus infection resolved by genetic analysis of HCV-RNA. J Clin Microbiol 2002;40:4363-6. [ Links ]
14. Allander T, Gruber A, Naghavi M, Beyene A, Soderstrom T, Bjorkholm M, et al. Frequent patient-to-patient transmission of hepatitis C virus in a haematology ward. Lancet 1995;345:603-7. [ Links ]
15. Sánchez-Tapias JM. Nosocomial transmission of hepatitis C virus. J Hepatol 1999;31(Supl.1):107-12. [ Links ]
16. Tassopoulos NC, Koutelou MG, Papatheodoridis G, Polychronaki H, Delladetsima I, Giannikakis T, et al. Recombinant human interferon alfa-2b treatment for acute non-A, non-B hepatitis. Gut 1993;34(Supl.2): S130-2. [ Links ]
17. European Association for the Study of the Liver. EASL International Consensus Conference on hepatitis C: Paris, 26-28, February 1999, Consensus Statement. J Hepatol 1999;30:956-61. [ Links ]
18. Hernández Febles M, Rodríguez San Román JL, Martín Suárez JM, Pena-López MJ. Acute hepatitis due to hepatitis C virus infection in the adult population. Gastroenterol Hepatol 2009;32:677-80. [ Links ]
19. Viladomiu L, Genescà J, Esteban JI, Allende H, González A, López-Talavera JC, et al. Interferon-alpha in acute posttransfusion hepatitis C: a randomized, controlled trial. Hepatology 1992;15:767-9. [ Links ]
20. Delwaide J, Bourgeois N, Gérard C, De Maeght S, Mokaddem F, Wain E, et al. Treatment of acute hepatitis C with interferon alpha-2b: early initiation of treatment is the most effective predictive factor of sustained viral response. Aliment Pharmacol Ther 2004;20:15-22. [ Links ]
21. Wiegand J, Buggisch P, Boecher W, Zeuzem S, Gelbmann CM, Berg T, et al. Early monotherapy with pegylated interferon alpha-2b for acute hepatitis C infection: the HEP-NET acute-HCV-II study. Hepatology 2006;43:250-6. [ Links ]
22. Corey KB, Mendez-Navarro J, Gorospe EC, Zheng H, Chung TR. Early treatment improves outcomes in acute hepatitis C virus infection: a meta-analysis. J Viral Hepat 2010;17:201-7. [ Links ]
23. Gerlach JT, Diepolder HM, Zachoval R, Gruener NH, Jung MC, Ulsenheimer A, et al. Acute hepatitis C: high rate of both spontaneous and treatment-induced viral clearance. Gastroenterology 2003;125:80-8. [ Links ]
24. Kamal SM, Ismail A, Graham CS, He Q, Rasenack JW, Peters T, et al. Pegylated interferon alpha therapy in acute hepatitis C: relation to hepatitis C virus-specific T cell response kinetics. Hepatology 2004;39:1721-31. [ Links ]
25. Morin T, Pariente A, Lahmek P, Rabaud C, Silvain C, Cadranel JF, et al. Acute hepatitis C: analysis of a 126-case prospective, multicenter cohort. Eur J Gastroenterol Hepatol 2010;22:157-66. [ Links ]
26. Ozaras R, Tahan V. Acute hepatitis C: prevention and treatment. Expert Rev Anti Infect Ther 2009;7:351-61. [ Links ]
27. Coppola N, Pisapia R, Tonziello G, Masiello A, Martini S, Pisaturo M, et al. Improvement in the aetiological diagnosis of acute hepatitis C: a diagnostic protocol based in the anti-HCV-IgM titre and IgG Avidity index. J Clin Virol 2009;46:222-9. [ Links ]
28. Araujo AC, Astrakhantseva IV, Fields HA, Kamili S. Distinguishing acute from chronic hepatitis C virus (HCV) infection based on antibody reactivities to specific HCV structural and nonstructural proteins. J Clin Microbiol 2011;49:54-7. [ Links ]
29. Hofer H, Watkins-Riedel T, Janata O, Penner E, Holzmann H, Steindl-Munda P, et al. Spontaneous viral clearance in patients with acute hepatitis C can be predicted by repeated measurements of serum viral load. Hepatology 2003;37:60-4. [ Links ]
30. Jaeckel E, Cornberg M, Wedemeyer H, Santantonio T, Mayer J, Zankel M, et al. German Acute Hepatitis C Therapy Group. Treatment of acute hepatitis C with interferon alfa-2b. N Engl J Med 2001;345:1452-7. [ Links ]
31. Santantonio T, Fasano M, Sinisi E, Guastadisegni A, Casalino C, Mazzola M, et al. Efficacy of a 24-week course of PEG-interferon alpha-2b monotherapy in patients with acute hepatitis C after failure of spontaneous clearance. J Hepatol 2005;42:329-33. [ Links ]
32. Dore GJ, Hellard M, Matthews GV, Grebely J, Haber PS, Petoumenos K, et al. Effective treatment of injecting drug users with recently adquired hepatitis C virus infection. Gastroenterology 2010;138:123-35. [ Links ]
33. De Rosa FG, Bargiacchi O, Audagnotto S, Garazzino S, Cariti G, Veronese L, et al. The early HCV RNA dynamics in patients with acute hepatitis C treated with pegylated interferon-alpha2b. Antivir Ther 2006;11:165-71. [ Links ]
34. De Rosa FG, Bargiacchi O, Audagnotto S, Garazzino S, Cariti G, Raiteri R, et al. Dose-dependent and genotype-independent sustained virological response of a 12 week pegylated interferon alpha-2b treatment for acute hepatitis C. J Antimicrob Chemoter 2006;57:360-3. [ Links ]
35. Calleri G, Cariti G, Gaiottino F, De Rosa FG, Bargiacchi O, Audagnotto S, et al. A short course of pegylated interferon in acute HCV hepatitis. J Viral Hepat 2007;14:116-21. [ Links ]
36. Villano SA, Vlahov D, Nelson KE, Cohn S, Thomas DL. Persistence of viremia and the importance of long-term follow-up after acute hepatitis C infection. Hepatology 1999;29:908-14. [ Links ]
37. Santantonio T, Sinisi E, Guastadisegni A, Casalino C, Mazzola M, Gentile A, et al. Natural course of acute hepatitis C: a long-term prospective study. Dig Liver Dis 2003;35:104-13. [ Links ]
38. Grebely J, Petoumenos K, Hellard M, Matthews GV, Suppiah V, Applegate T, et al. Potential role for interleukin-28B genotype in treatment decision-making in recent hepatitis C virus infection. Hepatology 2010;52:1216-24. [ Links ]











 texto en
texto en