Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Nutrición Hospitalaria
versión On-line ISSN 1699-5198versión impresa ISSN 0212-1611
Nutr. Hosp. vol.34 no.1 Madrid ene./feb. 2017
https://dx.doi.org/10.20960/nh.998
Utilidad en la clínica de la goma guar parcialmente hidrolizada: revisión de la evidencia y experiencia
Clinical utility of partially hydrolyzed guar gum: review of evidence and experience
Ana Cantón Blanco1, M.a Teresa Fernández López2, Gloria Lugo Rodríguez3, Miguel Á. Martínez Olmos1, Regina Palmeiro Carballeira4, Francisco Pita Gutiérrez3 y Cristina Tejera Pérez5
1Complejo Hospitalario Universitario de Santiago de Compostela. Santiago de Compostela, A Coruña.
2Complejo Hospitalario Universitario de Ourense. Ourense.
3Complejo Hospitalario Universitario de A Coruña. A Coruña.
4Complejo Hospitalario Universitario de Vigo. Vigo, Pontevedra.
5Complejo Hospitalario Universitario de Ferrol. El Ferrol, A Coruña
Dirección para correspondencia
RESUMEN
Introducción: la fibra dietética es un componente importante de la dieta humana. Cada tipo de fibra tiene efectos específicos a nivel metabólico y en el funcionamiento gastrointestinal, por lo que en cada patología concreta habremos de elegir la fibra óptima teniendo en cuenta sus propiedades químicas, físicas y fisiológicas.
Objetivo: encuadrar la goma guar parcialmente hidrolizada en su lugar en el complejo marco de la fibra dietética, revisar sus propiedades físico-químicas y posibles mecanismos de acción; así como su potencial utilidad en distintas situaciones clínicas en pacientes adultos.
Métodos: revisión no sistemática en Medline.
Resultados: la goma guar parcialmente hidrolizada (GGPH) se obtiene a partir de una hidrólisis enzimática parcial de la goma guar mediante la enzima β-endo-mananasa. Se trata de una fibra soluble, altamente fermentable y de baja viscosidad. La fermentación de la GGPH a nivel colónico produce ácidos grasos de cadena corta, implicados en los principales mecanismos fisiopatólogicos responsables de sus efectos a nivel clínico. Su uso en la diarrea asociada a la nutrición enteral está avalada por diversos estudios y por la recomendaciones de sociedades científicas como la European Society for Clinical Nutrition and Metabolism y la American Society for Parenteral and Enteral Nutrition. Se ha estudiado la utilidad de la GGPH en otras muchas situaciones clínicas, como diabetes, hipercolesterolemia, sobrecrecimiento bacteriano, etc. con resultados prometedores.
Conclusiones: la GGPH es útil en el manejo de la diarrea asociada a nutrición enteral. Respecto a otras situaciones clínicas, serían necesarios más estudios de calidad para poder hacer recomendaciones concretas.
Palabras clave: Goma guar parcialmente hidrolizada. Diarrea. Nutrición enteral. Fibra. Enfermedad inflamatoria intestinal.
ABSTRACT
Introduction: Dietary fiber is an important component of human diet. Since each fiber type has specific metabolic and gastrointestinal function effects, in each specific pathology we will have to choose the optimum type of fiber, considering its chemical, physical and physiological properties.
Objective: to put partially hydrolyzed guar gum in its place in the complex framework of dietary fiber, to review its physicochemical properties and possible mechanisms of action; as well as its potential usefulness in different clinical situations in adult patients.
Methods: non-systematic review in Medline.
Results: Partially hydrolyzed guar gum (PHGG) is obtained from a partial enzymatic hydrolysis of guar gum by the enzyme β-endo-mannanase. It is a soluble, highly fermentable fiber with low viscosity. The fermentation of GGPH in colon produces short chain fatty acids, implicated in the main pathophysiological mechanisms responsible for their clinical effects. Its use in enteral nutrition associated diarrhea is supported by several studies and by the recommendations of scientific societies such as the European Society for Clinical Nutrition and Metabolism and the American Society for Parenteral and Enteral Nutrition. The usefulness of GGPH has been studied in many other clinical situations, such as diabetes, hypercholesterolemia, bacterial overgrowth, etc. with promising results.
Conclusions: GGPH is useful in the management of enteral nutrition associated diarrhea. In other clinical situations, more quality studies would be necessary in order to make concrete recommendations.
Key words: Partially hydrolyzed guar gum. Diarrhoea. Enteral nutrition. Fiber. Inflammatory bowel disease.
Introducción
La fibra dietética, por sus efectos funcionales y metabólicos, es un componente importante de la dieta humana (1). Teniendo en cuenta que cada tipo de fibra tiene efectos específicos a nivel metabólico y en el funcionamiento gastrointestinal, en cada patología concreta habremos de elegir la fibra óptima en función de sus propiedades químicas, físicas y fisiológicas (2).
El objetivo del presente trabajo es encuadrar la goma guar parcialmente hidrolizada (GGPH) en su lugar en el complejo marco de la fibra dietética, revisar sus propiedades físico-químicas y posibles mecanismos de acción; así como su potencial utilidad en distintas situaciones clínicas en pacientes adultos, entre las que cabe destacar la diarrea asociada a nutrición enteral, la enfermedad inflamatoria intestinal (EII), el síndrome de intestino irritable (SII), etc.
Material y métodos
La revisión fue realizada a partir de una búsqueda electrónica en Medline-PubMed que se llevó a cabo en el último trimestre de 2015. Las palabras clave usadas fueron: fibra, goma guar, goma guar parcialmente hidrolizada, diarrea, nutrición enteral, enfermedad inflamatoria intestinal, síndrome de intestino irritable, síndrome de intestino corto, diabetes. Se incluyeron análisis clínicos, revisiones y guías de práctica clínica publicados en inglés o español, sin límite de tiempo.
FIBRA DIETÉTICA: CONCEPTO Y CLASIFICACIÓN
El primer científico que utilizó el término fibra dietética fue Hispley en 1953. Pero, ¿a qué nos referimos cuando hablamos de fibra dietética? En realidad existen diferentes definiciones, aunque ninguna de ellas es una definición universal. Básicamente todas identifican la fibra dietética como oligómeros y polímeros de carbohidratos que no son digeridos en el intestino delgado y que por lo tanto llegan intactos al intestino grueso, donde son parcial o completamente fermentados por las bacterias colónicas (3). Este proceso de fermentación facilitará la proliferación de determinadas poblaciones bacterianas y dará lugar a la liberación de ácidos grasos de cadena corta (AGCC) (acetato, propionato y butirato) y a la producción de gases como dióxido de carbono, hidrógeno y metano (4).
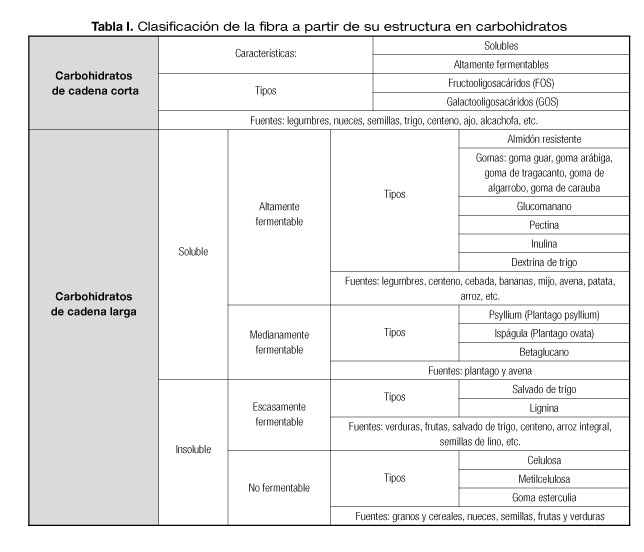
La fibra puede clasificarse en función de su estructura de carbohidratos (cadena larga o cadena corta), de su fermentabilidad (fibras fermentables, parcialmente fermentables y no fermentables) y de su solubilidad o comportamiento en contacto con el agua (fibra soluble e insoluble) (5,6). Dentro de las fibras solubles hay que diferenciar entre fibras viscosas y no viscosas. Las fibras viscosas al contactar con el agua forman un retículo con gran capacidad para retenerla, originando como consecuencia soluciones de elevada viscosidad. Entre estas fibras solubles viscosas cabe mencionar el psyllium, la goma guar, las pectinas, los polisacáridos procedentes de algas, etc. Las fibras solubles no viscosas tienen escasa capacidad para formar soluciones viscosas; es el caso, entre otras, de la inulina o la GGPH (7).
En la tabla I puede verse una clasificación de la fibra a partir de su estructura de carbohidratos.
La GGPH se clasifica como una fibra soluble, altamente fermentable y de baja viscosidad.
CARACTERÍSTICAS FÍSICO-QUÍMICAS DE LA GOMA GUAR
La goma guar es un galactomanano en forma de gel que se obtiene a partir del endospermo de la leguminosa Cyamoposis tetragonolobus L. (8). Con un peso molecular de 200.000-300.000 dalton (Da), su estructura química se basa en una larga cadena de moléculas α-D-manopiranosilo, unidas mediante enlaces glucosídicos tipo β-D- (1-4). La hexosa ligada a esta cadena es la α-D-galactopiranosa y la ratio manosa: galactosa es de 2:1 (9). Esta estructura química puede degradarse a altas temperaturas. Respecto a sus propiedades físicas decir que en su forma purificada se presenta como un polvo blanco, y que cuando se hidrata forma una solución coloidal con alta viscosidad (2.000-3.000 mPa.s); lo que le confiere la capacidad de retrasar el vaciamiento gástrico y hacer que la absorción de macronutrientes sea más sostenida en el tiempo (10). Su viscosidad es estable con los cambios de pH.
La GGPH no se encuentra en los alimentos como tal, sino que se obtiene mediante hidrólisis enzimática controlada de la goma guar, para lo cual se emplea la enzima β-endomananasa, que rompe la molécula de galactomanano dejando los grupos galactosilos intactos. El producto obtenido de esta hidrólisis es después separado, purificado, secado y pulverizado. Se presenta como un polvo blanco, soluble en agua y casi insípido cuyo peso molecular oscila entre 1.000 y 100.000 dalton (media 20.000). Conserva las propiedades metabólicas, nutricionales y analíticas de la goma guar (8), y en agua forma una solución transparente, incolora y de baja viscosidad (< 10 mPa.s); característica, esta última, que permite su uso en la elaboración de fórmulas de nutrición enteral para sondas. Es estable y soluble a distintos niveles de pH propios de los alimentos, así como resistente al calor (temperaturas muy elevadas no alteran su estructura química, pero si disminuyen la viscosidad), al ácido, la sal, las altas presiones y las enzimas digestivas. Presenta una escasa interacción con otros componentes alimentarios, por lo que no desestabiliza emulsiones, no cambia la viscosidad, ni afecta al sabor ni al color de los productos (1) (Fig. 1).
La GGPH, con un contenido en fibra dietética ≥ 75%, es el principal contribuyente a la producción total de AGCC durante la fermentación anaeróbica in vitro de inóculos fecales humanos (11), alcanzando un pico de producción entre las 8 y las 12 horas, con una razón molar a las 24 horas de 50:42:8 para acetato, propionato y butirato respectivamente (12). Si se analizan separadamente los distintos AGCC el nivel de butirato obtenido también es mayor con la fermentación de GGPH frente a otras fibras, excepto frente al psyllium, no existiendo en este caso diferencias significativas (11). Disponemos de GGPH para su uso en la práctica clínica formando parte de fórmulas de nutrición enteral o como módulo, que podremos añadir a alimentos, fórmulas de nutrición o usar de forma aislada.
EVIDENCIAS CIENTÍFICAS EN CLÍNICA
La fibra dietética aumenta la saciedad y mejora la función gastrointestinal y sus trastornos, asociándose también a una reducción en el riesgo de enfermedades crónicas. De hecho, ya en los años setenta Burkitt (13) estableció el papel de la fibra dietética en la prevención de varias enfermedades altamente prevalentes en los países occidentales, como la diabetes, la obesidad, el estreñimiento, la enfermedad coronaria o el cáncer. A continuación pasamos a analizar el papel de la GGPH en varias situaciones clínicas.
Diarrea en pacientes con nutrición enteral
Las primeras fórmulas de nutrición enteral con fibra aportaban casi exclusivamente fibra insoluble derivada del polisacárido de soja, con la finalidad de disminuir el estreñimiento. Ahora la mayoría de las fórmulas con fibra aportan mezclas de fibras de diferentes orígenes y en distintas proporciones (14). Algunos autores recomiendan el uso de este tipo de productos en todos los pacientes; sin embargo, no existe suficiente evidencia científica que avale un efecto superior si se los compara con las fórmulas estándar en pacientes con función gastrointestinal normal (14,15). En general, los efectos de la fibra sobre la función gastrointestinal en los distintos estudios clínicos no son consistentes, como consecuencia de diferencias en la población analizada, la duración de la intervención, la fuente de fibra, la dosis, etc. (16).
Durante la nutrición enteral puede aparecer diarrea en el 2-95% de los pacientes. La gran diferencia en el porcentaje de pacientes afectados en distintos estudios se explica en función de las poblaciones estudiadas y de la definición de diarrea adoptada (17). Las consecuencias clínicas derivadas están en relación con alteraciones en el equilibrio hidroelectrolítico, úlceras por presión, cese innecesario del soporte nutricional (18) o aporte insuficiente de macro y micronutrientes.
La administración de GGPH (21 g/día durante 2 semanas) conduce a un incremento de las bifidobacterias en las heces, lo que sugiere beneficios sobre la microbiota intestinal (19). Los AGCC que se forman como consecuencia de la fermentación de la GGPH, en especial el butirato, son la principal fuente de energía de los colonocitos; ejerciendo además otras acciones que contribuyen al correcto funcionamiento intestinal, como promover la absorción hidroelectrolítica, inducir la diferenciación y reducir la proliferación epitelial o preservar la función de barrera del intestino. Otros efectos potencialmente beneficiosos atribuidos a los AGCC a este nivel son: aumentar el flujo sanguíneo en el colon, estimular el sistema nervioso autonómico e incrementar la producción de hormonas gastrointestinales (20).
La GGPH ha demostrado ser efectiva en la prevención y tratamiento de la diarrea asociada a nutrición enteral. Homann y cols. realizaron un estudio aleatorizado, prospectivo, doble ciego, sobre una población de 100 pacientes hospitalizados con enfermedades médicas o sometidos a intervenciones quirúrgicas, que recibían nutrición enteral total o suplementaria. Ambos grupos eran subdivididos en dos grupos más pequeños que recibían una fórmula enteral estándar o bien la misma fórmula suplementada con 20 g de GGPH. El estudio mostró una disminución de la diarrea con la administración de GGPH (21). La nutrición enteral enriquecida con GGPH también se relacionó con un descenso de los episodios de diarrea en pacientes críticos que ya la presentaban previamente (22). Spapen y cols. obtuvieron resultados similares en una población crítica específica constituida por pacientes con shock séptico, una vez resucitados, sometidos a ventilación mecánica (23).
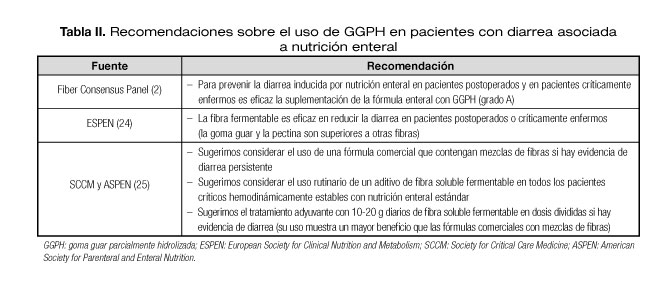
En la tabla II pueden apreciarse las recomendaciones emitidas por distintos grupos de trabajo y sociedades científicas respecto al uso de GGPH en pacientes con diarrea relacionada con nutrición enteral.
Enfermedad inflamatoria intestinal
El concepto enfermedad inflamatoria intestinal (EII) incluye dos entidades relacionadas: colitis ulcerosa (CU) y enfermedad de Crohn (EC). Ambas cursan en brotes y ocurren en individuos genéticamente predispuestos expuestos a factores ambientales desencadenantes. La incidencia y prevalencia de la EII en los países industrializados continua incrementándose en las últimas décadas, lo que sugiere que su desarrollo podría verse favorecido por factores ambientales con capacidad para modificar la respuesta inmune intestinal, alterar la microbiota o la integridad de la barrera epitelial intestinal (26). Entre los factores ambientales que pueden modificar el riesgo de enfermedad de Crohn (EC) y colitis ulcerosa (CU) se encuentran los patrones dietéticos, que influyen en la inflamación intestinal a través de diversos mecanismos; así, varios estudios implican a hidratos de carbono, grasas, proteínas y fibra dietética en la predisposición a desarrollar EII (27).
En los pacientes con EII la microbiota intestinal presente en el colon sintetiza una menor cantidad de AGCC. Un aporte adicional de fibra soluble podría facilitar un aumento en la producción de estos AGCC deficitarios (6). Varios estudios evalúan el efecto terapéutico de la fibra soluble en pacientes con EEII, objetivando que la CU es más sensible que la EC (28-32). Estos resultados pueden atribuirse a que la fermentación de la fibra y consiguiente producción de AGCC tiene lugar en el colon. Sin embargo, en pacientes con brote agudo de CU este proceso podría ser potencialmente perjudicial, ya que los AGCC son moderadamente ácidos y por tanto descienden el pH colónico; lo que junto con la presencia de sangre intraluminal propia del brote agudo, podría favorecer el crecimiento de bacterias productoras de ácido láctico, ocasionando un daño directo sobre la mucosa intestinal (27,33).
Naito y cols. evaluaron los efectos de la GGPH sobre el daño de la mucosa del colon y la respuesta inflamatoria en un modelo experimental de colitis inducida por sulfato de sodio dextrano (DSS) en ratones. La patogénesis de la lesión no es bien conocida, pero parece ser consecuencia del efecto tóxico del DSS sobre las células epiteliales, la alteración de la flora luminal o el estrés oxidativo. En todo caso los hallazgos histológicos objetivados son muy similares a los observados en pacientes con EII. Los autores del estudio concluyen que el tratamiento crónico con GGPH atenúa la inflamación de la colitis inducida por el DSS; estando medidado este efecto antiinflamatorio por la disminución del factor de necrosis tumoral alfa (TNF-α) y la modificación de la flora intestinal. Estos resultados sugieren que la GGPH podría ser un agente terapeútico adicional en pacientes con EII (34).
En el Fiber Consensus Panel de 2004 se concluye que aunque existen numerosos datos experimentales que sugieren un papel de la producción y oxidación insuficiente de los metabolitos de la fibra en la patogénesis de la inflamación colónica, no existe suficiente evidencia científica que apoye el uso de la fibra en pacientes con CU, siendo necesarios más estudios en este campo (grado B) (2).
Tras la revisión bibliográfica solo pudimos encontrar un trabajo publicado en abstract que evaluara específicamente el efecto de la GGPH en la CU en humanos. Se trata de un estudio aleatorizado doble ciego en 18 pacientes con CU, tratados con esteroides y 5-ASA, a la mitad de los cuales se les administra una nutrición enteral polimérica estándar, y a la otra mitad una fórmula con GGPH a razón de 2 g/100 ml. La tolerancia a la fórmula con fibra fue buena, y los autores concluyeron que la nutrición enteral con fibra parecía tener un mayor efecto trófico que la estándar, lo que debería ser confirmado con una serie más amplia (35).
Síndrome de intestino irritable
El síndrome de intestino irritable (SII) es un trastorno intestinal que cursa con dolor abdominal y cambios en el hábito defecatorio (diarrea, estreñimiento o ritmo alternante) sin alteraciones demostrables por los métodos diagnósticos actuales. El dolor mejora al defecar y los síntomas pueden presentarse de forma continua o discontinua, pero siempre tienen un curso prolongado.
El SII representa hasta una de cada cuatro consultas por problemas digestivos. Sus síntomas están presentes hasta en el 22% de la población, aunque solo una parte acude al médico. Se trata de un trastorno funcional digestivo. Su diagnóstico se basa en la presencia de los síntomas típicos, una exploración física normal y la ausencia de hallazgos patológicos en los estudios complementarios (análisis de sangre y de heces, radiografías, colonoscopia, etc.). En el diagnóstico del SII también se incluye la valoración de los posibles factores desencadenantes. La existencia de datos clínicos de alarma (pérdida de peso, anemia, presencia de sangre en las heces, fiebre, inicio de los síntomas después de los 50 años de edad, antecedentes familiares de cáncer de colon, de EII o de enfermedad celiaca, etc.) y la falta de respuesta al tratamiento o el empeoramiento o cambio de los síntomas, requerirá otras exploraciones complementarias a juicio del médico.
En el tratamiento del SII el apoyo del médico y la confianza del paciente son fundamentales. El médico debe tranquilizar al paciente indicándole la naturaleza benigna del trastorno, explicándole de forma comprensible los motivos por los que aparecen los síntomas y ayudándole a detectar y controlar los factores desencadenantes. Algunas recomendaciones dietéticas pueden ayudar en el alivio de los síntomas; realizar comidas no copiosas, pobres en grasas y ricas en proteínas puede mejorar el dolor abdominal y la urgencia defecatoria; evitar alimentos formadores de gas mejora la distensión abdominal y la flatulencia; y el consumo abundante de alimentos ricos en fibra dietética (frutas, verduras, salvado de trigo, etc.) y agua (1-2 litros diarios) es útil para combatir el estreñimiento. Por otra parte, el ejercicio físico regular mejora el dolor abdominal y el estreñimiento. Además, se pueden utilizar diferentes fármacos en función del síntoma predominante. Así, el dolor y la distensión abdominales mejoran con espasmolíticos y con antidepresivos a dosis bajas; y la diarrea y el estreñimiento lo hacen con el uso, respectivamente, de antidiarreicos y laxantes. Los pacientes con síntomas refractarios a estos tratamientos pueden requerir psicoterapia.
Entre los aspectos fundamentales del manejo del SII cabe mencionar (36):
- Debemos tener la máxima seguridad diagnóstica a partir de un diagnóstico diferencial exhaustivo que permita excluir otras patologías específicas.
- El tratamiento debe individualizarse, e incluye el manejo de la dieta, de los espasmolíticos y de los analgésicos (37).
- Si se opta por hacer una dieta de exclusión FODMAPS (diet low in fermentable oligo-, di-, and monosaccharides and polyols), siempre debe realizarse bajo la supervisión de un experto en nutrición y dietética, asegurando un adecuado equilibrio nutricional acorde con los requerimientos específicos del paciente (38).
- En los casos con afectación significativa del hábito deposicional los mayores beneficios se han visto con fibra soluble (psyllium) (39), aunque algunos sujetos pueden, potencialmente, experimentar un empeoramiento de sus síntomas al aumentar el aporte de fibra dietética (sobre todo si se realiza de forma brusca) por un aumento de la producción de gas, lo que podría ser debido al incremento de la presión endoluminal (38).
Al realizar la revisión bibliográfica no hemos encontrado estudios relevantes que demuestren un papel específico claramente favorable de la GGPH en esta patología (40).
Estreñimiento y diarrea no asociada a nutrición enteral
El hábito intestinal está influido por multitud de factores: medicaciones, estrés, ejercicio físico, volumen y tipo de comida, hormonas, etc.; lo que hace que estreñimiento y diarrea sean entidades difíciles de diagnosticar y tratar. La fibra aumenta el peso de las heces, debido a la propia fibra, al agua que retiene y al incremento del número de bacterias fecales secundario al proceso de fermentación; y promueve un ritmo intestinal normal (41), de forma que su consumo tiende a normalizar la frecuencia defecatoria a una deposición diaria y el tiempo de tránsito gastrointestinal a 2-4 días. Por ello, puede ser útil en el tratamiento de estreñimiento y diarrea.
Se han publicado varios estudios sobre el uso de la GGPH en el tratamiento del estreñimiento, la mayoría con un número pequeño de pacientes incluidos. Takahashi y cols. (42) estudiaron la frecuencia defecatoria, pH, humedad, peso de las heces y flora bacteriana en 15 mujeres jóvenes sanas con estreñimiento antes y después de añadir 11 g de GGPH en forma de bebida durante 3 semanas, demostrando mejoría de la frecuencia defecatoria y aumento de la humedad fecal con el tratamiento. En un grupo de 16 ancianos institucionalizados que precisaban laxantes la administración de GGPH en dosis progresiva hasta alcanzar los 15 g diarios en 3 dosis redujo la necesidad de tratamiento con laxantes, sin diferencias en la frecuencia defecatoria y presentando como único efecto secundario el incremento de la flatulencia (43). Sin embargo no pudo demostrase beneficio de la adición de GGPH (10 g) a la dieta laxante hospitalaria (28,9 +/- 5,8 gramos de fibra) en un ensayo ciego, aleatorizado, realizado en 64 pacientes ingresados con estreñimiento (44). Dimitrios y cols. (45) demostraron reducción en el tiempo de tránsito colónico, aumento en la frecuencia de deposiciones y disminución del dolor, así como en la necesidad de consumo de laxantes en un estudio prospectivo realizado con 39 pacientes que cumplían criterios de Roma III para estreñimiento crónico.
También se ha estudiado el uso de la GGPH en la diarrea no asociada a nutrición enteral, encontrándose resultados positivos en pacientes con diarrea severa por cólera, si bien es difícil determinar la dosis óptima en este tipo de pacientes (46); y en la diarrea transitoria inducida por maltitol o lactitol en mujeres (47).
Sobrecrecimiento bacteriano
El sobrecrecimiento bacteriano se presenta clínicamente con diarrea, flatulencia y distensión y dolor abdominal, pudiendo asociarse un cuadro de malabsorción. Furnani y cols. (48) objetivaron una tasa de erradicación significativamente mayor (87,1% vs. 62,1%) con rifaximina + GGPH (5 g diarios) vs. rifaximina en 77 pacientes diagnosticados de sobrecrecimiento bacteriano mediante test del aliento con glucosa.
Síndrome de intestino corto
En el síndrome de intestino corto se produce un proceso de adaptación intestinal condicionado fundamentalmente por la presencia de nutrientes en la luz. En los pacientes que conservan el colon en continuidad la metabolización de la fibra fermentable a ácidos grasos de cadena corta constituye una fuente calórica importante (49) y un estímulo para la reabsorción de agua y sodio (50). En pacientes con pérdidas intestinales elevadas resulta útil la administración de suplementos de fibra altamente viscosa de cara a conseguir tanto un descenso en el débito como un aumento de la consistencia de las heces (6). Sin embargo, en las más recientes guías de manejo del fallo intestinal crónico no se recomienda la adición de fibra soluble a la dieta de cara a aumentar la absorción de nutrientes (51).
Diabetes mellitus, dislipemia y obesidad
La fibra es útil en la optimización del control glucémico, estando implicados en ello varios mecanismos: retraso del vaciamiento gástrico, incremento de la viscosidad del quimo, enlentecimiento de la absorción de glucosa desde la luz del intestino delgado, disminución del índice glucémico y mejoría de la respuesta hormonal a nutrientes (52), como es el caso de las fibras solubles viscosas que estimulan la liberación de GLP-1. Se han realizado múltiples estudios sobre el efecto de la suplementación con fibra en pacientes diabéticos (53). El psyllium parece reducir los niveles de glucosa plasmáticos tras tratamientos de 6-8 semanas, y de insulina, siendo necesario para esto mayores dosis o un período de tratamiento más prolongado. En contraste, la fibra soluble no viscosa no ha demostrado mejoría en el control glucémico, así aunque la goma guar disminuye significativamente el pico de glucemia tras sobrecarga oral de glucosa en voluntarios sanos, este efecto no está presente con la GGPH.
La fibra soluble mejora el perfil lipídico, fundamentalmente al prevenir la reabsorción de sales biliares por la circulación enterohepática y al disminuir la síntesis hepática de colesterol (debido al descenso en los niveles de insulina y al efecto del AGCC propionato). El beneficio de la fibra soluble junto con la dieta baja en grasa para reducir el colesterol está bien documentado en múltiples ensayos clínicos de corta duración. El psyllium es la fibra más estudiada, habiéndose obtenido también buenos resultados en lo que se refiere a descenso de LDL colesterol y colesterol total con harina de avena y con Minolest (mezcla de goma guar y psyllium) (54).
La fibra dietética, por varios de los mecanismos de actuación ya mencionados, puede tener un efecto anorexígeno, y ser por tanto eficaz en el control de peso; sin embargo los resultados de los estudios son controvertidos. Un metaanálisis de 16 ensayos clínicos aleatoriazados que incluían pacientes con dieta hipocalórica aleatorizados a placebo vs. fibra demostró una reducción significativa del peso con el uso de fibra, si bien en la mayoría de los estudios la fibra utilizada era insoluble; solo alguno usó goma guar o glucomanano (55). Cicero y cols. demostraron un descenso del índice de masa muscular (IMC) tras 6 meses de tratamiento con psyllium y goma guar (56).
Conclusiones
- La GGPH es una fibra soluble, altamente fermentable y de baja viscosidad obtenida a partir de la hidrólisis parcial de la goma guar. Su baja viscosidad permite que sea usada formando parte de fórmulas de nutrición enteral.
- La GGPH es útil en la prevención y tratamiento de la diarrea asociada a nutrición enteral.
- La utilidad de la GGPH ha sido estudiada en otras varias patologías y situaciones clínicas con resultados prometedores en algunas de ellas, y no existe en este momento, a nuestro juicio, base suficiente para recomendar su uso.
Agradecimientos
Agradecemos a Nestlé Health Science estimular y facilitar las reuniones de nuestro grupo, que tan útiles nos están resultando desde el punto de vista científico como satisfactorias a nivel personal.
Bibliografía
1. Quartarone G. Role of PHGG as a dietary fiber: a review article. Minerva Gastroenterol Dietol 2013;59:329-40. [ Links ]
2. Meier R, Gasull MA. Consensus recomendations on the effects and benefits of fibre in clinical practice. Clin Nutr Supplements 2004;1:73-80. [ Links ]
3. Jones JM. CODEX-aligned dietary fiber definitions help to bridge the "fiber gap". Nutr J 2014;13:34. [ Links ]
4. Cummings JH, Macfarlane GT, Englyst HN, et al. Prebiotic digestion and fermentation. Am J Clin Nutr 2001;73:415S-20S. [ Links ]
5. Eswaran S, Muir J, Chey WD. Fiber and functional gastrointestinal disorders. Am J Gastroenterol 2013;108:718-27. [ Links ]
6. Sánchez Almaraz R, Martín Fuentes M, Palma Milla S, et al. Fiber-type indication among different pathologies. Nutr Hosp 2015;31:2372-83. [ Links ]
7. Chutkan R, Fahey G, Wright WL, et al. Viscous versus nonviscous soluble fiber supplements: mechanisms and evidence for fiber-specific health benefits. J Am Acad Nurse Pract 2012;24:476-87. [ Links ]
8. Yoon SJ, Chu DC, Raj Juneja L. Chemical and physical properties, safety and application of partially hydrolized guar gum as dietary fiber. J Clin Biochem Nutr 2008;42:1-7. [ Links ]
9. Mudgil D, Barak S, Khatkar BS. Guar gum: processing, properties and food applications-A Review. J Food Sci Technol 2014;51(3):409-18. [ Links ]
10. Ikegami S, Tsuchihashi F, Harada H, et al. Effect of viscous indigestible polysaccharides on pancreatic-biliary secretion and digestive organs in rats. J Nutr 1990;120(4):353-60. [ Links ]
11. Velázquez M, Davies C, Marret R, et al. Effect of oliogaccharides an fibre substitutes on short chain fatty acid production by human faecal microflora. Anaerobe 2000;6:87-92. [ Links ]
12. Stewart ML, Slavin JL. Molecular weight of guar gum affects short-chain fatty acid profile in model intestinal fermentation. Mol Nutr Food Res 2006;50:971-6. [ Links ]
13. Burkitt D, Walter ARP, Painter NS. Effect of dietary fibre on stools and transit time and its role in the causation of disease. Lancet 1972;2:1408-11. [ Links ]
14. Del Olmo García D. Productos dietéticos para usos nutricionales específicos. En: Angel Gil. Tratado de Nutrición, 2.a edición. Editorial médica Panamericana: Madrid; 2010. [ Links ]
15. Del Olmo D, López del Val T, Martínez de Icaya P, et al. La fibra en nutrición enteral: revisión sistemática de la literatura. Nutr Hosp 2004;29(3):167-74. [ Links ]
16. Klosterbeur A, Fariba Roughead Z, Slavin J. Benefits of Dietary Fiber in Clinical Nutrition. NCP 2011;26(5):625-35. [ Links ]
17. Whelan K. Enteral tube feeding diarrhea: manipulating the colonic microbiota with probiotics and prebiotics. Proc Nutr Soc 2007;66:299-306. [ Links ]
18. Whelan K, Schneider SM. Mechanisms, prevention, and management of diarrhea in enteral nutrition. Current Opinion in Gastroenteroly 2011;27:152-9. [ Links ]
19. Okubo T, Ishihara N, Takahashi H, et al. Effects of partially hydrolyzed guar gum intake on human intestinal microflora and its metabolism. Biosci Biotech Biochem 1994;58:1364-9. [ Links ]
20. Compher C, Seto RW, Lew JI, et al. Fibra dietética y sus aplicaciones clínicas a la alimentación enteral. En: Rombeau, Rolandelli. Nutrición Clinica. Alimentación enteral, 3.a edición. McGraw-Hill Interamericana editores: México DF; 1998. [ Links ]
21. Homann HH, Kemen M, Fuessenish C, et al. Reduction in diarrhea incidence by soluble fiber in patients receiving total or supplemental enteral nutrition. JPEN 1994;18(6):486-90. [ Links ]
22. Rushi TA, Pichard C, Dhater YH. Control of diarrhea by fiber-enriched diet in ICU patients on enteral nutrition: a prospective randomized contolled trial. Clin Nutr 2004;23(6):1344-52. [ Links ]
23. Spapen H, Diltoer M, van Malderen C, et al. Soluble fiber reduces the incidence of diarrhea in septica patients receiving total enteral nutrition: a prospective, doble-blind, randomized, and controlled trial. Clin Nutr 2001;20(4):301-5. [ Links ]
24. Lochs H, Allison SP, Meier R, et al. Introductory to the ESPEN guidelines on enteral nutrition: terminology, definitions and general topics. Clin Nutr 2006;25:180-6. [ Links ]
25. McClave SA, Taylor BE, Martindale RG, et al. Guidelines for the provision and assessment of nutrition support therapy in the adult critically ill patient: Society of Critical Care Medicine and American Society for Parenteral and Enteral Nutrition. JPEN 2016;40:159-211. [ Links ]
26. Jason KH, Dale Lee JL. Inflammatory Bowel Disease: Review of Patient-Targeted Recommendations. Clin Gastroenterol Hepatol 2014;12(10):1592-600. [ Links ]
27. Cabré E, Doménech E. Impact of environmental and dietary factors on the course of inflammatory bowel disease. World J Gastroenterol 2012;18(29):3814-22. [ Links ]
28. Escudero Álvarez, González Sánchez P. La fibra dietética. Nutr Hosp 2006;21(2):61-72. [ Links ]
29. Gálvez J, Rodríguez-Cabezas ME, Zarzuelo A. Effects of dietary fiber on inflammatory bowel disease. Mol Nutr Food Res 2005;49(6):601-8. [ Links ]
30. Fernández-Bañares F, Hinojosa J, Sánchez-Lombraña JL. Randomized clinical trial of Plantago ovata seeds (dietary fiber) as compared with mesalamine in maintaining remission in ulcerative colitis. Spanish Group for the Study of Crohn's Disease and Ulcerative Colitis (GETECCU). Am J Gastroenterol 1999;94(2):427-33. [ Links ]
31. Kanauchi O, Suga T, Tochichara M, et al. Treatment of ulcerative colitis by feeding with germinated barley foodstuff: first report of a multicenter open control trial. J Gastroenterol 2002;37(14):67-72. [ Links ]
32. Welters Carlo FM, Heineman E, Fredekik BJM, et al. Effect of dietary inulin supplementation on inflammation of pouch mucosa in patients with an ileal pouch-anal anastomosis. Diseases of the Colon and Rectum 2002;45(5):621-7. [ Links ]
33. Vernia P, Caprilli R, Latella G, et al. Fecal lactate and ulcerative colitis. Gastroenterol 1988;95(6):1564-8. [ Links ]
34. Naito Y, Takagi T, Katada K, et al. Partially hydrolyzed guar gum down-regulates colonic inflammatory response in dextran sulfate sodium-induced colitis in mice. J Nutr Bioch 2006;17(6):402-9. [ Links ]
35. García Peris P, de la Cuerda C, Camblor M, et al. Dieta enteral polimérica estándar vs. polimérica con fibra soluble en pacientes con colitis ulcerosa. Rev Esp Enf Dig 1997;89:86-7. [ Links ]
36. Lesbros-Pantoflickova D, Michetti PP, Fried M, et al. Meta-analysis: the treatment of irritable bowel syndrome. Aliment Pharmacol Ther 2004;20:1253-69. [ Links ]
37. Ford AC, Talley NJ, Spiegel BMR, et al. Effect of fibre, antispasmodics, and peppermint oil in the treatment of irritable bowel syndrome: systematic reviewand meta-analysis. BMJ 2008;337:a2313. [ Links ]
38. Rao SSC, Yu S, Fedewa A. Systematic review: dietary fibre and FODMAP-restricted diet in the management of constipation and irritable bowel síndrome. Aliment Pharmacol Ther 2015;41:1256-70. [ Links ]
39. Bijkerk CJ, de Wit NJ, Muris JWM, et al. Soluble or insoluble fiber in irritable bowel syndrome in primary care? Randomised placebo controlled trial. BMJ 2009;339:b3154. [ Links ]
40. Russo L, Andreozzi P, Zito FP, et al. Partially Hydrolyzed Guar Gum in the Treatment of Irritable Bowel Syndrome with Constipation: Effects of Gender, Age, and Body Mass Index. Saudi J Gastroenterol 2015;21(2):104-10. [ Links ]
41. Cummings JH. The efecto of dietary fiber on fecal weight and composition. Handbook of dietary fiber in human nutrition, 2nd ed. Boca Raton, FL: CRC Press; 1993. p. 263. [ Links ]
42. Takahashi H, Wako N, Okubo T, et al. Influence of partially hydrolized guar gum on constipation in women. J. Nutr Sci Vitam 1994;40:251-9. [ Links ]
43. Patrick PG, Gohman SM, Marx SC, et al. Effect of supplements of partially hydrolized guar gum on the occurrence of constipation and use of laxative agents. J Am Deit Assoc 1998;98:912-4. [ Links ]
44. Belo GMS, Diniz AS, Pereira APC. Effect of partially hidrolized guar gum in the treatment of funtional constipation among hospitalized patients. Arq Gastroenterol 2008;45:93-6. [ Links ]
45. Dimitrios P, Beintaris I, Gaglia A. Partially hydrolized guam guar accelerates colonic transit time and improves symtphoms in adults with chronic constipation. Dig Dis Sci 2014;S9:2207-14. [ Links ]
46. Alam NH, Ashraf II, Sarker SA, et al. Efficacy of partially hidrolyzed guar gum added oral rehydration solution in the treatment fo severe cholera in adults. Digestion 2008;78:24-9. [ Links ]
47. Nakamura S, Hongo R, Moji K, et al. Suppresive effect of partially diarrhea induced by ingestion of maltitol and lactitol in healthy humans. Eur J Clin Nutr 2007;61:1086-9313. [ Links ]
48. Furnani M, Parodi A, Gemignani L, et al. Clinical trial: the combination of rifaximina with partially hydrolysed guar gum is more effective than rifaximin alone in eradicating small intestinal bacterial overgrowth. Aliment Pharmacol Ther 2010;32:1000-6. [ Links ]
49. Byrne TA, Persinger RL, Young LS, et al. A New Treatment for Patients with Short-Bowel Syndrome Growth Hormone, Glutamine and a Modified Diet. Ann Surg 1995;222(3):243-55. [ Links ]
50. Pérez de la Cruz AJ, Moreno-Torres Herrera R, Pérez Roca C. Tratamiento nutricional del fallo intestinal y potenciales mecanismos de estimulación. Nutr Hosp 2007;22(2):86-102. [ Links ]
51. Pironi L, Arends J, Bozzetti F, et al. ESPEN guidelines on chronic intestinal failure in adults. Clin Nutr 2016;35:247-307. [ Links ]
52. Guillon F, Champ M. Structural and physical properties of dietary fibres and consequences of processing on human physiology. Food Res Int 2003;33:233-45. [ Links ]
53. Ziai S, Larijani B, Akhoondzadeh S, et al. Psyllium decreased serum glucose and glycosylated hemoglobin significantly in diabetic outpatientes. Journal of Ethnopharmacology 2005;102:202-7. [ Links ]
54. Tai ES, Fok AC, Chu R, et al. A study to assess the effect of dietary suplemmentation with soluble fiber (Minolest) on lipid levels in normal subjets. Ann Acad Med Singapore 1999:28(2):209-13. [ Links ]
55. Anderson J, Baird P, Davis R, et al. Health benefits of dietary fiber. Nutr Rev 2009;67:188-205. [ Links ]
56. Cicero A, Derosa G, Bove M, et al. Psyllium improves dyslipidemaemia, hyperglycaemia and hypertension, while guar gum reduces body weight more rapidly in patientes affected by metabolic syndrome following an AHA Step 2 diet. Med J Nutrition Metab 2010;3:47-54. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Miguel Á. Martínez Olmos.
Servicio de Endocrinología y Nutrición.
Complejo Hospitalario Universitario de Santiago de Compostela.
C/ Choupana, s/n.
15706 Santiago de Compostela. A Coruña
e-mail: miguel.angel.martinez.olmos@sergas.es
Recibido: 04/06/2016
Aceptado: 13/10/2016