INTRODUCCIÓN
El Capítulo de Diagnóstico Vascular de la Sociedad Española de Angiología y Cirugía Vascular publicaba en el año 2009 la Guía básica para el estudio no invasivo de la isquemia crónica de los miembros inferiores (1). Esta guía se ha convertido en uno de los referentes para el estudio de la isquemia de las extremidades. Pero han pasado más de diez años desde su publicación. Es por ello por lo que, desde el Capítulo, se ha creído llegado el momento de realizar su actualización.
Repasando la temática y el contenido de la guía, los principios y las exploraciones que la constituyen no han perdido vigencia ni han modificado en gran medida sus detalles. Esto mismo pasa con otras guías de diagnóstico avaladas por nuestra entidad. Por lo tanto, lejos de anular el contenido de la guía anterior, lo que se ha pretendido elaborar en esta guía es una ampliación de los conceptos y de la metodología de estudio en la patología isquémica de los miembros inferiores. Solo se ha permitido la licencia de reescribir el capítulo dedicado al estudio ecográfico Doppler de las arterias de los miembros inferiores, no porque el anterior no fuese excelente, sino con el ánimo de potenciar, si cabe, la metodología para llevar a cabo el estudio ecográfico comentado, que podría considerarse la piedra angular del estudio en isquemia de las extremidades inferiores. Las otras secciones en las que se divide esta guía tratan aspectos novedosos en el diagnóstico de la isquemia, no abordados en la versión anterior, pero que, posiblemente, a corto o medio plazo, supondrán parámetros cada vez más útiles en el estudio, en el diagnóstico y en el pronóstico de esta entidad patológica.
ECOGRAFÍA DOPPLER ARTERIAL DE MIEMBROS INFERIORES
La ecografía Doppler arterial de miembros inferiores se ha dado en llamar cartografía arterial. Esta expresión es más afín a lo que implica la exploración: una descripción topográfica de las arterias principales de las extremidades inferiores, de sus lesiones y del estado de su flujo. Esto lleva a la afirmación de que esta exploración no es la más adecuada para diagnosticar y dimensionar la patología isquémica de miembros inferiores. De hecho, se trata de una exploración compleja que precisa de tiempo, de maquinaria de alta gama y de exploradores entrenados. Por lo tanto, no debería usarse para otro propósito que no fuese la planificación de intervenciones quirúrgicas en pacientes afectados de isquemia de extremidades y no para documentar el estado arterial ante cualquier sospecha de clínica isquémica (2).
La primera consideración respecto al uso de la ecografía Doppler en el estudio de las arterias de las extremidades inferiores que debería tenerse en cuenta sería qué es lo que puede estudiarse con esta exploración. La ecografía Doppler permite valorar:
– Anomalías morfológicas de las arterias de los miembros inferiores, tales como alteraciones en el diámetro arterial, tortuosidades arteriales y presencia de colateralidad aumentada.
– Anomalías posicionales, como variaciones en la relación de las arterias respecto a las estructuras adyacentes o alteración en el origen de las arterias.
– Anomalías estructurales, entendidas como la presencia de alteraciones en la pared arterial que conforman la presencia de placa de ateroma, su posición, su extensión e incluso su composición.
– Anomalías hemodinámicas, que son la peculiaridad más específica de la cartografía arterial de las extremidades inferiores: la posibilidad de estudiar a tiempo real el flujo vascular. Todo ello mediante la evaluación cualitativa, y sobre todo cuantitativa, de la onda de flujo arterial (3).
El estudio mediante ecografía Doppler de una arteria de las extremidades inferiores no patológica implica a las tres vertientes de esta exploración:
En modo B, o escala de grises, la arteria se muestra como una estructura redondeada, anecoica, es decir, prácticamente negra, homogénea, rodeada de un fino anillo hiperecoico, blanco, que es la pared arterial, y muestra pulsatilidad.
En modo Doppler color, el color llena de forma homogénea la luz del vaso, delimitando la cara interna del anillo hiperecoico, que define el endotelio, y, por supuesto, manifiesta pulsatilidad.
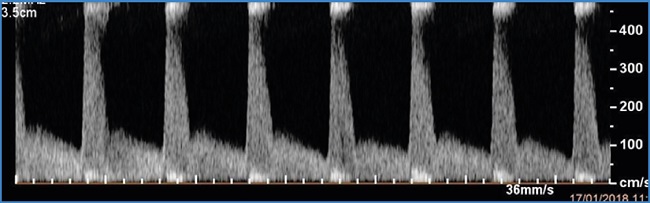
Finalmente, en modo Doppler pulsado, se obtiene la curva de flujo arterial, que, en una arteria de alta resistencia, como las de las extremidades inferiores, muestra una morfología trifásica, con ascenso y descenso agudos y rápidos en sístole y con una inversión de flujo en la fase diastólica que expresa la elasticidad de la pared arterial y que, si esta elasticidad es suficiente, puede hacer que el segmento más distal de la fase diastólica vuelva a positivizar (Fig. 1). La evaluación cualitativa de la morfología de la curva y, sobre todo, las diversas mediciones de las velocidades que permite esta curva, dan una idea precisa del flujo de la arteria evaluada (4).
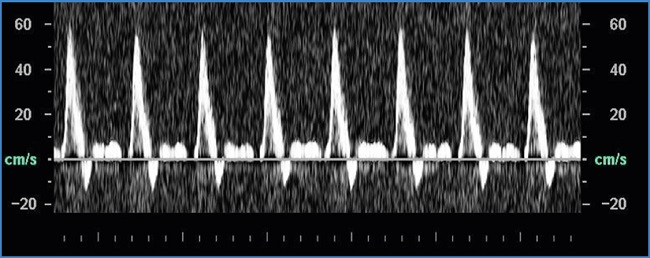
Figura 1. Onda de flujo arterial de alta resistencia típica de las arterias de las extremidades inferiores.
La exploración ecográfica arterial de los miembros inferiores requiere instrumentos de gama alta para conseguir un correcto análisis de las arterias y de sus flujos. Estas máquinas llevan programas de serie que permiten adaptar la exploración a los requerimientos deseados. De forma general, hay que decir que es necesario adaptar todas las directrices del ecógrafo para que puedan captar los flujos más bajos posibles, típicos de los miembros inferiores afectados de patología isquémica. Para ello, es necesario:
– Disminuir los filtros, así como aumentar el rango dinámico en modo B, para lograr una mejor identificación y caracterización de la placa de ateroma.
– Aumentar la ganancia del Doppler color y del Doppler pulsado.
– Disminuir la frecuencia de repetición de pulsos en los mismos modos Doppler.
– El volumen de muestra no debe superar el tercio o la cuarta parte de la luz de la arteria estudiada.
– El ángulo Doppler en modo Doppler pulsado siempre debe estar entre 45° y 60° respecto al eje longitudinal del vaso estudiado.
Puede ser mejor programar el ecógrafo en un modo de estudio venoso para obtener de entrada los parámetros de medición tan sensibles que se precisan.
El transductor de elección para realizar la exploración es el lineal de frecuencias medias a altas, entre 7 y 12 MHz. Ahora bien, la sonda curvilínea de frecuencias bajas a medias, entre 3 y 5 MHz, es indispensable para la evaluación del eje ilíaco y muy útil para el estudio de los primeros centímetros de la arteria femoral profunda, de la arteria poplítea supragenicular en pacientes obesos e incluso del tronco tibioperoneo y del origen de la arteria tibial anterior (5).
El paciente debe situarse en una habitación tranquila y es importante lograr su máxima comodidad, puesto que la exploración puede ser larga. Debe colocarse en decúbito, supino con unas ligeras flexión, abducción y rotación externa de cadera y de rodilla. Es útil colocar al paciente en decúbito lateral opuesto a la extremidad explorada para el estudio de la arteria poplítea, del tronco tibioperoneo y de la arteria peronea.
La exploración sigue un sentido de craneal a caudal desde la ingle hasta la arteria poplítea infragenicular. En cambio, para el estudio del eje ilíaco y para el de los vasos distales, es mejor adoptar un sentido de la exploración de caudal a craneal. Esto se justifica por la facilidad en la localización de las arterias a nivel de la ingle y del maléolo.
El sentido de exploración de caudal a craneal en los troncos distales permite una localización más fácil de estos en el maléolo y un ahorro de tiempo, puesto que, en el caso de constatarse oclusión distal a nivel maleolar, no tiene mucho sentido explorar todo el vaso.
La secuencia de estudio empieza con la aplicación del modo B, o escala de grises, primero en proyección transversal para después pasar a la longitudinal. Con esta evaluación puede localizarse la arteria, relacionarla con las estructuras a su alrededor, medirla y valorar la presencia o no de placa de ateroma, así como su localización, su extensión y su composición. Acto seguido se aplica el modo Doppler color mediante el que acaba de caracterizarse en superficie la placa de ateroma y puede evaluarse, de forma cualitativa, el flujo arterial. Finalmente, debe aplicarse el modo Doppler pulsado para obtener la curva de flujo arterial, que permite la valoración cuantitativa de este flujo. El modo Doppler pulsado debe aplicarse cada vez que se avanzan 2 o 3 centímetros en la exploración, en las bifurcaciones arteriales, ante anomalías detectadas en modo Doppler color y ante cualquier imagen que se crea sospechosa de manifestar una estenosis.
La evaluación de la anatomía ecográfica de las arterias de las extremidades inferiores incluye el eje ilíaco, la arteria femoral común, los primeros centímetros de la arteria femoral profunda, la arteria femoral superficial, la arteria poplítea, el tronco tibioperoneo, la arteria tibial anterior, la arteria tibial posterior y la arteria peronea (6).
El eje arterial ilíaco se relaciona con las venas homónimas, lateral a ellas cerca de la ingle y superficial a esas venas a nivel de la arteria ilíaca primitiva e ilíaca externa proximal. Se trata de arterias de gran tortuosidad. La ilíaca primitiva es un vaso más corto que la externa y ambas se relacionan con el suelo pélvico sobre el que reposan. Una forma indirecta y económica de evaluar el eje ilíaco sin tener que explorarlo por entero, consiste en el estudio de la onda de flujo femoral. La morfología trifásica de la onda traduce ausencia de lesiones en este eje ilíaco.
Dada la frecuencia de la presencia de placas complejas en la femoral común, puede ser más útil explorar la onda de flujo en la arteria ilíaca externa distal.
La arteria femoral común está ubicada de forma superficial en la ingle y externa a la vena homónima. Se trata de una arteria corta, de 4 a 6 centímetros de longitud, que rápidamente se divide en la arteria femoral superficial y en la arteria femoral profunda.
En obesos, las referencias anatómicas, como el pliegue inguinal, pueden estar modificadas. Hay pacientes en los que la bifurcación puede ser alta o baja. Hay que identificar siempre las arterias femorales superficial y profunda.
La arteria femoral profunda es evaluable en sus primeros centímetros, siguiendo una dirección craneal a caudal y anterior a posterior, paralela al haz de los ultrasonidos.
En cuanto a la arteria femoral superficial, es un vaso largo, ubicado subsartorial en el compartimento medial del muslo, en relación con su vena homónima, primero lateral a esta y posteriormente de forma superficial.
En la identificación y diferenciación de las arterias femorales superficial y profunda es de gran ayuda su relación con la vena femoral: esta siempre es profunda respecto a la arteria femoral superficial y superficial respecto a la arteria femoral profunda.
Debe estudiarse la arteria femoral superficial en toda su extensión, incluso si está ocluida, para identificar el punto de recanalización, a veces más preciso con ecografía que la propia arteriografía.
La arteria poplítea es la continuación de la arteria femoral superficial más allá del canal de los músculos aductores. Se caracteriza por sus abundantes colaterales, así como por su relación con la vena o las venas homónimas. También presenta una relación íntima con los cóndilos femorales y con la meseta tibial. La arteria poplítea infragenicular se divide en tronco tibioperoneo y arteria tibial anterior. El tronco tibioperoneo supone, pues, la continuación de la arteria poplítea. Tiene un diámetro menor que esta y con una dirección perpendicular al haz de los ultrasonidos respecto a ella.
La arteria tibial posterior se localiza de forma posterior al maléolo interno en el tobillo y asciende por el compartimento interno de la pierna con relación a dos o tres venas homónimas y al músculo gemelo interno. La arteria tibial anterior se localiza en el aspecto anterior del tobillo, siempre con relación a sus dos o tres venas homónimas, y asciende a través de la pierna por el compartimento anterior sobre la membrana interósea. A nivel de la cabeza del peroné, la arteria describe un arco posterior para ir a buscar la arteria poplítea.
La identificación del tronco tibioperoneo y su diferenciación respecto de la arteria poplítea se basa en:
La arteria peronea se ubica de forma posterior al maléolo externo en el tobillo y asciende por el compartimento posteroexterno de la pierna con relación a sus dos o tres venas homónimas, al músculo gemelo externo y al propio hueso peroné.
Es más fácil localizar las arterias distales en proyección transversal que en longitudinal.
Para diferenciar una arteria distal principal de una colateral, es de gran ayuda la identificación de las venas homónimas, que solo aparecen en las arterias distales principales.
Entre los hallazgos patológicos a considerar, el primero de ellos es la presencia y las características de la placa de ateroma. La ecografía en modo B permite identificar y ubicar la placa de ateroma, así como determinar su extensión: protrusiones en la luz arterial más o menos excéntricas. Además, mediante la ecografía en modo B y el modo Doppler color es posible caracterizar la placa de ateroma respecto a su homogeneidad o heterogeneidad, su ecogenicidad, su superficie lisa o irregular y su contenido en calcio. La extensión de la placa de ateroma establece los denominados patrones regionales de enfermedad. Se definen cono una serie de patrones de distribución de las placas de ateroma que se repiten en la mayoría de los pacientes con isquemia de miembros inferiores orientando, facilitando y economizando el estudio. Algunos ejemplos serían la estenosis de la arteria femoral superficial al nivel del canal de los aductores, la oclusión de toda la arteria femoral superficial o la lesión de los vasos distales en pacientes diabéticos (3).
El modo Doppler color permite valorar de forma cualitativa el flujo de las arterias. De esta forma, la presencia de alteraciones del color, lo que se denomina el fenómeno del aliasing de color, indica la presencia de turbulencias por estenosis. La ausencia de color en una de las arterias estudiadas traduce su oclusión.
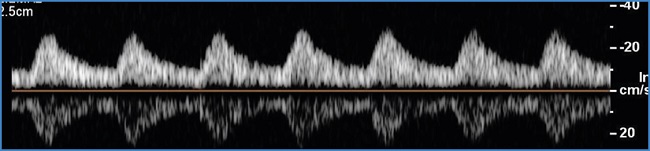
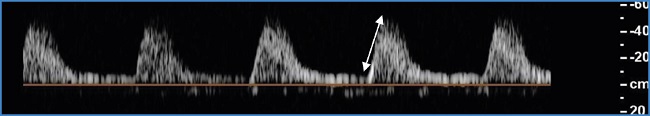
El modo Doppler pulsado ofrece la posibilidad de caracterizar cuantitativamente el flujo arterial. Se trata del método predilecto y el más fiable para la valoración del grado de estenosis. Existe una modificación progresiva de la onda de flujo que depende de la gravedad de las estenosis. En una estenosis significativa, la onda de flujo experimenta un ascenso y un descenso sistólicos agudos, con una velocidad pico sistólica muy acelerada y una positivización de toda la fase diastólica de la onda (Fig. 2). La onda de flujo posterior a estas estenosis o a una oclusión muestra un aplanamiento llamativo de la fase sistólica, con gran pérdida de la velocidad pico sistólica y mayor positivización, si cabe, de la fase diastólica de la onda (Fig. 3).
Es muy importante conferir valor a la presencia de una onda de flujo atenuada a lo largo de una exploración, a pesar de no hallar previamente signos Doppler de estenosis significativas.
Existen diversos parámetros cuantitativos para medir el grado estenosis. Son muy variables entre grupos. Posiblemente, el parámetro más objetivo para cuantificar el grado de estenosis es la ratio entre las velocidades pico sistólicas en el segmento sospechoso de estenosis respecto del segmento preestenótico. Aunque existen multitud de posibilidades, se considera que una ratio superior a 2 o 3 implica la presencia de una estenosis significativa. La ausencia de onda de flujo traduce oclusión del vaso estudiado (7).
TIEMPO DE ACELERACIÓN PEDAL
Las pruebas hemodinámicas no invasivas son el pilar para el estudio vascular en la mayoría, si no en la totalidad, de pacientes con isquemia crónica de miembros inferiores. La ecografía Doppler, los índices tobillo-brazo y los índices dedo-brazo son los métodos estándar para evaluar la perfusión de las extremidades en este tipo de pacientes. Sin embargo, tanto los índices tobillo-brazo como los índices dedo-brazo pueden no ser creíbles o fiables en pacientes diabéticos o con arterias no compresibles, por lo que muchas veces, en este tipo de pacientes, es difícil conocer exactamente cuál es el grado de perfusión. Este hecho dificulta la toma de decisiones al aparecer algún tipo de lesión: ante la necesidad de una amputación menor, ¿es preciso revascularizar la extremidad o una amputación menor primaria sería suficiente? ¿Manteniendo las curas podría epitelizar una lesión sin necesidad de cirugía de revascularización? En años recientes, se ha descrito la técnica de medición del tiempo de aceleración pedal (más conocido como PAT, por sus iniciales en inglés) en diferentes arterias a nivel del pie (8).
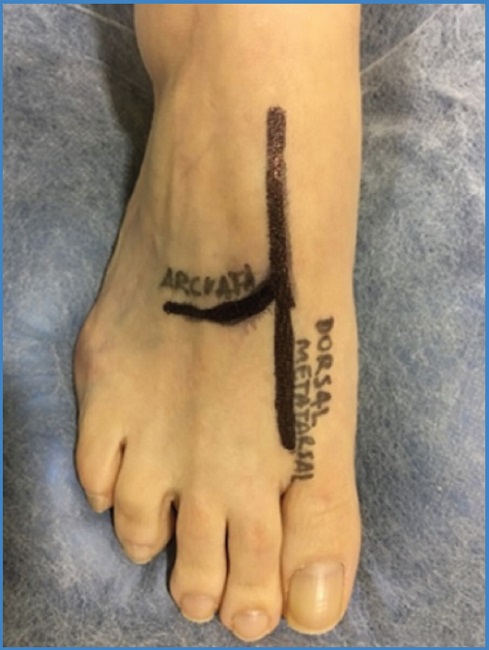
El PAT se define como el espacio de tiempo, en la curva de flujo arterial Doppler, entre el inicio de la sístole y su punto de máxima aceleración. Se mide en milisegundos (ms) (Fig. 4). Esta medición puede llevarse a cabo obteniendo la curva de flujo arterial mediante la realización de una ecografía Doppler arterial estándar en un laboratorio vascular acreditado. El PAT se obtiene de varios vasos a nivel del pie. En concreto, se evalúa en cinco arterias: arteria arcuata, arteria metatarsal dorsal, arteria plantar medial, arteria plantar lateral y arteria plantar profunda. Proporciona información fisiológica en tiempo real sobre el estado hemodinámico y puede aportar también conocimientos sobre la perfusión de los distintos angiosomas del pie.
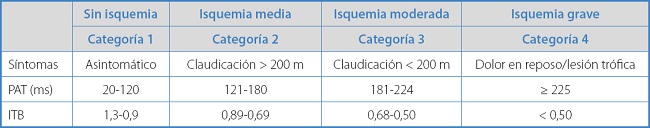
El PAT se ha utilizado en la evaluación de la enfermedad oclusiva arterial, correlacionándose con los índices tobillo-brazo en pacientes sintomáticos y no sintomáticos con vasos tibiales compresibles. Aunque el valor de PAT absoluto es importante, es mejor clasificar sus valores en intervalos en función de su afectación. Su concordancia con el estado clínico del paciente se ha contrastado dividiéndose en cuatro grupos en función de los valores obtenidos durante su medición (Tabla I). Los tiempos más alargados corresponden a patrones de enfermedad más evolucionada y nos indicarían que el flujo arterial de llegada al pie es un flujo cada vez más atenuado (9).
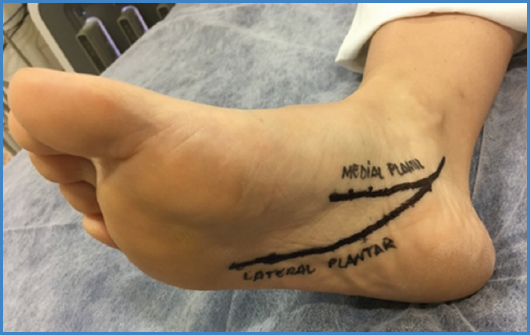
La obtención del PAT implica la realización de una ecografía Doppler a nivel de las arterias del pie. Para ello es imprescindible cierto conocimiento anatómico ecográfico de estas arterias. A nivel del dorso del pie, la arteria de referencia es la arteria pedia. La arteria pedia nace al pasar la arteria tibial anterior el nivel del maléolo hacia el antepié y después del nacimiento de la arteria tarsal. La arteria pedia se divide, a nivel medio-distal del antepié, en arteria arcuata, que rellena el arco digital dorsal, y arteria metatarsal dorsal, que es arteria terminal, hacia el primer dedo (Fig. 5). A nivel plantar, la arteria de referencia es la arteria tibial posterior. La arteria tibial posterior, al pasar el maléolo tibial, se bifurca en arteria plantar medial y en arteria plantar lateral. Esta última se continúa distalmente, originando la arteria plantar profunda (9) (Fig. 6).
El estudio de las arterias inframaleolares debe hacerse con una sonda lineal de alta frecuencia (de 3 a 12 MHz). Son ideales las de muy alta frecuencia (de más de 12 MHz), tipo palo de hockey, para la circulación distal. La optimización de los parámetros para la exploración de los vasos inframaleolares debe considerar:
– El aumento de la ganancia y la disminución de la frecuencia de repetición de pulsos en modo Doppler color para rellenar correctamente con color la luz del vaso estudiado.
– El volumen de muestra, que sea una tercera o una cuarta parte de la luz arterial estudiada.
– La angulación adecuada, entre 45 y 60°, respecto al eje longitudinal del vaso en modo Doppler pulsado.
– Al congelar la imagen, la onda de flujo Doppler obtenida debe ocupar unas tres cuartas partes de la pantalla para una correcta medición del PAT.
– La elección, entre las herramientas de cálculo del ecógrafo, de la opción tiempo/pendiente.
Un uso correcto del PAT implica la obtención de sus valores en, al menos, cuatro de las cinco arterias mencionadas más arriba. Las preferentes son:
Si la curva espectral obtenida es buena, una sola medida implica un valor fiable. Por el contrario, si la curva espectral no es buena o el flujo es muy bajo, es recomendable realizar 3 o 4 medidas, cogiendo como valor de referencia la media de las diferentes medidas. Los pacientes con una velocidad sistólica máxima en la curva de flujo arterial inferior a 5 cm/s podrían catalogarse directamente dentro del grupo 4.
El protocolo de estudio del PAT empieza con la evaluación de la arteria arcuata. Siguiendo la arteria tibial anterior distal, desplegando este vaso en proyección longitudinal y con el marcador del transductor orientado hacia la cabeza del paciente, se recoge la permeabilidad o no de dicha arteria, su curva espectral y se miden las velocidades pico sistólicas. Se procede igual con la arteria pedia, que es la continuación de la anterior después de la salida de la arteria tarsal. Cuando la arteria pedia se divide en arteria metatarsal dorsal y en arteria arcuata, debe aplicarse el protocolo para calcular el PAT en la arteria arcuata: se obtiene la curva de flujo espectral en la arteria a ese nivel y se realiza la medición del PAT. En el caso de que exista una lesión a nivel del primer dedo del pie, es especialmente útil la medición del PAT en la arteria metatarsal dorsal.
Una vez estudiadas las arterias del dorso del pie, se evalúan las arterias plantares. La localización de estas arterias se basa en el seguimiento distal de la arteria tibial posterior maleolar hasta encontrar su bifurcación. Para su identificación, puede ser útil la visualización transversal en lugar de la longitudinal de esta arteria. Una vez localizada, y de cara a dar validez a la obtención y a las mediciones sobre la curva espectral arterial, debe procederse a la visualización de la arteria en proyección longitudinal y con el marcador del transductor orientado hacia el hueso calcáneo. La arteria plantar medial suele encontrarse más superficial y ser de menor calibre que la arteria plantar lateral. La arteria plantar lateral, pues, es de mayor tamaño que la plantar medial y de localización lateral y profunda respecto a esta. Se relaciona con los huesos metatarsianos y con las venas plantares laterales, de mayor diámetro, que muchas veces permiten su detección. Nuevamente, para la obtención de mediciones sobre la curva espectral que sean fiables y verdaderas, debe procederse a insonar la arteria plantar lateral en proyección longitudinal con el marcador del transductor orientado hacia el hueso calcáneo. El seguimiento en sentido distal de la arteria plantar lateral conduce a la arteria plantar profunda, ubicada a nivel de la cabeza de los huesos metatarsianos. Esta es la última arteria en la que es preciso obtener el parámetro PAT nuevamente y siempre en una proyección longitudinal del vaso (9,10).
PRESIÓN TRANSCUTÁNEA DE OXÍGENO EN CIRUGÍA VASCULAR
La presión transcutánea de oxígeno (TcPO2), también denominada oximetría transcutánea, es una herramienta no invasiva de diagnóstico de enfermedad arterial periférica, y fundamentalmente de isquemia crítica, especialmente útil en pacientes con presiones e índices tobillo-brazo o dedo-brazo no valorables por calcificación arterial (11-15). Esta recomendación se publicó en el año 2014, cuando la Society for Vascular Surgery (SVS) desarrolló la clasificación WIfI (Wound, Ischemia, and foot Infection) (14) y se estableció con un grado de evidencia 2C en la última guía, publicada en el año 2019, por la European Society for Vascular Surgery (ESVS) (GVG) (15).
Además, la TcPO2 es una prueba con valor pronóstico para la cicatrización de las úlceras en extremidades inferiores. Ayuda a determinar el beneficio de realizar un procedimiento de revascularización y permite estratificar el riesgo de amputación, principalmente en pacientes diagnosticados de diabetes mellitus o enfermedad renal crónica (11,12,14-16). Esta recomendación se estableció con un grado de evidencia 1B en las guías del Grupo de Trabajo Internacional de Pie Diabético (IWGDF, en sus siglas en inglés) para la prevención y el manejo de la enfermedad de pie diabético publicadas en el año 2019 (16).
Asimismo, según recogen las GVG y las guías del IWGDF, la TcPO2 también permite determinar el nivel de amputación y monitorizar la eficacia de un procedimiento de revascularización, de oxigenoterapia hiperbárica sistémica, de estimulación medular o de utilización de células madre (15,16).
La TcPO2 proporciona información de la macrocirculación y fundamentalmente de la microcirculación, porque refleja el estado metabólico tisular, ya que determina la cantidad de oxígeno arterial, el consumo de oxígeno, la presión arterial, la presión de perfusión y la función neurovascular de los tejidos estudiados, principalmente de la piel (11,17-19). Su valor depende del flujo sanguíneo, de la actividad metabólica, de la disociación de la oxihemoglobina y de la difusión del oxígeno a través de los tejidos (1,2).
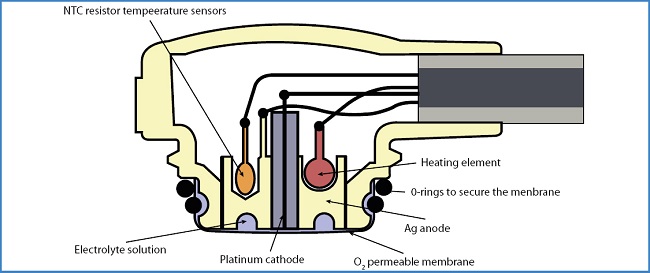
La determinación de la TcPO2 puede obtenerse utilizando un método electroquímico o fotoóptico (11-13,19-21). El método electroquímico (eTcPO2) (Fig. 7) es el tradicional. Se compone de un electrodo Clark, formado por un cátodo de platino y un ánodo de plata cubierto con una membrana que es permeable al oxígeno. Para asegurar la permeabilidad cutánea al oxígeno, el electrodo se calienta, creando una hipertermia local que, por un lado, licua el estrato córneo y, por otro, produce una vasodilatación capilar que favorece la difusión del oxígeno. La reacción electroquímica genera un flujo que es proporcional a la presión parcial de oxígeno, expresada en mmHg (11-13,19,22). La duración media de la prueba es de 25-30 minutos. Una de sus limitaciones es que consume tiempo, ya que el electrodo requiere un periodo de calentamiento para alcanzar una temperatura cutánea, que oscila entre 42 y 45 °C, según los estudios (se desconoce cuál es el valor óptimo) (11,12,15,21,22). El método fotoóptico (pTcPO2) (Fig. 8) es un método alternativo desarrollado en los últimos años. Se compone de un sensor con una membrana y una luz led verde que lo excita emitiendo fluoresceína. El contacto de la fluoresceína con el oxígeno genera una energía relacionada con la presión parcial de oxígeno, también expresada en mmHg (13). La duración media de la prueba es de 8 minutos. Entre sus ventajas destaca que no requiere calentamiento previo del sensor, ya que directamente calienta la piel a 44 °C. Además, tampoco precisa limpieza adicional de los electrodos ni cambio de membrana. Por lo tanto, este método de medición consume menos tiempo, y además es más sencillo y económico, por lo que resulta más accesible (20,21).
Aunque la pTcPO2 tiene tendencia a registrar valores mayores en comparación con la eTcPO2 (probablemente porque el electrodo Clark consume oxígeno), existe una alta correlación de los valores de TcPO2 obtenidos con ambos métodos. Se ha observado un potencial beneficio de la pTcPO2 frente a la eTcPO2 (20,21).
Independientemente del método utilizado, generalmente la prueba se realiza de forma preoperatoria y posoperatoria, en una habitación a 20 °C, con el paciente en decúbito supino, colocando el electrodo/sensor sobre una superficie plana y esterilizada de tejido sano y viable, fundamentalmente en el dorso del pie (11,12,19,22). Algunos autores describen falta de consenso en la colocación del electrodo/sensor, porque hay estudios publicados que lo sitúan en otras localizaciones, como el tobillo o la pantorrilla, sin que tampoco se haya establecido uniformidad en cuanto a su posición próxima o alejada de la lesión trófica (11,12,17,18).
Aunque generalmente la prueba se realiza en reposo, en los últimos años existen varias publicaciones que analizan la determinación de la TcPO2 con el ejercicio (ExTcPO2). Determinan que esta medición resulta útil para diagnosticar formas latentes de enfermedad arterial periférica y, sobre todo, de isquemia pélvica secundaria a estenosis significativas en arterias hipogástricas (13,19,23).
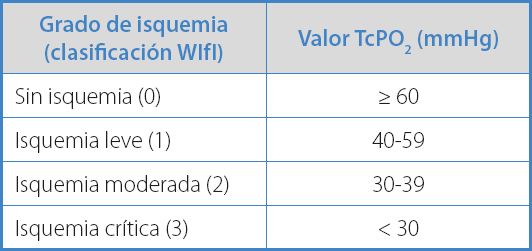
La escala WIfI adjudica un valor determinado de TcPO2 a cada grado de isquemia (14) (Tabla II). Teniendo esta escala en cuenta, las GVG estratifican el riesgo de amputación y consideran que existe dificultad para la cicatrización de la lesión trófica, precisando una revascularización si la TcPO2 es inferior a 30 mmHg. Proponen que puede existir posibilidad de cicatrización de la lesión trófica si la TcPO2 se encuentra entre 30 y 59 mmHg y establecen altas posibilidades de cicatrización de la lesión trófica si la TcPO2 es ≥ 60 mmHg (15). La Guía del IWGDF establece que una TcPO2 ≥ 25 mmHg predice una adecuada cicatrización de la úlcera de pie diabético y recomienda la revascularización en pacientes con úlcera de pie diabético y TcPO2 inferior a 25 mmHg (grado de evidencia 1C) (16). Además, sugiere que la revascularización se considera efectiva cuando la TcPO2 supera los 25 mmHg y aconseja, junto a otros autores, realizar la medición posoperatoria transcurridas al menos de una a tres semanas del procedimiento, ya que argumentan que la presión de oxígeno aumenta progresivamente tras una revascularización exitosa (11,16,17,22,24).
Las ventajas del estudio de la TcPO2 (11,19) incluyen:
– Su medición no es sensible a cambios hemodinámicos.
– La calcificación arterial y la esclerosis de la media no influyen en sus resultados.
– La presencia de amputaciones menores no impide su realización.
Entre las limitaciones, destacan:
– La falta de precisión en presencia de edema o infección (15).
-
– La falta de consenso sobre:
La colocación del electrodo/sensor, ya que se ha descrito que el grosor de la piel puede influir en su resultado (11,12,17,18).
La necesidad de calibración mediante la utilización de una sonda de referencia en otra localización (tórax, brazo o extremidad contralateral), ya que se ha sugerido que el nivel de oxígeno sistémico puede modificar su valor. Así, varios artículos destacan que la posición en declive de la extremidad, la aplicación de hiperemia reactiva o la inhalación de oxígeno suelen mejorar su resultado. Aunque en relación con esto, algunos autores han establecido un índice de perfusión regional, que es el cociente entre la TcPO2 medida en la extremidad afectada y la TcPO2 obtenida en la otra localización. Hoy en día no existe unanimidad en su valor de referencia (11,12,15,21,22).
La diferencia de temperatura alcanzada en el electrodo influye en su resultado cuando se utiliza el método electroquímico (eTcPO2) (12), aunque es cierto que esta limitación se ha solventado al desarrollarse el método fotoóptico (pTcPO2) (12,18).
– La leve o moderada fiabilidad y reproducibilidad por heterogeneidad en los protocolos de medición y en los valores de referencia de los estudios publicados (12,15). Es necesario que exista una estandarización, una homogeneidad y un consenso para que los resultados sean fiables y la prueba sea reproducible, ya que, según se ha comentado previamente, tienen utilidad para establecer decisiones terapéuticas (12,14,16-19).
ANGIOGRAFÍA DE PERFUSIÓN
La angiografía de perfusión es un método de estudio de la perfusión de los miembros inferiores que consiste en un análisis de la imagen cinemática de las angiografías por substracción digital. Se realiza a través de un software altamente sofisticado y específico aplicado en salas híbridas de intervencionismo vascular. Este software mide inicialmente la densidad de contraste en cada píxel de la imagen obtenida para calcular posteriormente el valor medio entre todos los píxeles dentro de una región de interés (en inglés, region of interest: ROI) definida por el usuario. Una vez obtenido dicho valor promedio, lo representa en una gráfica en la que se presenta la variación del tiempo en las abscisas, con la duración de este tiempo también definida por el usuario. Finalmente, con las mediciones del gráfico resultante, obtendremos los parámetros de perfusión (25) (Fig. 9). Estos parámetros, a pesar de que pueden variar ligeramente según la versión del software utilizado, son:
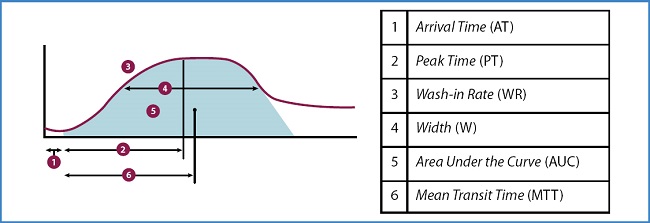
Figura 9. Visualización esquemática de los parámetros de perfusión obtenidos en una angiografía de perfusión.
Arrival Time (AT): es el tiempo transcurrido entre el primer fotograma seleccionado y el fotograma en el que se detecta el contraste. Es el tiempo transcurrido entre el flujo arterial principal y el flujo entrando en el tejido de la ROI.
Peak Time (PT): es el tiempo transcurrido entre el punto de captación de contraste (AT) y el momento en que el contraste tiene la máxima densidad.
Wash-in Rate (WR): es la pendiente de la curva de captación. El WR da una indicación de la velocidad del flujo.
Width (W): la W se mide entre los puntos de inflexión de la curva de entrada y de la curva de salida del contraste. El parámetro W es una alternativa al parámetro de tiempo de tránsito medio, pero no considera ninguna asimetría en la curva de tiempo-densidad.
Area Under the Curve (AUC): es el área bajo la curva entre el AT y el punto en que el contraste ha salido del vaso o el final de la serie angiográfica.
Mean Transit Time: es el tiempo entre el AT y el punto del centro de gravedad en la curva de perfusión. Este parámetro funcional es una indicación del tiempo medio que tarda el contraste en atravesar el tejido.
Estas son las medidas más habituales en la literatura, pero algunas versiones del software ofrecen otros parámetros, como Peak Density, que ha caído en desuso por considerarse especialmente propensa a artefactos de movimiento y estar sujeta a la variabilidad de la composición del tejido, de la anatomía y de la posición del pie (26). Enfatizando el hecho de que un gráfico puede medirse de múltiples formas, se propuso también el parámetro del AUC/segundo para compensar que, a mayor duración de la serie angiográfica, aumentaba la AUC artificialmente, aunque no demostró ninguna correlación clínica (27).
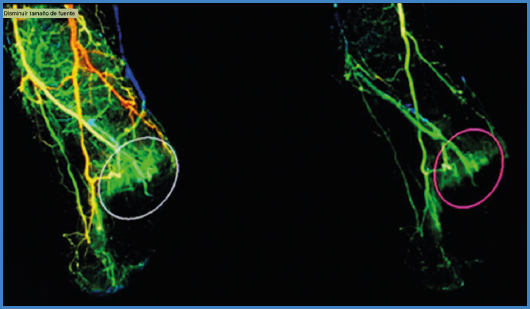
En cuanto al área de estudio preferida, puede haber cierto debate. Mientras que, por un lado, el trazado de la ROI recomendado por algunos grupos excluye el antepié (partiendo de realizar una proyección lateral) (28) y otros grupos comparan el retropié con el antepié (26), por otro lado también se ha considerado que la ROI más fidedigna a la perfusión real del tejido subyacente a una úlcera era el trazado sobre la misma úlcera, tratando de evitar la superposición de tejido no lesionado realizando habitualmente una proyección anteroposterior del pie, dado que las úlceras isquémicas se localizan típicamente en los dedos o en el antepié.
Para finalizar con su descripción, el software de perfusión también realiza una codificación por colores según el tiempo del pico de contraste, o PT, en cada píxel creando una representación de la angiografía con un interés principalmente estético (Fig. 10), aunque puede resultarnos útil para identificar zonas de movimiento en el pie que puedan generar artefactos.
Entre las limitaciones de la exploración ya se han mencionado los artefactos de movimiento. Estos son la principal limitación de la técnica y pueden llegar a invalidar más de un 20 % de las series realizadas en un escenario de práctica clínica diaria (27). En caso de tener que repetir la serie, ello ya supondría una inyección adicional de contraste y dejaría de ser una técnica “no invasiva”. Pequeños movimientos del pie se interpretan como grandes variaciones de contraste que falsean el valor de los parámetros. Ver, en la representación en color de la angiografía, los contornos de la piel o del hueso, o también ver un moteado en la médula ósea, o incluso ver espículas o trazados anómalos en el gráfico de la perfusión, permite detectar artefactos que falsearán los parámetros de la perfusión. Una anestesia raquídea o varias estrategias para inmovilizar el pie pueden resultar útiles para minimizar la posibilidad de movimiento del pie. Con la estrategia de inmovilizar el pie se reportaron en la literatura tasas de artefactos entre el 5 y el 14 % (26). Alternativamente, en el caso de un movimiento localizado a una zona del pie, también puede trazarse la ROI excluyendo una zona, guardando la simetría respecto a referencias anatómicas entre la serie de antes y de después de la revascularización (28).
Entre 2015 y 2017 se publicaron 4 estudios principales (26,28-30) que describían la técnica y su viabilidad y sensibilidad a los cambios hemodinámicos en poblaciones de entre 18 y 89 pacientes. Lamentablemente, la heterogeneidad entre los parámetros utilizados, la versión o el desarrollador del software, así como las diferencias en los protocolos de inyección de contraste (longitud del introductor y densidad y volumen de contraste), no permiten realizar una comparación útil entre los resultados.
La traducción clínica solo se exploró en un estudio de cohortes retrospectivo de 246 pacientes en el que se correlacionaron los parámetros de la perfusión con la curación de las úlceras a 30 días y con la TcPO2. Asimismo, se exploró el efecto hemodinámico de presentar un arco plantar cortado quirúrgicamente (27). Los puntos de corte de los parámetros con mayor capacidad predictiva fueron un AT superior a 6 segundos y una variación del MTT superior a 1,7 segundos (o un MTT superior a 4,1 segundos en la serie posrevascularización), con odds ratio de 2,64 y 3,21, respectivamente (3,19 para MTT superior a 4,1 segundos). El AT también mostró una correlación débil, pero estadísticamente significativa con la TcPO2 (sr = 0,23, p = 0,029). Los parámetros relacionados con la forma del gráfico de perfusión (PT, WS, W y MTT) se relacionaron significativamente con la presencia de un arco plantar incompleto. En este estudio no se valoraron el salvamento de extremidad por una baja prevalencia de amputaciones en la serie (3,4 %) y otros puntos de corte en tiempo de curación resultaron tener menor correlación con los parámetros (medidos en la intervención). No se obtuvieron correlaciones clínicas en pacientes sin úlceras (en grado Rutherford 4).
Los resultados que sugieren que valores más altos de AT y de MTT se traducen en mejores resultados clínicos son sorprendentes debido a que la costumbre hace que se valore solo la angiografía de gran vaso, concretamente vasos mayores a 1 milímetro. Sin embargo, la angiografía de perfusión depende en más de un 90 % de la microcirculación, ya que esta es su proporción en el tejido. Así, se trata de una imagen bidimensional con información tridimensional acerca del tejido. El grosor del tejido explorado es lo que da el sumatorio de la densidad de contraste en cada píxel (que es lo que la técnica mide). Además, en una angiografía de perfusión en el pie, la gran mayoría de los píxeles estudiados ni siquiera están en el trazado de las arterias pedia, plantares o metatarsales.
La angiografía de perfusión tiene su aplicación clínica, pues, en el diagnóstico del estado de la microcirculación. No nos sugiere qué lesiones tratar o el grado de agresividad del tratamiento de revascularización que demanda un paciente en concreto. Para ubicar los conceptos expuestos, proponemos un algoritmo de tratamiento expuesto en la figura 11.
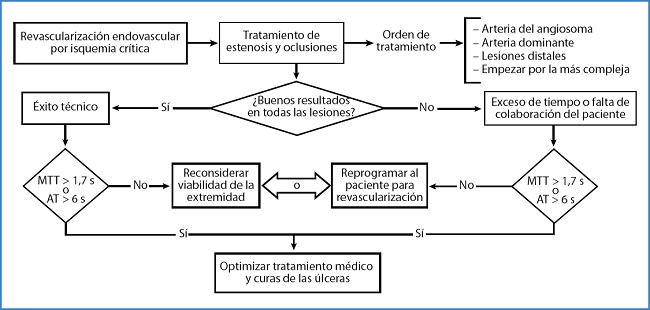
Figura 11. Algoritmo para el uso adecuado de la angiografía de perfusión. MTT: Mean Transit Time; AT: Arrival Time.
Esta técnica diagnóstica nos aporta datos acerca del intercambio de oxígeno y de nutrientes a nivel de los tejidos, aportando información acerca de la densidad capilar y de la rigidez arterial, entre otros factores, de los que depende la microcirculación. Sin embargo, la respuesta capilar no es constante, especialmente cuando se mide tras un tratamiento invasivo que genera vasoespasmo y disfunción endotelial aguda, como también se observó con la administración de tolazolina (un antagonista del receptor α-adrenérgico), que modificaba los parámetros de la perfusión (29). Es decir, también podría verse modificada la perfusión con una anestesia raquídea, el tono simpático y de vasoconstricción, factores que modifiquen el tono del esfínter arteriolocapilar, como el consumo de tabaco, y podría seguirse con un largo etcétera de variables que pueden influir en la perfusión, mucho más allá de lo que pueda observarse a modo de instantánea en la serie angiográfica y que serán mucho más determinantes para la evolución clínica final del paciente.