Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Medicina Intensiva
versão impressa ISSN 0210-5691
Med. Intensiva vol.33 no.7 Out. 2009
PUESTA AL DÍA EN MEDICINA INTENSIVA: DONACIÓN DE ÓRGANOS
Donación tras la muerte cardíaca. Parada cardíaca en el mantenimiento del donante en muerte encefálica
Donation after cardiac death: Cardiac arrest during donor maintenance after brain death
F. del Río-Gallegosa, J.L. Escalante-Cobob, J.R. Núñez-Peñaa, E. Calvo-Manuelc
aCoordinación de Trasplantes, Hospital Clínico San Carlos, Madrid, España
bDirección de Programas de Trasplante, Hospital Gregorio Marañón, Madrid, España
cServicio de Medicina Interna, Hospital Clínico San Carlos, Madrid, España
Dirección para correspondencia
RESUMEN
La muerte encefálica comporta el cese completo e irreversible de las funciones de ambos hemisferios cerebrales y del tronco encefálico. Esto conlleva trastornos fisiopatológicos muy graves que hacen que el mantenimiento del donante sea complejo y el riesgo de deterioro orgánico aumente de forma muy rápida.
El corazón es uno de los órganos diana en este proceso evolutivo de fracaso multiorgánico. Sobre él actúan el propio aturdimiento miocárdico producido por la tormenta catecolamínica y posteriormente la liberación de multitud de mediadores proinflamatorios, radicales oxígeno libres y el desequilibrio hidroelectrolítico secundario a la diabetes insípida e hipotermia. La parada cardíaca en el mantenimiento del donante en muerte encefálica es una situación aún relativamente frecuente.
La carencia de órganos para el trasplante ha llevado a desarrollar programas de donación con criterios expandidos, entre los que se incluye la donación tras la muerte cardíaca o donación a corazón parado.
Palabras clave: Donación tras la muerte cardíaca. Muerte encefálica. Mantenimiento del donante en muerte encefálica. Donante a corazón parado. Donación con criterios expandidos.
ABSTRACT
Brain death implies the complete cessation of activity in both cerebral hemispheres and in the brainstem; this leads to severe physiopathological disorders that make donor maintenance complex and involve the concomitant risk of rapid organ deterioration.
The heart is one of the target organs in this process of multiple organ failure. Myocardial stunning occurs due to a "catecholamine storm" and subsequent release of many proinflammatory mediators, free oxygen radicals, and electrolyte imbalance secondary to insipid diabetes and hypothermia. Cardiac arrest during the maintenance of a donor after brain death is relatively frequent.
The shortage of organs for transplantation has led to the broadening of the criteria for organ donation to include donation after cardiac death or non heart beating donation, among others.
Key words: Donation after cardiac death. Brain death. Maintenance of donors after brain death. Donor with cardiac arrest. Expanded donor criteria.
El donante cadáver de órganos puede serlo bajo los criterios de muerte cardíaca o de muerte encefálica. La muerte por criterios cardíacos comporta la demostración del cese irreversible de la actividad de bomba del corazón, aún a pesar de la correcta aplicación de las medidas de resucitación cardiopulmonar (RCP) avanzada, siempre a más de 32oC y durante, al menos, 30 min. Esta situación está perfectamente recogida en la ley española (Real Decreto 2070/1999)1.
En Maastricht en 1995 se estableció la clasificación de los donantes tras la muerte cardíaca o donantes a corazón parado2 (tabla 1). De acuerdo con esta clasificación, los donantes tipo III y IV se consideran controlados porque su muerte se produce bajo una intensiva vigilancia o incluso se puede prever o intuir el momento en que se va a producir la parada cardiorrespiratoria (PCR). Los tipos I y II se denominan incontrolados porque la muerte sobreviene habitualmente en ausencia de un médico que la presencie, y de una forma súbita o inesperada.
Las características y procedimientos más habituales de cada uno de los tipos de donante tras la muerte cardíaca son los siguientes:
Donante tipo IV
Se corresponde con la parada cardíaca que acontece durante el período de mantenimiento del donante en muerte encefálica.
El riesgo de parada cardíaca tras el enclavamiento es elevado, y deriva de varios factores: 1) trastornos hidroelectrolíticos y acidosis grave secundarios a la poliuria que aparece tras la muerte encefálica; 2) descarga catecolamínica intensa por la propia muerte encefálica; 3) depresión miocárdica grave por la descarga catecolamínica; 4) disminución del umbral de arritmias ventriculares por la hipotermia, y 5) cardiopatía isquémica en relación con la edad del paciente en un sujeto en el que, además, la causa de muerte encefálica suele ser la enfermedad cerebrovascular3-5.
Afortunadamente, la asistolia no es una situación habitual, pero en ocasiones el tiempo necesario para la obtención del asentimiento familiar y el consentimiento judicial se prolonga durante varias horas en una situación de inestabilidad hemodinámica y eléctrica del potencial donante, que propician la aparición de una PCR. En estos casos, es imprescindible disponer de un procedimiento que permita continuar la donación tras la muerte cardíaca.
Hay que diferenciar 2 situaciones distintas en este tipo de donante:
1. Aquélla en que la muerte se produce por parada cardíaca antes de que se alcance el diagnóstico de muerte encefálica. En este caso estamos ante un donante a corazón parado controlado (tipo IV), de acuerdo con la clasificación de Maastricht. Los criterios legales que determinan la muerte son los cardiorrespiratorios. Se trata realmente de una muerte súbita, pues en el momento de aparición de la parada cardíaca el enfermo está clínica y legalmente vivo. La muerte, y por tanto la posibilidad de plantear la donación, se establecerán de acuerdo con el Real Decreto 2070/1999, tras 30 min de maniobras de reanimación infructuosas. A partir de este momento se podrá iniciar el procedimiento que se crea necesario para preservar los órganos, de cara a la donación.
2. El enfermo ya ha alcanzado el estadio de muerte encefálica y posteriormente le sobreviene una parada cardíaca de la que no se recupera. La causa de muerte, en este caso, no será esta última. Las medidas de preservación se establecerán de igual modo que en el donante a corazón parado, pero serán medidas que se inician en un cadáver por criterios de muerte encefálica, y en el que se altera el procedimiento habitual con objeto de no perder la donación de órganos. En el supuesto de no revertir la situación de paro circulatorio, las maniobras de reanimación se consideran una maniobra más de preservación. En este caso no es necesario mantener la RCP durante 30min, pues la muerte clínica y legal ya está bien establecida.
De ambas situaciones, la más habitual es la del paro cardíaco en torno al enclavamiento, pero con la muerte encefálica aún no certificada. Como ya se ha dicho, la descarga adrenérgica y el resto de factores que influyen en la aparición del paro circulatorio durante e inmediatamente después del enclavamiento hacen necesarias una monitorización exhaustiva y una rápida intervención sobre los factores desencadenantes de la parada cardíaca6. La reanimación se debe establecer de acuerdo con los procedimientos de RCP, y en el caso de lograrse la recuperación del pulso se debe continuar con la donación bajo la perspectiva de la muerte encefálica.
Los criterios médicos de inclusión y exclusión como donantes de las personas fallecidas por PCR son los mismos que rigen para los donantes en muerte cerebral. Es necesario, no obstante, tener en cuenta 2 factores. Por una parte, el tiempo de isquemia caliente, esto es, el tiempo que transcurre desde la parada cardíaca hasta el establecimiento de las medidas de preservación de órganos. Por otra parte, el tiempo de preservación del cadáver hasta el inicio de la extracción de órganos, que no es indefinido y que viene determinado fundamentalmente por el tiempo necesario para la obtención del asentimiento familiar y el permiso judicial. El límite para la extracción renal es de 240min, y para la extracción de los pulmones es de 180min. La edad sí es un factor limitante, se excluye a aquellos donantes por encima de 55 años para la donación de hígado o riñones y mayores de 50 años para la donación de pulmones. Hay equipos que elevan el límite de edad a 65 años, pero en nuestra experiencia este límite añade factores de riesgo que, unidos al período de isquemia caliente prolongado, ponen en peligro la viabilidad del órgano que se va a trasplantar.
El inicio de las maniobras de preservación del cadáver exige la solicitud de permiso al Juzgado y la autorización por parte de éste, aunque el Art 10.5 del Real Decreto 2070/1999 señala que si transcurridos 15min desde la solicitud no existe respuesta, podrán iniciarse las maniobras de preservación por considerarse éstas autorizadas.
Están descritos diferentes procedimientos de preservación en estos donantes:
. Mantenimiento de las medidas de reanimación
Es el procedimiento más simple. Consiste en no detener la reanimación y trasladar al potencial donante a quirófano, bajo maniobras de RCP para realizar una extracción rápida de los órganos. En estos casos se debe anticoagular al donante con heparina sódica intravenosa. La posibilidad de utilizar dispositivos mecánicos de cardiocompresión facilita notablemente el traslado interno del donante y el inicio del acto quirúrgico. Una vez en quirófano, se debe realizar una laparotomía media para una rápida canulación aórtica y perfusión con solución fría de preservación de ambos riñones tras pinzamiento aórtico por encima y debajo de los vasos renales. En estos donantes, la preservación de los riñones con este método y la de los pulmones con el método que más adelante se describe en el epígrafe específico de preservación pulmonar son muy eficaces y los resultados del trasplante son excelentes.
La preservación hepática con este procedimiento es más compleja, pues este órgano es mucho más sensible a la isquemia. En el caso de optarse por preservar el hígado también, no se deberá pinzar la aorta por encima y debajo de los vasos renales, sino respetando la circulación mesentérica hepática. Una extracción para trasplante en estas condiciones exige un alto nivel de experiencia por parte del cirujano hepático.
. Perfusión renal con solución de preservación e hipotermia
Algunos grupos utilizan este protocolo como medio de preservación cara a la extracción renal únicamente. Consiste en la colocación, mientras se mantienen las maniobras de RCP y a través de la arteria femoral, de un catéter de doble balón que bloquea el flujo por encima y por debajo de los vasos renales. Este catéter tiene varios orificios de entrada y salida entre ambos balones que permiten extraer la sangre existente en ese territorio y perfundir a través de éste solución de preservación a 4oC (fig. 1). Tras la colocación del catéter se detienen las maniobras de RCP, se mantiene la perfusión hipotérmica con solución de preservación y se realiza la extracción renal. Con este método sólo sería posible la donación de los riñones y, si se establecen las medidas oportunas, la preservación y donación pulmonar. Es necesaria también la anticoagulación con heparina.
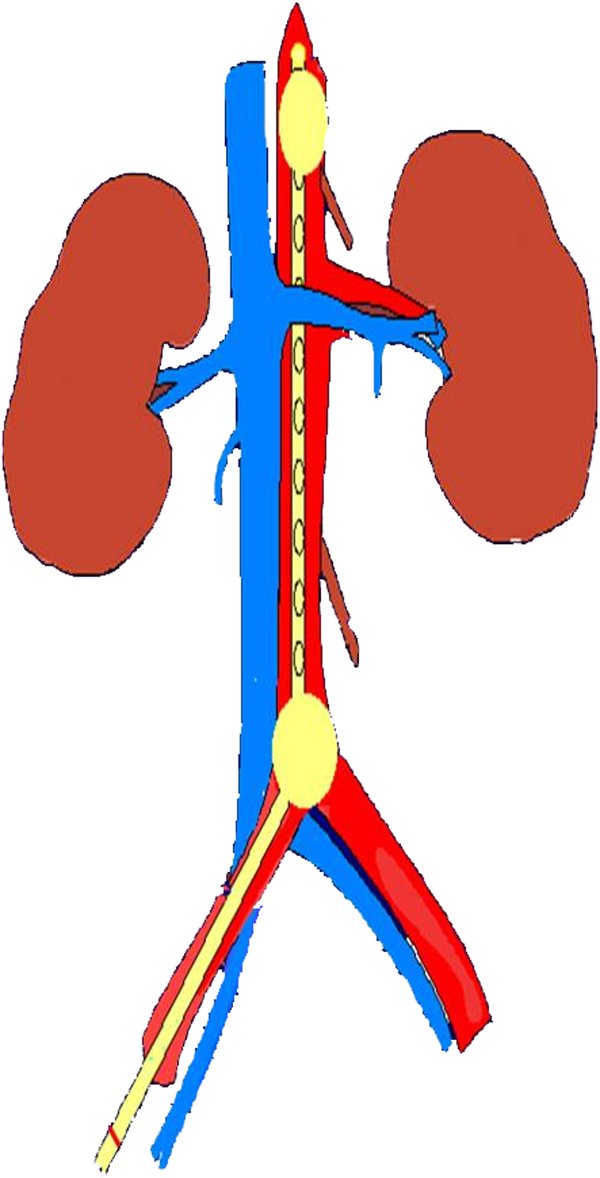
Figura 1. Catéter de doble balón para perfusión renal con solución fría de preservación.
. By-pass femorofemoral con hipotermia y oxigenación de membrana
Éste es, sin duda, el método de elección para la preservación del donante. Se describe con detalle más adelante, en el apartado del donante tipo I.
Donante tipo III
Es una alternativa válida y eficaz en muchos países desarrollados7-9. Se trata de pacientes en situación de gran deterioro neurológico, pero no en muerte encefálica, y dependientes de medidas de soporte vital, a los que se retiran estas medidas con el único objetivo de la donación10,11. El primer protocolo que permitió la puesta en marcha de este tipo de donación es el de la Universidad de Pittsburgh12,13, y a partir de él se han desarrollado la mayoría de los hoy existentes14,15. A grandes rasgos, consiste en solicitar consentimiento a la familia para retirar el soporte vital. Tras presentarse la PCR, se haría posible la donación de órganos.
Varios son los problemas que puede plantear este tipo de donación. En primer lugar, es difícil prever cuánto tiempo va a tardar en producirse la PCR, que se prolonga a veces durante varias horas. Durante este tiempo, el paciente y potencial donante, al que se le han retirado las medidas de soporte vital, atraviesa períodos de hipotensión que pueden afectar a los órganos susceptibles de ser trasplantados. Es necesario establecer medidas terapéuticas no en beneficio del paciente, sino del posible receptor. Entre estas medidas destacan como más habituales la administración de anticoagulantes y vasodilatadores. Es frecuente también la colocación de catéteres de doble balón que aíslan los riñones de la circulación sistémica; a través de éstos, se puede mejorar la viabilidad mediante la perfusión con solución de preservación fría.
El debate ético al que está sometida esta clase de donación es intenso16,17. Por un lado, se limita el esfuerzo terapéutico, no en beneficio del propio paciente, sino con el objetivo final de la donación de órganos. En segundo lugar, para hacer posible la donación es necesaria una intervención terapéutica, farmacológica o invasiva, que tampoco va destinada a aliviar el sufrimiento del paciente, sino a optimizar el trasplante. En tercer lugar, es necesario establecer un tiempo mínimo tras la parada cardíaca que permita afirmar que ésta es irreversible, y excluya definitivamente la autorresucitación. La mayor parte de los procedimientos establecen este período de tiempo en 5 min (rango entre 2 y 10). Por último, aunque es cierto que estos programas de donación tras la muerte cardíaca proporcionan un número importante de donantes, cabe pensar que una parte de ellos, probablemente, serían pacientes que, de haber permitido su evolución natural, habrían alcanzado la situación de muerte encefálica, con lo que el incremento de donaciones reales no es tan alto como inicialmente pudiera parecer.
En España no hay actualmente ningún procedimiento de donación a corazón parado con donantes tipo III. De plantearse un cambio en la actual legislación se podría plantear el surgir de estos programas. Sería necesario un abordaje muy cuidadoso para no interferir con la excelente acogida que los programas de trasplante tienen en España.
Donante tipo II
Se trata de pacientes ingresados en el servicio de urgencias o en la planta del hospital, que presentan una PCR y en los que se valora la donación tras la muerte cardíaca. El procedimiento y los criterios de inclusión son en todo iguales a los que se describen más abajo en el apartado de donante tipo I.
Aún a pesar de tener tiempos de isquemia caliente más cortos, este donante ofrece peores resultados en lo referente a la supervivencia y calidad funcional del órgano trasplantado. Esto está relacionado con el hecho de que el paciente parte de una situación de deterioro orgánico previo.
Donante tipo I
Exige un procedimiento complejo. Es necesaria la presencia de unos servicios de urgencia extrahospitalarios perfectamente dotados y entrenados, un hospital con una infraestructura adecuada y una perfecta coordinación entre ambos. Varias son las razones para considerar a los donantes tipo I como los donantes en asistolia óptimos. En primer lugar, los criterios de selección específicos son muy estrictos, con unos límites de edad que favorecen la calidad de los órganos. En segundo lugar, son personas que hasta el momento de su fallecimiento desarrollan una vida completamente normal. En tercer lugar, son pacientes que no han estado ingresados previamente con el consiguiente riesgo de infección nosocomial. Por último, no atraviesan por la fase de tormenta catecolamínica y denervación con hipotensión que acontecen en la muerte encefálica y que tiene efectos deletéreos sobre diferentes órganos18-24.
En el procedimiento hay 2 fases bien diferenciadas, que deben estar perfectamente coordinadas.
Fase 1: Asistencia extrahospitalaria
Ante un paciente que muere en la calle o en su domicilio y tras la activación de los sistemas de urgencia, la secuencia de acontecimientos es la siguiente:
1. Constatación de la asistolia e inicio de las maniobras de soporte vital avanzado (SVA).
2. Inicio de las maniobras de RCP con objeto de reanimar al paciente.
3. Determinación de la hora de la PCR a partir del testimonio de los testigos.
4. Transcurridos al menos 30min desde el inicio de las maniobras de SVA sin conseguir recuperación de latido eficaz, se realiza valoración del fallecido como potencial donante sobre la base de los criterios de inclusión in situ (tabla 2).
5. Mantenimiento del potencial donante con ventilación mecánica y masaje cardíaco externo durante el traslado al hospital. Hemostasia de las lesiones sangrantes.
6. El equipo de urgencias extrahospitalarias se pone en contacto con el coordinador de trasplantes y realizan una evaluación de acuerdo con los criterios iniciales de inclusión (tabla 2). Tras decidir su viabilidad, se procede a la activación del Código de donación tras la muerte cardíaca.
7. La activación incluye, por parte del servicio de urgencias, la solicitud a la policía de su colaboración en el traslado del cadáver escoltando a la UVI móvil, que permite a ésta mantener una velocidad constante de 40-50km/h hasta su llegada al hospital.
8. Durante el traslado se mantienen la cardiocompresión y la ventilación mecánica. Se traslada sin perfusión de drogas ni fluidos, aunque se conservan las vías canalizadas.
9. Por parte del coordinador de trasplantes, la activación implica su traslado inmediato al hospital y la localización del equipo extractor.
Fase 2: Asistencia hospitalaria
A su llegada a urgencias se mantienen las maniobras de RCP mediante cardiocompresión y ventilación mecánica. El intensivista de guardia firma el certificado de defunción y pasa a hacerse cargo del cadáver el coordinador de trasplantes. Éste reevalúa al donante y decide seguir adelante o no con el proceso de acuerdo con los criterios generales de selección de donantes y los específicos del donante en asistolia. En el caso de posibles donantes cuya causa de muerte sea politraumatismo, se excluirá a todos aquellos en los que el valor de hematocrito sea inferior al 15%.
1. Una vez tomada la decisión de seguir adelante con el proceso, se realizan los siguientes pasos:
. Solicitud por fax al Juzgado de Guardia de permiso para iniciar las maniobras de preservación del cadáver.
. Obtención de muestras para analítica, grupo sanguíneo, Rh y serología.
. Anticoagulación con heparina.
. Localización de la familia (el tiempo límite para localizar a la familia y obtener la autorización para la donación desde que se establecen las medidas de preservación es de 4 h).
2. Traslado del paciente al quirófano para iniciar maniobras de preservación. Éstas deben estar instauradas en menos de 120 min desde que se produjo la PCR.
3. Inicio de maniobras de preservación, by-pass cardiopulmonar con oxigenación externa.
Establecimiento de by-pass femorofemoral de circulación extracorpórea con oxigenación de membrana.
Es, sin duda, el mejor método de preservación en los donantes tras la muerte cardíaca. Gracias a él se ha logrado poner en marcha un programa de donación a corazón parado con donantes incontrolados, que ha acreditado su excelencia y ha igualado e incluso superado los resultados obtenidos con donantes en muerte encefálica. Este protocolo de preservación es común a cualquier tipo de donante, controlado o incontrolado, y se resume en los siguientes apartados:
. Canulación mediante arteriotomía y flebotomía de arteria y vena femorales para conexión con el sistema de circulación extracorpórea con oxigenador de membrana e intercambiador de temperatura.
. Colocación a través de la arteria femoral contralateral de un balón de Fogarty para interrupción de flujo por encima de la altura de la arteria mesentérica superior (fig. 2).
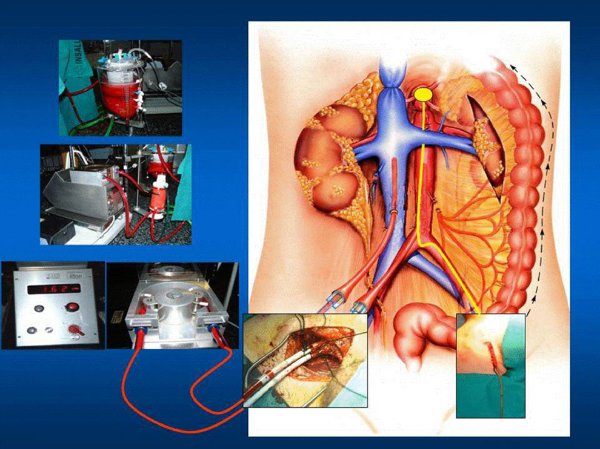
Figura 2. Esquema del procedimiento de establecimiento de by-pass con oxigenación de membrana,
circulación extracorpórea e hipotermia. Se puede apreciar la canulación para establecimiento de
by-pass en la arteria y vena femorales de un lado y la colocación del catéter de Fogarty en la ingle contralateral.
. Con objeto de garantizar la correcta colocación del balón de Fogarty, tras la entrada en by-pass, se realizará placa de tórax al cadáver y se asegurará que éste se encuentre en situación proximal al tronco celíaco; se movilizará en caso de necesidad, para asegurar su correcta ubicación.
. Cebado y premedicación de la bomba de circulación extracorpórea con solución de preservación. Es necesario añadir en el circuito de by-pass heparina sódica en dosis de 1.000U/kg de peso.
. Mantenimiento del cadáver en by-pass extracorpóreo con oxigenación de membrana hasta la extracción de órganos.
. En el caso de considerarse la extracción hepática, la circulación extracorpórea será normotérmica. Sólo es posible realizar la extracción hepática para trasplante bajo esta condición. En la donación de hígado en el donante no controlado tras la muerte cardíaca hay 2 opciones: realizar la extracción hepática y renal, así como la de tejidos, pero no la pulmonar, o establecer 2 circuitos independientes, uno para enfriar el tórax y otro para mantener el abdomen en normotermia. Este procedimiento es técnicamente complejo, aunque posible, y se han realizado varias extracciones multiorgánicas válidas. Es necesario un intercambiador de temperatura de doble circuito, con posibilidad de establecer 2 áreas independientes con diferente temperatura. La comunicación entre ambas quedaría cortada por la presencia de un balón de Fogarty colocado por encima del nivel de la arteria mesentérica superior. Este tipo de procedimiento con bitermia está todavía en fase de desarrollo. Hay que decir que, de acuerdo con la experiencia del grupo del Hospital Clínico, los resultados del trasplante renal cuando la preservación se ha hecho en normotermia son peores que cuando se ha utilizado hipotermia, y presentan una mayor tasa de rechazo, una mayor incidencia de complicaciones trombóticas y una peor función inmediata del injerto. Sin duda, es necesario introducir cambios en el procedimiento de extracción hepática que permitan optimizar el resultado de este trasplante sin alterar los excelentes resultados del trasplante de pulmón y riñón.
. Si se plantea la opción de realizar la extracción hepática, se mantendrá la circulación normotérmica abdominal hasta que se considere el hígado como válido. Se comprobará mediante biopsia la validez del órgano y después se procederá a la perfusión con solución de preservación fría (solución de Wisconsin®, Euro-Collins®), a través de la cánula situada en la arteria femoral con exanguinación simultáneamente a través de la cánula venosa. Estas maniobras se llevarán a cabo por indicación expresa del cirujano hepático, tras la evaluación del hígado y una vez que se haya completado la laparotomía. Este momento se considerará como el inicio del período de isquemia fría. Las maniobras de preservación se suspenderán en las siguientes situaciones:
. Cuando una vez obtenidos todos los permisos se realice la extracción de órganos.
. Cuando no se obtenga el necesario asentimiento familiar y permiso judicial.
. Pasadas 4h de by-pass sin haber completado los requisitos necesarios para iniciar la extracción. Éste es límite de tiempo para realizar la extracción desde el inicio de la circulación extracorpórea.
4. Finalmente, se efectúa la extracción de riñones y, si procede, de hígado/pulmones, así como de tejidos.
Protocolo específico de donación pulmonar
De acuerdo con los trabajos experimentales del Dr. Stig Steen y el buen resultado clínico del trasplante unipulmonar que realizó éste en 200125,26, se inició en el Hospital Clínico San Carlos un estudio clinicoexperimental para valorar la viabilidad de los pulmones dentro del programa de asistolia. Durante 8 meses se estudiaron 30 pulmones, y se evidenció la eficacia del procedimiento tanto desde el punto de vista macroscópico/histológico como funcional. A la vista de los excelentes resultados del estudio previo, se realizó el 25 de noviembre de 2002 el primer trasplante bipulmonar del mundo de estos órganos procedentes de un donante en asistolia27,28. En la actualidad, el programa de trasplante de pulmón con donante a corazón parado ha acreditado completamente su eficacia.
Para considerar la posible donación de pulmón se establecen unos criterios de inclusión específicos (tabla 3).
La preservación pulmonar se realiza acorde al procedimiento siguiente:
. Inicio de la preservación general del cadáver tal y como se describe en el apartado anterior.
. Una vez en quirófano, y tras establecerse el circuito extracorpóreo, se realizará la extracción de 300 cm3 de sangre venosa que se conservarán en una bolsa heparinizada (bolsa habitual de transfusión de sangre).
. Realización de broncoscopia y cese de ventilación y cardiocompresión.
. Colocación de drenajes pleurales anteriores e infusión de solución de preservación (Perfadex®) a 4oC hasta llenado completo de cada cavidad pleural (5-6l por hemitórax) y dejar los drenajes pinzados.
. Se mantiene al potencial donante con los pulmones colapsados y bañados en solución fría de preservación, dentro del tórax, hasta la obtención de los permisos necesarios para la donación (fig. 3).
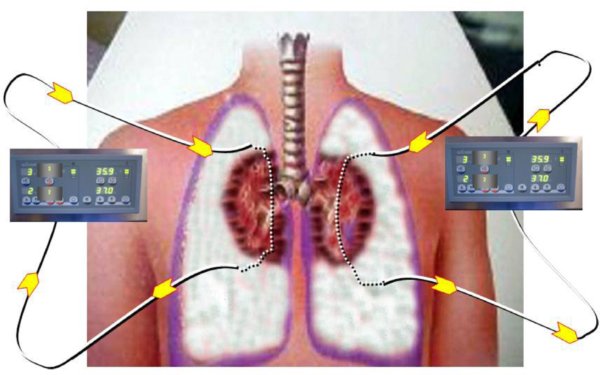
Figura 3. Esquema del circuito de hipotermia para la preservación pulmonar. Se establecen 2 circuitos
completos, uno para cada hemitórax, que mantienen una recirculación hipotérmica (2-4oC),
que conserva los pulmones fríos y colapsados.
Tras el asentimiento familiar y el permiso judicial se procede a la validación funcional de los pulmones. Para ello, se vacían ambos hemitórax de solución de preservación, se reinicia la ventilación mecánica (fracción inspirada de oxígeno [FiO2], positive end expiratory pressure [PEEP]+5cm H2O) y se recircula la sangre del donante previamente preservada desde la arteria pulmonar hacia la aurícula izquierda. Se obtienen muestras gasométricas en arteria y venas pulmonares. Si la diferencia de presión arterial de oxígeno (PaO2) es superior a 300mmHg, se consideran aptos para el trasplante.
El donante a corazón parado permite la donación de riñones, pulmones, hígado y tejidos. La única limitación lógica viene impuesta por la imposibilidad de donar el corazón. La donación simultánea de hígado y pulmones, además de riñones, hace necesario un intercambiador de temperatura de doble circuito, capaz de mantener el tórax en hipotermia, tal y como se describe en el procedimiento expuesto, y el abdomen en normotermia. De no disponerse de este dispositivo capaz para 2 circuitos simultáneos de diferente temperatura, se debe elegir entre donación de riñones y pulmones (todo el procedimiento y la circulación extracorpórea se realizarán a 4oC), o riñones e hígado, en el que todo el procedimiento se realizará en normotermia. La temperatura en cualquiera de los casos se debe monitorizar mediante la colocación de termómetros en esófago, cuando se realice hipotermia o normotermia aisladas, o en esófago y cavidad abdominal (vía femoral) simultáneamente, cuando se realice con bitermia.
Resultados funcionales de órganos trasplantados desde donantes tras la muerte cardíaca
Los resultados funcionales de los órganos trasplantados y procedentes de donantes en asistolia son equiparables o incluso mejores que los de muerte encefálica. Las razones de esto surgen de una cuidadosa selección de los potenciales donantes, del hecho de que se trata de un grupo de donantes más jóvenes y que parten de una situación previa de buena salud y, también, de la eficacia de las medidas de preservación, así como de la experiencia del equipo a cargo del programa.
En lo referente al trasplante renal con donantes incontrolados tras la muerte cardíaca, el grupo del Hospital Clínico de Madrid ha demostrado una supervivencia del injerto mayor en el grupo de donantes en asistolia (incluso determinada por grupos de edad), y la función del órgano a largo plazo medida a través del nivel de creatinina sérica y de proteinuria (fig. 4, fig. 5)19,23. La incidencia de complicaciones entre los órganos procedentes de asistolia y muerte encefálica no presenta diferencias significativas. Sí está presente un período más prolongado de retraso en la función inicial del injerto (RFI), derivado de la intensa necrosis tubular aguda que acompaña al período de isquemia caliente. Este RFI es secundario a la necrosis tubular aguda producida por la isquemia caliente prolongada, es reversible y no tiene valor pronóstico, como en la muerte encefálica, de cara a la supervivencia y función del órgano trasplantado.
Figura 4. Resultados de la supervivencia del injerto renal, que comparan órganos procedentes de donantes
en muerte encefálica y asistolia tipo I. Podemos apreciar una mayor supervivencia en los de corazón parado a los 5 años.
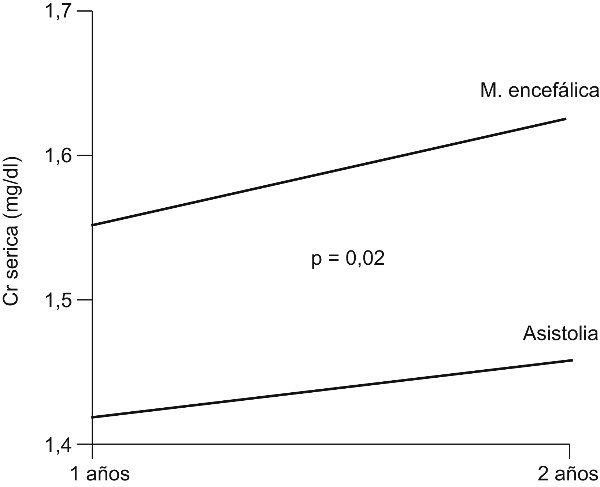
Figura 5. Función del injerto renal de donante incontrolado tras la muerte cardíaca comparada
con riñones procedentes de muerte encefálica.
La introducción de máquinas de preservación con flujo pulsátil e hipotermia de forma habitual en el trasplante de riñones con donantes a corazón parado tipo I ha permitido mejorar los resultados de este tipo de trasplante. Al comparar la duración del RFI, así como la presencia de complicaciones, la estancia media hospitalaria, el número de sesiones de hemodiálisis postrasplante y los niveles de creatinina sérica en los primeros 90 días tras el trasplante, el grupo de riñones preservados con máquina ofrece mejores resultados que el grupo de riñones preservados con hipotermia aislada.
Los resultados del trasplante de pulmón son también excelentes. Hasta ahora se han realizado 21 trasplantes bipulmonares y 10 unipulmonares. La mortalidad es equiparable a la de la donación en muerte encefálica, la tasa de complicaciones infecciosas postrasplante es inferior a la tasa del trasplante en muerte encefálica, y el rechazo precoz es comparable de forma global e inferior a largo plazo (fig. 6, fig. 7). La calidad funcional de los pacientes trasplantados es excelente.
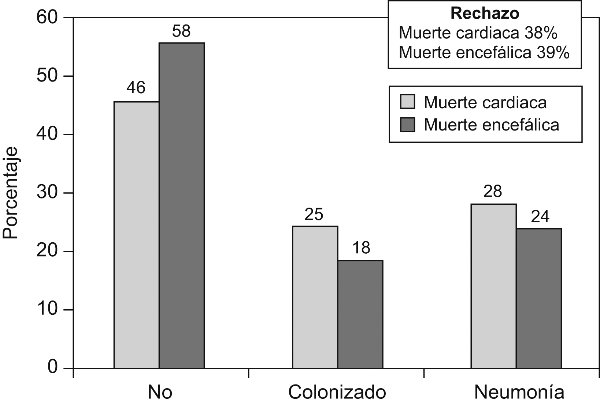
Figura 6. Tasa de infección y rechazo en el postoperatorio inmediato del trasplante de pulmón en
donantes tras la muerte cardíaca y en muerte encefálica.
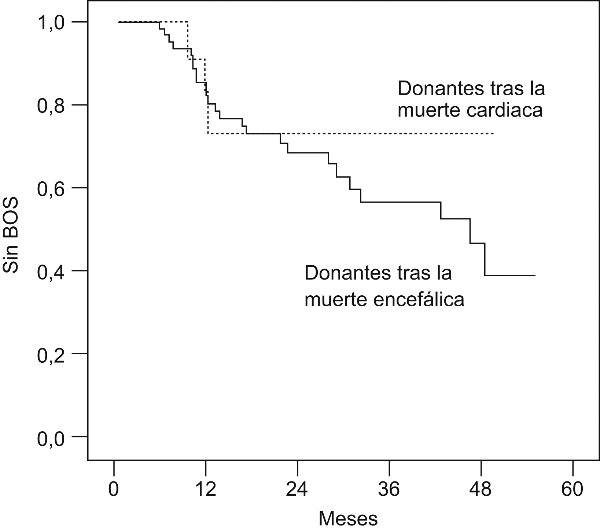
Figura 7. Tasa de pacientes libres de bronquiolits obliterante tras el trasplante de pulmón desde
donantes en muerte encefálica (amarillo) y corazón parado (verde) a los 5 años del implante.
En cuanto al trasplante hepático con donantes incontrolados a corazón parado, grupos como el del Hospital 12 de Octubre de Madrid y el Clinic de Barcelona están obteniendo buenos resultados, aunque con una tasa de mal función primaria del injerto superior a la de la muerte encefálica. En países donde hay en vigor programas de donación a corazón parado (DCP) tipo III se están reportando muy buenos resultados procedentes de este tipo de donación29-34.
Conclusiones
La puesta en marcha de programas de donación tras la muerte cardíaca es, sin duda, rentable desde el punto de vista de obtención de órganos válidos para el trasplante35. Estos programas alcanzarían su máxima efectividad en ciudades con una población de al menos 500.000 habitantes, que contasen con un servicio de urgencias extrahospitalario coordinado con el hospital y con recursos humanos y materiales suficientes. Es de especial importancia centralizar este programa en un número limitado de centros, pues sin duda la experiencia de los equipos y su buena coordinación interna, en gran parte derivada de la experiencia, son bazas fundamentales cara al éxito.
A la vista de los resultados del programa de donación tras la muerte cardíaca de Madrid, cabría preguntarse si se trata realmente de un grupo de donantes marginales o con criterios expandidos, máxime cuando la donación de muerte encefálica hoy en día proviene cada vez más de donantes por encima de los 70 años, que mueren por causas de origen cardiovascular. Los resultados del trasplante renal y pulmonar son excelentes y comparables a los obtenidos con donantes en muerte encefálica36. Los resultados del trasplante hepático con donantes tras la muerte cardíaca tipos III y IV son también muy buenos, y con tipos I y II, aunque la experiencia es aún corta son cuando menos prometedores.
Bibliografía
1. Real Decreto 2070/1999, del 30 de diciembre, por el que se regulan las actividades de obtención y utilización clínica de órganos humanos y la coordinación territorial en materia de donación y trasplante de órganos y tejidos. BOE de 1 de enero de 2000. [ Links ]
2. Kootstra G., Daemen J.H.C., Oomen A.P.A. Categories of non-heartbeating donors. Transpl Proc. 1995; 27:2893-4. [ Links ]
3. Bittner H.B., Kendall S.W., Chen E.P., Davis R.D., Van Trigt III P. Myocardial performance after graft preservation and subsequent cardiac transplantation from brain - dead donors. Ann Thorac Surg. 1995; 60:47-54. [ Links ]
4. Shivalkar B., Vam Loon J., Wieland W., Tjandra-Maga T.B., Borgers M., Plets Ch., et-al. Variable effects of explosive or gradual increase of intracranial pressure on myocardial structure and function. Circulation. 1993; 87:230-9. [ Links ]
5. Cheung M.M., Redington A.M. Assesment of myocardial ventricular function in donor hearts: Is isovolemic acceleration measured by tissue doppler the Holy Grail?. J Heart Lung Transplant. 2004; 23:S253-6. [ Links ]
6. Adrie C., Haouache H., Saleh M., Memain N., Laurent I., Thuong M., et-al. An underrecognized source of organ donors: Patients with brain death after successfully resuscitated cardiac arrest. Intensive Care Med. 2008; 34:132-7. [ Links ]
7. DuBois J.M., DeVita M. Donation after cardiac death in the United States: How to move forward. Crit Care Med. 2006; 34:3045-7. [ Links ]
8. Bernat J.L., D'Alessandro A.M., Port F.K., Bleck T.P., Heard S.O., Medina J., et-al. Report of a national conference on donation after cardiac death. Am J Transplant. 2006; 6:281-91. [ Links ]
9. Rady M.Y., Verheijde J.L., McGregor J. Organ donation after circulatory death: The forgotten donor?. Crit Care. 2006; 10:166. [ Links ]
10. O'Connor K., Delmonico F.L. Donation after cardiac death and the science of organ donation. Clin Transpl. 2005; 2:229-34. [ Links ]
11. Steinbrook R. Organ donation after cardiac death. N Engl J Med. 2007; 357:209-13. [ Links ]
12. Edwards J.M., Hasz Rd., Robertson V.M. Non-heart-beating organ donation: Process and review. AACN Clin Issues. 1999; 10:293-300. [ Links ]
13. Anonymous. University of Pittsburgh Medical Center Policy and Procedure Manual. Kennedy Inst Ethics J. 1993; 3:A1-A15. [ Links ]
14. Pomfret E.A., Sung R.S., Allan J., Kinkhabwala M., Melancon J.K., Roberts J.P. Solving the organ shortage crisis: The 7th annual American Society of Transplant Surgeons' State-of-the-Art Winter Symposium. Am J Transplant. 2008; 8:745-52. [ Links ]
15. Sung R.S., Galloway J., Tuttle-Newhall J.E., Mone T., Laeng R., Freise C.E., et-al. Organ donation and utilization in the United States, 1997-2006. Am J Transplant. 2008; 8:922-34. [ Links ]
16. Lock M. Recommendations for non-heart-beating donation. A position paper by the Ethics Committee, American College of Critical Care Medicine, Society of Critical Care Medicine. Crit Care Med. 2001; 29:1826-31. [ Links ]
17. Daar A.S. Non-heart-beating donation: Ten evidence-based ethical recommendations. Transplant Proc. 2004; 36:1885-7. [ Links ]
18. Del Rio F., Núñez Peña J.R., Soria García , Moreno Roy M.A., Varela A., Calatayud J. Non heart beating donors. Successfully expanding the donor's pool. Ann Transp. 2004; 9:19-20. [ Links ]
19. Sánchez Fructuoso A.I., Marques M., Del Rio F., Núñez J.R., Barrientos A. Victims of cardiac arrest occurring outside the hospital: A source of transplantable kidneys. Ann Intern Med. 2006; 145:157-64. [ Links ]
20. Del Río F, Núñez Peña JR. La donación a corazón parado. En: Rafael Matesanz, editor. El modelo español de donación y trasplante de órganos y células. Cap 8. Madrid: Ministerio de Sanidad y Consumo; 2008. [ Links ]
21. Álvarez J., Del Barrio R., Arias-Díaz J., Vázquez S., Sánchez A., Iglesias J., et-al. Non-heart-beating-donors: Estimated actual potential. Transplant Proc. 2001; 33:1101-3. [ Links ]
22. Álvarez J., Del Barrio R., Arias J., Cuesta C., Crespo P., Bilbao J., et-al. Non heart-beating donors and emergency health care systems. Transplant Proc. 1999; 31:2215-6. [ Links ]
23. Álvarez J., Iglesias J., Pulido O., Maldonado L., San Juan G., Sánchez P., et-al. Type I non-heart-beating donors: Policy and results. Transplant Proc. 1997; 29:3552. [ Links ]
24. Weber M., Dindo D., Demartines M. Transplantation from donors without a heartbeat. N Engl J Med. 2002; 347:248-55. [ Links ]
25. Steen S., Sjoberg T., Pierre L., Liao Q., Eriksson L., Algotsson L. Transplantation of lungs from a non heart beating donor. Lancet. 2001; 357:825-9. [ Links ]
26. Steen S., Ingemansson R., Algimantas B., Bolys R., Roscher R., Sjoberg T. Successful transplantation of lungs topically cooled in the non- heart-beating donor for 6h. Ann Thorac Surg. 1997; 63:345-51. [ Links ]
27. Núñez J.R., Varela A., Del Rio F. Bipulmonary transplant with lungs obtained from two non heart beating donors died out of the hospital. J Thorac Cardiovasc Surg. 2004; 127:297-9. [ Links ]
28. Gómez de Antonio D., Marcos R., Laporta R., Usetti P., Moradiellos J., Calatayud J., et-al. Results of clinical lung transplant from uncontrolled non heart beating donors. J Heart Lung Transplant. 2007; 26:270-6. [ Links ]
29. White S.A., Prasad K.R. Liver transplantation from non heart beating donors. A promising way to increase the supply of organs. BMJ. 2006; 332:376-7. [ Links ]
30. Walia A., Schumann R. The evolution of liver transplantation practices. Curr Opin Organ Transplant. 2008; 13:275-9. [ Links ]
31. Fung J.J., Eghtesad B., Patel-Tom K. Using livers from donation after cardiac death donors: A proposal to protect the true Achilles heel. Liver Transpl. 2007; 13:1633-6. [ Links ]
32. Fondevila C., Hessheimer A.J., Ruiz A., Calatayud D., Ferrer J., Charco R., et-al. Liver transplant using donors after unexpected cardiac death: Novel preservation protocol and acceptance criteria. Am J Transplant. 2007; 7:1849-55. [ Links ]
33. Lee KW, Simpkins CE, Montgomery RA, Locke JE, Segev DL, Maley WR. Factors affecting graft survival after liver transplantation from donation after cardiac death donors. Transplantation. 2006;82:1683-8. [ Links ]
34. Otero-Raviña F., Rodríguez-Martínez M., Sellés C.F., Gutiérrez M.G., Blanco M.D., De Rituerto S.T., et-al. Analysis of survival after liver transplantation in Galicia, Spain. Transplant Proc. 2005; 37:3913-5. [ Links ]
35. Cuende N., Cuende J.I., Fajardo J., Huet J., Alonso M. Effect of population aging on the international organ donation rates and the effectiveness of the donation process. Am J Transplant. 2007; 7:1526-35. [ Links ]
36. Del Rio F., Escudero D., De la Calle B., Gordo-Vidal F., Nuñez J.R. Evaluación y mantenimiento del donante pulmonar. Med Intensiva. 2009; 33:40-9. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
frio.hcsc@salud.madrid.org
jrio@pdi.ucm.es
(F. del Río-Gallegos)
Recibido: 17 Diciembre 2008
Aceptado: 20 Diciembre 2008














