INTRODUCCIÓN
La OMS define una reacción adversa a medicamento como una respuesta nociva y no intencionada, que se produce a dosis normalmente utilizadas en seres humanos para profilaxis, diagnóstico o tratamiento de una enfermedad o para modificar una función fisiológica1. Entre su clasificación de la A – F, las reacciones de tipo B, establece que no son predecibles por el mecanismo de acción del fármaco y dependen de la susceptibilidad del paciente; estas reacciones pueden ser de causa inmunológica o no inmunológicas1.
Esta susceptibilidad individual de cada paciente determina tanto la severidad de las reacciones adversas (desde las leves y autolimitadas hasta las más severas) así como los órganos que se encuentren afectados (ya sea en forma individual o en un conjunto).
Hablando específicamente de la piel, las reacciones adversas cutáneas severas inducidas por medicamentos conforman un conjunto de enfermedades de la piel que se presentan posterior a la administración a determinados medicamentos, estas incluyen reacciones de necrosis de la epidermis, mucosas y anexos cutáneos con ocasional afección sistémica.
El desconocimiento y la baja incidencia poblacional de estas enfermedades hace que se consideren enfermedades muy raras y son poco estudiadas y reportadas. Es por esto que se considera importante identificar los medicamentos inductores a reacciones adversas cutáneas severas de los casos que se han reportado en Iberoamérica. El objetivo de este estudio es brindar una actualización a partir de una recopilación de datos para identificar los medicamentos que con mayor frecuencia causan estas reacciones que permitan relacionar los cuadros clínicos a los fármacos sospechosos.
DEFINICIÓN Y FISIOPATOLOGÍA
Las reacciones adversas cutáneas severas, por sus siglas en inglés (SCARs) son reacciones complejas donde las células del sistema inmune adaptativo (linfocito T) y otras células del sistema inmune innato (células natural killer, células linfoides innatas, monocitos, macrófagos y células dendríticas) participan en la patogenia de los cuadros clínicos. Además de esto, células propias de tejidos específicos como los queratinocitos de la piel pueden contribuir a la fisiopatogenia al secretar quimocinas u otros mediadores inflamatorios. Todo esto junto con los factores genéticos que se detallaran más adelante es responsable de las diferentes variedades clínicas de las reacciones severas cutáneas a drogas2. Específicamente las reacciones adversas cutáneas severas son reacciones tipo IV de hipersensibilidad tardía en la clasificación de Gell and Coombs3 en las cuales linfocitos T fármaco-específicos pueden identificarse en la sangre periférica o infiltrados cutáneos. La variación de las condiciones clínicas de las reacciones adversas cutáneas severas ha llevado a que estas reacciones de tipo IV sean subclasificadas de acuerdo con los diferentes patrones de producción de citocinas a cargo de los linfocitos T. Esto conlleva a distintos patrones de inflamación y daño tisular, que tienen como resultado los hallazgos físicos diversos que se observan en cada fenotipo clínico que presentan estas reacciones adversas cutáneas severas.
De esta forma las reacciones de hipersensibilidad tardía o tipo IV se subclasifican en: reacciones IVa con activación de linfocitos Th1 que conlleva a la participación de monocitos y liberación de interferón gamma (IFN-ϒ). Reacciones IVb con activación de linfocitos Th2, con producción de interleucina (IL) IL-4, IL-13 e IL-5 que conlleva a eosinofilia característica de las reacciones a drogas. Reacciones IVc donde los linfocitos citotóxicos son los agentes principales de daño tisular y por último reacciones IVd donde los linfocitos T por medio de la IL-8 promueven la quimiotaxis de neutrófilos.
Tradicionalmente se considera al síndrome de hipersensibilidad a medicamentos con eosinofilia y síntomas sistémicos (DRESS) una reacción IVb, el síndrome de Stevens Johnson/necrólisis epidérmica toxica (SSJ/NET) una reacción IVc y la pustulosis exantematosa aguda generalizada (PEAG) una reacción IVd. Aunque esta clasificación pueda ayudar a entender las reacciones adversas a drogas mediadas por los linfocitos T, en ocasiones hay síndromes con traslapes, además que estas reacciones no siempre son mutualmente excluyentes (figuras 1 y 2).
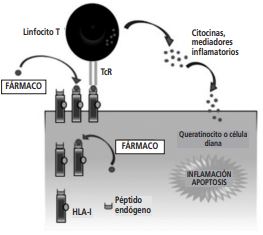
Figura 1. Modelo propuesto para la inmunopatogénesis de las reacciones adversas cutáneas severas. Linfocitos T fármaco-específicos liberan proteínas citolíticas y otros mediadores de la inflamación. HLA antígeno leucocitario humano, TcR receptor de linfocito T.
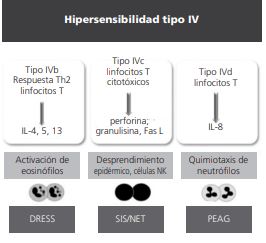
Figura 2. Una revisión de la clasificación de Gell and Coombs se ha propuesto, de acuerdo a las células efectoras y a los perfiles de citocinas involucrados. DRESS reacción a drogas con eosinofilia y síntomas sistémicos, IL interleucina, NET necrólisis epidérmica toxica, NK natural killer, PEAG pustulosis exantematosa aguda generalizada, SJS síndrome de Stevens Johnson.
En la actualidad estas reacciones se basan en reportes de casos y en estudios retrospectivos, ya que existen pocos datos epidemiológicos de su prevalencia. Se estima que un 10-15% de los pacientes medicados desarrollan reacciones cutáneas severas inducidas por medicamentos, representan el 3,5% de las causas de ingreso en Europa, y en Estados Unidos se calculan 197.000 muertes anuales a causa de ellas4. En este conjunto de reacciones se encuentran: la necrólisis epidérmica tóxica (NET), el síndrome de Stevens Johnson (SSJ), el síndrome de hipersensibilidad a medicamentos con eosinofilia y síntomas sistémicos (DRESS) y la pustulosis exantemática aguda generalizada (PEAG).
PUSTULOSIS EXANTEMATOSA AGUDA GENERALIZADA
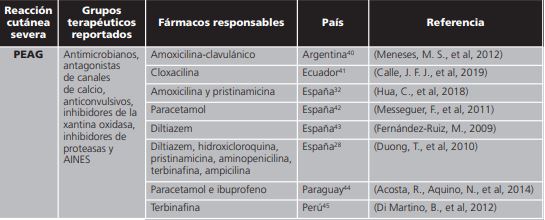
La pustulosis exantematosa aguda generalizada (PEAG o AGEP por sus siglas en inglés) se caracteriza por la aparición aguda de pústulas estériles de distribución no folicular en una base de piel eritematosa, acompañado de fiebre y neutrofilia5, de inicio rápido y resolución espontanea después de 2 semanas de la suspensión del medicamento, es de las reacciones adversas cutáneas severas menos frecuentes: menos de 10 casos por millón de habitantes por año6. De la misma manera presenta una mortalidad más baja que las otras reacciones que se estudian; el estudio internacional EuroSCAR estimó una tasa de mortalidad de aproximadamente 4%7 (figura 3).
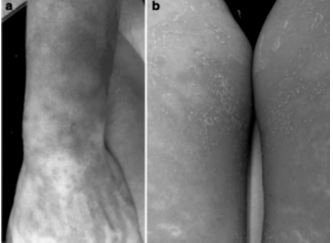
Figura 3. Pustulosis exantematosa aguda generalizada inducida por hidroxicloroquina. a) Eritema macular previo a la formación de lesiones pustulares en antebrazo izquierdo. b) Pústulas diseminadas no foliculares y superficiales sobre una piel eritematosa en los muslos8.
REACCIÓN A DROGAS CON EOSINOFILIA Y SÍNTOMAS SISTÉMICOS (DRUG REACTION WITH EOSINOPHILIA AND SYSTEMIC SYMPTOMS, DRESS)
El DRESS se caracteriza por la tríada de: rash cutáneo polimorfo, alteraciones hematológicas como eosinofilia y linfocitosis atípica periférica, e involucro de órganos internos9. Se trata de una reacción adversa cutánea severa que puede tener un inicio tardío (hasta 8 semanas) no siendo raro que tenga una evolución prolongada con recaídas frecuentes. Si bien la participación del herpes virus 6 como parte de su etiología, se considera que el 80% de los casos de DRESS sean secundarios a fármacos10. La incidencia exacta es difícil de calcular debido a la presentación tan variable que este síndrome puede presentar, estudios japoneses describen la incidencia en 10 casos por millón por año11, sin embargo la frecuencia podría estar aumentando a medida que nuevas formas más leves de la enfermedad están en estudio12. Análisis retrospectivos han reportado como las principales causas de muerte la falla multiorgánica, shock séptico o cardiogénico con tasas de mortalidad de 5-10%13 (figura 4).
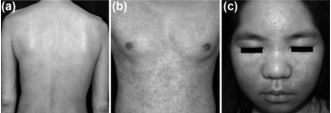
Figura 4. Presentaciones cutáneas del síndrome de reacción a drogas con eosinofilia y síntomas sistémicos. a) Pápulas y placas purpúricas diseminadas en tronco y miembros superiores. b) Lesiones infiltrativas en tronco. c) Edema facial respetando región periorbitaria14.
SÍNDROME DE STEVENS-JOHNSON/NECRÓLISIS EPIDÉRMICA TÓXICA (SSJ/NET)
Las manifestaciones típicas del SSJ/NET son característicamente el desprendimiento epidérmico simulando quemadura cutánea, esto se acompaña de daño de las mucosas, siendo la mucosa conjuntival y oral las más frecuentemente afectadas. Los órganos internos pueden estar afectados pero de menor manera que el DRESS15. Aunque la reacción a drogas es la causa etiológica más frecuente16, otros factores etiológicos son responsables del 15% de los casos. Casos idiopáticos de SSJ/NET son más comunes en los niños, y solo una pequeña facción están atribuidos a agentes infecciosos como Mycoplasma pneumoniae 17. La incidencia es variable dependiendo de la población afectada: ha sido descrita en 1,53 a 1,89 casos por millón por año en Alemania7, siendo más elevada en descendientes asiáticos18. Como dato importante se describe una incidencia 100 veces mayor en pacientes VIH (+)19. Las tasas de mortalidad se relacionan directamente al porcentaje de superficie corporal afectado. El grupo de investigación de RegiSCAR, responsable de la documentación y de la creación de criterios diagnósticos de las reacciones adversas cutáneas severas, ha descrito frecuencias de 12%, 29% y 46% para el SSJ, traslape SSJ/NET y NET respectivamente20. En adición, los pacientes que sobreviven al síndrome SSJ/NET presentan riesgo aumentado de tener secuelas incluyendo cicatrices cutáneas, complicaciones pulmonares, genitourinarias y dentales y de mayor importancia y con frecuencia lesiones oculares residuales. La mayoría de estas secuelas tienen un impacto considerable en la calidad de vida del paciente, y vuelven al SSJ/NET una condición crónica21 (figura 5).
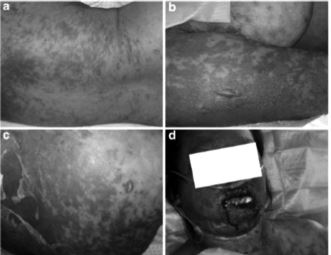
Figura 5.. Presentación clínica del SJS/NET. a) Lesiones maculares purpúricas en el tronco. b) Formación de ampollas sobre base de piel purpúrica. c) Desprendimiento de piel extenso. d) Afección de mucosa oral8.
La incidencia aproximada de NET es de 0,4 a 1,2 casos por millón de personas al año y la del SSJ entre 1 a 6 casos por millón de personas al año22. Se desconoce la incidencia global del síndrome de DRESS, pero se calcula que aparece en 1/1.000 a 1/10.000 pacientes que toman anticonvulsivantes y/o sulfonamidas22. El síndrome de PEAG tiene una incidencia de 1 a 5 casos/millón al año23.
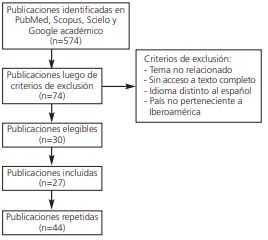
Se realizó un estudio retrospectivo, no experimental con el objetivo de identificar los medicamentos inductores a reacciones adversas cutáneas severas que se han reportado hasta el año 2020 en países de Iberoamérica, e identificar los medicamentos que se asocian por cada síndrome (SSJ-NET, DRESS and PEAG) a través de una revisión sistemática de la literatura médica relacionada y expuesta en la base de datos PubMed, Scopus, Scielo y Google académico, limitando la búsqueda a artículos publicados en español y sin límites de tiempo. Entre las limitaciones del estudio puede mencionarse la infra notificación de estas reacciones adversas, ya que no existen reportes de todos los países de esta región.
MÉTODOS
Se realizó un estudio retrospectivo, no experimental con el objetivo de identificar los medicamentos inductores a reacciones adversas cutáneas severas que se han reportado hasta el año 2020 en países de Iberoamérica, y su asociación por cada tipo de reacción adversa cutánea severa a drogas (SSJ-NET, DRESS and PEAG). Se realizó una revisión sistemática de la literatura médica relacionada a los medicamentos inductores de reacciones adversas cutáneas severas en Iberoamérica, expuesta en la base de datos PubMed, Scopus, Scielo y Google académico, limitando la búsqueda a artículos publicados en español y sin límites de fecha de publicación, utilizando los siguientes términos: toxicodermias severas, reacción grave medicamentosa por SSJNET, DRESS y PEAG. Se excluyeron los casos de reacciones adversas cutáneas severas en las que no se especificó asociación secundaria a medicamentos, publicaciones sin acceso a texto completo, de países no pertenecientes a Iberoamérica o realizadas en un idioma distinto al español. Los artículos se revisaron independientemente por los investigadores, incluyendo 27 de 574 publicaciones que identificaron los medicamentos inductores a reacciones cutáneas severas. Se incluyeron publicaciones originarias de Argentina, Costa Rica, Guatemala, México, Paraguay, Ecuador, Perú y España (figura 6).
RESULTADOS
Tabla 1. Distribución de medicamentos inductores a síndrome de Steven Johnson y necrosis epidérmica tóxica reportados en países de Iberoamérica.
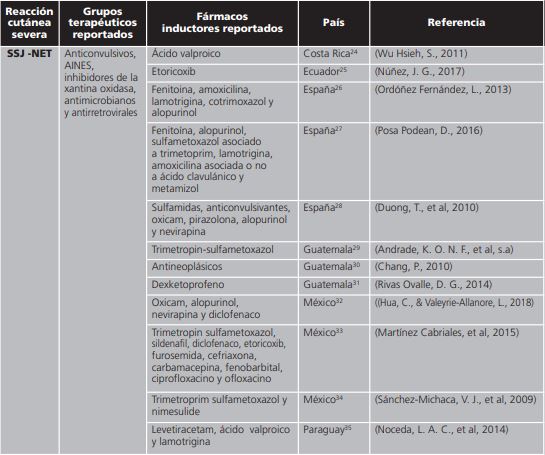
NET: necrólisis epidérmica tóxica; SSJ: síndrome de Stevens Johnson.
Tabla 2. Distribución de medicamentos inductores a síndrome de hipersensibilidad a medicamentos con eosinofilia y síntomas sistémicos reportados en países de Iberoamérica.
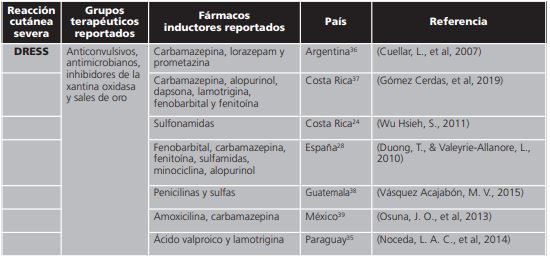
DRESS: síndrome de hipersensibilidad a medicamentos con eosinofilia y síntomas sistémicos.
DISCUSIÓN
De 574 publicaciones identificadas, 27 cumplieron con los criterios de inclusión (figura 2), incluyendo publicaciones provenientes de Argentina (2), Costa Rica (3), Ecuador (2), España (8), Guatemala (4), México (4), Paraguay (3) y Perú (1).
En esta revisión se determinó que la etiopatogenia de las reacciones adversas cutáneas severas incluyó una amplia variedad de medicamentos en su mayoría pertenecientes a los grupos terapéuticos: anticonvulsivos, AINES, inhibidores de la xantina oxidasa, antimicrobianos, antirretrovirales, algunos en asociación farmacológica; todas ellas con un pronóstico entre grave y mortal.
En cuanto a la mortalidad por fármacos, datos recientes indican un aumento en la última década, las tasas de mortalidad por fármacos procedentes de dos metaanálisis indican una prevalencia entre 0,32-5% (IC 95%)46,47. Los datos existentes para la mortalidad debida a fármacos son aún imprecisos por lo que se requieren estudios más amplios y específicos sobre el tema dada su trascendencia en clínica.
De acuerdo con la revisión de medicamentos inductores del síndrome de StevensJohnson y necrólisis epidérmica tóxica destacaron los reportes de fenitoína, sulfas y alopurinol. El síndrome de Stevens-Johnson y la necrólisis epidérmica tóxica son clínicamente similares, los cambios afectan <10% de la superficie corporal en el SSJ y >30% en NET; cuando se ve compromiso del 15 al 30% de la superficie corporal, se clasifica como un traslape entre ambas entidades (SSJ-NET)48, por esta razón fueron analizados en la misma clasificación. Se encontró un reporte atribuido a drogas antineoplásicas únicamente en Guatemala. Los grupos de medicamentos asociados a las reacciones adversas cutáneas severas fueron similares en todos los países en los que se identificó la relación: agente causal-cuadro clínico. Es por eso que se encuentra una similitud en los fármacos relacionados a SJS/NET, DRESS y PEAG entre todos los países que se incluyeron en la investigación.
La gran variabilidad de medicamentos y grupos terapéuticos encontrados en la presente revisión no mostró ninguna tendencia por medicamento o país. Estudios de farmacogenética ha demostrado que existen grupos poblacionales en los que algunas variantes alélicas se expresan con mayor frecuencia que en otras y esto puede incidir de forma directa en la respuesta a los medicamentos cuando estas variantes están implicadas en procesos bioquímicos farmacocinéticos49.
En cuanto a las reacciones de hipersensibilidad asociadas a fármacos, es un claro y conocido ejemplo la relación existente entre la expresión de alelos del gen HLA y el desarrollo de algunas reacciones adversas cutáneas severas, tales como la variante HLA-B*1502 que se asocia al desarrollo de SJS o NET inducido por anticonvulsivantes (carbamazepina o fenitoína), HLA-B*5801 asociado al desarrollo de SJS o NET inducido por alopurinol y HLA-B*5701 asociado a reacción de hipersensibilidad por abacavir50. Existe además evidencia que este riesgo aumenta al existir más de un gen implicado, por ejemplo, el riesgo de desarrollar SJS o NET inducido por fenitoína aumenta en pacientes que son portadores de variantes alélicas de CYP2C9 y HLA-B*1502 a la vez51.
Este comportamiento se ha evidenciado en ciertos grupos poblacionales que pueden definirse como grupos vulnerables, al presentar mayor frecuencia de ciertas variantes alélicas asociadas a reacciones adversas a fármacos. Tal es el caso del alelo HLA-B*1502, que se ha reportado específicamente en ancestros chinos Han asiáticos y se ha atribuido a esto la explicación del alto riesgo de esta población a desarrollar SSJ/NET inducida por carbamazepina, comparado con población caucásica y japonesa. También se conoce el efecto protector que se asocia a la presencia de la variante HLA-B*0702 contra las reacciones adversas graves por carbamazepina específicamente en población caucásica50.
También es conocida la relación entre un menor riesgo asociado de padecer el síndrome de hipersensibilidad inducido por abacavir en personas de raza negra y con diagnóstico de VIH, en comparación con individuos caucásicos en las mismas condiciones, que demuestra diferencias étnicas en relación al gen HLA-B*570152.
El gen HLA-B es uno de los más estudiados en la implicación de su expresión en distintas variantes alélicas. La distribución de frecuencias poblacionales de estas variantes demuestra diferencias importantes. La variante HLA-B*15:02 se encuentra con mayor frecuencia en poblaciones de Asia del Este (6,88%), Asia del Sur y Central (4,64%) y Oceanía (5,37%), encontrándose en nula o muy baja frecuencia en poblaciones de África (0,00%), grupos afroamericanos (0,10%) y caucásicos (0,04%) y americanos (0,16%). La variante HLA-B*15:01 se encuentra con mayor frecuencia en poblaciones de Asia del Sur y Central (4,49%) y población caucásica (3,23%), encontrándose en baja frecuencia en poblaciones del Medio Oriente (1,70%), América (1,55%), Oceanía (1,11%) y África (0,79%)53.
Esto es importante, ya que permite identificar poblaciones en riesgo, y determinar posibles acciones de seguimiento y vigilancia de reacciones adversas a los medicamentos asociados. En este sentido, el desarrollo de la farmacogenética en la actualidad apunta no solo a determinar los genes asociados a estas reacciones, sino más bien a su aplicación en la práctica clínica al poder predecir la respuesta de un paciente a un medicamento en específico tanto en la eficacia como en la seguridad (medicina personalizada). Este es el caso del abacavir, para el cual la Administración de Medicamentos y Alimentos del gobierno de los Estados Unidos (FDA) y la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) han incluido en sus fichas técnicas la necesidad de realizar un screening farmacogenético previo al abordaje terapéutico y la aplicación de las pautas de dosificación de las sociedades profesionales, tales como el Consorcio de Implementación de Farmacogenética Clínica (CPIC)54. La farmacogenética también se ha constituido y considerado en la actualidad como una herramienta clínica en farmacovigilancia, recordando que uno de los objetivos de esta disciplina es la identificación de grupos de riesgo y la prevención de reacciones adversas55.
Debido a esto es importante el estudio de las relaciones genéticas en poblaciones, que a su vez permitan el desarrollo de nuevas prácticas que permitan prevenir y disminuir los efectos adversos a los medicamentos conociendo el comportamiento tanto poblacional, como individual, sin discriminar el hecho de tratarse de efectos poco frecuentes o conocidos. El coste que el abordaje de reacciones adversas graves puede representar a los sistemas de salud es considerable y, por lo tanto, el disminuirlos o evitarlos podría significar un beneficio económico en los mismos. Es necesario impulsar actividades de farmacovigilancia activa en los servicios de salud, que permitan disponer de información y datos poblacionales para determinar el comportamiento de estas y crear a futuro pautas de tratamiento propias de la región.
Es necesario mencionar que una cuestión importante e inherente a la recolección de reportes sobre reacciones cutáneas severas inducidas por medicamentos es su infra detección56. Se sabe que cuando se aplica una monitorización intensiva, en cualquiera de sus variantes, se obtiene un mayor número de reportes comparado a otros métodos de detección, por ejemplo, los casos de notificación voluntaria. Esto puede considerarse una limitación al presente estudio, ya que no se encontró información de estas reacciones en todos los países de la región. Además, debe considerarse que la no existencia de reportes no es indicativa de la ausencia de casos o de la existencia de casos atribuidos a otros medicamentos.
A pesar de ello, se considera que los resultados obtenidos representan un aporte importante al conocimiento de las reacciones cutáneas severas inducidas por medicamentos en Iberoamérica.
Las reacciones cutáneas severas inducidas por medicamentos (SSJ, NET, DRESS y PEAG) son un problema clínico que pasa frecuentemente inadvertido por el personal de salud ya que en algunas ocasiones no está familiarizado con ellas. Es importante socializar estos problemas, ya que representan un interés sanitario, económico y social creciente.