MENSAJES CLAVE
1. Las vitaminas B influencian la homocisteínemia y la EA.
2. Las vitaminas B no mejoran los resultados en las escalas ADAS-Cog, CDR y MMSE.
3. Suplementar vitaminas B por más de 6 meses mejora la escala CDR
4. Las vitaminas B podrían afectar algunos dominios cognitivos.
5. Las multi intervenciones podrían mejorar el tratamiento del Alzheimer.
INTRODUCCIÓN
La enfermedad de Alzheimer (EA) es la demencia más frecuente a nivel mundial. La EA afecta aproximadamente a 47 millones de personas, su prevalencia es del 5-8% y en los últimos años ha aumentado debido al incremento en la longevidad de la población, estimándose que para el año 2050 podrían existir 130 millones de personas con EA. Generalmente, su edad de presentación es alrededor de los 65 años y su prevalencia es del 20-40% en la población mayor de 85 años1. A nivel económico, la EA representa un alto costo para la sociedad debido a las implicaciones del cuidado y el tratamiento. Se estima que para el 2015 el costo global fue de 818 millones de dólares, incrementándose el costo en un 35% con respecto al año 2010. En Estado Unidos durante el 2020, se estimaron costos aproximados de 335.000 millones de dólares y la atención no remunerada dada por los cuidadores se estimó en 256.700 millones de dólares1,2.
La fase preclínica de la EA inicia hasta 30 años antes de la identificación del daño cognitivo medio y cursa con cambios a nivel bioquímico3. La EA se caracteriza por la presencia de placas seniles o también denominadas β-amiloide (βA) y ovillos neurofibrilares (ONF), los cuales se constituyen en marcadores biológicos de la EA4. El papel que juegan estas proteínas no es del todo establecido, planteándose una relación entre las βA y los ONF en la respuesta inflamatoria neuronal que puede afectar el metabolismo y la fosforilación de las proteínas Tau, promoviendo así su aglutinación y posterior declive cognitivo5,6. Además, se describe de un posible desequilibrio de los radicales libres y sustancias oxidativas que pueden incrementar la apoptosis neuronal7. Al mismo tiempo, se han descrito varios factores de riesgo no modificables (ej., genética y edad) y modificables (ej., tabaquismo, dieta, y sedentarismo) relacionados con la formación de βA y aglutinación de las proteínas Tau6,8.
Uno de estos mecanismos y que se plantea como opción terapéutica en la EA es el desbalance de la homocisteína9. La homocisteína se considera un factor de riesgo para pérdida de la función neurocognitiva y daño en las paredes de los vasos sanguíneos, debido a su capacidad neurodegenerativa a través de la proteína β-amiloide, la cual es mediada por mecanismos de excitotoxicidad, daño en el ADN, modificación oxidativa de las bases nitrogenadas y fallas en los mecanismos de reparación10,11. La oxidación de su grupo sulfhidrilo produce formas reactivas (ej., anión superóxido, anión hidroxilo y peróxido de hidrógeno) que generan un daño endotelial, activación de la cascada de la coagulación, vasoconstricción y reducción de la perfusión cerebral, la cual favorece la acumulación de radicales libres y menor disponibilidad de nutrientes a nivel neuronal. Del mismo modo, el ambiente prooxidante de la homocisteína genera daño en el material genético de la neurona, altera sus mecanismos de reparación y favorece la apoptosis neuronal12,13.
La homocisteína es un aminoácido sulfurado producido durante el metabolismo de la metionina, en el cual actúan vitaminas del complejo B (VCB) como cofactores enzimáticos del metabolismo de la metionina y metilación de la homocisteína. Por ejemplo, la vitamina B6 participa en la interconversión de serina-glicina (un proceso para la conversión de homocisteína en cistationina) y la vitamina B12 es un cofactor de la metionina sintasa (enzima responsable de la metilación de la homocisteína para dar lugar a la metionina)14. De esta manera, la suplementación con VCB facilitaría la interconversión de homocisteína en metionina; por el contrario, la ausencia de VCB suprime los cofactores necesarios para el metabolismo de la metionina, lo cual promueve la acumulación homocisteína y su correspondiente incremento del efecto oxidante y neurodegenerativo descrito previamente15. Paralelamente, las VCB desempeñan un papel antioxidante al contrarrestar el efecto prooxidante de la homocisteína. Por lo tanto, la suplementación de VCB se plantea como opción terapéutica para mejorar la homeostasis de este aminoácido y así contribuir al tratamiento del deterioro cognitivo12,16,17.
De acuerdo a lo anterior, la suplementación con VCB podría impactar positivamente en el desenlace cognitivo de los pacientes con daño cognitivo y EA, al disminuir los niveles de homocisteína, sin embargo, la literatura científica es discordante18,19. Estudios observacionales apoyan el efecto benéfico de las VCB sobre el declive cognitivo20 al tiempo que los resultados de estudios experimentales son controversiales. Una revisión Cochrane21 de estudios experimentales determinó que la suplementación con VCB en pacientes con daño cognitivo medio no mejoraba el desempeño cognitivo. El metaanálisis de Li et al.19 concluye que la suplementación de VCB podría retrasar el deterioro cognitivo en adultos con daño cognitivo medio. Estas discordancias entre estudios experimentales podrían deberse a la diversidad de criterios diagnósticos de EA, diversidad en la medición del declive cognitivo, heterogeneidad en las intervenciones y el estadio o espectro de la EA en que se realiza la intervención.
Por lo anterior, se requiere de una revisión que abarque estas diferencias y permita dilucidar el efecto de la suplementación de VCB en la EA, por lo cual, la presente revisión pretende determinar el efecto de la suplementación individual o combinada de vitaminas del complejo B sobre la progresión del declive cognitivo en personas mayores de 60 con daño cognitivo o diversos estadios de la EA.
METODOLOGÍA
Diseño de estudio
Se realizó una revisión sistemática y metaanálisis siguiendo las recomendaciones de PRISMA. Las estrategias y métodos de búsqueda se determinaron antes del inicio del estudio y el estudio está registrado en línea en PROSPERO (CRD42021247743).
Estrategia de búsqueda
Se condujo una búsqueda bibliográfica en PubMed, Embase, Proquest, Web of Science y Biblioteca virtual de salud. La fecha de la búsqueda comprendió desde el 1 de enero del año 2000 hasta el 21 de junio de 2021. El algoritmo de búsqueda adaptado en cada base de datos y buscador fue: (Alzheimer) AND (vitamin B) (Ver Material Suplementario). Todas las referencias y sus resúmenes fueron exportados a un gestor de referencias, se eliminaron los duplicados y se creó un archivo Excel para su posterior selección.
Selección de estudios
Se incluyeron artículos originales de estudios experimentales controlados, debido a que permiten dar respuesta al objetivo de investigación. Los criterios de elegibilidad se describen en la Tabla 1.
Tabla 1. Criterios de elegibilidad de los estudios.
| Criterios de inclusión |
|---|
| 1. Estudios experimentales controlados. |
| 2. Seguimiento mínimo de 3 meses. |
| 3. Idioma de publicación en español o inglés |
| 4. Adultos de 60 o más años de edad. |
| 5. Personas con diagnóstico de EA (criterios de NINCDS, ADRDA, Petersen, bajo puntaje en las pruebas CDR-ADAS Cog y/o imágenes PET) o daño cognitivo medio (bajo puntaje en escalas MMSE o criterios Petersen). |
| 6. Suplementación oral con una o más VCB (vitaminas B individual, combinada o en conjunto a otras intervenciones). |
| 7. Medición del desempeño cognitivo mediante las herramientas Alzheimer’s disease assessment scale-cognitive (ADAS-Cog), Clinical dementia rating (CDR) y/o Mini Mental State Examination (MMSE). |
| Criterios de exclusión |
| 1. Estudios con intervenciones herbales. |
| 2. Participantes con otros tipos de demencia (ej., síndrome de Down, enfermedad de Parkinson, demencia vascular, etc.). |
| 3. Estudios sin información de la intervención y/o desenlace. |
Tres revisores examinaron de forma independiente el título y resumen de todas las referencias obtenidas a partir de la búsqueda bibliográfica. Los revisores fueron entrenados para seleccionar las referencias y tuvieron un alto acuerdo entre evaluadores (K=0,86) para la inclusión y exclusión de artículos. Todos los desacuerdos se resolvieron por consenso entre cinco investigadores. Una vez seleccionadas las referencias por título y resumen, se procedió a obtener la versión completa de los artículos preseleccionados y a verificar nuevamente en el documento los criterios de selección de estudio.
Extracción de información
Las variables de interés fueron las características del estudio (país, diseño, tiempo de seguimiento, tamaño de muestra, sexo y edad), diagnóstico de EA o daño cognitivo, suplementación con VCB y evaluación del declive cognitivo. Los revisores incorporaron estas variables en una hoja de cálculo Excel para la recopilación de datos, la extracción de información se realizó por duplicado y la fuente de información fue el artículo completo publicado.
Evaluación de la calidad de los artículos seleccionados
Cinco revisores entrenados y estandarizados evaluaron la calidad de la literatura con la herramienta Revised Cochrane risk-of-bias tool for randomized trials (RoB 2).
Síntesis y análisis de datos
Los datos de los desenlaces fueron de tipo continuo y se reportaron como el valor al final del seguimiento o como diferencia entre el valor final y el valor inicial en cada intervención. Las medidas del efecto fueron diferencia de medias (DM). El peso de los estudios se determinó mediante el método inverso de la varianza. La heterogeneidad estadística se midió mediante una prueba Chi2, asumiendo como heterogeneidad valores de p<0,1. El porcentaje de variabilidad se midió con el estadístico I2, asumiendo un I2>50% como heterogeneidad significativa.
Se empleó un metaanálisis de efectos aleatorios para incorporar la heterogeneidad de los estudios en el efecto combinado. Además, se realizaron análisis de sensibilidad mediante la distinción de los resultados por subgrupos según la suplementación de VCB (sólo vitaminas del complejo B, vitaminas complejo B + medicamento o suplemento con multivitaminas), población evaluada (EA, daño cognitivo medio o combinación de ambos), uso de comparador (placebo o tratamiento activo) y la duración de la intervención (≤6 meses o >6 meses). La evaluación del sesgo del informe se realizó mediante el gráfico de embudo. Todos los análisis y gráficos se realizaron en RevMan 5.4 (Colaboración Cochrane).
RESULTADOS
Resultados de la búsqueda
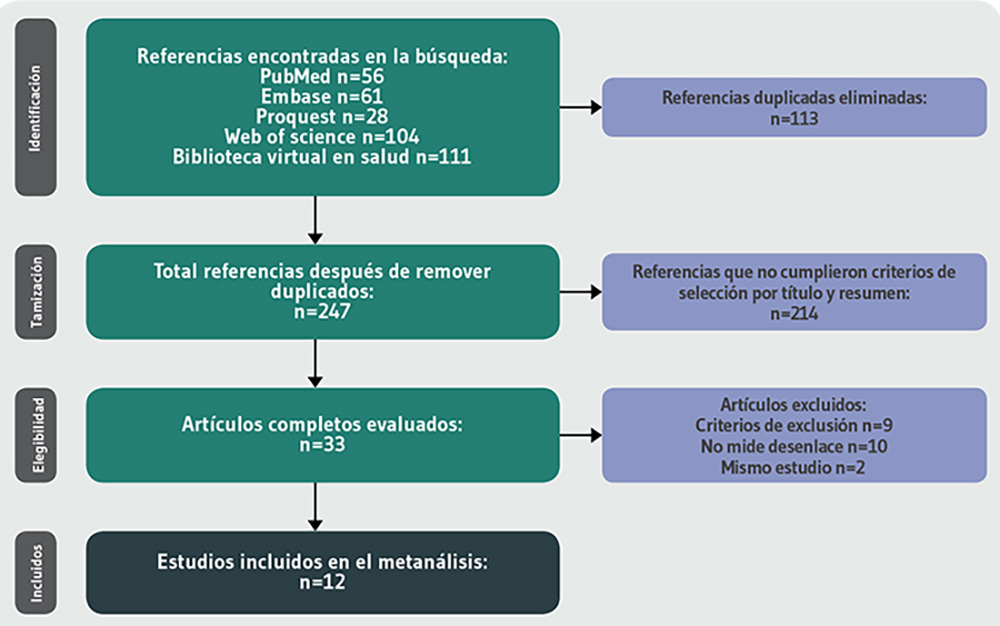
La búsqueda arrojó 247 referencias. Se preseleccionaron 34 artículos y, finalmente, 12 artículos22-33 cumplieron con los criterios de elegibilidad (Figura 1).
Característica de los estudios incluidos
De los 12 estudios incluidos, cuatro investigaciones23,25,29,31 fueron realizadas en Estados Unidos y siete estudios22,24,25,28,31-33 se realizaron exclusivamente en participantes con EA (Tabla 2).
Tabla 2. Características de los estudios incluidos.
| Referencia | Diseño | Seguimiento | Lugar | Muestra | Método diagnóstico | Intervención | Comparador |
|---|---|---|---|---|---|---|---|
| Chen, 202122China | Aleatorizado, controlado, paralelo, simple enmascarado | 6 meses | Hospital | Alzheimer Hombre 56 Mujer 64 68,58±7,29 | Criterios NINCDS, MOCA | n=60 Inhibidor de acetilcolinesterasa o memantina, tres tabletas de 400 μg ácido fólico y dos tabletas 25 μg vitamina B12 | n=60 Inhibidor de acetilcolinesterasa o memantina, placebo |
| Gibson, 202023USA | Aleatorizado, controlado, paralelo, doble enmascarado | 12 meses | Hospital | Alzheimer y daño cognitivo Hombre 29 Mujer 41 75,77±7 | PET, ADAS-Cog | n=15 Dos cápsulas de 300 mg de benfotiamine | n=14 Placebo |
| Chen, 201624China | Aleatorizado, controlado, paralelo, simple enmascarado | 6 meses | Hospital | Alzheimer Hombre 61 Mujer 59 68,10±8,50 | MMSE, TC, RM | n=81 Ácido fólico 1,25 mg/d + donepezil | n=81 donepezil y placebo |
| Remington, 201525USA | Aleatorizado, controlado, paralelo, simple enmascarado | 3 meses | Hogar geriátrico | Alzheimer n=82 77,8±8,4 | NINCDS | n=48 2 tabletas diarias: 400 g de ácido fólico, 6 ug de B12, 30 UI alfa-tocoferol, 400 mg de SAM (200 mg de ion activo), 600 mg de NAC, 500 mg de ALCAR | n=34 Placebo |
| Jager, 201226UK | Aleatorizado, controlado, paralelo, simple enmascarado | 2 años | Comunidad | Daño cognitivo Hombre 123 Mujer 143 76,7±4,8 | MMSE | n=110 Ácido fólico 0,8 mg, B12 0,5 mg y B6 20 mg | n=113 Placebo |
| Ford, 201027Australia | Aleatorizado, controlado, paralelo, doble enmascarado | 2 años | Comunidad | Daño cognitivo Hombre 299 79,3±2,8 | TICS, MMSE | n=118 1 capsula diaria: 0,4 mg B12, 2 mg ácido fólico y 25 mg B6 | n=123 Placebo |
| Scheltens, 201028Multicéntrico | Aleatorizado, controlado, paralelo, doble enmascarado | 3 meses | Hospital | Alzheimer Hombre 106 Mujer 106 74,1±7,2 | ADAS-Cog | n=113 Bebida diaria 125 mL: EPA 300 mg, DHA 1200 mg, fosfolípidos 106 mg colina 400 mg, E 40 mg, vitamina C 80 mg, B12 0,3 mg, B6 1 mg, ácido fólico 0,4 mg | n=112 Placebo |
| van Dyck, 200929USA | Emparejado, controlado, paralelo, simple enmascarado | 4 meses | Hogar geriátrico | Daño cognitivo Hombre 6 Mujer 50 86,8±6,9 | MMSE | n=28 1 mg de B12 diario durante una semana, luego semanal durante 15 semanas | n=28 Misma intervención en pacientes con niveles normales de B12 |
| Manders, 200930Holanda | Aleatorizado, controlado, paralelo, doble enmascarado | 6 meses | Hogar geriátrico | Daño cognitivo Hombre 54 Mujer 122 83 (72,9-92) | MMSE | n=78 Bebida 2 veces al día: 80 mg Sodio, 550 mg potasio, 40 mg cloro, 400 mg calcio, 400 mg fósforo, 9 mg hierro, 18 mg zinc, 3 mg cobre, 4 mg manganeso, 85 mg selenio, vitamina A 240 g, vitamina D 13 mg, vitamina E 70 mg, vitamina K 80 mg, vitamina C 250 mg, B12 5,3 mg, 480 mg de ácido fólico, B5 4,5 mg, biotina 70 mg, piridoxina 2,5 mg, niacina 14 mg riboflavina 1,9 mg, tiamina 1,9 mg | n=33 Placebo |
| Aisen, 200831USA | Aleatorizado, controlado, paralelo, doble enmascarado | 18 meses | Hospital | Alzheimer Hombre 180 Mujer 229 75,7±8,0 | MMSE | n= 204 5 mg/d ácido fólico, 1 mg/d B12 y 25 mg/d B6 | n=140 Placebo |
| Connelly, 200832Escocia | Aleatorizado, controlado, paralelo, doble enmascarado | 6 meses | Comunidad | Alzheimer Hombre 12 Mujer 29 76,27±6,23 | Criterios NINCDS, ADRDA | n=23 Inhibidor de colinesterasa y 1 mg ácido fólico | n=18 Inhibidor de colinesterasa y placebo |
| Sun, 200733China | Aleatorizado, controlado, paralelo, doble enmascarado | 6 meses | Hospital | Alzheimer Hombre 45 Mujer 44 75±7,3 | MMSE, CDR | n=45 Donezepil y suplemento multivitamínico: ácido fólico 1 mg, B6 5 mg, B12 500 mg, hierro 60 mg, nicotinamida 10 mg, carbonato de calcio 250 mg, riboflavina 2 mg, tiamina 3 mg, vitamina C 100 μg, iodo100 μg, cobre 150 μg, B12 3 μg, vitamina A 4000 IU, y vitamina D3 400 IU | n=44 Placebo |
NINCDS: National Institute of Neurological and Communicative Disorders and Stroke; MOCA: Montreal Cognitive Assessment; ADAS-Cog: Alzheimer disease assessment scale-cognitive; MMSE: Mini mental state examination; CDR: Clinical dementia rating; TICS: Telephone Interview for Cognitive Status; ADRDA: Alzheimer’s Disease and Related Disorders Association; PET: Positron emission tomography; RM: Resonancia magnética; TC: Tomografía computarizada.
Evaluación de la calidad
De acuerdo a la herramienta RoB-2, las características más habituales en los estudios incluidos fueron el ocultamiento de la asignación, grupos homogéneos, análisis apropiados y datos completos. Paralelamente, las limitaciones más habituales fueron la falta de ocultamiento en la intervención, información incompleta de todos los participantes y análisis de datos no preespecificados (Ver Material Suplementario).
Evaluación del sesgo de publicación
De acuerdo con las gráficas de embudo (Ver Material Suplementario), no se observó sesgo de publicación en los desenlaces medidos por las tres herramientas de declive cognitivo.
Efecto del suplemento de vitamina B sobre declive cognitivo
A nivel individual, únicamente el estudio de Jager et al.26 demostró en pacientes con daño cognitivo que la suplementación por dos años con ácido fólico, B6 y B12 mejoró el desempeño cognitivo, disminuyendo 0,4 puntos en la escala CDR.
El metaanálisis indica que a nivel global no hay un efecto de la suplementación con VCB sobre el declive cognitivo medido por ADAS-Cog (DM: 0,01; IC95%: -0,7 a 0,72), CDR (DM: -0,06; IC95%: -0,48 a 0,36) y MMSE (DM: 0,3; IC95%: -0,01 a 0,61). En los análisis de sensibilidad, se encontró que la suplementación con vitamina B por más de 6 meses podría disminuir el declive cognitivo según la escala CDR (DM: -0,19; IC95%: -0,36 a -0,02) (Tabla 3 y Material Suplementario).
Tabla 3. Resultados del metaanálisis.
| ADAS-CogDM [IC95%] | CDRDM [IC95%] | MMSEDM [IC95%] | |
|---|---|---|---|
| Global | 0,01 [-0,7; 0,72] | -0,06 [-0,48; 0,36] | 0,30 [-0,01; 0,61] |
| Tratamiento | |||
| Vitamina B | 0,14 [-0,68; 0,96] | -0,18 [-0,47; 0,10] | 0,33 [-0,01; 0,67] |
| Vitamina B+Medicamento | 0,83 [-2,03; 3,70] | *2,10 [0,26; 3,94] | 0,23 [-0,96; 1,42] |
| Multivitaminas | -0,79 [-2,42; 0,84] | --- | *0,10 [-0,87; 1,07] |
| Uso de Comparador | |||
| Placebo | 0,02 [-0,70; 0,74] | -0,10 [-0,47;0,27] | 0,29 [-0,03; 0,61] |
| Activo | *-0,63 [-5,59; 4,33] | *6,40 [-1,08; 13,88] | 0,53 [-0,98; 2,03] |
| Población | |||
| Alzheimer | 0,58 [-0,70; 1,85] | 0,89 [-1,06; 2,84] | 0,26 [-0,34; 0,85] |
| Daño cognitivo | -0,16 [-1,03; 0,72] | 1,93 [-4,39; 8,26] | 0,32 [-0,05; 0,68] |
| Alzheimer y daño cognitivo | -2,24 [-6,28; 1,80] | *-0,17 [-0,36; 0,02] | --- |
| Tiempo de intervención | |||
| Hasta 6 meses | -0,77 [-2,32; 0,77] | 2,66 [-0,18; 5,49] | 0,22 [-0,59; 1,04] |
| Más de 6 meses | 0,22 [-0,58; 1,02] | -0,19 [-0,36; -0,02] | 0,31 [-0,02; 0,65] |
* Resultado a partir de un solo estudio. ADAS-Cog:Alzheimer’s disease assessment scale-cognitive;CDR:Clinical dementia rating; MMSE: Mini Mental State Examination; DM: Diferencia de medias; IC: Intervalo de confianza.
Los resultados del presente metaanálisis de estudios experimentales de VCB sobre el declive cognitivo en pacientes con daño cognitivo o EA resaltan la ineficacia de la suplementación individual o combinada (con medicamento u otras vitaminas) sobre el declive cognitivo medido por MMSE y ADAS-Cog, al tiempo que la suplementación de VCB por más de seis meses podría retrasar el declive cognitivo al cuantificarse por la escala CDR.
La falta de efecto de la suplementación de VCB sobre el declive cognitivo es opuesto a los metaanálisis previos de estudios observacionales. Por ejemplo, Xu et al.20 sugieren que el folato actúa como factor protector al disminuir el estrés oxidativo promovido por la homocisteína. Al mismo tiempo, Zhang et al.34 resaltan que la concentración plasmática y el consumo de VCB no se asocian con el declive cognitivo en adultos de >45 años. Por tanto, consideramos que el efecto de la dieta sobre la prevención y/o tratamiento del declive cognitivo en el daño cognitivo y la EA podría deberse a la combinación de componentes nutritivos y no nutritivos en la matriz de los alimentos y no se debe adjudicar a un solo componente nutricional35-37.
Paralelamente, nuestros hallazgos coinciden con los resultados de metaanálisis previos con menor número de estudios experimentales. Li et al.38 concluyeron que la suplementación con VCB no demostraron efecto sobre el deterioro cognitivo medido por ADAS-Cog y MMSE en pacientes con daño cognitivo o EA. Muñoz, Ivanauskas & Lima39, Wang et al.40, Ford & Almeida41 y McCleery et al.21 evidenciaron que las intervenciones nutricionales con VCB no mostraron efecto sobre el desempeño cognitivo medido por MMSE en diferentes estadios de la EA o con daño cognitivo.
De acuerdo a nuestro conocimiento, este es el primer metaanálisis que describe un efecto de la suplementación con VCB por más de 6 meses sobre el declive cognitivo cuantificado con la escala CDR (DM: -0,19; IC95%: -0,36 a -0,02). A nivel poblacional, este resultado podría interpretarse clínicamente irrelevante pero estadísticamente significativo, sin embargo, este resultado también podría significar una importante mejoría para los pacientes42.
La asociación de la suplementación de VCB con la escala CDR podría deberse a que las VCB están relacionadas más a un mejoramiento en algunos dominios cognitivos medidos por la escala CDR (ej., motricidad y memoria, entre otros) y no a un efecto cognitivo global (como la medición de MMSE y ADAS-Cog). Li et al.19, al combinar el efecto de diversas escalas (ej., MMSE y CDR, entre otras) describen que la suplementación con VCB mejoraron la función cognitiva. Mcgrattan et al.43 demostraron que la suplementación VCB tiene un efecto positivo sobre algunos dominios relacionados al desempeño cognitivo, como memoria (DM: 0,41; IC95%: 0,11 a 0,70) y desempeño motor (DM: 0,38; IC95%: 0,17 a 0,58), los cuales también son cuantificados en la escala CDR44. Al mismo tiempo, nuestros hallazgos sustentan que las VCB no se relacionan con mejoría en los resultados cognitivos a nivel global, ya que las VCB no se asociaron con las mediciones por MMSE y ADAS-Cog y estas escalas realizan una aproximación global del deterioro cognitivo45.
Junto a lo anterior, la diferencia entre los resultados de las escalas MMSE, ADAS-Cog y CDR se debe a que cada una tiene un propósito diferente. Por ejemplo, el MMSE fue desarrollado para el tamizaje y no para el diagnóstico de demencias45; ADAS-Cog fue diseñada para pacientes con EA, posee múltiples adaptaciones y en pacientes con EA suele puntuar de manera elevada, dificultando evidenciar los cambios debido a una intervención46. La CDR evalúa la severidad de la demencia y no se altera drásticamente según el espectro de la EA46. Estas diferencias generan que las herramientas no sean intercambiables47 y por ende puede llegar a sesgar la asociación de la suplementación de VCB con el declive cognitivo46.
Otro factor que estaría influenciando los resultados en cada uno de los estudios incluidos es la homocisteínemia. Se ha determinado que los participantes con déficits nutricionales y altos niveles de homocisteína presentan mejores beneficios al momento de la suplementación con VCB, por tanto, la suplementación con VCB puede promover un mejor resultado cognitivo en pacientes con hiperhomocisteinemia, pero no cuando se observan niveles séricos normales de homocisteína12,19,34. Sin embargo, la obesidad, el tabaquismo y la diabetes mellitus 248-50 también pueden influenciar de manera independiente la concentración de la homocisteína, por lo que futuras investigaciones deberán establecer criterios de selección que permitan controlar los sesgos derivados de este aminoácido.
Direccionamiento de la investigación futura
Con base a nuestros hallazgos y debido a la consistencia con la evidencia científica previa, las próximas investigaciones deberán evitar enfocarse sobre el efecto individual de las VCB y optar por experimentos multi intervención, empleando más de una escala de medición cognitiva y combinando una o más estrategias (ej., alimentos fortificados, alimentos funcionales, ejercicio de resistencia y/o estímulo cognitivo)51. Además, dichas intervenciones deberán realizarse en grupos poblacionales en todo el espectro de la EA, con el fin de verificar su eficacia. Finalmente, las próximas investigaciones deberían controlar y reportar la medición de factores asociados al declive cognitivo, como factores psicológicos, actividad física y estímulo cognitivo, entre otros.
Fortalezas
Respecto a los metaanálisis previos, nuestros hallazgos poseen mayor validez externa, debido a que se incrementó el número de experimentos incluidos, se aumentó el tamaño de muestra, se incluyó un amplio espectro de la enfermedad (declive cognitivo y diversos estadios de la EA) y se evaluó el declive cognitivo mediante las escalas de MMSE, ADAS-Cog y CDR.
Limitaciones
Se deben considerar tres limitaciones que proceden de los estudios incluidos. Primero, los estudios no evaluaron la influencia de otros factores nutricionales que podrían sesgar sus hallazgos, como son el peso corporal y el consumo de alimentos antioxidantes52. Segundo, no resulta claro en los estudios incluidos el control de factores psiquiátricos (ej., diagnóstico, tratamiento y evolución de alteraciones mentales) que podrían estar alterando los resultados de las investigaciones incluidas53. Finalmente, los experimentos se enfocaron en la suplementación de VCB, pero no se encontraron estudios enfocados hacia el efecto de la fortificación de alimentos, alimentos funcionales o mayor ingesta de alimentos fuente de VCB sobre el declive cognitivo, lo cual resulta promisorio para futuras investigaciones, debido a que estudios en alimentos han sugerido que fuentes de estas vitaminas están asociadas con un mejor desempeño cognitivo54.
CONCLUSIONES
La evidencia disponible sugiere que la suplementación individual o combinada de vitaminas del complejo B no influencia el declive cognitivo en adultos con diversos estadios de la enfermedad de Alzheimer. La suplementación de estas vitaminas podría estar asociada con dominios cognitivos específicos, pero no a nivel cognitivo global evaluado por las herramientas ADAS-Cog, MMSE y CDR. Las futuras investigaciones deben enfocarse hacia estrategias multi intervención que incorporen la actividad física, el estímulo cognitivo y la alimentación.