Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Medicina Intensiva
versão impressa ISSN 0210-5691
Med. Intensiva vol.35 no.2 Mar. 2011
Hemorragia alveolar masiva por citomegalovirus (CMV) e infección por VIH
Massive alveolar hemorrhage due to cytomegalovirus (CMV) and HIV infection
A. Cortésa, E. Peñac, R. Vegab, G. Reyesb y E. Bautistad
a Servicio de Neumología Clínica, Instituto Nacional de Enfermedades Respiratorias "Dr. Ismael Cosío Villegas", Tlalpan, México D.F, México
b Servicio de Infectología Neumológica (CIENI), Instituto Nacional de Enfermedades Respiratorias "Dr. Ismael Cosío Villegas", Tlalpan, México D.F, México
c Servicio de Anatomía Patológica, Instituto Nacional de Enfermedades Respiratorias "Dr. Ismael Cosío Villegas", Tlalpan, México D.F, México
d Jefe del Servicio de Terapia Intensiva, Instituto Nacional de Enfermedades Respiratorias "Dr. Ismael Cosío Villegas", Tlalpan, México D.F, México
Dirección para correspondencia
RESUMEN
La hemorragia alveolar puede ser la complicación de enfermedades con manifestaciones locales y sistémicas, ambas comparten el mismo concepto fisiopatológico: daño a la microcirculación alveolar. Es una entidad clínica que genera un reto diagnóstico para el médico. El reconocimiento oportuno favorece un tratamiento agresivo, con lo que puede mejorar el pronóstico. A pesar de los avances tecnológicos en el diagnóstico y tratamiento, se mantiene como una condición de elevada morbilidad y mortalidad.
Se presenta el caso de una mujer de 42 años con diagnóstico de hemorragia alveolar masiva por citomegalovirus (CMV) e infección por VIH. La forma de presentación es atípica debido a que la mayoría de los casos reportados se presentan como proceso neumónico, siendo infrecuentes los episodios de hemorragia masiva. El diagnóstico se documentó mediante broncoscopia con lavado broncoalveolar y el diagnóstico etiológico con técnicas moleculares utilizando la reacción en cadena de la polimerasa en transcriptasa reversa.
Palabras clave: Hemorragia pulmonar, VIH. Citomegalovirus (CMV), Lavado broncoalveolar (LBA).
ABSTRACT
Alveolar hemorrhage may be a complication of diseases with local and systemic manifestations. Both share the same pathophysiological concept: damage to the alveolar microcirculation. It is a clinical entity that generates a diagnostic challenge for the physician. Early recognition favors aggressive treatment, which can improve the outcome. Despite the technological advances in its diagnosis and treatment, it is still a condition having high morbidity and mortality.
We present the case of a 42-year old woman diagnosed of massive alveolar hemorrhage induced by cytomegalovirus (CMV) and HIV infection. Its presentation is atypical because most reported cases have occurred as a pneumonic process, episodes of massive hemorrhage being uncommon. The diagnosis was documented by bronchoscopy with bronchoalveolar lavage and etiological diagnosis with molecular techniques using reverse transcription polymerase chain reaction.
Key words: Pulmonary hemorrhage, HIV, Cytomegalovirus (CMV), Bronchoalveolar lavage (BAL).
Introducción
La hemorragia alveolar difusa complica un gran número de condiciones clínicas que se presentan con manifestaciones locales (vgr. infecciones) y sistémicas (vgr. vasculitis). Ambas, comparten el mismo concepto fisiopatológico: daño a la microcirculación alveolar o capilaritis pulmonar, cuya lesión histológica ha sido representativa en el diagnóstico desde hace más de 50 años1,2.
La descripción histopatológica de la capilaritis pulmonar se caracteriza por: 1) presencia de hemosiderina en intersticio pulmonar, 2) necrosis de la pared capilar, 3) oclusión de capilares en los septos interalveolares, 4) presencia de neutrófilos y coágulos de fibrina en el intersticio bronquiolovascular e interalveolar3.
El daño en la microcirculación alveolar se clasifica en 3 grupos: a) pauciinmunitarias, asociadas a capilaritis y anticuerpos citoplásmicos antineutrófilos; b) por depósitos inmunológicos, y c) misceláneas, donde se incluye toxicidad por fármacos, infecciones (virus, hongos) e idiopáticas4.
La descripción histopatológica no confirma el diagnóstico etiológico de la hemorragia alveolar. Para ello, se recomienda complementar con estudios que permitan realizar un diagnóstico diferencial (perfil inmunológico, reacción en cadena de la polimerasa (rt-PCR), etc)2,3.
Habitualmente el diagnóstico definitivo es difícil de realizar porque es una condición médica situada en pacientes de extrema gravedad. Sin embargo, al conseguirlo favorece un tratamiento agresivo, debido a la elevada morbilidad y mortalidad cuando se manifiesta con insuficiencia respiratoria aguda1,2,4,5.
Caso clínico
Femenino de 42 años. Manifiesta 8 meses con herpes recurrente en boca.
Ingresa por padecimiento de 2 meses con tos seca en accesos y disnea rápidamente progresiva. Además dolor torácico bilateral, fiebre hasta 39oC y pérdida de peso de 14kg. La recurrencia de la lesión herpética le ocasionaba disfagia y odinofagia.
Al examen físico presentaba placas blanquecinas en orofaringe; la exploración del tórax, con disminución del ruido respiratorio y estertores finos. Al aire ambiente la saturación de oxígeno era del 86%. El reporte de la gasometría arterial con oxígeno suplementario al 70% fue: pH 7,30, pCO2 40,5mmHg, pO2 132mmHg, HCO3 19,5mmol/l, exceso de base -5,8mmol/l, saturación de oxígeno al 97,9%. Índice de oxigenación (IO) de 188. Los exámenes de laboratorio al ingreso destacan: linfopenia de 600células/mm3, Hb 11,8gr/dl, deshidrogenasa láctica de 971UI/l y albúmina 3,3gr/dl.
La Rx de tórax presentaba opacidades bilaterales en parche con vidrio deslustrado y neumomediastino, por lo cual, en el diagnóstico diferencial se incluyó inmunosupresión asociada a VIH y neumonía por P. jirovecii (PJP). El análisis para VIH por ELISA fue POSITIVO, se confirmó por Western Blot.
Se le realizó broncoscopia con biopsia transbronquial y lavado broncoalveolar (LBA). El estudio histopatológico se reporta en la figura 1. Recibió tratamiento con Trimetoprim/Sulfametoxasol y Prednisona en dosis de reducción por 21 días.
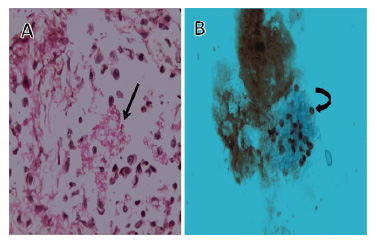
Figura 1. A) Biopsia transbronquial con macrófagos
y polimorfonucleares intraalveolares. Se identifican
estructuras esféricas compatibles con P.jiroveci
(flecha negra). PAS 40×. B) Lavado bronquial con
microorganismos esféricos y endospora evidente
(flecha curva). Grocot 100×.
En el 7.o día de tratamiento presentó deterioro respiratorio y el IO desciende a 110, por lo cual ingresa a terapia intensiva en estado de choque y apoyo con ventilación mecánica invasiva. Al ingresar, los exámenes de laboratorio destacan leucocitos de 24,300células/mm3, Hb 10,8gr/dl, deshidrogenasa láctica 2033UI/l y albúmina de 2,26gr/dl. Se agrega Imipenem por sospecha de neumonía intrahospitalaria y luego de 12 días mejora la cifra leucocitaria a 5800células/mm3, Hb 8,7gr/dl, deshidrogenasa láctica 879UI/l, albúmina 2.41gr/dl e IO en 243.5, lográndose extubar.
En las siguientes 24h, presenta hemoptisis masiva (volumen 250ml). Desciende la cifra de Hb a 6gr/dl, el IO disminuye a 106 y se apoya con ventilación mecánica invasiva. Por Swan-Ganz se mide una POAP de 10mmHg. La radiografía de tórax se muestra en la figura 2A. Se somete a LBA cuyo estudio de patología confirma la presencia de hemorragia alveolar reciente y activa (figura 2B). Además, por rt-PCR se documenta infección por CMV e inicia tratamiento con Ganciclovir 350mg/d durante 14 días.
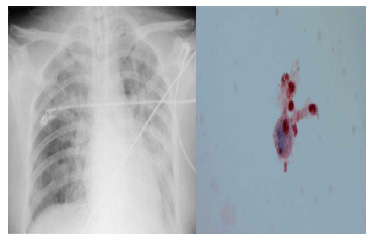
Figura 2. A) Rx del tórax proyección AP que muestra múltiples
opacidades diseminadas, bilaterales con mayor predominio
del hemitórax izquierdo. B) Citología de LBA compatible con
hemorragia alveolar difusa. Se muestra la presencia de
hemosiderófagos. PERLS 40×.
Tiene buena evolución, mejora el IO hasta 277 retirándose de ventilación mecánica invasiva 9 días posteriores al evento. Luego de 37 días egresa a su domicilio. En el seguimiento, la cuenta de CD4 es de 109células/µl y la carga viral <40copias/µl.
Discusión
La enfermedad por CMV es una de las principales infecciones oportunistas en pacientes con VIH. El advenimiento de la terapia antirretroviral altamente activa disminuyó el desarrollo de enfermedad por CMV, la cual, es considerada como factor de riesgo para mortalidad por sida (RR 2,22 IC 1,27-3,88)6.
Habitualmente luego del primer contacto con un huésped inmunocompetente el CMV permanece latente. Sin embargo, casos de inmunosupresión severa (VIH, fármacos, pacientes postrasplantados) estimulan una replicación no controlada del CMV, manifestándose como una condición médica de extrema gravedad7. Por ello, se le considera una enfermedad por reactivación8.
El mecanismo patogénico que precipita la reactivación y enfermedad por CMV en pacientes con VIH está por definirse. Se han descrito varios factores que se asocian con mayor severidad en la inmunosupresión, entre ellas: a) aumento del tropismo celular del VIH; b) incremento en la tasa de replicación del VIH; c) aumento de la concentración sérica del factor de necrosis tumoral α por el VIH, lo cual, aumenta la concentración intranuclear del factor nuclear κβ; d) disminución en la liberación del interferon-γ por las células mononucleares donde permanece latente el CMV, y e) uso de corticoesteroides, para el tratamiento primario de P. jirovecii con insuficiencia respiratoria aguda6,9,10.
Las manifestaciones de enfermedad por CMV en individuos con VIH son: 1) retinitis (representa el 40% de la progresión a sida y constituye el 85% de los episodios relacionados a enfermedad por CMV), 2) manifestaciones gastrointestinales (constituyen el 10% de los casos), 3) el restante 5%, está constituido por manifestaciones neurológicas, pulmonares (neumonitis, daño alveolar difuso, hemorragia alveolar), hepáticas y adrenales11.
Los pacientes con VIH manifiestan síntomas respiratorios cuando el recuento celular de CD4 es <200células/µl12,13. En tanto, el riesgo de enfermedad por CMV aumenta con CD4 <100células/µl14. A nivel pulmonar, el CMV se ha encontrado como coinfección asociado a P.jirovecii hasta en el 53% de los casos.
La reactivación del CMV genera un mayor número de inclusiones citoplasmáticas favoreciendo un aumento del daño citopático del tejido pulmonar, esto posiblemente se relacione con alteraciones en la vasculatura intersticial que favorece el desarrollo de daño alveolar difuso, hemorragia alveolar y formación de membranas hialinas15. Estas alteraciones estructurales son consideradas un factor de riesgo independiente para desarrollar hemorragia alveolar (OR 9,8 IC 95% 1-91)16,17.
En pacientes con VIH, las descripciones de hemorragia alveolar provienen de los estudios realizados por Vincent et al17 que reportaron una serie de 273 LBA en pacientes que manifestaban fiebre y síntomas respiratorios y Soeiro et al12 analizando 250 autopsias de pacientes con VIH que fallecieron por insuficiencia respiratoria aguda. La hemorragia alveolar tuvo una prevalencia del 13-32%, de los cuales 10 casos fueron positivos para CMV, 6 de ellas, con hemorragia alveolar masiva.
Por lo tanto, en el contexto del paciente críticamente enfermo con VIH, donde diversos factores están involucrados en la reactivación y progresión hacia enfermedad pulmonar por CMV, es difícil establecer la causa principal que precipita un episodio de hemorragia alveolar. Sin embargo, cuando el aislamiento sea atribuido a reactivación por inmunosupresión grave, se debe considerar un caso de enfermedad por CMV ante el riesgo elevado de mortalidad a corto plazo como fue descrito por d'Arminio et al desde 199710,18,19.
Luego entonces, la hemorragia alveolar por CMV se debe sospechar en pacientes que manifiesten tos, disnea, fiebre, hipoxemia y hemoptisis con descenso en nivel de Hb (33% de los casos); así como, opacidades de llenado alveolar en parches en los estudios de imagen del tórax y complementarse mediante la visualización histopatológica de inclusiones intranucleares en tejido pulmonar, ó a través de técnicas de rt-PCR en LBA y medición de Ac a nivel sérico6.
Se ha observado que durante la fase aguda de la enfermedad por CMV, los pacientes que no reciben tratamiento tienen un riesgo mayor de fallecer (RR 4,3 IC 95% 3-6,2), principalmente en los siguientes 3 meses de haberse realizado el diagnóstico10,20. Por lo tanto, a pesar de la controversia entre un colonizador latente o enfermedad por reactivación, una vez documentada la presencia de CMV se recomienda iniciar un esquema de tratamiento óptimo.
Conclusión
La manifestación poco frecuente pero mortal de hemorragia pulmonar masiva por CMV en pacientes con VIH con niveles de linfocitos T CD4+ menores a 50células/µl nos obliga a descartar o confirmar dicha enfermedad. Debido a la elevada coinfección con P.jirovecii, los casos que fracasan al tratamiento de neumonía por PCP e inmunosupresión grave el principal diagnóstico diferencial se debe establecer con CMV. El diagnóstico no resulta con frecuencia fácil, porque habitualmente son condiciones de extrema gravedad lo que dificulta realizar una biopsia pulmonar para confirmar el diagnóstico. Además, ante la baja relación del hallazgo de CMV en LBA con enfermedad pulmonar, sugerimos utilizar pruebas diagnósticas complementarias al síndrome clínico vgr. estudios de rt-PCR y análisis serológico para búsqueda de Ac. Por la elevada mortalidad recomendamos un tratamiento antiviral específico al demostrarse mejoría en la sobrevida.
Bibliografía
1. Collard HR, Schwarz MI. Diffuse alveolar hemorrhage. Clin Chest Med. 2004; 25:583-92. vii. [ Links ]
2. Ioachimescu OC, Stoller JK. Diffuse alveolar hemorrhage: diagnosing it and finding the cause. Cleve Clin J Med. 2008; 75:258. 60, 64-5 passim. [ Links ]
3. Green RJ, Ruoss SJ, Kraft SA, Duncan SR, Berry GJ, Raffin TA. Pulmonary capillaritis and alveolar hemorrhage. Update on diagnosis and management. Chest. 1996; 110:1305-16. [ Links ]
4. Gomez-Roman JJ. Diffuse alveolar hemorrhage. Arch Bronconeumol. 2008; 44:428-36. [ Links ]
5. Jin SM, Yim JJ, Yoo CG, Kim YW, Han SK, Shim YS, et al. Aetiologies and outcomes of diffuse alveolar haemorrhage presenting as acute respiratory failure of uncertain cause. Respirology. 2009; 14:290-4. [ Links ]
6. Deayton JR, Prof Sabin CA, Johnson MA, Emery VC, Wilson P, Griffiths PD. Importance of cytomegalovirus viraemia in risk of disease progression and death in HIV-infected patients receiving highly active antiretroviral therapy. Lancet. 2004; 363:2116-21. [ Links ]
7. Sinclair J, Sissons P. Latency and reactivation of human cytomegalovirus. J Gen Virol. 2006; 87(Pt 7):1763-79. [ Links ]
8. Waxman AB, Goldie SJ, Brett-Smith H, Matthay RA. Cytomegalovirus as a primary pulmonary pathogen in AIDS. Chest. 1997; 111:128-34. [ Links ]
9. Nelson MR, Erskine D, Hawkins DA, Gazzard BG. Treatment with corticosteroids--a risk factor for the development of clinical cytomegalovirus disease in AIDS. AIDS. 1993; 7:375-8. [ Links ]
10. d'Arminio Monforte A, Mainini F, Testa L, Vago L, Balotta L, Nebuloni M, et al. Predictors of cytomegalovirus disease, natural history and autopsy findings in a cohort of patients with AIDS. AIDS. 1997; 11:517-24. [ Links ]
11. Springer KL, Weinberg A. Cytomegalovirus infection in the era of HAART: fewer reactivations and more immunity. J Antimicrob Chemother. 2004; 54:582-6. [ Links ]
12. Soeiro Ade M, Hovnanian AL, Parra ER, Canzian M, Capelozzi VL. Post-mortem histological pulmonary analysis in patients with HIV/AIDS. Clinics (Sao Paulo). 2008; 63:497-502. [ Links ]
13. Khouli H, Afrasiabi A, Shibli M, Hajal R, Barrett CR, Homel P. Outcome of critically ill human immunodeficiency virus-infected patients in the era of highly active antiretroviral therapy. J Intensive Care Med. 2005; 20:327-33. [ Links ]
14. Chiche L, Forel JM, Roch A, Guervilly C, Pauly V, Allardet-Servent J, et al. Active cytomegalovirus infection is common in mechanically ventilated medical intensive care unit patients. Crit Care Med. 2009; 37:1850-7. [ Links ]
15. Kim EA, Lee KS, Primack SL, Yoon HK, Byun HS, Kim TS, et al. Viral pneumonias in adults: radiologic and pathologic findings. Radiographics. 2002; 22(Spec No):S137-49. [ Links ]
16. Tamm M, Traenkle P, Grilli B, Soler M, Bolliger CT, Dalquen P, et al. Pulmonary cytomegalovirus infection in immunocompromised patients. Chest. 2001; 119:838-43. [ Links ]
17. Vincent B, Flahault A, Antoine M, Wislez M, Parrot A, Mayaud C, et al. AIDS-related alveolar hemorrhage: a prospective study of 273 BAL procedures. Chest. 2001; 120:1078-84. [ Links ]
18. Steininger C, Puchhammer-Stockl E, Popow-Kraupp T. Cytomegalovirus disease in the era of highly active antiretroviral therapy (HAART). J Clin Virol. 2006; 37:1-9. [ Links ]
19. Rosen MJ, Narasimhan M. Critical care of immunocompromised patients: human immunodeficiency virus. Crit Care Med. 2006; 34(9 Suppl):S245-50. [ Links ]
20. Benfield TL, Helweg-Larsen J, Bang D, Junge J, Lundgren JD. Prognostic markers of short-term mortality in AIDS-associated Pneumocystis carinii pneumonia. Chest. 2001; 119:844-51. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
dr_morenheim@hotmail.com
(A. Cortés)
Recibido 17 Noviembre 2009
Aceptado 2 Marzo 2010














