Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nefrología (Madrid)
versão On-line ISSN 1989-2284versão impressa ISSN 0211-6995
Nefrología (Madr.) vol.31 no.2 Cantabria 2011
Calcificación vascular: tipos y mecanismos
Vascular calcification: types and mechanisms
J.M. Valdivielso
Servicio de Nefrología. Hospital Universitari Arnau de Vilanova. IRBLLEIDA. Lleida
Dirección para correspondencia
RESUMEN
Clásicamente se consideraba que la calcificación vascular era un proceso pasivo y degenerativo que frecuentemente ocurría con la edad avanzada, aterosclerosis, varias alteraciones metabólicas (como diabetes mellitus y estados finales de enfermedad renal) y en raras enfermedades genéticas. Sin embargo, desde hace algunos años, la calcificación vascular es considerada como un proceso activo y regulado de manera semejante a la mineralización y metabolismo del hueso, en el se encuentran implicadas diversas proteínas óseas. Resultados recientes cuestionan la clásica separación de la calcificación vascular en calcificación de la íntima y calcificación de la media, al menos en arterias de capacitancia. Mecanismos procalcificantes y anticalcificantes desempeñan un papel activo en la deposición de calcio en las células vasculares, por lo que su estudio se ha convertido en un área muy activa de investigación. La identificación de dianas terapéuticas que puedan enlentecer o incluso revertir la calcificación vascular podría suponer un avance muy importante en las estrategias terapéuticas para los pacientes afectados de enfermedades renales.
Palabras clave: Calcificación de la media, Calcificación de la íntima, Enfermedad renal crónica, Calcificación vascular.
ABSTRACT
Vascular calcification has traditionally been considered to be a passive process that was associated with advanced age, atherosclerosis, uncommon genetic diseases and some metabolic alterations such as diabetes mellitus and end–stage kidney failure. However, in the last years, vascular calcification has been proven to be an active and regulated process, similar to bone mineralisation, in which different bone–related proteins are involved. Recent results question the classic classification of vascular calcification into intimal and medial calcification, at least in capacitance arteries. Pro and anti–calcifying mechanisms play an active role in calcium deposition in vascular cells, making this area an active focus of research. The identification of therapeutic targets which can slow down the progression or even reverse vascular calcification could be an important step forward in the treatment of patients with chronic kidney disease.
Key words: Medial calcification, Intimal calcification, End stage renal disease, Vascular calcification.
Introducción
En la calcificación vascular la deposición de fosfato cálcico, en forma de cristales de bioapatita (similar al hueso), puede ocurrir en los vasos sanguíneos y en las válvulas cardíacas1. Clásicamente, se han distinguido los tipos de clacificación arterial dependiendo de dónde se depositara el calcio. Así, la calcificación arterial se ha dividido en calcificación de la íntima (asociada a la placa de ateroma)2, y en calcificación de la media (conocida como esclerosis de Mönckeberg), ligada a la rigidez vascular por mineralización de las fibras elásticas y la arteriosclerosis observada con la edad, diabetes y enfermedad renal crónica (ERC)3. La primera estaría relacionada con un aumento de la deposición de lípidos y el infiltrado de células inflamatorias mientras que en la segunda tendría más influencia el cambio de fenotipo de las células de músculo liso vascular hacia células parecidas a osteoblastos. En pacientes con ERC se observa una mezcla de ambas calcificaciones4,5. Sin embargo, resultados recientes parecen sugerir que esta clasificación no sería tan clara y que ambas serían manifestaciones del proceso aterosclerótico6, al menos en grandes arterias. La descripción original de Mönckeberg es del año 19037. En su artículo se describía la presencia de calcificaciones en la capa media de las arterias de 18 pacientes sin placa evidente. Sin embargo, la descripción se hizo sin la ayuda de técnicas actuales para medir deposición de lípidos, matriz extracelular, etc. No sería extraño pensar que lo que realmente estaba describiendo eran distintos grados de evolución de la placa aterosclerótica. Sin embargo, en los últimos años varios estudios han descrito pacientes con esclerosis de Mönckeberg8–12. Si analizamos detalladamente dichos estudios, podemos intuir que en la práctica totalidad se pueden apreciar características de lesiones ateroscleróticas, desde el aumento del grosor íntima–media, disrupción de la lámina elástica interna o incluso depósito de lípidos. Además, las grandes arterias presentan una capa media con un número muy bajo de células de músculo liso vascular, siendo más sensibles al proceso aterosclerótico que al cambio fenotípico hacia células parecidas a osteoblastos.
Un reciente estudio de nuestro grupo usando el único método no invasivo para determinar la exacta localización de las calcificaciones vasculares (ecografía) demuestra que, en arterias de capacitancia, la calcificación vascular se produce asociada a la presencia de aterosclerosis13. En este trabajo estudiamos la presencia de calcificaciones vasculares y placa de ateroma en las arterias carótida, femoral y braquial de 232 pacientes y 208 controles. El tipo de calcificación vascular más común fue la calcificación lineal de la íntima, seguida de la calcificación de la placa de ateroma. Este aparente nuevo tipo de calcificación vascular en realidad no es tal. Histológicamente, la calcificación de la lámina elástica interna ya se había descrito en arterias coronarias11. Otro resultado importante de este trabajo es que la calcificación lineal de la íntima estaba íntimamente asociada con la presencia de placas, pues no se detectaba en arterias radiales (que no desarrollan aterosclerosis) y la ausencia de placa carotidea constituía un factor protector. Así pues, nuestros resultados parecen indicar que, en grandes arterias de pacientes en diálisis, la calcificación vascular predominante está asociada a la presencia de aterosclerosis.
Mecanismos de calcificación vascular
La calcificación vascular es un proceso activo y regulado en el que intervienen diferentes mecanismos no excluyentes entre sí14.
Calcio y fósforo
Algunos autores se refieren a ellos como los «mecanismos pasivos de la calcificación». Los niveles elevados de Ca, P y Ca x P (prevalentes en pacientes con ERC y significativamente ligados a muerte por enfermedad cardiovascular [ECV] en estos pacientes15) promueven la formación de núcleos de cristales de bioapatita y su crecimiento16. La bioapatita es el principal componente mineral de huesos, espinas y conchas. En estudios in vitro se ha observado que al exponer las CMLV a altas concentraciones de calcio o fósforo se produce la deposición de bioapatita en la matriz extracelular. Cuando se incuba con ambos elementos a la vez se puede observar un efecto sinérgico de la calcificación17. Pero no se trata simplemente de un proceso pasivo de precipitación de los iones bivalente, sino que implica un cambio fenotípico de las CMLV y las up–regulation de genes comúnmente asociados con la diferenciación ósea18. Los efectos de la hiperfosfatemia están mediados por un contransportador de fosfato dependiente de sodio, el NPC, cuyo subtipo Pit–1 se ha encontrado en las CMLV. El alto fósforo estimula la actividad de la carga, mientras que el elevado calcio induce la expresión de ARNm de Pit–1. Este transportador permite la acumulación de fósforo dentro de la célula, que sirve como señal para la expresión de genes osteogénicos. Esto provoca la secreción de moléculas minerales (vesículas de matriz, proteínas ligadoras de calcio, fosfatasa alcalina y matriz extracelular rica en colágeno). La combinación de estos factores conlleva la transformación de la célula para ser susceptible de calcificación (figura 1).

Figura 1. Modelo de los efectos del calcio y el fósforo sobre la mineralización de las CMLV.
Muerte celular y apoptosis
La calcificación vascular está relacionada con la aparición de vesículas matriz con contenido citoplásmico y membrana celular intacta (al igual que sucede en el desarrollo óseo); estas vesículas se forman a partir de células donde se origina mineralización o son el resultado del proceso de apoptosis celular (cuerpos apoptóticos). La pared del paciente urémico está lesionada por procesos de inflamación y estrés oxidativo, por lo tanto es razonable pensar que exista apoptosis celular. Proudfoot et al.19 muestran que la apoptosis regula la calcificación vascular in vitro. De acuerdo con estos autores, las vesículas de matriz son capaces de concentrar calcio en su interior y son el origen de los cristales de bioapatita.
Inhibidores de la calcificación
Las células de los vasos expresan en condiciones normales moléculas inhibidoras de la mineralización. La pérdida de su expresión, como sucede en la ERC, provoca lo que se denomina «pérdida de la inhibición natural», dando lugar a una calcificación espontánea y a un aumento de la mortalidad. Mediante análisis mutacionales en ratones se ha elaborado una lista con estas moléculas inhibidoras de la calcificación, entre las que se incluyen a:
Matrix Gla Protein
La Matrix Gla Protein (MGP) fue el primer inhibidor de la calcificación identificado. Es una proteína dependiente de vitamina K que se expresa constitutivamente en CMLV y en células endoteliales de vasos normales, pero su expresión está muy disminuida en arterias calcificadas20. También se ha observado que su expresión disminuye en modelos in vitro de calcificación21. Los niveles séricos de MGP son menores en pacientes con calcificaciones que en los que no tienen22. Además, los ratones knock out para MGP desarrollan severas calcificaciones de la media y mueren por rotura aórtica23.
Fetuína A
Es una glicoproteína sérica que inhibe la calcificación vascular ectópica. Es un potente inhibidor de la formación de hidroxiapatita, reduciendo la formación de cristales en soluciones que contienen calcio y fósforo in vitro, sin afectar a los ya formados24. Los ratones deficientes en esta proteína desarrollan extensas calcificaciones de los tejidos blandos como miocardio, riñón, lengua y piel25.
Osteopontina
La osteopontina (OPN) es una fosfoproteína que se encuentra normalmente en los tejidos mineralizados como hueso y dientes, y está implicada en la regulación de la mineralización al actuar como inhibidor del crecimiento de los cristales de apatita26. Aunque no se encuentra en arterias normales algunos autores han detectado su expresión en placas ateroscleróticas y válvulas aórticas calcificadas27–29. Giachelli et al.30 para examinar el papel de OPN en la calcificación vascular cruzaron ratones OPN–/– (que no muestran manifestaciones vasculares) con ratones MGP–/– (que sí desarrollan calcificaciones vasculares). Los ratones OPN–/– MGP–/– muestran una calcificación más acelerada que los que sólo son deficientes en MGP (MGP–/– OPN+/+), por lo que estos estudios indican que OPN es un inhibidor inducible de la calcificación vascular in vivo.
Osteoprotegerina
La osteoprotegerina (OPG) es un miembro de la familia de receptores de los factores de necrosis tumoral que ha sido identificado como regulador de la resorción ósea31. La OPG es producida por una gran cantidad de tejidos, incluidos el sistema cardiovascular, pulmón, riñón y sistema inmune32. En las lesiones calcificadas avanzadas, la OPG se presenta alrededor del área calcificada. Se ha observado que los ratones deficientes en OPG desarrollan osteoporosis severa y calcificación de la media33, dejando clara su función como inhibidor de la calcificación vascular. Se ha estudiado el potencial de OPG como marcador de la enfermedad cardiovascular. Su nivel en suero se incrementa con la severidad de la calcificación vascular34. OPG funciona como un receptor soluble, señuelo de ligando (RANKL) del receptor activador del factor nuclearκB (RANK)32. RANKL es producido por las células T activadas y estimula RANK, y esta activación permite, entre otras, el aumento de expresión de los mediadores de inflamación. OPG es, además, receptora del ligando inductor de la apoptosis relacionada con el factor de la necrosis tumoral (TRAIL), que es un potente inductor de apoptosis. TRAIL se encuentra en gran variedad de tejidos, incluyendo las CMLV y las células endoteliales. En las lesiones ateroscleróticas humanas, TRAIL se ha localizado en torno a las áreas calcificadas9.
Activadores de la calcificación
Además de la hiperfosfatemia y de la hipercalcemia existen estudios que sugieren la presencia de sustancias en el suero de los pacientes con ERC capaces de estimular la calcicación35. CMLV bovinas en presencia de suero urémico incrementan la expresión de proteínas relacionadas con el proceso de calcificación. Se ha identificado un amplio número de factores de la uremia que son capaces de inducir genes osteogénicos, de transformación osteoblástica y de secreción de algunas proteínas de la matriz ósea en la pared de los vasos y tejidos blandos. Algunos de estos factores son: el factor de necrosis tumoral (TNF)36, citoquinas inflamatorias37, fibronectina38, colágeno tipo I38 y 25–hidroxicolesterol39. Estas sustancias del suero urémico promueven la expresión de moléculas fundamentales para la calcificación vascular.
Fosfatasa alcalina
La fosfatasa qalcalina (ALP) es una de los marcadores fenotípicos de los osteoblastos y se considera que es esencial en el proceso de calcificación vascular. Se ha detectado su presencia en las calcificaciones vasculares y de válvulas cardíacas. ALP expresada en la superficie celular puede actuar sobre los liberadores de fosfato, liberando fosfato inorgánico40. Las citoquinas inflamatorias y la vitamina D inducen su up–regulation y la mineralizazión40,41.
Core binding factor alpha 1
Core binding factor alpha 1 (Cbfa1) es el principal regulador de la diferenciación ósea. Los ratones deficientes en Cbfa1 tienen problemas en la formación de cartílago y mineralización del hueso42. Actúa como un factor de transcripción que dispara la expresión de importantes genes de la línea osteoblástica como son la osteocalcina, la osteopontina, la ALP o el colágeno tipo I20. El fosfato43 y las toxinas urémicas35 ejercen la up–regulation en su expresión.
Bone morphogenic proteins
Las bone morphogenic proteins (BMPs) son un grupo de, al menos, 30 proteínas que reciben este nombre por sus propiedades osteoinductivas. Las BMPs forman parte de la superfamilia del factor de crecimiento transformante beta (TGF–β). Actúan a través de la unión a un complejo heterodímero de receptores de transmembrana (receptor BMP I y II) que trimeriza después de la señal. La unión de una BMP a su receptor específico II da como resultado la activación de los receptores tipo I. Esto provoca la fosforilación y la translocación nuclear de los factores de transcripción Smad modificando así la tasa de transcripción de los genes diana44. Inducen la formación ectópica de hueso45.
BMP2 es un potente morfogénico óseo y su expresión desencadena programas de regulación transcripcional osteogénica en el árbol arterial. BMP2 induce tanto a Msx2 como a Cbfa1 en CMLV46. Msx2 es requerido para la formación de hueso intermembranoso y Cbfa1 es crítico para la diferenciación de osteoblastos, la formación de hueso endocondrial y la neovascularización.
Desde hace algún tiempo se las reconoce como mediadores de la calcificación vascular: BMP2 y BMP4 están implicadas en la mineralización y en la inducción de la inflamación local, mientras que BMP7 retrasa la calcificación vascular. Las BMPs se expresan en variedad de células en las lesiones ateroscleróticas como son en las endoteliales y en las CMLV47,48 El efecto de BMP2en la calcificación vascularestá inhibido por MGP49.
RANKL
RANKL (también denominada OPGL) es una proteína de 316 aminoácidos con un peso molecular de 38 kD. Su expresión está también modulada por varias citoquinas, glucocorticoides y PTH50. RANKL se produce por células de la línea osteoblástica y células T activadas. Promueve la formación, fusión, diferenciación, activación y supervivencia de osteoclastos, permitiendo el aumento de la resorción y pérdida de hueso51. RANKL estimula a su receptor específico RANK, que se expresa en un número más reducido de células como los progenitores y osteoclastos maduros, las células T activadas y las células dendríticas52–54. La activación de RANK por RANKL inicia la cascada de señalización intracelular de NF–κB. El paso final de activación de RANK es la translocación al núcleo de NF–κB, el cual puede tener lugar por la vía clásica o por la vía alternativa. Ambas vías están reguladas por sus quinasas que son, respectivamente, IKKβ e IKKα. La translocación al núcleo de NF–κB modula la expresión de diferentes genes como, por ejemplo, BMP455 (figura 2).
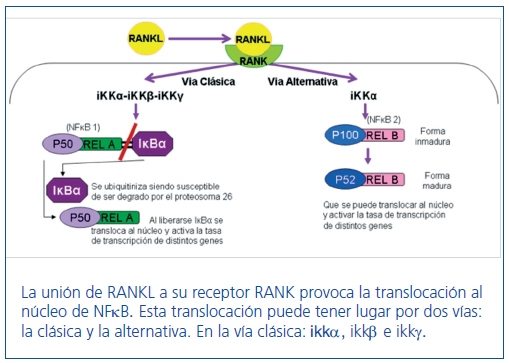
Figura 2. Esquema de la activación de RANK por RANKL.
Los efectos biológicos de OPG son opuestos a los mediados por RANKL, ya que OPG actúa como un inhibidor soluble que previene la interacción de RANKL y la subsiguiente estimulación de su receptor RANK56.
La primera evidencia de que este sistema estaba implicado en la calcificación vascular derivó del estudio del ratón knock out para OPG, el cual presenta osteoporosis y calcificaciones de la aorta y arterias renales33. La expresión de OPG se puede encontrar en la media de arterias grandes31 y en varios tipos de células del vaso, como son las VSMC y las endoteliales57,58. En células endoteliales se ha demostrado que actúa como un factor autocrino de supervivencia58. Por el contrario, RANKL y RANK sólo se han podido localizar en las áreas calcificadas de los ratones transgénicos, pero en las arterias de ratones con el genotipo salvaje59.Otros estudios han demostrado que OPG inhibe la calcificación vascular en ratas in vivo provocada tanto por vitamina D como por warfarina60. La evidencia definitiva de que el RANKL promueve directamente la calcificación vascular llegó en 2009. En ese año, un trabajo de nuestro laboratorio demostró que el RANKL directamente aumenta la calcificación de las CMLV mediante un aumento de la expresión de BMP4. Este aumento de la expresión se debe a la activación de la vía alternativa de señalización de NFkB.
Referencias Bibliográficas
1. Giachelli CM. Vascular calcification mechanisms. J Am Soc Nephrol 2004;15:2959–64. [ Links ]
2. Burke AP, Taylor A, Farb A, et al. Coronary calcification: insights from sudden coronary death victims. Z Kardiol 2000;89(Suppl 2):49–53. [ Links ]
3. Edmonds ME, Morrison N, Laws JW, Watkins PJ. Medial arterial calcification and diabetic neuropathy. Br Med J (Clin Res Ed) 1982;284:928–30. [ Links ]
4. Schwarz U, Buzello M, Ritz E, et al. Morphology of coronary atherosclerotic lesions in patients with end–stage renal failure. Nephrol Dial Transplant 2000;15:218–23. [ Links ]
5. Ibels LS, Alfrey AC, Huffer WE, et al. Arterial calcification and pathology in uremic patients undergoing dialysis. Am J Med 1979;66:790–6. [ Links ]
6. McCullough PA, Chinnaiyan KM, Agrawal V, et al. Amplification of atherosclerotic calcification and Monckeberg's sclerosis: a spectrum of the same disease process. Adv Chronic Kidney Dis 2008;15:396–412. [ Links ]
7. Mönckeberg JG. Ueber die reine Mediaverlakalkung der Extremitaetenarterien und ihr Verhalten zur Arteriosklerose. Virchows Arch A Pathol Anat Histol 1903;171:141–67. [ Links ]
8. Shanahan CM, Cary NR, Salisbury JR, et al. Medial localization of mineralization–regulating proteins in association with Monckeberg's sclerosis: evidence for smooth muscle cell–mediated vascular calcification. Circulation 1999;100:2168–76. [ Links ]
9. Schoppet M, Al Fakhri N, Franke FE, et al. Localization of osteoprotegerin, tumor necrosis factor–related apoptosis–inducing ligand, and receptor activator of nuclear factor–kappa B ligand in Monckeberg's sclerosis and atherosclerosis. J Clin Endocrinol Metab 2004;89:4104–12. [ Links ]
10. Castillo BV, Jr., Torczynski E, Edward DP. Monckeberg's sclerosis in temporal artery biopsy specimens. Br J Ophthalmol 1999;83:1091–2. [ Links ]
11. Micheletti RG, Fishbein GA, Currier JS, et al. Calcification of the internal elastic lamina of coronary arteries. Mod Pathol 2008;21:1019–28. [ Links ]
12. Goebel FD, Fuessl HS. Monckeberg's sclerosis after sympathetic denervation in diabetic and non–diabetic subjects. Diabetologia 1983;24:347–50. [ Links ]
13. Coll B, Betriu A, Martínez–Alonso M, et al. Large Artery Calcification on Dialysis Patients Is Located in the Intima and Related to Atherosclerosis. Clin J Am Soc Nephrol 2010. En prensa. doi:10.2215/CJN.04290510 [ Links ]
14. Speer MY, Giachelli CM. Regulation of cardiovascular calcification. Cardiovascular Pathology 2004;13:63–70. [ Links ]
15. Block GA, Hulbert–Shearon TE, Levin NW, Port FK. Association of serum phosphorus and calcium x phosphate product with mortality risk in chronic hemodialysis patients: A national study. Am J Kidney Dis 1998;31:607–17. [ Links ]
16. Block GA, Port FK. Re–evaluation of risks associated with hyperphosphatemia and hyperparathyroidism in dialysis patients: Recommendations for a change in management. Am J Kidney Dis 2000;35:1226–37. [ Links ]
17. Reynolds JL, Joannides AJ, Skepper JN, et al. Human vascular smooth muscle cells undergo vesicle–mediated calcification in response to changes in extracellular calcium and phosphate concentrations: A potential mechanism for accelerated vascular calcification in ESRD. J Am Soc Nephrol 2004;15:2857–67. [ Links ]
18. Steitz SA, Speer MY, Curinga G, et al. Smooth muscle cell phenotypic transition associated with calcification: upregulation of Cbfa1 and down regulation of smooth muscle lineage markers. Circ Res 2001;89:1147–54. [ Links ]
19. Proudfoot D, Skepper JN, Hegyi L, et al. Apoptosis regulates human vascular calcification in vitro – Evidence for initiation of vascular calcification by apoptotic bodies. Circ Res 2000;87:1055–62. [ Links ]
20. Tyson KL, Reynolds JL, McNair R, et al. Osteo/chondrocytic transcription factors and their target genes exhibit distinct patterns of expression in human arterial calcification. Arterioscler Thromb Vasc Biol 2003;23:489–94. [ Links ]
21. Mori K, Shioi A, Jono S, et al. Expression of matrix Gla protein (MGP) in an in vitro model of vascular calcification. FEBS Lett 1998;433:19–22. [ Links ]
22. Jono S, Ikari Y, Vermeer C, et al. Matrix Gla protein is associated with coronary artery calcification as assessed by electron–beam computed tomography. Thromb Haemost 2004;91:790–4. [ Links ]
23. Luo G, Ducy P, Mckee MD, et al. Spontaneous calcification of arteries and cartilage in mice lacking matrix GLA protein. Nature 1997;386:78–81. [ Links ]
24. Heiss A, DuChesne A, Denecke B, et al. Structural basis of calcification inhibition by alpha 2–HS glycoprotein/fetuin–A. Formation of colloidal calciprotein particles. J Biol Chem 2003;278:13333–41. [ Links ]
25. Schafer C, Heiss A, Schwarz A, et al. The serum protein alpha 2–Heremans–Schmid glycoprotein/fetuin–A is a systemically acting inhibitor of ectopic calcification. J Clin Invest 2003;112:357–66. [ Links ]
26. Giachelli CM, Steitz S. Osteopontin: a versatile regulator of inflammation and biomineralization. Matrix Biol 2000;19:615–22. [ Links ]
27. Ikeda T, Shirasawa T, Esaki Y, et al. Osteopontin mRNA is expressed by smooth muscle–derived foam cells in human atherosclerotic lesions of the aorta. J Clin Invest 1993;92:2814–20. [ Links ]
28. Fitzpatrick LA, Severson A, Edwards WD, Ingram RT. Diffuse calcification in human coronary arteries. Association of osteopontin with atherosclerosis. J Clin Invest 1994;94:1597–604. [ Links ]
29. Hirota S, Imakita M, Kohri K, et al. Expression of osteopontin messenger RNA by macrophages in atherosclerotic plaques. A possible association with calcification. Am J Pathol 1993;143:1003–8. [ Links ]
30. Speer MY, Mckee MD, Guldberg RE, et al. Inactivation of the osteopontin gene enhances vascular calcification of matrix Gla protein–deficient mice: evidence for osteopontin as an inducible inhibitor of vascular calcification in vivo. J Exp Med 2002;196:1047–55. [ Links ]
31. Simonet WS, Lacey DL, Dunstan CR, et al. Osteoprotegerin: A novel secreted protein involved in the regulation of bone density. Cell 1997;89:309–19. [ Links ]
32. Collin–Osdoby P. Regulation of vascular calcification by osteoclast regulatory factors RANKL and osteoprotegerin. Circ Res 2004;95:1046–57. [ Links ]
33. Bucay N, Sarosi I, Dunstan CR, et al. Osteoprotegerin–deficient mice develop early onset osteoporosis and arterial calcification. Genes & Development 1998;12:1260–8. [ Links ]
34. Jono S, Ikari Y, Shioi A, et al. Serum osteoprotegerin levels are associated with the presence and severity of coronary artery disease. Circulation 2002;106:1192–4. [ Links ]
35. Moe SM, Duan D, Doehle BP, et al. Uremia induces the osteoblast differentiation factor Cbfa1 in human blood vessels. Kidney Int 2003;63:1003–11. [ Links ]
36. Tintut Y, Patel J, Parhami F, Demer LL. Tumor necrosis factor–alpha promotes in vitro calcification of vascular cells via the cAMP pathway. Circulation 2000;102:2636–42. [ Links ]
37. Stenvinkel P, Ketteler M, Johnson RJ, et al. IL–10, IL–6, and TNF–alpha: central factors in the altered cytokine network of uremia––the good, the bad, and the ugly. Kidney Int 2005;67:1216–33. [ Links ]
38. Watson KE, Parhami F, Shin V, Demer LL. Fibronectin and collagen I matrixes promote calcification of vascular cells in vitro, whereas collagen IV matrix is inhibitory. Arterioscler Thromb Vasc Biol 1998;18:1964–71. [ Links ]
39. Watson KE, Bostrom K, Ravindranath R, et al. TGF–beta 1 and 25–hydroxycholesterol stimulate osteoblast–like vascular cells to calcify. J Clin Invest 1994;93:2106–13. [ Links ]
40. Shioi A, Katagi M, Okuno Y, et al. Induction of bone–type alkaline phosphatase in human vascular smooth muscle cells: roles of tumor necrosis factor–alpha and oncostatin M derived from macrophages. Circ Res 2002;91:9–16. [ Links ]
41. Jono S, Nishizawa Y, Shioi A, Morii H. 1,25–dihydroxyvitamin D–3 increases in vitro vascular calcification by modulating secretion of endogenous parathyroid hormone–related peptide. Circulation 1998;98:1302–6. [ Links ]
42. Ducy P, Zhang R, Geoffroy V, et al. Osf2/Cbfa1: a transcriptional activator of osteoblast differentiation. Cell 1997;89:747–54. [ Links ]
43. Jono S, Mckee MD, Murry CE, et al. Phosphate regulation of vascular smooth muscle cell calcification. Circ Res 2000;87:E10–E17. [ Links ]
44. Chen D, Zhao M, Mundy GR. Bone morphogenetic proteins. Growth Factors 2004;22:233–41. [ Links ]
45. Wang EA, Rosen V, D'Alessandro JS, et al. Recombinant human bone morphogenetic protein induces bone formation. Proc Natl Acad Sci USA 1990;87:2220–4. [ Links ]
46. Hruska KA, Mathew S, Saab G. Bone morphogenetic proteins in vascular calcification. Circ Res 2005;97:105–14. [ Links ]
47. Bostrom K, Watson KE, Horn S, et al. Bone morphogenetic protein expression in human atherosclerotic lesions. J Clin Invest 1993;91:1800–9. [ Links ]
48. Shin V, Zebboudj AF, Bostrom K. Endothelial cells modulate osteogenesis in calcifying vascular cells. J Vasc Res 2004;41:193–201. [ Links ]
49. Zebboudj AF, Imura M, Bostrom K. Matrix GLA protein, a regulatory protein for bone morphogenetic protein–2. J Biol Chem 2002;277:4388–94. [ Links ]
50. Kong YY, Boyle WJ, Penninger JM. Osteoprotegerin ligand: a regulator of immune responses and bone physiology. Immunol Today 2000;21:495–502. [ Links ]
51. Kong YY, Feige U, Sarosi I, et al. Activated T cells regulate bone loss and joint destruction in adjuvant arthritis through osteoprotegerin ligand. Nature 1999;402:304–9. [ Links ]
52. Anderson DM, Maraskovsky E, Billingsley WL, et al. A homologue of the TNF receptor and its ligand enhance T–cell growth and dendritic–cell function. Nature 1997;390:175–9. [ Links ]
53. Myers DE, Collier FM, Minkin C, et al. Expression of functional RANK on mature rat and human osteoclasts. FEBS Lett 1999;463:295–300. [ Links ]
54. Green EA, Flavell RA. TRANCE–RANK, a new signal pathway involved in lymphocyte development and T cell activation. J Exp Med 1999;189:1017–20. [ Links ]
55. Kanegae Y, Tavares AT, Izpisua Belmonte JC, Verma IM. Role of Rel/NF–kappaB transcription factors during the outgrowth of the vertebrate limb. Nature 1998;392:611–4. [ Links ]
56. Yasuda H, Shima N, Nakagawa N, et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis–inhibitory factor and is identical to TRANCE/RANKL. Proc Natl Acad Sci USA 1998;95:3597–602. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
José Manuel Valdivielso,
Servicio de Nefrología,
Hospital Universitari Arnau de Vilanova.
IRBLLEIDA, Rovira Roure 80,
25198, Lleida
E–mail:
valdivielso@medicina.udl.es
Enviado a Revisar: 29 Nov. 2010
Aceptado el: 30 Nov. 2010














