Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nefrología (Madrid)
versão On-line ISSN 1989-2284versão impressa ISSN 0211-6995
Nefrología (Madr.) vol.32 no.2 Cantabria 2012
Microalbuminuria en pacientes adultos ambulatorios sin control nefrológico y con factores de riesgo de enfermedad renal crónica en Servicios de Nefrología de Perú
Microalbuminuria in adult outpatients not receiving nephrological care and with risk factors for chronic kidney disease in Peruvian nephrology departments
Campaña Nacional del Día Mundial del Riñón 2010*
Sociedad Peruana de Nefrología.
Dirección para correspondencia
RESUMEN
Antecedentes: La enfermedad renal crónica es un problema de salud pública. Un diagnóstico precoz anticipa la posibilidad de daño vascular y sus complicaciones, y obliga a tomar medidas terapéuticas rápidas para impedir futuras complicaciones.
Objetivo: Determinar la frecuencia de microalbuminuria (MAU) en pacientes ambulatorios sin control nefrológico, con factores de riesgo conocidos y definir si hay un modelo de paciente en el cual el tamizaje se hace más eficiente.
Métodos: Se realizó un estudio transversal en 2968 pacientes, en 23 centros hospitalarios de Perú. Fueron incluidos pacientes ambulatorios mayores de 18 años de edad, con diagnóstico previo de obesidad, hipertensión arterial (HTA) y/o diabetes mellitus (DM). En ellos se determinó el índice de masa corporal, el índice cintura cadera (IC/C), la presencia de MAU mediante tira reactiva y la presión arterial. Se determinó la fuerza de asociación (odds ratio [OR]) de estas variables con la presencia de MAU. Resultados: La edad media fue 52,76 ± 14,24 años. El 57,48% de la muestra provino de Lima y el 68,41% fueron mujeres. Hubo 508 (19,29%) que tenían diagnóstico de DM, 1368 (51,93%) HTA y 758(28,78%) obesidad. La prevalencia general de MAU fue del 53,45%. El 8,96% tuvo MAU > 100 mg/l. Hubo asociación significativa con DM (OR: 11,62, intervalo de confianza [IC]: 8,55-15,78) y con HTA mal controlada (OR: 1,48; IC: 1,24-1,76). Los captados en Lima (OR: 0,75; IC: 0,64-0,89) y las mujeres (OR: 0,72; IC: 10,60-0,86) mostraron asociación como factores protectores.
Conclusión: La prevalencia de MAU en la población estudiada fue del 53,45%. El modelo de asociación más relevante fue tener DM y estar hipertenso durante la evaluación.
Palabras clave: Microalbuminuria, Diabetes mellitus, Hipertesión arterial.
ABSTRACT
Chronic kidney disease (CKD) is a public health issue and is considered a common and harmful, but treatable disease. Early diagnosis can prevent the possibility of severe vascular damage and its complications, facilitating prompt and aggressive therapeutic measures.
Objective: To determine the frequency of microalbuminuria (MAU) in outpatients with known risk factors and to analyse whether a patient model exists in which screening is more efficient.
Methods: Ours was an observational, cross-sectional study involving 2968 patients from 23 nephrology centres in Peru. Inclusion criteria were: male and female outpatients aged ≥18 years with previous diagnosis of hypertension (AHT), diabetes mellitus (DM) and/or obesity. We obtained values for body mass index (BMI), waist hip ratio (WHR), blood pressure, and microalbuminuria by dipstick. We then tested for the association of these variables with MAU using odds ratios (OR).
Results: The mean age of our patients was 52.76±14.24 years, 68.41% were women, and 57.48% of the patients came from the capital. DM was diagnosed in 508 patients (19.29%), 1368 (51.93%) had hypertension, and 758 (28.78%) were obese. The frequency of MAU was 53.45%, and 8.96% of patients had MAU>100 mg/L. There was a highly significant correlation with DM (OR: 11.62; 95% CI: 8.55-15.78) and AHT (OR: 1.48; 95% CI: 1.24-1.76), while being from the capital (OR: 0.75; 95% CI: 0.64-0.89) and female sex (OR: 0.72; 95% CI: 10.60-0.86) acted as protective factors.
Conclusions: The frequency of microalbuminuria in the population studied was 53.45%. There was a highly significant correlation with diabetes and a hypertension found during evaluation, while being from the capital and female sex acted as protective factors.
Key words: Microalbuminuria, Diabetes mellitus, Hypertension.
Introducción y objetivos
La enfermedad renal crónica (ERC) es un problema de salud pública y es considerada una enfermedad común, dañina pero tratable. Hay estudios que indican que su prevalencia en el mundo es alta 10-16%1,2 y que su incidencia se ha incrementado dramáticamente durante la última década, influyendo gravemente en la economía de la salud3,4.
La prevalencia de la ERC que requiere terapia de diálisis (ERC terminal) es aproximadamente de 337 pacientes por millón de habitantes (ppmh) en Estados Unidos1, 126 ppmh en Europa4,5 y en nuestro país, si se considera la población general, de alrededor de 268 pacientes pmp6.
Las principales causas que generan la ERC son la diabetes mellitus (DM), la hipertensión arterial (HTA) y las enfermedades glomerulares primarias4,5. Estas tres patologías agrupan cerca del 50% de los pacientes que actualmente se encuentran en programas de reemplazo renal crónico7,8, y todas ellas se caracterizan por tener como marcador temprano o tardío de la enfermedad la presencia de proteinuria8,9.
Existe evidencia de que ciertos tratamientos pueden prevenir o retrasar las complicaciones, retardar la progresión y reducir el riesgo de enfermedad cardiovascular en los pacientes con ERC10. En este sentido, valorar la proteinuria es parte importante del diagnóstico para evaluar el pronóstico de la enfermedad y para el seguimiento de las intervenciones terapéuticas8,11. Incluso, la detección temprana mediante la microalbuminuria (MAU) ha quedado definida como uno de los mejores métodos para cambiar el curso natural de las enfermedades que generan ERC.
El concepto de MAU fue introducido en 198212 como marcador biológico precoz de nefropatía diabética. Posteriormente fue extendido como factor de riesgo cardiovascular, de mortalidad en la población general, de disfunción endotelial y/o como alteración vascular sistémica en la HTA13.
En la ERC, el interés es disminuir su incidencia, por lo que es imperativo enfatizar la detección temprana de daño renal en las enfermedades mayormente responsables de la ERC en la población: DM, HTA y glomerulopatías14. En 1968, Wilson y Jungner definieron criterios a cumplir para que un programa de prevención de ERC y tamizaje fuera beneficioso15. Entre estos criterios se subraya su focalización en las enfermedades de alta prevalencia con efectos importantes sobre el individuo, asintomáticos por largo tiempo, prevenibles, fácilmente detectables y, sobre todo, donde se hubiere demostrado que el coste de la detección y la prevención es menor que el de la enfermedad. A los conceptos antes referidos se ha agregado la enfermedad cardiovascular, la historia familiar de ERC y la obesidad16-18.
Muchos conceptos anteriores ya han sido estudiados en poblaciones de países desarrollados. Sin embargo, la influencia específica de ciertas enfermedades prevalentes en poblaciones de países en vías de desarrollo no está bien definida, por cuanto estas mismas enfermedades podrían tener gravitación variable según la composición de una población específica, como la edad, la raza y el medio ambiente.
En esta dirección, este estudio pretende determinar la frecuencia de la MAU en pacientes con factores de riesgo definidos, como DM, HTA y obesidad, que acudieron a servicios de Nefrología de hospitales de Perú el Día Mundial del Riñón del año 2010, y establecer un modelo de paciente en el cual el tamizaje se hace más eficiente.
Material y métodos
El presente es un estudio descriptivo transversal, que incluyó pacientes ambulatorios, voluntarios de ambos sexos, mayores de 18 años de dad, con factores de riesgo conocidos para ERC (HTA, DM y obesidad), que acudieron a la campaña de detección de ERC en el año 2010, con motivo del Día Mundial del Riñón, y que no tuvieron control nefrológico previo. Esta campaña fue organizada por la Sociedad Peruana de Nefrología, en coordinación con los Servicios de Nefrología de los diferentes hospitales del país, con los que se coordinó seis meses previos al evento. Cada Servicio de Nefrología fue dotado de los materiales necesarios para la campaña. La difusión se realizó a nivel nacional, en los diferentes medios de comunicación: radio, televisión y medios escritos, donde se daban a conocer conceptos básicos sobre la enfermedad renal y se invitaba a la población con factores de riesgo a acercarse a los locales de campaña.
Mediante una ficha de datos estándar y común para todas las sedes, se recogieron datos demográficos (sexo, edad, procedencia, grado de instrucción), antecedentes de historia personal de salud (DM, HTA) y detalles sobre el estilo de vida (actividad física, tabaquismo, ingesta de alcohol). Cada paciente tuvo una evaluación clínica que registró su presión arterial, talla, peso, cálculo de índice de masa corporal (IMC) e índice cintura/cadera (IC/C).
Según el resultado de la evaluación, cada paciente tuvo consejo nutricional y médico. Los pacientes con resultado positivo para MAU fueron derivados para evaluación y seguimiento por cada servicio de Nefrología.
La determinación de MAU se realizó con tiras reactivas Micral Test II® (Boehringer Mannheim), basándose en una técnica de inmunocaptura específica, en la que la reacción de color está mediada por una enzima ligada a anticuerpos. Siguiendo las directrices del fabricante respecto a la conservación, la toma de muestra e interpretación de los resultados, que son únicamente cualitativos, se consideró positivo un valor de MAU cuya tira reactiva fue ≥ 20 mg/l (1+, 2+ o 3+), teniendo en cuenta la escala cromática indicada por el fabricante
Se consideró sobrepeso si el IMC fue ≥ 25 y obesidad si fue ≥ 30. Se consideró IC/C normal en varones valores entre 0,78-0,94 y en mujeres entre 0,71-0,85.
En el análisis descriptivo se examinó la distribución de las frecuencias para cada una de las variables consideradas, expresándolas como media y desviación estándar para variables continuas y proporciones para variables categóricas.
Definiendo MAU como variable dependiente, se calculó el odds ratio (OR) y su intervalo de confianza del 95% (IC 95%) para las variables cualitativas categóricas y la prueba de t-test para las variables continuas. Posteriormente, se realizó análisis multivariado para definir el modelo significativo asociado a MAU en la población estudiada. Se utilizó el programa estadístico STATA 9,9.
Resultados
Fueron evaluados 2968 pacientes. De ellos, 334 (11,25%) no presentaban ningún antecedente de enfermedad crónica, por lo que fueron excluidos de la evaluación final, siendo la población de estudio 2634 pacientes, con una edad media de 52,76 ± 14,24 (rango 18-95 años). La población fue mayormente compuesta por mujeres (68,41%). La campaña de salud se realizó en 23 hospitales de todo el país: 11 de la ciudad capital (Lima) y 12 de otras ciudades (figura 1). El 57,48% de los pacientes fueron de Lima y el 42,52% del resto del país. Trescientos noventa y siete (15,1%) provenían de ciudades con altitud superior a 1500 msnm.
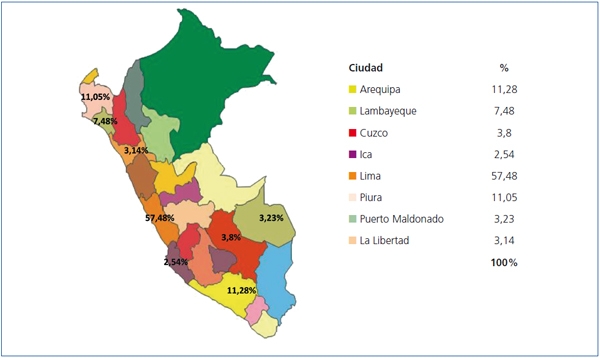
Figura 1. Distribución de pacientes según su procedencia
Según el grado de instrucción, 950 pacientes (35,46%) tenían estudios superiores, 916 (34,78%) tenían estudios secundarios, 634 (24,07%) tenían estudios primarios y 150 (5,69%) eran analfabetos.
De los pacientes, 1368 (51,93%) sabían que tenían HTA, 758 (28,78%) tenían obesidad y 508 (19,29%) presentaban DM. El tabaquismo estuvo presente en el 4% (105) de todos los evaluados, mientras que la ingesta de alcohol de al menos una vez por semana fue referido en el 10,5% (277) y sólo el 30,48% (803) realizaban ejercicio físico regular.
El peso medio de los pacientes evaluados fue de 68,11 ± 13,23 kg (34-137,5), y la media de IMC fue de 27,95 ± 4,86 kg/m2 (15,76-56,39). El IC/C fue en promedio de 0,90 ± 0,07 cm (0,62-1,47).
Se encontró MAU de 53,45% (1408) de la población estudiada y, al evaluarse la gravedad de la MAU, se halló que el 9,3% de los pacientes tuvieron una MAU > 100 mg/l.
La asociación de MAU en función de los antecedentes patológicos se observa en la tabla 1. Está presente en el 89,96% (457/508) de los diabéticos, en el 52,12% (713/1368) de los hipertensos, en el 57,65% (437/758) de los obesos, en el 28,42% (27/95) de los fumadores y en el 18,77% (52/277) de los pacientes que referían ingesta de alcohol por lo menos una vez por semana. En el caso de los pacientes que tenían presencia de dos patologías, el 69,4% (422/608) de ellos presentó MAU.
Tabla 1. Características generales 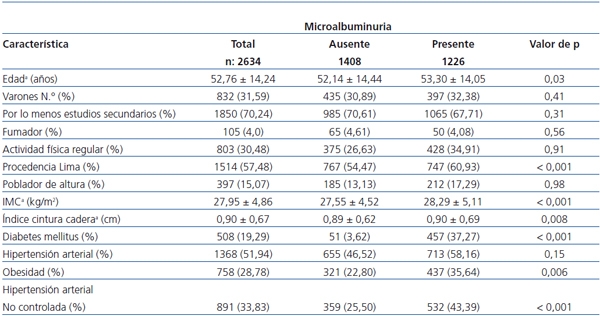
* Valores son media ± desviación estándar.
Poblador de altura definido como habitante de altitud > 1500 m sobre el nivel del mar.
IMC: índice de masa corporal definido como peso/talla2.
Al realizar regresión logística multivariada, se encontró que el modelo de paciente en el que el tamizaje mostró ser más eficiente es aquél con antecedente de DM y que durante la evaluación se le encontró HTA no controlada. El hecho de vivir en Lima y el de ser mujer se asociaron con la MAU como factores de protección. Sin embargo, fue la DM (OR: 11,62; IC: 8,55-15,78) el factor más importante para el hallazgo de MAU (tabla 2).
Tabla 2. Análisis multivariado 
IC: intervalo de confianza; OR: odds ratio.
Discusión
La ERC en Perú, al igual que en otros países, ha tenido un incremento exponencial en los últimos años asociado a varios factores, como: el aumento de la supervivencia, la mayor prevalencia de las enfermedades crónicas, pero sobre todo la falta de medidas de promoción y prevención de la salud renal.
Este trabajo es un esfuerzo realizado por los médicos nefrólogos de Perú, con la finalidad de tener datos nacionales y poder reforzar las estrategias sanitarias de prevención.
Encontramos que la frecuencia de MAU en diabéticos evaluados (89,9%) es mayor que la reportada por otros autores.
La prevalencia de MAU en pacientes con DM varía según la raza, siendo más alta en asiáticos e hispanos que en blancos19,20. La magnitud de esta diferencia se reportó en un estudio internacional de 24.000 pacientes con DM sin albuminuria conocida20. La media de duración de DM fue casi de ocho años y la tasa de MAU fue significativamente más alta en asiáticos e hispanos (43%) que en blancos (33%). Y así lo demuestran las cifras obtenidas por trabajos realizados en Latinoamérica, especialmente en México. Cerón Sánchez et al.21 reportaron un 67,3% de pacientes con MAU en una población de Tamaulipas (México) mediante relación albúmina/creatinina; Olaguer et al.22 hallaron un 85,3% de MAU medida en orina de 24 horas en pacientes de la Seguridad Social de Coahuila; Gonzales Villalpando et al.23 encuentran un 54,7% de MAU en Ciudad de México, y Cueto Manzano et al. demuestran un 40% de nefropatía temprana (MAU con tasa de filtración glomerular normal o levemente alterada) en pacientes mexicanos24. Estas cifras difieren de las encontradas en población europea, en las que la MAU en promedio alcanza el 30%25-27.
Nuestra cifra de MAU en los pacientes hipertensos sólo es comparable con la que encontraron Habbal et al.28 (67,8%) en un estudio transversal que incluyó 457 sujetos hipertensos de Marruecos.
Respecto a la altitud, hay reportes previos que encuentran MAU en poblaciones que habitan entre 3200 y 4000 msnm y que presentan policitemia y/o hiperuricemia29,30. En nuestro caso, no evaluamos habitantes de gran altitud.
Una explicación probable para la mayor proporción de MAU en nuestro trabajo es el hecho de que se trató de una campaña de salud donde no se llevó a cabo estratificación de los pacientes de acuerdo al tiempo de enfermedad, lo que es extremadamente importante e involucra mayor gravedad, especialmente en DM. Como se realizó en los recintos hospitalarios, puede haber atraído a pacientes de mayor nivel de complejidad, y finalmente está el uso de la tira reactiva como medio de medición, que entre sus limitaciones tiene la producción de falsos positivos o negativos según el nivel de dilución o alcalinización de la orina.
Si bien la mayoría de guías de práctica clínica desaconsejan el uso de la tira reactiva como prueba de cribado para detectar proteinuria y MAU, las que la incluyen recomiendan la confirmación del resultado mediante una medida cuantitativa31,32.
Sin embargo, en países donde se desconoce la prevalencia de la ERC y se inician las campañas de despistaje, se la ha utilizado para el tamizaje, reduciendo costes, ampliando la cobertura y haciendo difusión sobre la misma29,33. A pesar de sus limitaciones para la búsqueda de enfermedad renal, nosotros la usamos, porque no todos los servicios de Nefrología tenían la capacidad de medir los cocientes de proteinuria/creatinina o albúmina/creatinina. Todo paciente con resultado de MAU positivo fue orientado para realizar una consulta con Nefrología para descartar definitivamente la ERC.
A partir de este trabajo, es importante plantear futuros estudios que incluyan la medición del nivel de función renal, lo que permitirá identificar el estadio y dirigir a los pacientes a las instancias respectivas. Además, hay que poner énfasis en programas de control y prevención de enfermedades crónicas (DM e HTA) y fortalecer los programas de salud renal para mejorar la atención y disminuir la morbimortalidad asociada a enfermedad renal.
En conclusión, encontramos que para nuestro estudio la frecuencia de MAU fue del 53,41%, y el modelo de paciente en el que el tamizaje es más eficiente para la búsqueda de la enfermedad renal es aquel que es portador de DM y que durante la evaluación presenta HTA no controlada. La procedencia de Lima y el ser de sexo femenino actuaron como factores de protección.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Agradecimientos
A todos los equipos multidisciplinarios que en cada centro hospitalario colaboraron para el desarrollo de la Campaña Nacional del Día Mundial del Riñón 2010 en Perú.
*Grupo Formado por:
Carmen Berrios Medina (Sociedad Peruana de Nefrología, Comité Organizador), Jessica Bravo Zúñiga (Sociedad Peruana de Nefrología, Comité Organizador), Pedro Castillo Rodríguez (Sociedad Peruana de Nefrología, Comité Organizador), Martín Gómez Luján (Sociedad Peruana de Nefrología, Comité Organizador), Leonidas Carrillo Carrillo (Sociedad Peruana de Nefrología, Comité Organizador), César Torres Zamudio (Sociedad Peruana de Nefrología, Comité Organizador), Alaciel Palacios Guillén (Sociedad Peruana de Nefrología Comité Organizador, Hospital Daniel A. Carrión, Callao), Javier Cieza Zevallos (Hospital Cayetano Heredia, Lima), César Loza Munarriz (Hospital Cayetano Heredia, Lima), Raúl Hinojosa Obando (Hospital ESSALUD, Arequipa), José Luis Gonzáles Polar Garcés (Hospital Honorio Delgado, Arequipa), Carlos Barbarán García (Hospital Santa Rosa, Puerto Maldonado), Jhony Paredes Silva (Hospital Essalud, La Libertad), Rina Barreto Jara (Hospital Essalud, Cusco), Anna Kaluguina de Yrigoin (Hospital Essalud, Chiclayo), Myrian Fiestas Mogollón (Hospital Cayetano Heredia, Piura), Ana Tafur Villalobos (Hospital Essalud, Piura), Clarense Campos Buleje (Hospital Regional de Ica), Ernesto Valencia Valz (Hospital Naval, Callao), Carlos Huamán Hidalgo (Hospital Central Fuerza Aérea del Perú), Aníbal Zambrano Sifuentes (Hospital Militar Central del Ejército del Perú), Abdías Hurtado Arestegui (Hospital Arzobispo Loayza, Lima), Víctor Gonzales Perez (Hospital 2 de Mayo, Lima), Juan Rodríguez Prkut (Hospital Hipólito Unanue, Lima), Rebeca Belling Salas (Hospital María Auxiliadora, Lima), Dimas Rodríguez Conde (Hospital SergioBernales, Lima), Gina Solís Vásquez (Hospital Alberto Sabogal, Callao).
Referencias Bibliográficas
1. Chadban SJ, Briganti EM, Kerr PG, Dunstan DW, Welborn TA, Zimmet PZ, et al. Prevalence of kidney damage in Australian adults: The AusDiab kidney study. J Am Soc Nephrol 2003;14(7 Suppl 2):S131-8. [ Links ]
2. Zhang L, Zhang P, Wang F, Zuo L, Zhou Y, Shi Y, et al. Prevalence and factors associated with CKD: a population study from Beijing. Am J Kidney Dis 2008;51:373-84. [ Links ]
3. US Renal Data System. USRDS annual data reports (2000-2007): atlas of chronic kidney disease and end-stage renal disease in the United States. Bethesda, MD: National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases; 2007. [ Links ]
4. Van Dijk PC, Jager KJ, de Charro F, Collart F, Cornet R, Dekker FW, et al.; ERA-EDTA registry. Renal replacement therapy in Europe: the results of a collaborative effort by the ERA-EDTA registry and six national or regional registries. Nephrol Dial Transplant 2001;16:1120-9. [ Links ]
5. Amenábar JJ, García F, Robles NR, Saracho R, Pinilla J, Gentil MA, et al. Informe de diálisis y trasplante de la Sociedad Española de Nefrología y Registros Autonómicos año 2000. Nefrologia 2002;22:310-7. [ Links ]
6. Pereda C. Programas de Prevención de enfermedad renal crónica en los países del Cono Sur Latinoamericano. I Conferencia sobre enfermedad renal en poblaciones en desventaja en el Cono Sur Latinoamericano. Chaco, Argentina. Abril 2010. [ Links ]
7. Abboud H, Henrich WL. Clinical practice. Stage IV chronic kidney disease. N Engl J Med 2010;362(1):56-65. [ Links ]
8. Martín de Francisco AL, Piñera C, Gago M, Ruiz J. Robledo C, Arias M. Epidemiología de la enfermedad renal crónica en pacientes no nefrológicos. Nefrologia 2009;29(Sup. Ext. 5):101-5. [ Links ]
9. Cusumano AM, Inserra F. Enfermedad renal crónica: necesidad de implementar programas para su detección precoz y prevención de su progresión. Revista de nefrología, diálisis y trasplante 2007;27(3):113-8. [ Links ]
10. Snyder S, Pendergraph B. Detection and evaluation of chronic kidney disease. Am Fam Physician 2005;72(9):1723-32. [ Links ]
11. Escalante C, Zeledón-Sánchez F, Ulate-Montero G. Proteinuria, fisiología y fisiopatología aplicada. AMC 2007;49(2):83-9. [ Links ]
12. Viberti G, Jarrett R, Mahmud U, Hill R, Argyropoulos A, Keen H. Microalbuminuria como un predictor de nefropatía clínica en diabetes mellitus insulino-dependientes. Lancet 1982;2(8298):611. [ Links ]
13. Kaplan NM. Microalbuminuria: A risk factor for vascular and renal complications of hypertension. Am J Med 1992;92(4B):8S. [ Links ]
14. Sokol J, Hyde M. Hearing screening. Pediatr Rev 2002;23:155-62. [ Links ]
15. Wilson JM, Jungner YJ. Principles and practice of screening for disease. Geneva: World Health Organization; 1968. [ Links ]
16. Levey AS, Atkins R, Coresh J, Cohen EP, Collins AJ, Eckardt KU, et al. Chronic kidney disease as a global public health problem: approaches and initiatives - a position statement from Kidney Disease Improving Global Outcomes. Kidney Int 2007;72:247-59. [ Links ]
17. National Kidney Foundation. K/DOQI clinical practice guidelines guidelines for chronic kidney disease: evaluation, classification, and stratification. Kidney Disease Outcome Quality Initiative. Am J Kidney Dis 2002;39(Suppl 2):S1-246. [ Links ]
18. Crowe E, Halpin D, Stevens P; Guideline Development Group. Early identification and management of chronic kidney disease: summary of NICE guidance. BMJ 2008;337:a1530. [ Links ]
19. Young BA, Katon WJ, Von Korff M, Simon GE, Lin EH, Ciechanowski PS, et al. Racial and ethnic differences in microalbuminuria prevalence in a diabetes population: the pathways study. J Am Soc Nephrol 2005;16(1):219-28. [ Links ]
20. Parving HH, Lewis JB, Ravid M, Remuzzi G, Hunsicker LG. DEMAND investigators. Prevalence and risk factors for microalbuminuria in a referred cohort of type II diabetic patients: a global perspective. Kidney Int 2006;69(11):2057-63. [ Links ]
21. Cerón-Sánchez C, Bocanegra-Alonso A, Acosta-González R, Rodríguez-Hernández R, Mier N. Microalbuminuria y su asociación con retinopatía en pacientes con diabetes mellitus tipo 2. Bioquímica 2009;34(3):115-20. [ Links ]
22. Leza-Torres O, Briones-Lara E, González-Madrazo MA, De la Cruz-Martínez Mdel C, Ramos-Dávila E. Microalbuminuria en pacientes con diabetes tipo 2. Rev Med Inst Mex Seguro Soc 2005;43(6):487-93. [ Links ]
23. González Villalpando C, Stern MP, Arredondo Pérez B, Martínez Díaz S, Islas Andrade S, Revilla C, et al. Nephropathy in low income diabetics: The Mexico City Diabetes Study. Arch Med Res 1996;27:367-72. [ Links ]
24. Cueto-Manzano AM, Cortes-Sanabria L, Martínez-Ramírez HR, Rojas-Campos E, Barragan G, Alfaro G, et al. Detection of early nephropathy in mexican patients with type 2 diabetes mellitus. Kidney Int Suppl 2005;(97):S40-5. [ Links ]
25. Lou Arnal LM, Campos Gutiérrez B, Cuberes Izquierdo M, Gracia García O, Turón Alcaine JM, Bielsa García S, et al. Prevalencia de enfermedad renal crónica en pacientes con diabetes mellitus tipo 2 atendidos en atención primaria. Nefrologia 2010;30(5):552-6. [ Links ]
26. Newman DJ, Mattock MB, Dawnay AB, Kerry S, McGuire A, Yaqoob M, et al. Systematic review on urine albumin testing for early detection of diabetic complications. Health Technol Assess 2005;9(30):iii-vi, xiii-163. [ Links ]
27. ADVANCE Collaborative Group, Patel A, MacMahon S, Chalmers J, Neal B, Billot L, et al. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008;358(24):2560-72. [ Links ]
28. Habbal R, Sekhri AR, Volpe M. Prevalence of microalbuminuria in hypertensive patients and its associated cardiovascular risk in clinical cardiology: Moroccan results of the global i-SEAR CH survey - a sub-analysis of a survey with 21 050 patients in 26 countries worldwide. Cardiovasc J Afr 2010;21(4):200-5. [ Links ]
29. Perico N, Plata R, Anabaya A, Codreanu I, Schieppati A, Ruggenenti P, Remuzzi G, et al. Strategies for national health care system in emerging. The case of screening and prevention of renal disease progression in Bolivia. Kidney Int Suppl 2005;(97):S87-94. [ Links ]
30. Jefferson JA, Escudero E, Hurtado ME, Kelly JP, Swenson ER, Wener MH, et al. Hyperuricemia, hypertension, and proteinuria associated with high-altitude polycythemia. Am J Kidney Dis 2002;39(6):1135-42. [ Links ]
31. Montañés Bermúdez R, Gracia García S, Pérez Surribas D, Martínez Castelao A, Bover Sanjuán J; Sociedad Española de Bioquímica Clínica y Patología Molecular; Sociedad Española de Nefrología. Documento de Consenso. Recomendaciones sobre la valoración de la proteinuria en el diagnóstico y seguimiento de la enfermedad renal Crónica. Nefrologia 2011;31(3):331-45. [ Links ]
32. The National Collaborating Centre for Chronic Conditions (UK). Chronic Kidney Disease: National Clinical Guideline for Early Identification and Management in Adult in Primary and Secundary Care. London: Royal College of Physicians (UK); 2008. [ Links ]
33. Rosas M, Attie F, Pasteling G, Lara A, Velazquez O, Tapia-Conyer R, et al. Prevalence of proteinuria in Mexico: A conjunctive consolidation approach with other cardiovascular risk factors: The Mexican Health Survey 2000. Kidney Int Suppl 2005;(97):S112-9. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Campaña Nacional del Día Mundial del Riñón 2010,
Sociedad Peruana de Nefrología.
E-mail: ivobz@yahoo.es
E-mail: sociedadperuananefrologia@yahoo.es
Enviado a Revisar: 22 Feb. 2011
Aceptado el: 14 Nov. 2011














