Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nefrología (Madrid)
versão On-line ISSN 1989-2284versão impressa ISSN 0211-6995
Nefrología (Madr.) vol.32 no.4 Cantabria 2012
https://dx.doi.org/10.3265/Nefrologia.pre2012.Jan.11168
Índices de calidad y eficiencia diagnóstica de varios marcadores de función renal para detectar la pérdida de parénquima en la edad pediátrica
Diagnostic efficiency and quality indexes of several markers of renal function for detecting the loss of parenchyma in paediatric patients
Víctor M. García-Nieto 1, María Afonso-Coderch2, Victoria E. García-Rodríguez2, Margarita Monge-Zamorano1, M. José Hernández-González1, M. Isabel Luis-Yanes1
1Sección de Nefrología Pediátrica. Hospital Universitario Nuestra Señora de Candelaria. Santa Cruz de Tenerife
2Sección de Pediatría. Hospital Universitario de Canarias. La Laguna, Santa Cruz de Tenerife
Dirección para correspondencia
RESUMEN
Introducción: En una muestra amplia de niños diagnosticados de malformaciones del tracto urinario y/o infección urinaria, hemos calculado los índices de calidad y eficiencia diagnóstica de cinco marcadores funcionales con la intención de comprobar cuáles son los más sensibles para detectar la existencia de una pérdida de parénquima renal.
Pacientes y métodos: Estudio retrospectivo transversal en el que se han evaluado las historias clínicas de 179 pacientes en edad pediátrica (91 varones, 88 mujeres). En 102 de ellos (57%), la gammagrafía demostró pérdida de parénquima. Las lesiones morfológicas más frecuentes fueron las cicatrices renales. A todos se les había practicado, al menos, una prueba de concentración realizada con estímulo de desmopresina. Además, se recogieron los resultados de los cocientes albúmina/creatinina y N-acetilglucosaminidasa (NAG)/creatinina, el filtrado glomerular renal (FGR) y el volumen urinario.
Resultados: Distribuidos los pacientes según la normalidad o anormalidad de la gammagrafía, se observaron diferencias estadísticamente significativas entre ambos grupos en cuanto a la osmolalidad urinaria máxima y el FGR. El volumen urinario estaba elevado en el 31,3% de los casos (sensibilidad: 37,9%, especificidad: 81,8%) y en el 24% se comprobó defecto de la capacidad de concentración renal (sensibilidad: 30,4%, especificidad: 84,8%). En el 12,2% de los niños la eliminación urinaria de albúmina estaba incrementada y en el 7,2% lo estaba el cociente NAG/creatinina. El FGR estaba reducido únicamente en el 5,7% de los pacientes. Estos dos últimos marcadores fueron los menos sensibles pero los más específicos para detectar pérdida de parénquima renal (100%).
Conclusiones: En nuestro estudio, las pruebas funcionales más sensibles para detectar pérdida de parénquima fueron las dos que estudian el manejo renal del agua, volumen urinario y osmolalidad urinaria máxima. Ambas mostraron, además, una especificidad superior al 80%. No obstante, la especificidad fue máxima para el cociente NAG/creatinina y el FGR que, a su vez, fueron las pruebas menos sensibles. Un FGR normal no indica necesariamente una función renal normal.
Palabras clave: Capacidad de concentración. Volumen urinario. Albuminuria. NAG. CAKUT. Enfermedad renal crónica. Pérdida de parénquima renal.
ABSTRACT
Introduction: We analysed a large sample of children diagnosed with urinary tract malformations and/or infections and calculated diagnostic efficiency and quality indexes for five different functional markers, with the goal of testing which is the most sensitive for detecting a loss of renal parenchyma.
Patients and method: Ours was a cross-sectional retrospective study in which the clinical histories of 179 paediatric patients (91 male and 88 female) were evaluated. In 102 of these patients (57%), a scintigraphy revealed loss of parenchyma. The most commonly observed morphological type of damage was renal scarring. All patients had undergone at least one desmopressin urine concentration test. We also analysed albumin/creatinine and N-acetyl-glucosaminidase (NAG)/creatinine ratios, glomerular filtration rate (GFR), and urine volume.
Results: By distributing patients according to normal/abnormal scintigraphy, we observed statistically significant differences between the two groups in maximum urine osmolality and GFR. Urine volume was elevated in 31.3% of cases (sensitivity: 37.9%; specificity: 81.8%) and 24% had a defect in renal concentrating ability (sensitivity: 30.4%; specificity: 84.8%). Urinary albumin excretion was high in 12.2% of patients, and 7.2% had a high NAG/creatinine ratio. GFR was low in only 5.7% of patients. These last two markers were the least sensitive but most specific for detecting a loss of renal parenchyma (100%).
Conclusions: In our study, the most sensitive functional tests for detecting the loss of renal parenchyma were the two that take into account the ability of the kidney to manage water, i.e. urine volume and maximum urine osmolality. These two tests had specificity >80%. However, the maximum specificity was obtained by the NAG/creatinine ratio and GFR, which were, conversely, the least sensitive tests. A normal GFR does not necessarily show normal renal function.
Key words: Concentrating capacity. Urinary volume. Albuminuria. NAG. CAKUT. Chronic kidney disease. Loss of renal parenchyma.
Introducción
Las malformaciones del tracto urinario (congenital abnormalities of the kidney and urinary tract, CAKUT) son la causa más frecuente de enfermedad renal crónica en la infancia1,2. Esta relación etiológica se debe tanto a la reducción prenatal del número de nefronas en algunos casos como a la formación secundaria de cicatrices renales cuando los pacientes padecen una o más pielonefritis agudas3-5. La nefropatía cicatrizal se desarrolla después de una pielonefritis aguda en un 25-57% de los casos6,7.
Algunas malformaciones son aparentemente «benignas» en el sentido de que el parénquima renal está intacto, como sucede en los riñones en herradura, el doble sistema pielocalicial o la ectopia renal cruzada, por ejemplo, en los que la función renal es normal. Una circunstancia peculiar es lo que acontece cuando existe una pérdida nefronal unilateral total, como es el caso de la agenesia renal o de la displasia renal multiquística. En estas circunstancias, se comprueba la instauración progresiva, a partir del nacimiento, de un proceso de hipertrofia de las nefronas remanentes con la consecuencia de que, al cabo de cierto tiempo, la función renal, en la mayoría de los casos, es normal8-10. Puesto que el comportamiento de las diversas variantes de CAKUT, en cuanto a su repercusión sobre la función renal, es tan dispar, sería adecuado en la práctica diaria disponer de unos marcadores sensibles, puesto que si, al determinarlos, son normales, se podría evitar la realización de ciertas pruebas morfológicas invasivas.
En una muestra amplia de niños diagnosticados de CAKUT y/o infección del tracto urinario, hemos calculado los índices de calidad y eficiencia diagnóstica de cinco marcadores de función renal con la intención de comprobar cuáles son los más sensiblespara detectar la existencia de una pérdida de parénquima.
Pacientes y métodos
Estudio retrospectivo transversal en el que se han evaluado las historias clínicas de 179 pacientes en edad pediátrica (91 varones, 88 mujeres) que fueron remitidos a las Consultas Externas de nuestro hospital por ser portadores de CAKUT y/o haber padecido una o más infecciones del tracto urinario. Su edad al realizar el estudio fue 5,84 ± 3,81 años (rango: 1-16 años).
Los criterios de inclusión fueron que los pacientes contaran más de un año de edad y que, al menos, tuvieran realizada una gammagrafía efectuada con ácido dimercaptosuccínico y determinada la osmolalidad urinaria máxima. Además, cuando fue posible, se recogieron los valores de los cocientes calculados entre las concentraciones de albúmina y de N-acetilglucosaminidasa (NAG) con respecto a la creatinina, correspondientes a la primera orina del día (n = 172 y 83, respectivamente). Se anotaron los niveles de creatinina plasmática y la talla en cm con objeto de calcular el filtrado glomerular renal (FGR) según la fórmula de Schwartz (n = 122)11,12. Con los valores de la creatinina plasmática y la urinaria, se calculó el volumen urinario corregido por 100 ml de FGR (n = 99). Éste se calculó mediante la siguiente fórmula: creatinina plasmática x 100/creatinina urinaria13.
Los valores bioquímicos recogidos correspondían a la determinación más cercana a la realización de la gammagrafía. Se excluyeron los pacientes con reflujo vesicoureteral persistente y aquellos que hubieran padecido una pielonefritis aguda en los dos meses previos. Igualmente, en ningún caso las gammagrafíasrecogidas habían sido realizadasdurante el episodio agudo de pielonefritis y correspondían a las realizadas, al menos, 6-9 meses después de éste.
Prueba de concentración con desmopresina
Tras vaciar la vejiga, se administraron 20μg de desmopresina por vía intranasal, 0,2 mg (200 μg) de desmopresina en tabletas o bien 0,12 mg (120 μg) del liofilizado oral (MELT) que se disuelve instantáneamente en la boca14,15. Se recogieron las tres muestras de orina emitidas a continuación que, en el caso de que el niño fuera continente, estuvieron separadas por intervalos de 90 minutos. Se dio como resultado de la prueba el valor máximo de osmolalidad obtenido.
Técnicas de laboratorio
La creatinina se determinó con el método de la creatininasa utilizando un autoanalizador Modular Analytics (Roche/Hitachi, Mannheim, Alemania). La osmolalidad urinaria se cuantificó mediante la determinación de la depresión del punto de congelación en un osmómetro Osmo Station OM-6050 (Menarini Diagnostics, Florencia, Italia). La albúmina se midió mediante una técnica nefelométrica (Array).La NAG se determinó mediante un método colorimétrico enzimático basado en la hidrólisis de la NAG-diclorofenolsulfoftaleína (Boehringer Mannheim).
Valores de normalidad
Se consideró defecto de concentración renal cuando la osmolalidad urinaria máxima fue inferior a 835 mOsm/kg15,16. Los valores de normalidad de los dos cocientes urinarios citados17-19 figuran en la tabla 1 y tabla 2. Se aceptó que los pacientes padecían enfermedad renal crónica cuando el FGR fue inferior a 90 ml/min/1,73 m2. Se consideró que el volumen urinario estaba elevado cuando fue superior a 1,03 ml/100 ml de FGR13.
Tabla 1. Valores normales del cociente albúmina/creatinina a partir del primer año de vida 
(Referencias 17 y 18).
Tabla 2. Valores normales del cociente NAG/creatinina a partir del primer año de vida 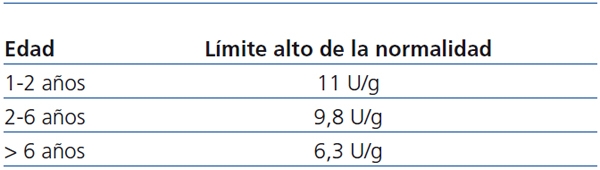
(Referencia 19).
NAG: N-acetilglucosaminidasa.
Métodos estadísticos
Para estudiar la distribución de la muestra se empleó la prueba de Kolmogorov-Smirnov. La variable FGR, que seguía una distribución normal, se expresó como media y desviación estándar. El resto de las variables cuantitativas cuya distribución no era gaussiana se expresaron en forma de mediana y rango intercuartil. Técnicas bivariantes se utilizaron para la evaluación inicial de contrastes. De este modo, la prueba exacta de Fisher se utilizó para la comparación de frecuencias entre las variables cualitativas, y el test de la U de Mann-Whitney, para la comparación de las medias entre las variables cuantitativas.
Índices de calidad y eficiencia diagnóstica
Se calcularon la sensibilidad, la especificidad, los valores predictivos positivo (VPP) y negativo (VPN) y los cocientes de probabilidad positivo (CPP) y negativo (CPN) de los cinco marcadores funcionales estudiados. Estos análisis se realizaron mediante el programa de estadística SPSS (SPSS v. 17.0, SPSS Inc., EE. UU.). Un valor de probabilidad menor de 0,05 fue considerado estadísticamente significativo.
Resultados
Los diagnósticos clínico-radiológicos de los 179 pacientes figuran en la tabla 3. Prácticamente, la mitad de ellos habían sido diagnosticados de reflujo vesicoureteral (n = 98, 54,7%) (4 de grado I, 17 de grado II, 38 de grado III, 33 de grado IV, 6 de grado V). En 58 casos, el reflujo fue unilateral y en 40, bilateral. En 9 de esos 98 niños, el reflujo fue secundario a válvulas de uretra posterior o vejiga neurógena.
Tabla 3. Diagnósticos clínico-radiológicos 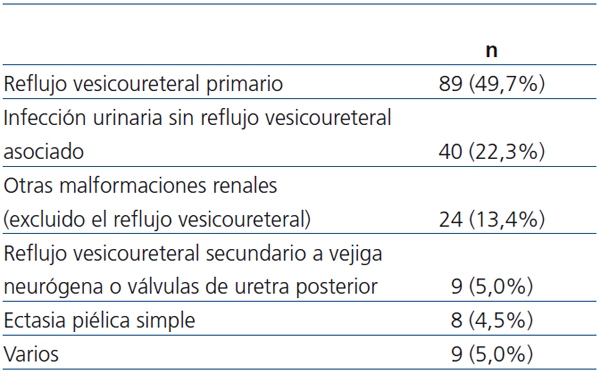
En 77 niños (43%), la gammagrafía no demostró pérdida de parénquima. En este subgrupo, además de los pacientes con estudios normales, se englobaron aquéllos con ectasia piélica y con riñones en herradura. En los 102 niños restantes (57%), la gammagrafía mostró pérdida de parénquima renal (tabla 4). Las lesiones morfológicas más frecuentes fueron las cicatrices renales.
Tabla 4. Hallazgos gammagráficos 
En 43/179 casos (24%) se comprobó defecto de la capacidad de concentración renal. En 21/172 (12,2%), la eliminación urinaria de albúmina estaba incrementada y en 6/83 (7,2%) lo estaba el cociente NAG/creatinina. En 7/122 (5,7%), el FGR estaba reducido. Además, se comprobó que el volumen urinario estaba elevado en 31/99 de los casos (31,3%).
Distribuidos los pacientes según la normalidad o anormalidad de la gammagrafía, se observaron diferencias estadísticamente significativas entre ambos grupos en cuanto a la osmolalidad urinaria máxima y el FGR (tabla 5).
Tabla 5. Valores de los parámetros funcionales estudiados distribuida la muestra según
la presencia o ausencia de alteraciones en la gammagrafía renal 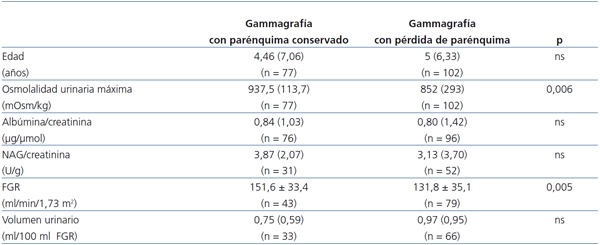
FGR: filtrado glomerular renal; NAG: N-acetilglucosaminidasa: ns: no significativa.
En la tabla 6 a tabla 10, aparece la comparación de frecuencias entre la ausencia o presencia de una alteración gammagráfica y la normalidad o anormalidad de la osmolalidad urinaria máxima, la eliminación urinaria de albúmina y NAG, el FGR y el volumen urinario, respectivamente.
Tabla 6. Comparación entre los resultados obtenidos en la prueba de concentración y los de la
gammagrafía renal 
Prueba exacta de Fisher, p = 0,02.
Tabla 7. Comparación entre los resultados de la eliminación urinaria de microalbúmina y los de
la gammagrafía 
Prueba exacta de Fisher p = 0,001.
Tabla 8. Comparación entre los resultados de la eliminación urinaria de NAG y los de
la gammagrafía 
Prueba exacta de Fisher, p = 0,32.
NAG: N-acetilglucosaminidasa.
Tabla 9. Comparación entre los resultados de FGR y los de la gammagrafía 
Prueba exacta de Fisher, p = 0,32.
FGR: filtrado glomerular renal.
Tabla 10. Comparación entre los resultados del volumen urinario corregido por 100 ml de FGR y los de
la gammagrafía renal 
Prueba exacta de Fisher p = 0,32.
FGR: filtrado glomerular renal.
Los valores de la sensibilidad, la especificidad, los valores predictivos positivo y negativo y los cocientes de probabilidad positivo y negativo de los cinco parámetros estudiados figuran en la tabla 11.
Tabla 11. Resultados obtenidos en los índices de calidad y eficiencia diagnóstica de los cinco parámetros estudiados 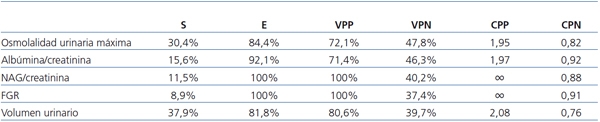
CPN: cociente de probabilidad negativo; CPP: cociente de probabilidad positivo; E: especificidad;
FGR: filtrado glomerular renal; NAG: N-acetilglucosaminidasa; S: sensibilidad; VPN: valor predictivo negativo;
VPP: valor predictivo positivo.
En los 39 pacientes que tenían en común la ausencia morfológica o funcional de uno de los riñones, analizamos la frecuencia de alteraciones en los parámetros estudiados. En todos los niños, el FGR y la eliminación urinaria de NAG fueron normales, el cociente albúmina/creatinina estaba incrementado en 6/37 casos (16,2%), la osmolalidad urinaria estaba reducida en 10/39 (25,6%) y el volumen corregido por 100 ml de FGR estaba aumentado en 8/24 (33,3%).
Cuando se compararon los valores de los marcadores funcionales estudiados entre los niños portadores de una sola cicatriz unilateral (n = 28) y los que tenían ausencia morfológica o funcional de uno de los riñones (n = 39), no se observaron diferencias en ninguno de los parámetros salvo en el FGR (154,8 ± 26,9 vs. 135,3 ± 22 ml/min/1,73 m2; p = 0,03).
Discusión
Inicialmente, nuestro estudio demuestra que en un número importante de casos, aunque el FGR sea normal, puede existir una lesión funcional renal que, obviamente, no se detecta si se determinan únicamente los niveles de los marcadores habituales de función glomerular. Así, el FGR fue el parámetro menos sensible para detectar pérdida de parénquima (tabla 11), de lo que se deduce que los mecanismos compensatorios renales determinan que el FGR se altere muy tardíamente. Por tanto, cuando el FGR estuvo alterado, siempre se comprobó la existencia de una pérdida de parénquima (especificidad: 100%).
La NAG es una enzima característica de las células tubulares proximales renales. En situación de normalidad, aparecen pequeñas cantidades en la orina. Cuando existe una agresión tubular proximal, sus niveles urinarios se incrementan19,20; el caso más paradigmático de incremento de la excreción urinaria de esa sustancia y de otras proteínas de bajo peso molecular es la administración de antibióticos aminoglucósidos21,22. En nuestros pacientes, la NAG se elevó, a excepción de un caso, cuando la pérdida de parénquima fue tan importante como para originar una enfermedad renal crónica. Algunos estudios recientes han confirmado que, en esta última circunstancia, se produce una agresión tubular proximal progresiva23que parece estar mediada por la vía de la mTOR constitutiva24. En este sentido, el uso experimental de everolimus suprime la acumulación de alfa-actina en el músculo liso, la infiltración de macrófagos y la expresión de la proteína kidney injury molecule-1 (Kim-1) en los túbulos proximales24. En definitiva, el comportamiento de la NAG fue muy similar al del FGR, es decir, con una baja sensibilidad y una alta especificidad, señal de que son parámetros muy fiables para predecir la existencia de daño renal, ya que todos los pacientes que mostraron resultados anormales de esos dos parámetros tenían una gammagrafía patológica, de tal modo que el cociente de probabilidad positivo fue ∞ para ambos parámetros (tabla 11). En consecuencia, ambos son los últimos parámetros, entre los determinados, que se alteran cuando existe una pérdida de parénquima renal.
Desde finales de los ochenta se conoce que la albúmina aparece en pequeñas cantidades en la orina desde las fases de inicio de la nefropatía diabética y en otras circunstancias clínicas que cursan con hiperfiltración glomerular25-27. Asimismo, se considera un marcador precoz de enfermedad cardiovascular28,29. Se ha descrito un incremento en la albuminuria en pacientes con reflujo vesicoureteral30,31, motivo por el que, en nuestra serie, los pacientes en los que se mantenía se excluyeron del estudio. La cuantificación de la albuminuria fue algo más sensible que los dos parámetros anteriores (15,6%) y un poco menos específica (92,1%). El 84,4% de los niños portadores de una pérdida de parénquima renal tenían la albuminuria normal (tabla 7), signo de que no existía hiperfiltración en las nefronas remanentes o, por el contrario, de una mayor capacidad glomerular para protegerse de la hiperpresión glomerular en la edad pediátrica. Una tercera opción explicativa es que, quizás, un cierto exceso de albúmina filtrada podría haber sido reabsorbido en el túbulo proximal renal32,33.
El manejo renal del agua se estudió mediante la prueba de concentración renal y la cuantificación del volumen urinario corregido por 100 ml de FGR. La concentración de la orina es el resultado de un complejo mecanismo glomerulotubular que culmina con la estimulación de la actividad de las acuaporinas para reabsorber agua en respuesta a la acción de la arginina-vasopresina (ADH) en el túbulo colector renal. Cuando cualquiera de los distintos mecanismos implicados (reabsorción tubular de agua y solutos en las distintas porciones de la nefrona, mecanismo de contracorriente, hiperosmolalidad medular, acción de la ADH) se altera, se produce un defecto en la capacidad de concentración renal que se asocia a poliuria, aunque, en los casos leves, puede no ser perceptible clínicamente. Todos los pacientes con enfermedad renal crónica de nuestra serie mostraron una osmolalidad máxima urinaria reducida (rango: 238-518 mOsm/kg) y poliuria (rango: 1,46-5,48 ml/100 ml de FGR), circunstancia que ya habíamos observado previamente13.
El volumen urinario está íntimamente relacionado con una adecuada función glomerulotubular. Como es conocido, el 99% del líquido contenido en el ultrafiltrado glomerular se reabsorbe a lo largo de los distintos túbulos renales. El volumen urinario corregido por 100 ml de FGR se utiliza escasamente en la práctica diaria. Nuestros resultados prueban como un parámetro de cálculo tan sencillo puede ser útil, de tal modo que fue el más sensible para detectar pérdida de parénquima, incluso con un porcentaje ligeramente superior al obtenido para la osmolalidad urinaria máxima. Dicho de otro modo, en aquellas situaciones que cursan con pérdida de parénquima, los parámetros que estudian el manejo renal del agua son los primeros que se afectan y, por ende, los últimos que se normalizan.
La capacidad del parénquima renal para hipertrofiarse y compensar la ausencia del tejido renal contralateral es muy elevada en la edad pediátrica. Por ello, es conocido que la agenesia o la ausencia funcional de un riñón se acompaña de una hipertrofia del riñón contralateral que deviene, generalmente, en un FGR normal8-10. No obstante, últimamente, se han publicado resultados disidentes34,35. Nuestros pacientes portadores de un riñón único funcionante mostraron niveles normales de los marcadores más específicos pero menos sensibles (FGR, eliminación urinaria de NAG), aunque, no obstante, la albuminuria estaba elevada en el 16,2% de los casos y el manejo renal del agua estaba alterado en el 25,6-33,3% de ellos.
Somos conscientes de que una de las limitaciones de este trabajo es el no haber podido cuantificar el porcentaje de la pérdida de parénquima en los estudios gammagráficos positivos. Creemos, no obstante, que es un tema ciertamente relativo, puesto que lo que realmente habría que determinar es algo irrealizable en la práctica diaria, es decir, cuantificar el número de nefronas y el grado de hipertrofia de éstas en los casos en los que existe pérdida de parénquima. La complejidad del asunto se subraya por la ausencia de diferencias, a excepción del FGR, cuando comparamos los resultados obtenidos en los niños con una sola cicatriz unilateral y los que tenían ausencia morfológica o funcional de uno de los riñones. Es difícil explicar la razón por la que existían diferencias en el FGR entre ambos subgrupos, si bien tanto los valores de la media como de -2 DS (desviación estándar) estaban dentro de la normalidad.
En resumen, en nuestra muestra las pruebas funcionales más sensibles para detectar pérdida de parénquima fueron las dos que estudian el manejo renal del agua, volumen urinario y osmolalidad urinaria máxima, mostrando ambas, además, una especificidad superior al 80%. No obstante, la especificidad fue máxima para el cociente NAG/creatinina y el FGR, las pruebas que, a su vez, se mostraron menos sensibles. Los valores obtenidos de los cocientes de probabilidad correspondientes a todos los marcadores determinados fueron superiores a 1, lo que implica que cada una de ellos es útil para detectar una pérdida de parénquima renal en la edad pediátrica. No obstante, aquellos de los que disponemos en la actualidad son muy pocos sensibles debido, sobre todo, a la gran capacidad compensadora de las nefronas restantes. El corolario final es que un FGR normal no indica necesariamente una función renal normal.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Referencias Bibliográficas
1. Areses Trapote R, Sanahuja Ibáñez MJ, Navarro M; Investigadores Centros participantes en el REPIR II. Epidemiología de la enfermedad renal crónica no terminal en la población pediátrica española. Proyecto REPIR II. Nefrologia 2010;30:508-17. [ Links ]
2. Van der Heijden BJ, Van Dijk PC, Verrier-Jones K, Jager KJ, Briggs JD. Renal replacement therapy in children: data from 12 registries in Europe. Pediatr Nephrol 2004;19:213-21. [ Links ]
3. Gordon I, Barkovics M, Pindoria S, Cole TJ, Woolf AS. Primary vesicoureteric reflux as a predictor of renal damage in children hospitalized with urinary tract infection: a systematic review and meta-analysis. J Am Soc Nephrol 2003;14:739-44. [ Links ]
4. Faust WC, Díaz M, Pohl HG. Incidence of postpyelonephritic renal scarring: a metaanalysis of the dimercapto-succinic acid literature. J Urol 2009;181:290-7. [ Links ]
5. Shaikh N, Ewing AL, Bhatnagar S, Hoberman A. Risk of renal scarring in children with a first urinary tract infection: a systematic review. Pediatrics 2010;126:1084-91. [ Links ]
6. Ditchfield MR, Grimwood K, Cook DJ, Powell HR, Sloane R, Gulati S, et al. Persistent renal cortical scintigram defects in children 2 years after urinary tract infection. Pediatr Radiol 2004;34:465-71. [ Links ]
7. Lin KY, Chiu NT, Chen MJ, Lai CH, Huang JJ, Wang YT, et al. Acute pyelonephritis and sequelae of renal scar in pediatric first febrile urinary tract infection. Pediatr Nephrol 2003;18:362-5. [ Links ]
8. Robitaille P, Mongeau JG, Lortie L, Sinnassamy P. Long-term follow-up of patients who underwent unilateral nephrectomy in childhood. Lancet 1985;1:1297-9. [ Links ]
9. Wikstad I, Pettersson BA, Elinder G, Sökücü S, Aperia A. A comparative study of size and function of the remnant kidney in patients nephrectomized in childhood for Wilms' tumor and hydronephrosis. Acta Paediatr Scand 1986;75:408-14. [ Links ]
10. Hegde S, Coulthard MG. Follow-up of early unilateral nephrectomy for hypertension. Arch Dis Child Fetal Neonatal Ed 2007;92:F305-6. [ Links ]
11. Schwartz GJ, Haycock GB, Edelmann CM Jr, Spitzer A. A simple estimate of glomerular filtration rate in children derived from body length and plasma creatinine. Pediatrics 1976;58:259-63. [ Links ]
12. Schwartz GJ, Gauthier B. A simple estímate of glomerular filtration rate in adolescents boys. J Pediatr 1985;106:522-6. [ Links ]
13. García Nieto V, Luis Yanes MI, Monge Zamorano M, Hernández González MJ, Peralta Aros C, Garin EH. Renal concentrating capacity as a marker for glomerular filtration rate. Acta Paediatr 2008;97:96-9. [ Links ]
14. Aronson AS, Svenningsen NW. DDAVP test for estimation of renal concentrating capacity in infants and children. Arch Dis Child 1974;49:654-9. [ Links ]
15. Monnens L, Smulders Y, van Lier H, de Boo T. DDAVP test for assessment of renal concentrating capacity in infants and children. Nephron 1981;29:151-4. [ Links ]
16. García Nieto V, Santos F, Rodríguez Iturbe B. Pruebas funcionales renales. En: García Nieto V, Santos Rodríguez F, Rodríguez-Iturbe B (eds.). Nefrología Pediátrica, 2.a ed. Madrid: Aula Médica; 2006. p. 51-62. [ Links ]
17. Gibb DM, Shah V, Preece M, Martin Barratt T. Variability of urine albumin excretion in normal and diabetic children. Pediatr Nephrol 1989;3:414-9. [ Links ]
18. Yap C, Yap HK, Chio LF. Urine microalbumin/creatinine ratios in Singapore children. J Singapore Paediatr Soc 1991;33:101-6. [ Links ]
19. García Nieto V, Muros M, León C, Duque J, Oliva C, Duque R, et al. Estudio de la eliminación urinaria de N-acetil-glucosaminidasa y Beta2-microglobulina en la infancia. Trastorno de su excreción en la diabetes mellitus y en patología renal. Nefrologia 1990;10:393-9. [ Links ]
20. Sherman RL, Drayer DE, Leyland-Jones BR, Reidenberg MM. N-acetyl-beta-glucosaminidase and beta 2-microglobulin. Their urinary excretion in patients with renal parenchymal disease. Arch Intern Med 1983;143:1183-5. [ Links ]
21. Powell JH, Reidenberg MM. Further studies of the response of kidney lysosomes to aminoglycosides and other cations. Biochem Pharmacol 1983;32:3213-20. [ Links ]
22. Glass S, Plant ND, Spencer DA. The effects of intravenous tobramycin on renal tubular function in children with cystic fibrosis. J Cyst Fibros 2005;4:221-5. [ Links ]
23. Zager RA. Uremia induces proximal tubular cytoresistance and heme oxygenase-1 expression in the absence of acute kidney injury. Am J Physiol Renal Physiol 2009;296:F362-8. [ Links ]
24. Nakagawa S, Masuda S, Nishihara K, Inui K. mTOR inhibitor everolimus ameliorates progressive tubular dysfunction in chronic renal failure rats. Biochem Pharmacol 2010;79:67-76. [ Links ]
25. Dahlquist G, Stattin EL, Rudberg S. Urinary albúmina excretion rate and glomerular filtration rate in the prediction of diabetic nephropathy; a long term follow-up study of childhood onset type-1 diabetic patients. Nephrol Dial Transplant 2001;16:1382-6. [ Links ]
26. Palatini P, Mormino P, Dorigatti F, Santonastaso M, Mos L, De Toni R, et al.; HARVEST Study Group. Glomerular hyperfiltration predicts the development of microalbuminuria in stage 1 hypertension: the HARVEST. Kidney Int 2006;70:578-84. [ Links ]
27. Vergouwe Y, Soedamah-Muthu SS, Zgibor J, Chaturvedi N, Forsblom C, Snell-Bergeon JK, et al. Progression to microalbuminuria in type 1 diabetes: development and validation of a prediction rule. Diabetologia 2010;53:254-62. [ Links ]
28. Deckert T, Feldt-Rasmussen B, Borch-Johnsen K, Jensen T, Kofoed-Enevoldsen A. Albuminuria reflects widespread vascular damage. The Steno hypothesis. Diabetologia 1989;32:219-26. [ Links ]
29. de Zeeuw D, Parving HH, Henning RH. Microalbuminuria as an early marker for cardiovascular disease. J Am Soc Nephrol 2006;17:2100-5. [ Links ]
30. Tomlinson PA, Smellie JM, Prescod N, Dalton RN, Chantler C. Differential excretion of urinary proteins in children with vesicoureteric reflux and reflux nephropathy. Pediatr Nephrol 1994;8:21-5. [ Links ]
31. Konda R, Kakizaki H, Nakai H, Hayashi Y, Hosokawa S, Kawaguchi S, et al; Reflux Nephrology Forum, Japanese Prospective Study Group. Urinary concentrations of alpha-1-microglobulin and albumin in patients with reflux nephropathy before and after puberty. Nephron 2002;92:812-6. [ Links ]
32. Park CH, Maack T. Albumin absorption and catabolism by isolated perfused proximal convoluted tubules of the rabbit. J Clin Invest 1984;73:767-77. [ Links ]
33. Birn H, Fyfe JC, Jacobsen C, Mounier F, Verroust PJ, Orskov H, et al. Cubilin is an albumin binding protein important for renal tubular albumin reabsorption. J Clin Invest 2000;105:1353-61. [ Links ]
34. Hegde S, Coulthard MG. Renal agenesis and unilateral nephrectomy: what are the risks of living with a single kidney? Pediatr Nephrol 2009;24:439-46. [ Links ]
35. Westland R, Schreuder MF, Bökenkamp A, Spreeuwenberg MD, van Wijk JA. Renal injury in children with a solitary functioning kidne-the KIMONO study. Nephrol Dial Transplant 2011;26:1533-41. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Víctor M. García-Nieto
Sección de Nefrología Pediátrica
Hospital Universitario Nuestra Señora de Candelaria
Carretera del Rosario no 145
38010, Santa Cruz de Tenerife
vgarcianieto@gmail.com
mabelyanes2@gmail.com
Enviado a Revisar: 21 Sep. 2011
Aceptado el: 31 Ene. 2012














