Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nutrición Hospitalaria
versão On-line ISSN 1699-5198versão impressa ISSN 0212-1611
Nutr. Hosp. vol.34 supl.1 Madrid 2017
https://dx.doi.org/10.20960/nh.1238
Nuestros grandes olvidados, los enfermos respiratorios crónicos
Our great forgotten, chronic respiratory sufferers
M.ª Luisa Bordejé Laguna
Servicio de Medicina Intensiva. Hospital Germans Trias i Pujol. Badalona, Barcelona
Dirección para correspondencia
RESUMEN
Las peculiaridades del pulmón hacen que el soporte nutricional, además de cubrir los requerimientos, pueda modular su respuesta inflamatoria. El pulmón tiene mínima capacidad de almacenar glucosa. Los lípidos son el sustrato energético de elección de los neumocitos tipo II que los utilizan para formar fosfolípidos, componentes esenciales del surfactante. Su síntesis y liberación disminuyen en la lesión pulmonar aguda (LPA). La glutamina es un buen sustrato para las células endoteliales y los neumocitos tipo II.
La valoración nutricional de los pacientes con EPOC y SDRA es fundamental dado su alto riesgo nutricional. La calorimetría indirecta evalúa la respuesta del soporte nutricional y ventilatorio, evitando la sobrenutrición. La hipofosfatemia del síndrome de realimentación es frecuente y debe evitarse por la morbilidad que conlleva.
En críticos, la desnutrición puede mantener la insuficiencia respiratoria y prolongar el tiempo de ventilación mecánica (VM). En fase de weaning se deberían controlar los aportes de glucosa para evitar la retención de CO2.
Fórmulas con un alto cociente grasas/hidratos de carbono no han demostrado una clara utilidad en el paciente EPOC ni en la retirada de la VM. Los pacientes con LPA se benefician del soporte nutricional precoz y del control del aporte de volumen. Las dietas enterales con alto contenido en grasas (EPA, DHA y γ-linolénico) y antioxidantes no han demostrado superioridad. En nutrición parenteral, las emulsiones con mayor contenido de ácidos grasos omega-3 parecen modular positivamente la inflamación y la inmunosupresión. La utilización de glutamina, vitaminas o antioxidantes en estos pacientes podría estar justificada.
Palabras clave: EPOC. LPA. SDRA. VCO2. Hipermetabolismo. Desnutrición.
ABSTRACT
Lung's own properties make that nutritional support, besides covering the requirements can modulate its inflammatory response.
Lung tissue has a low glucose stock. Fatty acids are the main energy producer of type II pneumocytes, which use them in order to form phospholipids, essential for surfactant whose creation and release decrease in acute lung injury (ALI). Glutamine is a good substratum for endocrine cells and type II pneumocytes.
Due to high nutritional risk, it is important its assessments in disorders as COPD and acute respiratory distress syndrome (ADRS). Indirect calorimetry values the effect of ventilation and nutritional support, avoiding overfeeding. Hypophosphatemia and refeeding syndrome are frequent and need to be avoided because of their morbidity.
In critically ill patients, malnutrition can lead to respiratory failure and increasing mechanical ventilation time. To avoid hypercapnia in weaning, glucose levels should be controlled.
High lipids/carbohydrates ratio do not show usefulness in COPD neither mechanical ventilation removal. ALI patients beneficiate from an early start and the volume administered. Enteral nutrition with high fatty acids ratio (EPA, DHA and γ-linolenic acid) and antioxidants do not show any superiority. Omega-3 fatty acid in parenteral nutrition could modulate inflammation and immunosuppression in a positive manner. The use of glutamine, vitamins or antioxidants in these patients could be justified.
Key words: COPD. ALI. ARDS. VCO2. Hypermetabolism. Malnutrition.
INTRODUCCIÓN
En los últimos años se ha despertado un gran interés en la relación entre nutrición y pulmón, tanto en el paciente con enfermedad pulmonar obstructiva crónica (EPOC) en ventilación espontánea, como en el paciente en fase de insuficiencia respiratoria aguda (IRA) con ingreso en unidades de críticos, con especial referencia al síndrome de distrés respiratorio del adulto (SDRA).
La EPOC forma parte de las patologías más frecuentes del paciente crónico complejo. Se caracteriza por la obstrucción del flujo aéreo, por estrechamiento de las vías respiratorias en la bronquitis crónica o por pérdida del tejido elástico pulmonar y destrucción de las paredes alveolares en el enfisema. En ambos casos, la entrada de aire a los pulmones estará comprometida con atrapamiento del aire no expulsado. Esta situación provoca cambios en la dinámica respiratoria caracterizados por sobreesfuerzo muscular y cambios anatómicos como el aplanamiento del diafragma y ensanchamiento de la caja torácica. Se asocia a una respuesta inflamatoria anormal de los pulmones ante gases o partículas nocivas, fundamentalmente el humo del tabaco. Es de carácter progresivo y con pocas posibilidades de reversibilidad. Además, no solo se manifiesta por alteraciones pulmonares, sino que puede afectar a otros órganos y sistemas por reacción inflamatoria (1-4).
La situación nutricional del paciente EPOC es uno de los factores determinantes en el fracaso respiratorio. El bajo peso y la pérdida importante de masa magra se asocian a un peor pronóstico (4,5). Existe poca evidencia acerca del estado nutricional y las anormalidades metabólicas del resto de neumopatías crónicas.
El SDRA es originado por la respuesta inflamatoria secundaria a un insulto pulmonar o extrapulmonar que se caracteriza por la aparición de edema pulmonar de origen no cardiogénico que condiciona la alteración en el intercambio gaseoso, caracterizado por la hipoxia refractaria (6). Cursa con hipercatabolismo intenso, donde las proteínas se degradan para ser utilizadas como sustrato energético y el enfermo presenta una pérdida de masa muscular con miopatía secundaria que hace que el destete de la VM sea complejo.
En las unidades de críticos nos podemos encontrar con las dos patologías respiratorias que pueden confluir en un mismo punto, se convierten en pacientes críticos crónicos. Dicha entidad representa entre un 6-10% de los ingresos en unidades de críticos, con un gran consumo de recursos. Estos enfermos se caracterizan por un estado de inflamación e inmunosupresión persistente, mayor pérdida de masa muscular y lenta desconexión del respirador que alarga el tiempo de ingreso en UCI. Estos enfermos difícilmente pueden regresar a su domicilio y se asocian con un alto riesgo de discapacidad, sufrimiento y muerte (7).
El soporte nutricional según el tipo de patología respiratoria junto un buen programa de rehabilitación tienen un papel preponderante en los pacientes con insuficiencia respiratoria, ya que pueden mejorar los resultados clínicos, disminuyendo los días de VM, la duración de la estancia hospitalaria y la mortalidad (1,4).
METABOLISMO PULMONAR
El pulmón presenta algunas peculiaridades metabólicas (8-10):
- Su VO2 es bajo en situación de normalidad y similar al del intestino y al del músculo esquelético en reposo. En la lesión pulmonar aguda (LPA) y/o el SDRA, el empleo de energía puede suponer el 15-20% del VO2 total, con disminución de la síntesis y liberación del surfactante, por efecto del factor de necrosis tumoral (TNF).
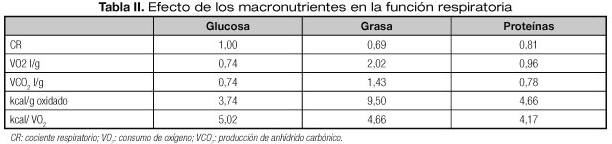
- Los ácidos grasos (AG) constituyen su sustrato energético fundamental y las velocidades pulmonares de captación y oxidación de AG son elevadas en comparación con las de otros tejidos. Los neumocitos tipo II los utilizan para formar fosfolípidos, componente esencial del surfactante.
- No tiene capacidad de almacenar glucosa como glucógeno o lípidos, pareciéndose en esto al músculo esquelético. En el pulmón el 75% de la glucosa es convertida en lactato y un 10% interviene en la síntesis de aminoácidos. Otra pequeña parte se incorpora a los lípidos, formando parte del α-glicerofosfato de los fosfolípidos que componen el surfactante.
- La glutamina es un buen sustrato energético para las células endoteliales y los neumocitos tipo II. Cuando el endotelio pulmonar se lesiona, por la acción de las endotoxinas, el TNF o las interleuquinas muestra un alto consumo de glutamina. La síntesis pulmonar de glutamina aumenta y la glutamina sintetasa en las células endoteliales alcanza concentraciones más altas que el músculo esquelético.
- Los neumocitos tipo II, que sintetizan el surfactante, muestran una actividad muy alta del ciclo de las pentosas, mientras que los neumocitos tipo I y las células endoteliales presentan escaso consumo de glucosa por esta vía metabólica. Ello explica la resistencia de los neumocitos tipo II en la agresión y en el estrés oxidativo.
- Las células endoteliales desempeñan un importante papel en el metabolismo de la arginina, generando óxido nítrico. En la sepsis la producción de óxido nítrico se incrementa, con independencia de los niveles de arginina.
MANEJO NUTRICIONAL
La valoración nutricional en pacientes con lesión pulmonar (EPOC/LPA) es necesaria para identificar a aquellos que tienen mayor riesgo de descompensación. Los antecedentes nutricionales que identifiquen la evolución del peso, la ingesta de nutrientes y la situación clínica son útiles para desarrollar los objetivos del soporte nutricional. Para su análisis sirven los mismos parámetros que se utilizan en el resto de enfermedades (IMC, bioimpedancia, marcadores bioquímicos, VSG).
En el cálculo de requerimientos calóricos es de elección la calorimetría indirecta, dado que evalúa la respuesta del soporte nutricional y ventilatorio, evitando la sobrenutrición. Pero su uso es limitado, sobre todo si se aplican altas dosis de oxígeno. En su defecto utilizaremos ecuaciones predictivas (11,12).
ESTADO NUTRICIONAL EN LA EPOC
La desnutrición es un problema común en las personas con EPOC con tasas de prevalencia que varían del 20% en pacientes estables a 35% en pacientes con enfermedad avanzada (13). En el paciente enfisematoso existe un deterioro progresivo del índice de masa corporal (IMC), llegando a desnutrición calórica grave, mientras que el paciente con bronquitis crónica suele acompañarse de obesidad (14,15). Pero en ambos casos existe una frecuente disfunción de la musculatura y cambios estructurales de la misma debidos a inflamación, estrés oxidativo, el tratamiento corticoideo y la situación nutricional, fenómeno que puede aparecer en fases precoces de la enfermedad (16-18).
La pérdida de masa libre de grasa (MLG), como medida indirecta de la masa muscular, afecta a la función muscular respiratoria (sobre todo al diafragma) y periférica, a la capacidad de ejercicio, al curso clínico e incluso a la mortalidad (19). La presencia de atrofia muscular evaluada a través de MLG (< 16 y < 15 kg/m2en hombres y mujeres respectivamente) y el bajo peso evaluado por el IMC (IMC < 20 kg/m2o pérdida de peso en EPOC con IMC < 25 kg/m2) son factores predictores de mortalidad y morbilidad (mayor número de reingresos y reagudizaciones más severas) (2). Las comorbilidades del paciente EPOC, especialmente la obesidad pueden condicionar la situación nutricional y requerirán una atención nutricional específica.
La desnutrición también tiene efectos sobre el parénquima pulmonar, ya que produce alteración del surfactante pulmonar que recubre las paredes alveolares e incrementa el agua pulmonar total, produciendo un descenso en la capacidad de difusión del monóxido de carbono a través de la membrana alveolo-capilar (8).
También aparecen alteraciones sistémicas condicionadas por la enfermedad, que, junto a las comorbilidades habituales de estos pacientes (osteoporosis, diabetes, síndrome metabólico y enfermedad cardiovascular), propician una mala evolución de la situación nutricional (18) (Tabla I).
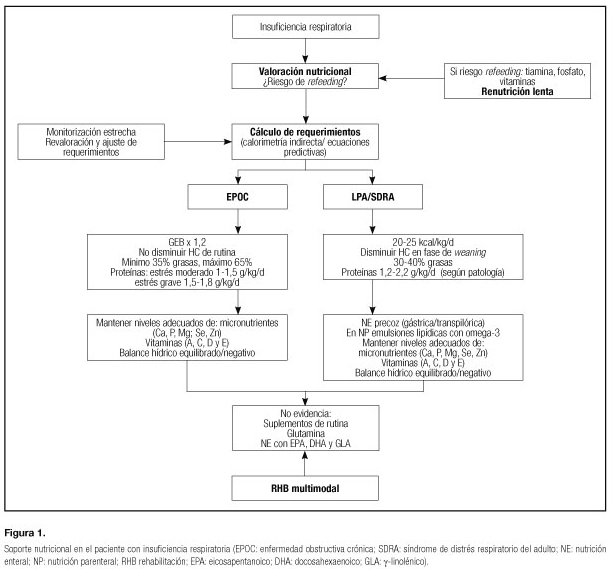
SOPORTE NUTRICIONAL EN EL PACIENTE EPOC (Fig. 1)
El soporte nutricional debe ser capaz de mejorar la utilización de oxígeno y la respuesta hemodinámica, disminuir el consumo de oxígeno y optimizar el intercambio gaseoso. En enfermos estables debe realizarse una dieta variada, sana y equilibrada al igual que en las personas sanas. Solo con carácter excepcional puede ser necesario manipular la cantidad, la calidad o la proporción de los nutrientes. Disminuir el aporte de nutrientes como medida terapéutica para disminuir el trabajo respiratorio puede resultar una alternativa peligrosa que conduzca a la desnutrición (20).
En nutrición artificial, el aporte calórico no debe superar el gasto energético basal (GEB) multiplicado por 1,2. Se desconoce cuál es la cantidad de lípidos más adecuada, así que se propone que la proporción de lípidos respecto a las calorías no proteicas ha de ser al menos del 35% pero no más del 65% (21-23). Se han desarrollado productos de nutrición enteral con alto contenido en grasas y bajo contenido en hidratos de carbono (50-55% grasas, alrededor del 30% hidratos de carbono y el resto proteínas), por las ventajas teóricas de un menor VCO2 debido a la oxidación grasa (Tabla II). Estas dietas no han conseguido demostrar un claro beneficio en el paciente EPOC en VM, excepto cuando se comparan con pacientes sobrenutridos (24,25).
La enfermedad respiratoria no modifica los requerimientos de nitrógeno que van a depender sobre todo del nivel de estrés. Aportes de 1-1,5 g/kg/día de proteínas son suficientes en pacientes no hipercatabólicos, mientras que aquellos que sufren una intensa agresión necesitarán 1,5-2 g/kg/día. El exceso en el aporte proteico puede originar un estímulo ventilatorio excesivo que incremente la fatiga muscular (24).
La glutamina sigue siendo objeto de numerosos estudios, dada su importancia como transportadora de nitrógeno y precursora de aminoácidos, proteínas y nucleótidos. En condiciones normales, el músculo y el pulmón son los principales donantes de glutamina del organismo. En situaciones como en la sepsis, el pulmón pasa a consumir gran cantidad de ella. Pero hasta el momento no hay evidencia para recomendar el uso de glutamina de forma rutinaria (26).
En cuanto a los micronutrientes, los aportes de magnesio, fosfato, calcio y potasio son importantes para restablecer la funcionalidad de la musculatura respiratoria. El fosfato es esencial para la síntesis de ATP y 2,3-difosfoglicerato, imprescindibles en la función pulmonar. El riesgo de realimentación es frecuente en estos pacientes que se encuentran en estado carencial por lo que se debe sospechar y tratar (27,28).
En fases de reagudización se produce una alteración en la fosforilación oxidativa, donde determinadas vitaminas desempeñan un papel importante por su acción antioxidante (29). Las vitaminas antioxidantes A, C y E parecen tener un efecto favorable sobre la respuesta inmunitaria, y la E, además, sobre la inflamación crónica. La vitamina D reduce las exacerbaciones si hay déficit previo (los niveles de vitamina D se deben corregir teniendo en cuenta los niveles de albúmina) (30-32). El selenio es un cofactor esencial como antioxidante de la glutatión peroxidasa, que contrarresta la posibilidad de lesión pulmonar sobre todo en pacientes fumadores (33).
SOPORTE NUTRICIONAL EN EL PACIENTE CON LPA Y SDRA (Fig. 1)
En el paciente con insuficiencia respiratoria aguda (LPA/SDRA) en situación de hipercatabolismo, la enfermedad de base (séptico, politraumatismo, posquirúrgico) es la que determina el cálculo de requerimientos. Estos procesos cursan con aumento del catabolismo proteico, de las necesidades energéticas y con resistencia a la insulina. Uno de los objetivos del soporte nutricional debe ser garantizar al menos entre el 50-65% del gasto energético en reposo. Además, no se debe olvidar la importancia de la restricción de líquidos (utilizar fórmulas concentradas) para evitar el edema pulmonar y periférico. Por todo ello, el soporte nutricional resulta complejo y debe ser dinámico, individualizado y ajustado a cada fase de la evolución del paciente (34).
Diferentes estudios han demostrado el beneficio de iniciar un soporte nutricional precoz (35-37) en los pacientes críticos, pero sin olvidar que un aporte excesivo de energía provoca lipogénesis con incremento de la producción de CO2. En el paciente con VM este hecho no supone un gran problema, pero en el paciente con ventilación protectora o en fase de retirada de la VM, este incremento de las necesidades ventilatorias puede hacerlo fracasar.
La estrategia nutricional para alcanzar los requerimientos calórico-proteicos, dependerá del riesgo nutricional del paciente. Existe controversia al respecto, así en pacientes con SDRA y/o necesidades de ventilación mecánica > 72 h, con un riesgo nutricional moderado o bajo, las estrategias de un aporte nutricional completo inicial mediante NE o el uso de NE trófica (con un volumen inicial bajo e hipocalórica) se han mostrado igualmente apropiadas, aunque el uso de NE trófica se ha asociado a menores complicaciones gastrointestinales. Sin embargo, en pacientes con necesidad de VM prolongada (> 8 días) con un riesgo nutricional elevado, recibir unos requerimientos calóricos medios (> 80%) en los primeros 8 días de ventilación mecánica y estancia en UCI, ya sea mediante NE y/o nutrición parenteral (NP) total o complementaria, parece ser más apropiado debido a que se ha asociado a una mayor supervivencia a los 6 meses y mejor recuperación física a los 3 meses de alta de UCI (38). Hay que ser prudentes a la hora de disminuir los aportes calóricos en el paciente crítico en insuficiencia respiratoria, porque estudios posteriores vuelven a demostrar que los pacientes con menor déficit calórico-proteico en la primera semana de ingreso no solo obtienen mejores resultados clínicos, sino que el destino al alta es a domicilio en vez de a un centro de rehabilitación (36). En el momento actual, parece que en la primera semana de ingreso en críticos debemos disminuir el aporte calórico (20-25 kcal/kg/d) con un aumento del aporte proteico (> 1,5 g/kg/d), pero desconocemos dónde está el límite (39).
En el paciente con SDRA la cantidad de glucosa aportada no debe superar el 40-50% de las calorías no proteicas, y ello dependiendo de los niveles plasmáticos de glucosa y triglicéridos. Aunque la cantidad de glucosa captada por el pulmón es pequeña, sus funciones no energéticas son trascendentes (34,40).
Las grasas, sustrato energético ideal en la insuficiencia respiratoria por su bajo cociente respiratorio y su alta densidad calórica, pueden presentar problemas en el paciente con SDRA (34). Los triglicéridos de cadena larga (TCL), que aportan ácidos grasos esenciales, son bien tolerados a dosis < 2 g/kg/día en los pacientes con bajo grado de estrés, pero su eficacia nutricional es cuestionada en el paciente crítico (34). Numerosos estudios han comprobado un aumento del shunt pulmonar y descensos en la presión arterial de oxígeno en pacientes con neumonía o SDRA. Este hecho se explicaría por el efecto de los eicosanoides y tromboxanos, generados a partir del ácido araquidónico (producido por el exceso de ácido linoleico de las emulsiones de TCL) sobre la vasoconstricción hipóxica pulmonar (34,41). Las mezclas de TCL con triglicéridos de cadena media (TCM), en proporción 1:1 o 1:2, consiguen reducir la cantidad de ácido linoleico y disminuir los efectos sobre la función pulmonar, el bloqueo del sistema reticuloendotelial y los cambios inmunitarios desfavorables (34,41).
Otras fuentes lipídicas como los omega-3 (abundante en el aceite de oliva y de colza) permitirían una menor liberación de eicosanoides, con el objetivo de modular la respuesta inflamatoria pulmonar (34,41). Pero hasta el momento, los estudios han sido contradictorios en demostrar la eficacia clínica de las dietas con combinaciones de grasas ricas en ácidos eicosapentanoico (EPA), docosahexaenoico (DHA), γ-linolénico (GLA) y antioxidantes en el complejo mundo de la LPA y el SDRA (42-51). La heterogenicidad de los estudios, la ausencia de información sobre el manejo clínico, la utilización de fórmulas con mezclas de farmaconutrientes y la disparidad de resultados hacen que no se pueda recomendar el uso rutinario de estas fórmulas enterales (52).
Sin embargo, estudios en NP donde se utilizan emulsiones lipídicas enriquecidas con omega-3 provenientes del aceite de pescado (53,54), señalan una disminución en el número de infecciones nosocomiales, un incremento de los días libres de infección en pacientes médicos y quirúrgicos, con una menor duración de la VM y de la estancia hospitalaria, siendo, además, un tratamiento coste-efectivo (55). Estas emulsiones se consideran seguras y no se han reportado efectos adversos significativos e incluso han mejorado o revertido la toxicidad hepática de la NP (56). En consecuencia, parece lógico recomendar NP enriquecida con omega-3 en pacientes críticos con SDRA que precisan NP (54).
No existen recomendaciones específicas para el aporte proteico en el SDRA, se deben ajustar al grado de estrés metabólico del paciente (34,40). Del metabolismo pulmonar se desprende el posible beneficio de aportar glutamina y hay que considerar el efecto del aporte de aminoácidos, especialmente los de cadena ramificada, aumentando el impulso o drive respiratorio. Este efecto puede ser de utilidad en el destete del respirador, pero puede contribuir al agotamiento de los pacientes con escasa reserva alveolar. No disponemos de estudios para establecer recomendaciones sobre el empleo glutamina, aminoácidos ramificados, vitaminas o antioxidantes en este grupo de pacientes, aunque la utilización de antioxidantes en forma de suplementos vitamínicos parece lógica y razonablemente segura (39,57).
OTRAS MEDIDAS EN EL MANEJO DEL PACIENTE CON PATOLOGÍA PULMONAR
Múltiples estudios epidemiológicos han señalado el potencial efecto protector de los vegetales y frutas debido a su alta concentración en sustancias antioxidantes (vitamina A, vitamina E) y de la fibra con propiedades antiinflamatorias (enlentecimiento de la absorción de glucosa y de almidón, disminución de oxidación lipídica o mediante la influencia de producción de citoquinas antiinflamatorias por la flora intestinal) (58,59). Por tanto, debe recomendarse este tipo de dieta en prevención primaria de la enfermedad (60).
En el paciente con EPOC la combinación de asesoramiento dietético, autocontroles y tratamiento conductual puede ayudar a mejorar la ingesta y conseguir un aporte nutritivo adecuado para evitar la pérdida de peso (61). Solo excepcionalmente sería necesario modificar la proporción de macronutrientes, siendo más útil procurar que el paciente reciba una dieta variada y adaptada a sus necesidades. Evitar alimentos productores de gas y el fraccionamiento en varias tomas (5-6 comidas al día) puede resultar útil a la hora de conseguir una mayor ingesta (62). También se ha podido comprobar la efectividad de acetato de megestrol como estimulante del apetito (63). Nuevos estudios están en marcha con utilización de otros fármacos como los análogos de la grelina para el tratamiento de la caquexia (64).
La utilización de suplementos es controvertida, aunque un reciente estudio demuestra que el soporte nutricional en forma de suplementos consigue aumentar la ingesta, mejorar las medidas antropométricas e incluso aumentar la fuerza muscular (65).
En caso de necesitar nutrición artificial la vía de elección es la enteral, pero es importante ser conscientes de la dificultad que existe para conseguir administrar > 80% de los requerimientos calculados en NE en un paciente crítico con SDRA habitualmente sometido a sedación y relajación profunda, con alteración de la motilidad intestinal y del vaciado gástrico. Cuando se produce intolerancia a la NE, a pesar de procinéticos y descartada la complicación abdominal, la primera medida a considerar es la NE transpilórica y, en el caso de que también fracase o no consigamos el aporte adecuado, deberemos pensar en la NP complementaria o total. Es importante hacer énfasis en evitar las sobrecargas calóricas y en reducir el aporte calórico en el momento del destete del respirador. También, un buen programa de rehabilitación respiratoria es fundamental para la desconexión de la VM (7).
La necesidad de maniobras como el decúbito prono en los pacientes con insuficiencia respiratoria grave no contraindica la utilización de la NE. Recientes estudios han demostrado que el grado de tolerancia a la NE no depende de la posición y no se asocia a mayores complicaciones gastrointestinales ni aumento de las neumonías por broncoaspiración (66,67).
En definitiva, todos nuestros esfuerzos deben ir encaminados a evitar la desnutrición y mejorar la calidad de vida de los pacientes crónicos complejos, evitando con la prevención los ingresos hospitalarios por reagudización respiratoria. La optimización del soporte nutricional en fase de descompensación respiratoria, junto con un buen programa de rehabilitación, ayudarán a evitar una mayor pérdida de peso y de masa magra que condicionen una peor evolución al alta.
BIBLIOGRAFÍA
1. Bellini LM. Nutritional support in advanced lung disease. UpToDate; 2017. [ Links ]
2. Vestbo J, Prescott E, Almdal T, Dahl M, Nordestgaard BG, Andersen T. Body mass, fat free body mass, and prognosis in patient s with chronic obstructive pulmonary disease from a random population sample findings from the Copenhagen City Heart Study. Am J Respir Crit Care Med 2006;173:79-83. [ Links ]
3. Donahoe M. Nutritional support in advanced lung disease. The pulmonary cachexia syndrome. Clin Chest Med 1997;183:547-61. [ Links ]
4. Schols AM. The 2014 ESPEN Arvid Wretlind Lecture: Metabolism & nutrition: Shifting paradigms in COPD management. Clin Nutr 2015;34(6):1074-9. [ Links ]
5. Schols AM,IM, Franssen FM, Gosker HR, Janssens W, Muscaritoli M, et al. Nutritional assessment and therapy in COPD: a European Respiratory Society statement. European Respiratory Journal 2014;44(6):1504-20. [ Links ]
6. García de Lorenzo A, López Martínez J, Planas Vila M, Montejo González JC, Anon Elizalde JM, Caparros Fernández de Aguilar T. Síndrome de distress respiratorio del adulto. Apoyo nutricional y metabólico. Nutr Hosp 1997;12(5):237-43. [ Links ]
7. Wischmeyer PE, San Millan I. Wining the war against ICU-adquired weakness: new innovations in nutrition and exercise physiology. Critical care: the Official Journal of the Critical Care Forum 2015;19:s6. [ Links ]
8. Colmenero Ruiz M, Pérez de la Cruz AJ. Fisiopatología del aparato respiratorio. En: Planas M, Pérez C, editores. Fisiopatología aplicada a la nutrición. Barcelona: Ediciones Mayo; 2002. pp. 171-89. [ Links ]
9. Kjaeve J. The lungs and the catabolic state. En: Revhaug A, editor. Acute catabolic state. Berlin: Springer; 1996. pp. 145-55. [ Links ]
10. Johson MM, Chin R, Haponik Efhin R, Haponik EF. Nutrición en la función y en la enfermedad respiratoria. En: Shils ME, Olson JA, Shike M, Ross CA, editors. Nutrición en salud y enfermedad. 9ª ed. México: McGraw-Hill Interamericana; 2009. [ Links ]
11. Ronco JJ. et al. Validation of an indirect calorimeter to measure oxygen consumption in critically ill patients. Journal of Critical Care 1991;6(1):36-41. [ Links ]
12. Moore JA, Angelillo VA. Equations for the prediction of resting energy expenditure in chronic obstructive lung disease. Chest 1988;94(6):1260-3. [ Links ]
13. Chapman KR, Mannino DM, Soriano JB, Vermeir PA, Buist AS, Thun MJ. Epidemiology and costs of chronic obstructive pulmonary disease. Eur Respir J 2006;27:188-207. [ Links ]
14. Vanfleteren LE, Spruit MA, Groenen M, Gaffron S, van Empel VP, Bruijnzeel PL, et al. Clusters of comorbidities based on validated objective measurements and systemic inflammation in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2013;187:728-35. [ Links ]
15. Miravitlles M, Calle M, Soler-Cataluña JJ. Fenotipos clínicos de la EPOC. Identificación, definición e implicaciones para las guías de tratamiento. Arch Bronconeumol 2012;48(3):86-98. [ Links ]
16. Gez J, Orzcolevi M, Barreiro E. Particularidades fisiopatológicas de las alteraciones musculares en el paciente con EPOC. Nutr Hosp 2006;21(S3):62-8. [ Links ]
17. Alcolea Batres S, Villamor León J, Álvarez-Sala R. Nutritional Status in COPD. Arch Bronconeumol 2007;43:283-8. [ Links ]
18. Chillón Martín MJ, Miguel Díez J, Ferreira Moreno A, Sánchez Muñoz G. EPOC y alteraciones endocrinometabólicas. Arch Bronconeumol 2009;45(S4):42-6. [ Links ]
19. Kelsen SG, Ference M, Kapoor S. Effects of prolonged undernutrition on structure and function of the diaphragm. J Appl Physiol 1985;58:1354. [ Links ]
20. Ferreira IM, Brooks D, White J, Goldstein R. Nutritional supplementation for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2012;12:CD000998. [ Links ]
21. Collins P F, Stratton RJ, Elia M. Nutritional support in chronic obstructive pulmonary disease: a systematic review and meta-analysis. Am J Clin Nutr 2012;95:1385-95. [ Links ]
22. Zheng PF, Shu L, Si CJ, Zhang XY, Yu XL, Gao W. Dietary patterns and chronic obstructive pulmonary disease: A meta-analysis. COPD: Journal of Chronic Obstructive Pulmonary Disease 2015:1-9. [ Links ]
23. Anker SD, Laviano A, Filippatos G, John M, Paccagnella A, Ponikowsk P. ESPEN Guidelines on Parenteral Nutrition: On Cardiology and Pneumology. Clinical Nutrition 2009;28:455-60. [ Links ]
24. Cook D, Meade M, Guyatt G, Butler R, Aldawood A, Epstein S. Trials of miscellaneous intervention to wean from mechanical ventilation. Chest 2001;120(Suppl 4):S38-44. [ Links ]
25. Schols AM, Soeters PB, Mostert R, Pluymers RJ, Wouters EF. Physiologic effects of nutritional support and anabolic steroids in patients with chronic obstructive pulmonary disease. A placebo-controlled randomized trial. Am J Respir Crit Care Med 1995;152:1268-74. [ Links ]
26. Oliveira GP, de Abreu MG, Pelosi P, Rocco PR. Exogenous Glutamine in respiratory diseases: myth or reality? Nutrients 2016;8(2):76. DOI: 10.3390/nu8020076 [ Links ]
27. Kew KM, Kirtchuk L, Michell CI. Intravenous magnesium sulfate for treating adults with acute asthma in the emergency department. Cochrane Database Syst Rev 2014;(5):CD010909. DOI: 10.1002/14651858 [ Links ]
28. Khan LU, Ahmed J, Khan S, Macfie J. Refeeding syndrome: a literature review. Gastroenterol Res Pract 2011;2011. DOI: 10.1155/2011/410971. [ Links ]
29. Itoh M, Tsuji T, Nemoto K, Nakamura H, Aoshiba K. Undernutrition in patients with COPD and its treatment. Nutrients 2013;5:1316-35. [ Links ]
30. Lehouck A, Mathieu C, Carremans C, Baeke F, Verhaegen J, Van Eldere J, et al. High doses of vitamin D to reduce exacerbations in chronic obstructive pulmonary disease: a randomized trial. Ann Intern Med 2012;156:105-14. [ Links ]
31. Afzal S, Lange P, Bojesen SE, Freiberg JJ, Nordestgaard BG. Plasma 25-hydroxyvitamin D, lung function and risk of chronic obstructive pulmonary disease. Thorax 2014;69:24-31. [ Links ]
32. El-Attar M, Said M, El-Assal G, Sabry NA, Omar E, Ashour L. Serum trace element levels in COPD patient: the relation between trace element supplementation and period of mechanical ventilation in a randomized controlled trial. Respirology 2009;14(8):1180-7. [ Links ]
33. Lee Y-H, Lee SJ, Lee MK, Lee W-Y, Yong SJ, Kim S-H. Serum selenium levels in patients with respiratory diseases: a prospective observational study. Journal of Thoracic Disease 2016;8(8):2068-78. DOI: 10.21037/jtd.2016.07.60 [ Links ]
34. Garcia de Lorenzo A, Pérez de la Cruz AJ, Ordoñez FJ. Nutrición en las enfermedades del aparto respiratorio. En: Gil A, editor. Tratado de Nutrición. Tomo IV. 2ª ed. Editorial Médica Panamericana; 2010. pp. 569-81. [ Links ]
35. Doig GS, Heighes PT, Simpson F, Sweetman EA, Davies AR. Early enteral nutrition, provided within 24h of injury or intensive care unit admission, significantly reduces mortality in critically ill patients: a meta-analysis of randomised cont rolled trials. Intensive Care Med 2009;35:2018-27. [ Links ]
36. Wei X, Day AG, Ouellette-Kuntz H, Heyland DK. The association between nutritional adequacy and longterm outcomes in critically il in patients requiring prolonged mechanical ventilation: A multicenter cohort study. Crit Care Med 2015;43:1569-79. [ Links ]
37. Reintam Blaser A, Starkopf, J, Alhazzani, W, Berger M, Caser M, Deane, et al. Early enteral nutrition in critically ill patients: ESICM clinical practice guidelines. Intensive Care Med 2017;43:380-98. [ Links ]
38. Rice TW, Mogan S, Hays MA, Bernard GR, Jensen GL, Wheeler AP. Randomized trial of initial trophic versus full-energy enteral nutrition in mechanically ventilated patients with acute respiratory failure. Crit Care Med 2011;39:967-74. [ Links ]
39. Bordejé ML, Martínez de Lagrán I, López Delgado JC. Hiponutrición vs nutrición artificial precoz. Nutrición Clínica en Medicina 2016;X(2):79-94. [ Links ]
40. McClave SA, Taylor BE, Martindale RG, Warren MM, Johson DR, Braunschweig C, et al. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). JPEN J Parenter Enteral Nutr 2016;40(2):159-211. [ Links ]
41. Mesa García MD, Aguilera García CM, Gil A. Importancia de los lípidos en el tratamiento nutricional de las patologías de base inflamatoria. Nutr Hosp 2006;21:S30-43. [ Links ]
42. Gadek JE, Demichele SJ, Karlstad MD, Pacht ER, Donahoe M, Albertson TE, et al. Effect of enteral feeding with eicosapentaenoic acid, gammalinoleic acid, and antioxidants in patients with acute respiratory distress syndrome. Crit Care Med 1999;27:1409-20. [ Links ]
43. Singer P, Theilla M, Fisher H, Gibstein L, Grozovski E, Cohen J. Benefit of an enteral diet enriched with eicosapentaenoic acid and gamma-linolenic acid in ventilated patients with acute lung injury. Crit Care Med 2006;34: 1033-8. [ Links ]
44. Rice TW, Wheeler AP, Thompson BT, DeBoisblanc BP, Steingrub J, Rock P. Enteral omega-3 fatty acid, gamma-linolenic acid, and antioxidant supplementation in acute lung injury. JAMA 2011;306:1574-81. [ Links ]
45. Elamin EM, Miller AC, Ziad S. Immune enteral nutrition can improve outcomes in medical-surgical patients with ARDS: A prospective randomized controlled trial. J Nutr Disord Ther 2012;2:109. DOI: 10.4172/2161-0509.1000109 [ Links ]
46. Pontes-Arruda A, Aragao AM, Albuquerque JD. Effects of enteral feeding with eicosapentaenoic acid, gamma-linolenic acid, and antioxidants in mechanically ventilated patients with severe sepsis and septic shock. Crit Care Med 2006;34:2325-33. [ Links ]
47. Pontes-Arruda A, Demichele S, Seth A, Singer P. The use of an inflammation-modulating diet in patients with acute lung injury or acute respiratory distress syndrome: a meta-analysis of outcome data. JPEN J Parenter Enteral Nutr 2008;32:596-605. [ Links ]
48. Nelson JL, DeMichele SJ, Pacht ER, Wennberg AK. Effect of enteral feeding with eicosapentaenoic acid, gamma-linolenic acid, and antioxidants on antioxidant status in patients with acute respiratory distress syndrome. JPEN J Parenter Enter Nutr 2003;27:98-104. [ Links ]
49. Pacht ER, DeMichele SJ, Nelson JL, Hart J, Wennberg AK, Gadek JE. Enteral nutrition with eicosapentaenoic acid, gamma-linolenic acid, and antioxidants reduces alveolar inflammatory mediators and protein influx in patients with acute respiratory distress syndrome. Crit Care Med 2003;31:491-500. [ Links ]
50. Theilla M, Singer P, Cohen J, Dekeyser F. A diet enriched in eicosapentanoic acid, gamma-linolenic acid and antioxidants in the prevention of new pressure ulcer formation in critically ill patients with acute lung injury: A randomized, prospective, controlled study. Clin Nutr 2007;26:752-7. [ Links ]
51. Pontes-Arruda A, Martins LF, de Lima SM, Isola AM, Toledo D, Rezende E, et al. Enteral nutrition with eicosapentaenoic acid, gamma-linolenic acid and antioxidants in the early treatment of sepsis: Results from a multicenter, prospective, randomized, double-blinded, controlled study: The INTERSEPT study. Crit Care 2011;15. DOI: 10.1186/cc10267 [ Links ]
52. Li C, Bo L, Liu W, Lu X, Jin F. Enteral immunomodulatory diet (omega-3 fatty acid, γ-linolenic acid and antioxidant supplementation) for acute lung injury and acute respiratory distress syndrome: An updated systematic review and meta-analysis. Nutrients 2015;7(7):5572-85.
53. Grau Cramona T, Bonet Saris A, Garcia de Lorenzo A, Sánchez Alvárez C, Rodríguez Pozo A, Acosta Escribano J, et al. Influence of n-3 polyunsaturated fatty acids enriched lipid emulsions on nosocomial infections and clinical outcomes in critically ill patients: ICU lipids study. Crit Care Med 2015;43:31-9. [ Links ]
54. Manzanares W, Langlois PL, Dhaliwal R, Lemieux M, Heyland DK. Intravenous fish oil lipid emulsions in critically ill patients: an updated systematic review and meta-analysis. Crit Care 2015;19:167. [ Links ]
55. Pradelli L, Eandi M, Povero M, Mayer K, Muscaritoli M, Heller AR, et al. Cost-effectiveness of omega-3 fatty acid supplements in parenteral nutrition therapy in hospitals: a discrete event simulation model. Clin Nutr 2014;33:785-92. [ Links ]
56. Chen W, Jiang H, Zhou ZY, Tao YX, Cai B, Liu J, et al. Is omega-3 fatty acids enriched nutrition support safe for critical ill patients? A systematic review and meta-analysis. Nutrients 2014;6:2148-64. [ Links ]
57. Smedberg M, Wernerman J. Is the glutamine story over? Critical Care 2016;20:361. [ Links ]
58. World Health Organization/Food and Agriculture Organization of the United Nations. Diet, nutrition and the prevention of chronic diseases. Report of a Joint WHO/FAO Expert Consultation. Geneva, Switzerland; 2003. [ Links ]
59. Leenders M, Sluijs I, Ros MM, Boshuizen HC, Siersema PD, Ferrari P, et al. Fruit and vegetable consumption and mortality: European prospective investigation into cancer and nutrition. Am J Epidemiol 2013;178:590-602. [ Links ]
60. Boeing H, Bechthold A, Bub A, et al. Critical review: vegetables and fruit in the prevention of chronic diseases. European Journal of Nutrition 2012;51(6):637-63. [ Links ]
61. Pison CM, Cano NJ, Cherion C, Caron F, Court-Fortune, Antonini MT, et al. Multimodal nutritional rehabilitation improves clinical outcomes of malnourished patients with chronic respiratory failure: A randomised controlled trial. Thorax 2011;66:953-60. [ Links ]
62. Broekhuizen R, Creutzberg EC, Weling-Scheepers CA, Wouters EF, Schols AM. Optimizing oral nutritional drink supplementation in patients with chronic obstructive pulmonary disease. Br J Nutr 2005;93:965-71. [ Links ]
63. Herrejón A, Palop J, Inchaurraga I, Lopez A, Bañuls C, Hernández A, et al. Low doses of megestrol acetate increase weight and improve nutrition in patients with severe chronic obstructive pulmonary disease and weight loss. Med Clin (Barc) 2011;137(5):193-8. DOI: 10.1016/j.medcli.2011.02.016 [ Links ]
64. Nagaya N, Itoh T, Murakami S, Oya H, Uematsu M, Miyatake K, et al. Treatment of cachexia with ghrelin in patients with COPD. Chest 2005;128: 1187. [ Links ]
65. Deutz NE, Matheson EM, Materese LE, Luo M, Baggs GE, Nelson Jl, et al. NOURISH study group. Readmission and mortality in malnourished, older, hospitalized adults treated with a specialized oral nutritional supplement: A randomized clinical trial. Clin Nutr 2016;35(1):18-26. DOI: 10.1016/j.clnu.2015.12.010. [ Links ]
66. Saez de la Fuente I, Saez de la Fuente J, Quintana Estelles MD, Garcia Gigorro R, Terceros Almanza LJ, Sanchez Izquierdo JA, et al. Enteral nutrition in patients receiving mechanical ventilation in a prone position. JPEN J Parenter Enteral Nutr 2016;40:250-5. [ Links ]
67. Reignier J, Dimet J, Martin-Lefevre L, Bontemps F, Fiancette M, Clementi E, et al. Before-after study of a standardized ICU protocol for early enteral feeding in patients turned in the prone position. Clin Nutr 2010;29:210-6. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
M.ª Luisa Bordejé Laguna.
Servicio de Medicina Intensiva.
Hospital Germans Trias i Pujol.
Ctra. Canyet, s/n.
08916 Badalona, Barcelona
e-mail: luisabordeje@gmail.com