Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Nutrición Hospitalaria
versão On-line ISSN 1699-5198versão impressa ISSN 0212-1611
Nutr. Hosp. vol.34 supl.1 Madrid 2017
https://dx.doi.org/10.20960/nh.1239
¿Y después del ictus, qué hacemos para nutrirle?
How is the patient's nutrition after a stroke?
María D. Ballesteros Pomar1 y Laura Palazuelo Amez2
1Unidad de Nutrición Clínica y Dietética. Sección de Endocrinología y Nutrición. Complejo Asistencial Universitario de León. León.
2Logopedia. Centro de Referencia Estatal de San Andrés del Rabanedo. León
Dirección para correspondencia
RESUMEN
Las enfermedades neurológicas conllevan, a menudo, alteraciones en el nivel de conciencia o en los mecanismos de la deglución que hacen necesario un soporte nutricional artificial. Las guías internacionales recomiendan realizar un cribado de malnutrición a los pacientes con enfermedades neurológicas.
La disfagia es un problema frecuente después de un ictus. Sin embargo, la disfagia es una patología tratable y la rehabilitación de la función deglutoria permite mejorar el estado nutricional de los pacientes.
Los equipos sanitarios deber estar sensibilizados ante este problema, tanto para su diagnóstico, como para instaurar medidas de intervención nutricional. La presencia de disfagia debería valorarse en las primeras 24 horas tras un ictus y no retrasarse más de 72 horas, así como el cribado de desnutrición. Se revisan el enfoque diagnóstico y terapéutico así como las indicaciones de las distintas modalidades de tratamiento nutricional y la transición a la alimentación oral en el paciente con ictus.
Palabras clave: Disfagia. Ictus. Indicaciones nutricionales.
ABSTRACT
Neurological conditions usually cause altered levels of consciousness or swallowing mechanisms which make artificial nutritional support necessary. International guidelines recommend nutritional screening to detect malnutrition in patients with neurological diseases.
Dysphagia is a common problem after a stroke, however, it is a treatable pathology, and swallowing rehabilitation allows for improving patients' nutritional status.
Awareness of this problem is required among healthcare professionals both for its diagnosis and for the implementation of nutritional intervention measures. Patients should be tested for dysphagia within the first 24 hours of the stroke onset; this swallowing assessment as well as malnutrition screening should never be delayed by more than 72 hours. The present study addresses diagnostic and therapeutic approaches, the indications of the different nutritional treatments available and the transition to oral feeding in patients who have had a stroke episode.
Key words: Dysphagia. Stroke. Nutritional intervention measures.
INTRODUCCIÓN
Las enfermedades neurológicas conllevan, a menudo, alteraciones en el nivel de consciencia o en los mecanismos de la deglución que hacen necesario, con frecuencia creciente, un soporte nutricional artificial, tanto a nivel hospitalario como domiciliario (1). Los datos sobre nutrición enteral domiciliaria (NED) recogidos por el grupo de trabajo NADYA indican que el 61% de los casi 3.300 pacientes que recibieron este soporte nutricional en España en el año 2013 sufrían una enfermedad neurológica (2).
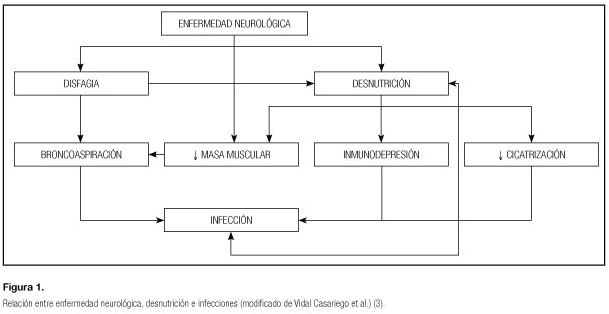
Los factores que condicionan el desarrollo de desnutrición en este grupo de pacientes son variados y se recogen en la tabla I. Por todo esto, las guías de la American Society for Parenteral and Enteral Nutrition (ASPEN) recomiendan realizar un cribado de desnutrición a los pacientes con enfermedades neurológicas. Mención aparte merece el desarrollo de disfagia, que se define como la dificultad para progresar el bolo alimenticio de forma eficaz y segura. Es muy prevalente en las patologías neurológicas crónicas y favorece el desarrollo de infecciones por aspiración; la aparición de infecciones a su vez favorece el desarrollo de desnutrición, cerrando así un círculo vicioso (3) (Fig. 1). Aproximadamente la mitad de las infecciones por broncoaspiración son neumonías, cuya tasa de mortalidad asciende al 50%.
ENFERMEDAD VASCULAR CEREBRAL
En el año 2009, el Instituto Nacional de Estadística concluyó que el ictus era la segunda causa más frecuente de muerte en la población española, y la primera en el caso de las mujeres. En España, la incidencia acumulada por 100.000 habitantes se ha estimado en 218 (IC95%, 214-221) en varones y 127 (IC95%, 125-128) en mujeres (4). En el momento del ictus, hasta el 20% de los pacientes ya están desnutridos, probablemente debido a su edad avanzada y a la existencia de alguna discapacidad previa, lo que se asocia a peor pronóstico (5). Después del ictus, el estado nutricional se deteriora, generalmente por disfagia y déficits neurológicos que dificultan la alimentación autónoma. Un paciente con ictus puede sufrir un déficit calórico importante y cubre con dificultad sus requerimientos de proteínas. La presencia de desnutrición en estos pacientes condiciona además de forma desfavorable su pronóstico al incrementar la morbilidad (infecciones, úlceras cutáneas), complicaciones y secuelas, y puede impedir la recuperación y prolongar la duración de la estancia hospitalaria (6,7).
DISFAGIA EN ICTUS
La disfagia es un problema frecuente después de un ictus (8). Un estudio reciente ha estimado que ocurre en más del 20% de los ictus, y persiste en más del 50% de ellos (9). La severidad del ictus, más que la localización, es lo que condiciona la aparición de disfagia. Condiciona el estado nutricional y favorece la broncoaspiración y la neumonía por aspiración en más del 20% de los pacientes, lo que causa la muerte del 20% de los pacientes en el año siguiente al ictus.
Sin embargo, conviene destacar que la disfagia es una patología tratable y que la rehabilitación de la función deglutoria permite mejorar el estado nutricional de los pacientes. Existen algunos factores independientes de riesgo que deben hacer pensar en la presencia de disfagia tras un ictus, como son: género masculino, edad mayor de 70, ictus severo, ausencia de respuesta faríngea, vaciamiento incompleto de la cavidad oral o debilidad/asimetría del paladar (10).
Otros factores demostrados en un reciente estudio son la presencia de trastornos de la comunicación (11), significativamente la afasia y la disartria, que están relacionados directamente con la presencia de disfagia. Esto nos conduce a que, en la mayoría de los casos, la disfagia no se produce de manera aislada, sino que la relación con otros trastornos asociados nos hace pensar en la valoración de la deglución como síntoma de deterioro.
El conocimiento de los signos y síntomas de la disfagia es relevante para una detección precoz. Las alteraciones que se producen en alguna de las fases del proceso deglutorio pueden tener consecuencias en la eficacia y la seguridad de la deglución. Algunos de los síntomas que más presencian evidencia como los atragantamientos, tos durante la comida o después, drenaje por narinas o infecciones respiratorias de repetición, son signos de alteración en la seguridad de la deglución (12). La desnutrición, deshidratación, restos de alimentos a nivel faríngeo, residuos orales o deglución fraccionada son signos de alteración en la eficacia; esto se produce cuando la deglución no realiza el objetivo de llevar el alimento hacia la vía digestiva y con ello se producen complicaciones que alargan las estancias hospitalarias, picos febriles de origen desconocido, pérdida de peso anormal, pérdida de masa muscular y deterioro del estado general. Otras consecuencias que se producen secundariamente son las repercusiones sociales, negativa a relacionarse o negativa a comer o beber fuera de casa, evitar ciertos alimentos difíciles de ingerir o miedo a comer solo, y con ello, un aislamiento social que repercute en la calidad de vida del paciente, puesto que, en la cultura de nuestro país, las celebraciones y los actos sociales, se llevan a cabo alrededor de una mesa y en multitud de actos sociales.
La disfagia silente se produce en un porcentaje bajo; este tipo de disfagia no presenta síntomas claros, no se produce una tos evidente ni un carraspeo, pero la presencia de algunos de los signos antes descritos como un deterioro generalizado, o infecciones respiratorias de repetición, nos pueden dar la voz de alarma.
EVALUACIÓN DE LA DISFAGIA EN EL PACIENTE CON ICTUS
Los equipos sanitarios deber estar sensibilizados ante este problema, tanto para su diagnóstico como para instaurar medidas de intervención nutricional. Desde una primera etapa se debe valorar durante el ingreso la posible disfagia del paciente, con pruebas relativamente sencillas de realizar como son la detección del reflejo nauseoso, la evaluación de la sensibilidad faríngea, la observación de los movimientos deglutorios y la aparición de síntomas y signos de atragantamiento o aspiración después de la deglución (13). En cualquier caso, la presencia de disfagia debería valorarse en las primeras 24 horas tras un ictus y no retrasarse más de 72 horas (14), así como el cribado de desnutrición. Se ha comunicado que el cribado de la disfagia en una unidad de ictus puede reducir hasta un 75% la incidencia de neumonía por aspiración (15).
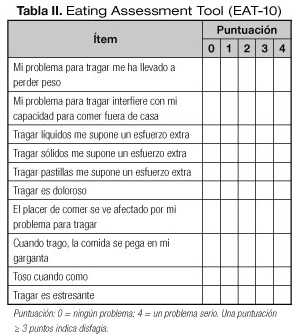
La EAT-10 es una escala de autoevaluación analógica verbal, unidimensional y de puntuación directa para evaluar síntomas específicos de disfagia (Tabla II). La validez y fiabilidad de la versión original han sido previamente demostradas y publicadas. Se trata de un cuestionario de 10 preguntas diseñado por un grupo multidisciplinar de expertos. El paciente debe responder a cada pregunta de forma subjetiva en una escala de cinco puntos (0-4 puntos), en la que cero (0) indica la ausencia del problema y cuatro (4) indica que considera que se trata de un problema serio (16,17).
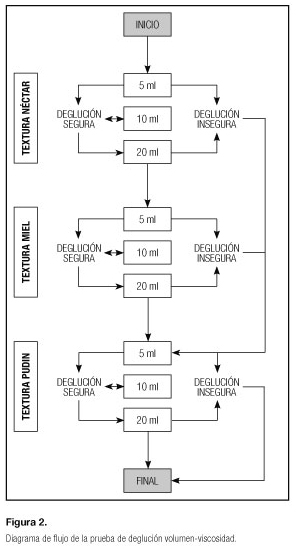
La valoración modificada de la deglución (MSA) ayuda al personal que la realiza a identificar a los pacientes con disfagia y a derivarlos a los correspondientes especialistas en disfagia para su posterior valoración (18). Se pueden identificar limitaciones deglutorias graves en las dos primeras partes de la valoración. Una prueba posterior con 90 ml de agua, según los criterios de Suiter y Leder, puede incluso detectar signos de aspiración de leves a moderados (Fig. 2).
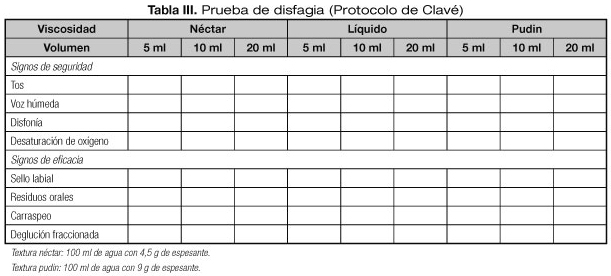
Hasta ahora, sin embargo, en los servicios de Neurología la prueba más utilizada es el test del agua de DePippo (19), que consiste en administrar unos 10 ml de líquido al paciente y observar la aparición de tos o alteraciones de la voz tras el intento de deglución. Su sensibilidad es del 76% y su especificidad del 59%. Es un test elemental ya que solo discrimina si hay riesgo de aspiración o no. Otro método propuesto es la observación de las variaciones en la saturación de oxígeno durante la deglución mediante un pulsioxímetro. Una disminución significativa (≥ 2%) de la saturación de oxígeno con la deglución indicaría aspiración. La prueba puede hacerse más específica con la administración de volúmenes y texturas diferentes (test de Clavé). La sensibilidad (73-87%) y la especificidad del test de Clavé son muy variables (39-87%), pero tiene la ventaja respecto al test de DePippo de que, además de detectar el riesgo de aspiración, permite determinar cuál es la textura y el volumen más seguro para la deglución (20) (Tabla III y Fig. 3).
Existen otros muchos test y pruebas disponibles para evaluar inicialmente la presencia de disfagia. Un reciente estudio de la Universidad de Seúl revisó 31 métodos de cribado (1992-2011) para elegir el óptimo basándose en: la calidad de la metodología de los estudios, propiedades de la medición de las herramientas utilizadas para la detección de disfagia y la aplicabilidad por enfermería. Concluyeron que los test GUSS (gugging swallowing screen) y SSA (standardized bedside swallowing assessment) son los que ofrecen mayor rigor científico y resultan aplicables en la práctica clínica diaria, sobre todo por enfermería (21).
Añadido al cribado y a las pruebas estandarizadas de la disfagia, cabe destacar la importancia de una evaluación instrumental. El conocimiento de las fases de la deglución es básico para realizar una valoración exhaustiva. La observación del proceso deglutorio in situ, valorar el entorno y el estado cognitivo nos proporciona información relevante en el estudio de la disfagia. El logopeda debe realizar una valoración completa a nivel orofacial, de los músculos faciales, deglutorios y masticatorios, y su función en cada fase de la deglución. La movilidad, tonicidad, sensibilidad y funcionalidad de cada uno de ellos, y el hecho de que la deglución sea un acto ordenado y coordinado de todos los músculos implicados, hace de su estudio una fuente de información para poder posteriormente actuar en concordancia.
Relevante a su vez la exploración de los pares craneales que intervienen en la deglución (22) como son el trigémino, facial, glosofaríngeo, vago, espinal e hipogloso. Otros parámetros observacionales es la valoración de los reflejos tusígeno, palatal y nauseoso, que nos proporciona una información necesaria sobre estos mecanismos de defensa.
En adultos de avanzada edad, la salivación o xerostomía y la dentición son elementos clave que influyen directamente en la fase preparatoria oral.
Durante el acto deglutorio la respiración se detiene en apnea y la epiglotis se sitúa por encima de las cuerdas vocales para que el alimento no caiga en la vía aérea, es por ello que el estudio de la capacidad respiratoria, la tos productiva y de aclaramiento, y la medición de la saturación de oxígeno son datos relevantes.
Las intubaciones pueden dejar secuelas a nivel interno y los traqueostomas suelen cursar cicatrices adheridas a los cartílagos que no permiten realizar una adecuada elevación hiolaríngea; estas secuelas pueden ser la base de una disfagia post-ictus. El movimiento laríngeo de ascenso es valorable mediante la escala de tonos y la capacidad vocal. La auscultación cervical se incluye en el protocolo (23), puesto que una escucha ruidosa nos informará sobre posibles aspiraciones o penetraciones.
La videofluoroscopia se considera a menudo la prueba de elección para la evaluación de la disfagia (24), pero no está disponible en todos los centros. Consiste en la administración de bebidas o comidas de diferente consistencia, impregnadas con bario, mientras el paciente está sentado o incorporado, y en la observación de su paso por la orofaringe mediante fluoroscopia. Permite distinguir si hay penetración (paso a la vía respiratoria por encima de las cuerdas vocales) o aspiración (paso por debajo de las cuerdas vocales). Por último, la fibroscopia da información acerca de la movilidad y sensibilidad faríngea y permite visualizar de forma directa la deglución (aunque no la aspiración). Es una prueba invasiva, aunque bien tolerada, pero precisa de material y personal específico para su realización.
TRATAMIENTO NUTRICIONAL EN LA ENFERMEDAD VASCULAR CEREBRAL
Dieta oral y suplementos
Los pacientes con enfermedad vascular cerebral (EVC) no tienen unos requerimientos de calorías y nutrientes diferentes de los de personas de su misma edad y sexo, salvo que coexista alguna condición o enfermedad (ej. úlceras de presión, infecciones) que los modifiquen. Buena parte de los pacientes van a poder recibir una alimentación oral normal. En caso de presentar alguna dificultad para la ingesta normal, y siempre que el riesgo de aspiración sea mínimo de acuerdo con las pruebas antes descritas, estará indicado realizar modificaciones en la textura de la dieta para facilitar la alimentación. La disfagia hará necesario realizar una dieta triturada ("túrmix") de consistencia más o menos fina. Con mucha frecuencia, la disfagia es para líquidos y habrá que espesar estos con productos farmacéuticos (módulos de espesante). El espesante debe añadirse en pequeñas cantidades, esperar al menos 5 minutos para valorar la consistencia alcanzada, e incrementarse progresivamente hasta conseguir la textura buscada, desde consistencia néctar, hasta pudin. Los financiados serían de sabor neutro, pero existen otros de sabor naranja que no son financiados y tienen un sabor más agradable. Recientemente se ha lanzado al mercado una segunda generación de espesantes que permiten utilizar dosis menores, obteniendo una apariencia más agradable y una consistencia más estable por la resistencia a la amilasa salivar. Existen, además, preparados de agua gelificada de sabor neutro o de frutas que pueden ayudar a mantener una correcta hidratación.
En los últimos años se ha desarrollado el concepto de alimentación básica adaptada (ABA), consistente en alimentos de textura modificada para pacientes con disfagia, generalmente de alta densidad calórica e hiperproteicos, listos para su consumo. Tienen como ventajas que no precisan de elaboración, su seguridad microbiológica y que garantizan el aporte de macro y micronutrie ntes. Sin embargo, no están incluidos entre las prestaciones complementarias financiadas, aunque su uso es cada vez más frecuente en centros hospitalarios y residencias geriátricas.
Una de las razones es el alto coste de estos productos por lo que durante los últimos años se han estudiado las dietas tradicionales modificadas. Según la severidad de la disfagia, los pacientes podrán optar por dietas de textura modificada (25) para mejorar la deglución. Se trata de partir de un menú normal con los alimentos de consumo habitual, cocinándolos siguiendo las recetas tradicionales y transformándolos según las necesidades. Las modificaciones en las consistencias de los alimentos, permiten un manejo del alimento en la cavidad oral y una deglución segura y eficaz. La forma de cocinar, proporcionando jugosidad, eliminando alimentos acuosos y añadiendo salsas espesas a las preparaciones son algunas de las modificaciones que se presuponen para las dietas de fácil deglución. La importancia de individualizar la texturificación requiere de un conocimiento de la deglución exhaustivo, que nos indique los alimentos que maneja cada paciente, en función del tipo de disfagia, la capacidad deglutoria y masticatoria. La masificación de las dietas y el generalismo muestran ineficacia en la alimentación de personas con disfagia, ya que como hemos visto en el apartado anterior, la disfagia puede producirse por diversos factores y en diferentes etapas deglutorias. En los últimos años este tipo de cocina está aumentando su relevancia, puesto que las dietas a base de alimentos preparados por la industria tienen una alta insatisfacción para los pacientes que las degustan. Así, la dieta tradicional modificada nos evoca a nuestra comida por su sabor. Para la modificación es imprescindible, según expertos culinarios, conocer cómo se comportan los alimentos y así conseguir una consistencia segura y eficaz. Se consigue degustar de esta forma cada plato de forma individual evocando los sabores tradicionales y buscando la satisfacción. Las modificaciones se pueden realizar utilizando triturados de alimentos que no contengan ni huesos, ni espinas, con elementos de densidad como harina, tapioca o los propios espantes de sabor neutro y siempre perdurando las propiedades organolépticas del producto, como son sabor, olor, textura final y apariencia. El emplatado y la presentación final utilizando diferentes colores, así como el moldeado de los diferentes alimentos, hacen de la comida diaria un momento saludable y satisfactorio, escapando de los monótonos y desaboridos purés.
La administración sistemática de suplementos orales a pacientes que han sufrido un ictus no aporta beneficio alguno (estudio FOOD 1), así que deben reservarse para aquellos pacientes malnutridos al ingreso o para aquellos cuyo estado nutricional se deteriora durante el mismo.
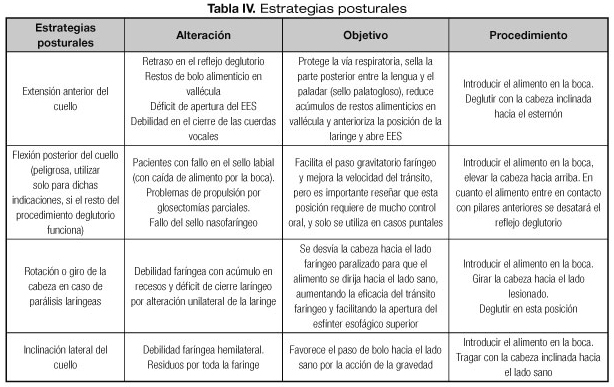
Determinadas medidas posturales pueden ser de utilidad para ayudar a una deglución segura y eficaz y se tratarán más adelante (Tablas IV y V).
Nutrición enteral (NE)
De forma habitual, este tipo de soporte nutricional se considera indicado cuando el paciente no puede recibir alimentación oral por un periodo de al menos 7 días (cinco si presenta desnutrición). Si la NE se mantiene durante menos de 1 mes, se administrará mediante sonda nasogástrica (SNG), y si se prolongase más tiempo estaría indicada la colocación de una gastrostomía por vía endoscópica o radiológica. Una revisión sistemática de la Biblioteca Cochrane concluyó que la gastrostomía endoscópica percutánea (PEG) se asoció a menor mortalidad y menos fracasos del tratamiento nutricional que la alimentación por SNG. El estudio FOOD 2 no demostró una diferencia estadísticamente significativa entre el inicio precoz (antes de 72 horas) o diferido de la NE sobre la mortalidad o las complicaciones. Sin embargo, el intervalo de confianza (95% CI -0,8 a 12,5%) de la reducción absoluta del riesgo de muerte del 5,8% observada en dicho estudio a favor de la NE precoz, se considera lo suficientemente preciso como para que sea muy improbable que se asocie a un incremento relevante del riesgo, por lo que algunas guías de práctica clínica recomiendan iniciar NE en las primeras 24 horas en todo paciente con ictus que no tolere la vía oral.
La vía de administración de elección sería la SNG, ya que tampoco la colocación temprana (en el primer mes después del ictus) de gastrostomías ha demostrado ventajas (estudio FOOD 3). Dado que los requerimientos nutricionales de estos pacientes no difieren de los de la población de su misma edad y sexo, la fórmula de elección será una polimérica, normoproteica, normocalórica y con fibra, salvo que alguna otra situación haga recomendable otro tipo diferente. En todo caso, hay que cuidar el balance hidroelectrolítico de estos enfermos. La NE domiciliaria ha demostrado ser coste-efectiva en este grupo de pacientes (26).
TRANSICIÓN A LA ALIMENTACIÓN ORAL
Nuestro principal objetivo en la transición a la alimentación oral es conseguir una deglución segura mientras se mantiene una hidratación y nutrición adecuada. Como hemos comentado en capítulos anteriores, una valoración exhaustiva nos indica cómo se comporta el paciente en la deglución; pero antes debemos comenzar por una rehabilitación oromotora no nutritiva, cuyo objetivo es la normalización de la función oromotora para conseguir una deglución más frecuente, y así conseguir disminuir el riesgo de aspirar las propias secreciones, y posteriormente una estimulación oromotora nutritiva.
Si el paciente está clínicamente estable, suficientemente alerta y ha recuperado la capacidad deglutoria segura, puede iniciarse la transición hacia la alimentación oral. El primer paso será administrar la NE en forma de bolos para comprobar su tolerancia y favorecer la sensación de apetito. Seguidamente se administrarán pequeñas cantidades de puré antes de los bolos de NE en los horarios de las comidas normales. Progresivamente se aumentará la cantidad de dieta oral y se disminuirá la de NE, de modo que si el paciente es capaz de cubrir el 75% de sus requerimientos mediante dieta oral durante al menos 3 días podría retirarse la sonda.
Muchos son los estudios y los manuales que hablan sobre las recomendaciones en cuanto a los alimentos, el entorno y las maniobras posturales, pero existe poca referencia a cómo debe ser esta transición real. Tras la valoración objetiva, y después de realizar estimulaciones no nutritivas, y aunque lo recomendable sería tener datos de videofluoroscopia para comenzar a dar de comer, pero esto en la mayoría de los centros sanitarios no es posible, nuestra indicación es que debemos de monitorizar al paciente en las primeras ingestas. La imposibilidad de que el equipo logopédico se encuentre en todas las ingestas a lo largo del día hace que la participación del equipo de enfermería sea fundamental. Ellos son quienes deben conocer las alteraciones en seguridad y eficacia, la exploración mediante pulxiosímetro y la auscultación cervical, así como una vigilancia continua en el proceso de deglución para ver el manejo del alimento, entre otras cosas, pidiendo por ejemplo al paciente que abra la boca al terminar el bocado y ver el vaciamiento de la cavidad oral. Una buena comunicación en el equipo multidisciplinar es la base de una ordenada transición a la dieta oral.
Existen técnicas de incremento sensorial, como son las variaciones de volumen, de la viscosidad del alimento, de sabor y temperatura, y de la estimulación predeglutoria mediante la vista y el olfato, que se utilizan a la hora de conseguir una buena deglución.
Según la guía SIGN, los pacientes con disfagia deben de realizar un programa de rehabilitación deglutoria que incluya las praxias, las técnicas compensatorias y la modificación de la dieta.
La rehabilitación deglutoria debe ir a la par en el camino en esta transición; la terapia miofuncional personalizada a cada paciente, encargada de enseñar los patrones neuromusculares orofaciales correctos y una estimulación oral, junto con un programa de praxias adecuado (27), rehabilitan en un alto porcentaje la disfagia en ictus agudos, consiguiendo una deglución normalizada.
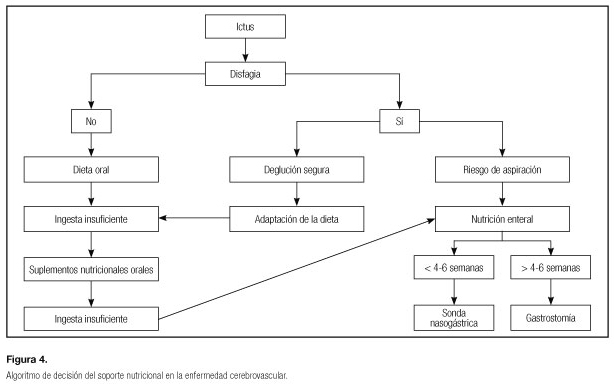
En la tabla VI se recogen las recomendaciones de las guías ESPEN de NE, publicadas en 2006 (están a punto de publicarse las recomendaciones actualizadas) y en la figura 4 un algoritmo de tratamiento nutricional en el paciente con ictus.
RECOMENDACIONES EN EL ENTORNO, ESTRATEGIAS POSTURALES Y MANIOBRAS DEGLUTORIAS
Para establecer una deglución segura y eficaz, el alimento debe estar preparado adecuadamente y, a ello, sumaremos una serie de consideraciones posturales, y también en cuanto al volumen ingerido, a la higiene bucal, al entorno y a los cuidadores, para que tengan conocimiento de las causas y sobre todo de las consecuencias de las dificultades que genera una disfagia.
Las recomendaciones generales que recogen los manuales, incluyen entre otras, un buen estado de alerta del paciente; este tiene que estar despierto y despejado a la hora de comer; es importante mantener buena postura, pies apoyados y el tronco lo más cercano a los 90 grados, cuidando de que si el paciente está en silla de ruedas vigilar que no haga hiperextensión de la cabeza, apoyándose cómodamente en el reposacabezas; se recomienda flexionar la cabeza ligeramente hacia delante en el momento de tragar como norma general; si la persona está encamada, debemos elevar el respaldo para conseguir una postura lo más cercana a los 60 grados. Ante la imposibilidad para mantener una postura correcta, se pueden necesitar adaptaciones para corregir dichas dificultades.
En cuanto al entorno y al cuidador, este deberá estar en posición cómoda, a la altura del paciente, si es necesario sentándose en una silla o taburete; no de dejar comiendo sola a la persona que tiene dificultades para tragar. Debe asegurarse la fijación de la prótesis dental antes de la ingesta; la comida se tiene que llevar a cabo en un ambiente tranquilo y agradable, evitar las distracciones, la televisión, gritos o conversaciones; hay que favorecer la concentración. Anticipar con palabras lo que se va a comer y enseñar el contenido. El cuidador debe ofrecer información sobre el alimento, incluso acercándole el plato para favorecer el olfato. Debe asegurarse de que la boca está vacía antes de introducir otra cucharada. Por regla general, se administra el alimento con cuchara y a volúmenes medios, esto vendrá determinado por los resultados de la valoración en cuanto a volumen admitido en cada caso en particular.
Es necesario buscar las adaptaciones necesarias en cuanto a cubiertos, platos y vasos para favorecer la autoalimentación, siendo esta mucho más beneficiosa, siempre y cuando sea segura y eficaz.
En caso de impulsividad recordarle la necesidad de comer despacio, con una estrategia, como puede ser, dejar los cubiertos encima de la mesa al terminar cada bocado. Y si, por el contrario, tuviera falta de iniciativa, motivar a seguir comiendo siempre de la misma forma, es recomendable seguir rutinas fijas en cuanto a horario, estancia y utensilios.
Después de cada comida, mantener una buena higiene oral, tanto de los dientes, como de la lengua, para evitar infecciones por restos alimenticios desperdigados y mantenerse erguido o sentado, durante al menos 20 o 30 minutos, para evitar aspiraciones.
Hay determinadas estrategias posturales que se detallan en la tabla IV indicadas para modificar las dimensiones faríngeas y redirigir el flujo del bolo, así como para proteger las vías respiratorias. Estas pueden utilizarse incluso en pacientes con un nivel cognitivo deteriorado o con limitaciones de movimiento porque no requieren de una participación activa por parte del paciente. Después de realizar una valoración exhaustiva, se pueden utilizar diferentes estrategias en determinados momentos de la rehabilitación.
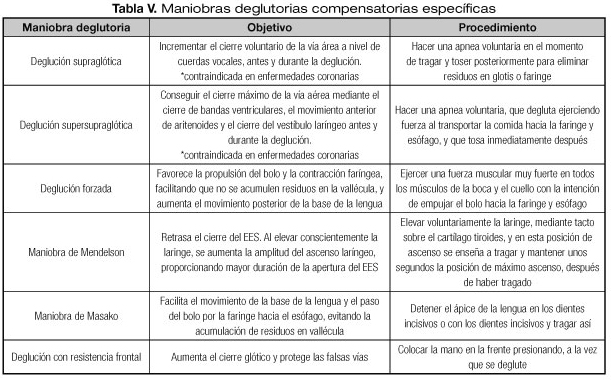
Diferentes manuales recogen las maniobras deglutorias compensatorias específicas, detalladas en la tabla V, estas maniobras requieren que el paciente debe ser capaz de aprenderlas y realizarlas de forma automatizada. Son maniobras voluntarias que ayudan a cambiar la fisiología de la deglución de manera consciente, por lo que necesitan de la participación activa del paciente, el cual deberá entenderlas y practicarlas hasta asimilarlas, por lo que se requiere un buen estado cognitivo y estado de alerta.
Tanto familiares, como cuidadores y personal sanitario deben conocer las recomendaciones generales para una alimentación segura y eficaz. Es función del personal sanitario ser conocedores y dar a conocer, en caso de atragantamiento severo, cuáles son las recomendaciones más actualizadas de la European Resucitation Council de 2015, para actuar con eficacia (28).
BIBLIOGRAFÍA
1. Ballesteros Pomar MD, Ares Luque A. Nutrición basada en la evidencia en las enfermedades neurológicas. Endocrinol Nutr 2005;52(Supl 2):97-101. [ Links ]
2. Wanden-Berghe C, Álvarez Hernández J, Burgos Peláez R, Cuerda Compes C, Matía Martín P, Luengo Pérez LM, et al.; Grupo NADYA-SENPE. A home enteral nutrition (HEN); Spanish registry of NADYA-SENPE group; for the year 2013. Nutr Hosp 2015;31:2518-22. [ Links ]
3. Vidal Casariego A, Calleja Fernández A, Villat Taibo R. Soporte nutricional en las enfermedades neurológicas. En: Cano Rodríguez I, Ballesteros Pomar MD, Corcoy Plá R, Jodar E, Mauricio D, Rubio MA, et al, editors. Manual del Residente de Endocrinología y Nutrición, SEEN; 2015. [ Links ]
4. Marrugat J, Arboix A, Garcia-Eroles LL, Salas T, Vila J, Castell C, et al. Estimación de la incidencia poblacional y letalidad de la vascular establecida isquémica y hemorrágica en 2002. Rev Esp Cardiol 2007;60:573-80. [ Links ]
5. Martineau J, Bauer JD, Isenring E, Cohen S. Malnutrition determined by the patient-generated subjective global assessment is associated with poor outcomes in acute stroke patients. Clinical Nutrition 2005;24:1073-7. [ Links ]
6. Gariballa SE, Parker SG, Taub N, Castleden M. Nutritional status of hospitalized acute stroke patients. Br J Nutr 1998;79:481-7. [ Links ]
7. FOOD Trial Collaboration. Poor nutritional status on admission predicts poor outcomes after stroke: observational data from the FOOD trial. Stroke 2003;34:1450-6. [ Links ]
8. Smithard DG. Dysphagia Management and Stroke Units. Curr Phys Med Rehabil Rep 2016;4(4):287-94. DOI: 10.1007/s40141-016-0137-2. [ Links ]
9. Arnold M, Liesirova K, Broeg-Morvay A, Meisterernst J, Schlager M, Mono ML, et al. Dysphagia in Acute Stroke: Incidence, Burden and Impact on Clinical Outcome. PLoS One 2016;11(2):e0148424. DOI: 10.1371/journal.pone.0148424 [ Links ]
10. Mann G, Hankey GJ. Initial clinical and demographic predictors of swallowing impairment following acute stroke. Dysphagia 2001;16:208-15. [ Links ]
11. Peña-Chavez R, López-Espinoza M, Guzmán-Inostroza M, Jara-Parra M, Sepúlveda-Arriagada C, Sepulveda-Arriagada C, et al. Factores asociados a la disfagia orofaríngea postictus. Rev Neurología 2015;61(7):295-300. [ Links ]
12. Clave P, García P. Guía de diagnóstico y tratamiento nutricional y rehabilitador de la disfagia orofaríngea. 2011. pp. 33-45. [ Links ]
13. Bath PM, Bath FJ, Smithard DG. Interventions for dysphagia in acute stroke. Cochrane Database of Systematic Reviews 1999; Issue 4. Art. No.: CD000323. DOI: 10.1002/14651858.CD000323. [ Links ]
14. National Institute for Health and Care Excellence (NICE). Stroke and Transient Ischaemic Attack in over 16s: Diagnosis and Initial Management. Clinical Guideline [CG68]. 2008. Available online: https://www.nice.org.uk/guidance/Cg68 (access0 24 de enero de 2017).
15. Mohr NI, Baldwin N, White P. Analysis of the implementation of a validated swallowing screening tool for acute stroke: the Modified Mann Assessment of Swallowing Ability (MMASA). Int J Stroke 2011;6(S2):8. [ Links ]
16. Belafsky PC, Mouadeb DA, Rees CJ, Pryor JC, Postma GN, Allen J, et al. Validity and reliability of the Eating Assessment Tool (EAT-10). Ann Otol Rhinol Laryngol 2008;117:919-24. [ Links ]
17. Burgos R, Sarto B, Segurola H, Romagosa A, Puiggrós C, Vázquez C, et al. Translation and validation of the Spanish version of the EAT-10 (Eating Assessment Tool-10) for the screening of dysphagia. Nutr Hosp 2012;27:2048-54. [ Links ]
18. Ickenstein GW, Riecker A, Höhlig C, Müller R, Becker U, Reichmann H, et al. Pneumonia and in-hospital mortality in the context of neurogenic oropharyngeal dysphagia (NOD) in stroke and a new NOD step wise concept. J Neurol 2010;257:1492-9. [ Links ]
19. DePippo KL, Holas MA, Reding MJ. Validation of the 3-oz water swallow test for aspiration following stroke. Arch Neurol 1992;49:1259-61. [ Links ]
20. Clavé P, Arreola V, Romea M, Medina L, Palomera E, Serra-Prat M. Accuracy of the volume-viscosity swallow test for clinical screening of oropharyngeal dysphagia and aspiration. Clin Nutr 2008;27:806-15. [ Links ]
21. Park YH, Bang HL, Han HR, Chang HK. Dysphagia screening measures for use in nursing homes: a systematic review. J Korean Acad Nurs 2015;45:1-13. [ Links ]
22. Gonzalez R, Bevilacqua J. Disfagia en el paciente neurológico. Rev Hops Clin Chile 2009;20:252-62. [ Links ]
23. Zenner PM. Using cervical auscultation in the clinical dysphagia examination in the longterm care. Dysphagia 1995;10:27-31. [ Links ]
24. Guillén-Solà A, Martínez-Orfila J, Boza Gómez R, Monleón Castelló S, Marco E. Cribaje de la disfagia en el ictus: utilidad de los signos clínicos y el método de exploración clínica de volumen viscosidad en comparación con la videofluoroscopia. Rehabilitación 2011;45:292-300. [ Links ]
25. Imserso. Guía de Nutrición para Personas con Disfagia. 2015. [ Links ]
26. Elia M, Stratton RJ. A cost-utility analysis in patients receiving enteral tube feeding at home and in nursing homes. Clin Nutr 2008;27:416-23. [ Links ]
27. Catriona M. Estrategias con base en ejercicio para rehabilitación de la disfagia. Nestle Nutrition Institute; 2015. Vol. 2. [ Links ]
28. Monsieurs KG, et al. European Resuscitation Council Guidelines for Resuscitation 2015. Section 1, 18. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
María D. Ballesteros Pomar.
Unidad de Nutrición Clínica y Dietética.
Sección de Endocrinología y Nutrición.
Complejo Asistencial Universitario de León.
Calle Altos de nava, s/n.
24001 León
e-mail: Mdballesteros@telefonica.net