INTRODUCCIÓN GENERAL AL CONCEPTO DE PROGRAMACIÓN NUTRICIONAL
La nutrición durante las etapas tempranas de la vida puede influir en el desarrollo y en la aparición de enfermedades en la edad adulta, lo cual tiene importantes implicaciones clínicas y de salud pública 1.
Desde hace años se conocen las consecuencias que a largo plazo conllevan determinados acontecimientos que suceden en etapas tempranas de la vida, incluso en el periodo embrionario-fetal. Dichos acontecimientos pueden actuar de tres formas diferentes: ocasionando un daño directo, induciendo o limitando el desarrollo de una estructura somática o alterando una función fisiológica. En 1991, Lucas propuso que el término "programación" se aplicara cuando un estímulo en un periodo sensible del desarrollo ("periodo crítico") ocasionase efectos a largo plazo o de por vida en un individuo 2. Desde una perspectiva antropológica, los cambios que se producen durante esos periodos críticos, en respuesta a la acción del ambiente, actuarían como un ajuste del organismo a estos estímulos precoces, con el fin de prepararlo para la exposición al medio que presumiblemente se encontrará después (adaptación biológica). Sin embargo, puede ocurrir que esos cambios puedan tener un sentido contrario a la adaptación o, más frecuentemente, que no sirvan para el ambiente al que realmente el organismo se enfrentará posteriormente (mismatch) 3.
En la naturaleza existen numerosos ejemplos que muestran la influencia de los factores ambientales, incluida la alimentación, en la programación precoz de los individuos. La nutrición durante las etapas tempranas es capaz de modular el crecimiento y el desarrollo funcional del organismo y puede ejercer efectos de programación metabólica precoz que perduren a lo largo de la vida 4.
Tras años de investigación en animales, en la que los estudios de McCance fueron pioneros en demostrar los efectos de la programación nutricional 5, los primeros datos en humanos se obtuvieron de estudios epidemiológicos, tanto sobre los efectos de la nutrición temprana en el neurodesarrollo como en el riesgo de enfermar a lo largo de la vida. En este contexto, fueron fundamentales los trabajos del grupo de Barker en los que se observó una asociación entre datos antropométricos al nacimiento y al año de edad y el riesgo de padecer una enfermedad cardiovascular en la edad adulta 6. Estas investigaciones dieron origen al nacimiento de una nueva disciplina científica, en inglés, Developmental Origins of Health and Disease (DOHaD) 7. El último avance lo constituyen los estudios de intervención en nutrición temprana, en los que se ha observado que actuaciones en esos periodos críticos del desarrollo, en especial en la etapa posnatal inmediata, contribuyen a modificar el crecimiento y la ganancia ponderal a medio y largo plazo 8.
Por tanto, la alimentación de la mujer durante el embarazo y la del niño en los dos primeros años de vida (los primeros 1000 días) resultan cruciales para el desarrollo y la salud en ese momento y en etapas posteriores 9. No se trata de recomendar una "dieta sana" y de aportar una cantidad suficiente de energía para garantizar un crecimiento adecuado, sino de optimizar el aporte de nutrientes al niño en desarrollo, lo que supondrá una verdadera "programación nutricional temprana". En esta línea apunta la Organización Mundial de la Salud (OMS) en su Plan de aplicación integral sobre nutrición materna, del lactante y del niño pequeño, en el que se priorizan acciones para conseguir mejorar el desarrollo y la salud de los niños en el mundo antes de 2025 10.
Adicionalmente, otros factores, entre los que destaca la microbiota intestinal, están cobrando importancia en los últimos años. Así, las interacciones entre esta y el hospedador son factores que potencialmente influyen en la programación temprana de las funciones intestinales y de otros órganos 11. Las alteraciones de la colonización bacteriana del tracto gastrointestinal tras el nacimiento pueden conducir a aumentar el riesgo de enfermedad en edades posteriores 12. Además, una microbiota intestinal saludable favorecerá la función y el desarrollo del sistema inmune del niño 13.
En este documento se revisará cómo los factores relacionados con la alimentación antes de la gestación, durante el embarazo y los dos primeros años de edad modifican el riesgo de desarrollar enfermedades no transmisibles, con especial atención a la obesidad y a la alergia.
EL PROBLEMA DE LAS ENFERMEDADES NO TRANSMISIBLES
Las enfermedades no transmisibles (ENT) son enfermedades crónicas no infecciosas que progresan lentamente durante largos periodos de tiempo. Estos trastornos son en gran parte prevenibles y comparten factores de riesgo, determinantes básicos y oportunidades de intervención.
La nutrición temprana, uno de los determinantes más importantes del desarrollo y de la función de órganos y sistemas, es un factor importante para la prevención de las ENT y la mejora de la salud futura.
La obesidad supone un factor metabólico de riesgo para el desarrollo de otras ENT. Se asocia desde la infancia con un mayor riesgo de alteraciones como el síndrome metabólico, la resistencia a la insulina, la hipertensión arterial, problemas musculoesqueléticos, alteraciones del sueño y la diabetes de tipo 2, entre otras. La obesidad infantil es un importante problema de salud pública a nivel mundial 14. En España, la prevalencia de sobrepeso y obesidad se cifra en el 41,3% de los niños de seis a nueve años (42,8% en niños y 39,7% en niñas) 15. En el informe de la OMS Ending childhood obesity se señala la oportunidad de realizar intervenciones para la prevención de la obesidad y de otras ENT asociadas durante el periodo de los primeros 1.000 días 16.
Las enfermedades alérgicas, cuya prevalencia no cesa de aumentar, especialmente en niños y adultos jóvenes, suponen también un problema de salud pública mundial. Se considera que un 30-40% de las personas padecen una o más enfermedades alérgicas en el mundo. Esta proporción es similar: uno de cada cuatro individuos está afectado por algún tipo de trastorno alérgico 17.
La inflamación que acompaña a casi todas las ENT sugiere un papel central del sistema inmune en el riesgo y la patogénesis de estas enfermedades. El importante aumento de la frecuencia de enfermedades alérgicas en la infancia, así como de otras enfermedades inmunes, indica la vulnerabilidad específica de este sistema a los cambios ambientales tempranos 18. Al igual que con otras ENT, los factores genéticos no pueden explicar por sí solos el gran incremento de la prevalencia de las enfermedades alérgicas, por lo que los factores ambientales, como el exceso de higiene, la menor exposición a los agentes infecciosos 19,20, los modernos patrones de alimentación y la contaminación atmosférica 21, parecen desempeñar un papel clave.
La relación entre las enfermedades alérgicas y otras ENT no se ha estudiado profundamente hasta hace relativamente poco tiempo. Algunas de las principales causas reconocidas como responsables del aumento de casos de alergias están emergiendo ahora también como posibles causantes de la epidemia de obesidad. Además, existen varios estudios que sugieren que la obesidad infantil aumenta a su vez el riesgo de asma 22,23 y de alergia a los alimentos 24.
Si bien muchas ENT no se manifiestan hasta la edad avanzada, las enfermedades alérgicas pueden aparecer en los primeros meses de vida 18. Parece existir relación entre la colonización intestinal en el recién nacido y el riesgo de padecer diversas manifestaciones alérgicas 25, lo que podría suponer una oportunidad como estrategia de intervención 26.
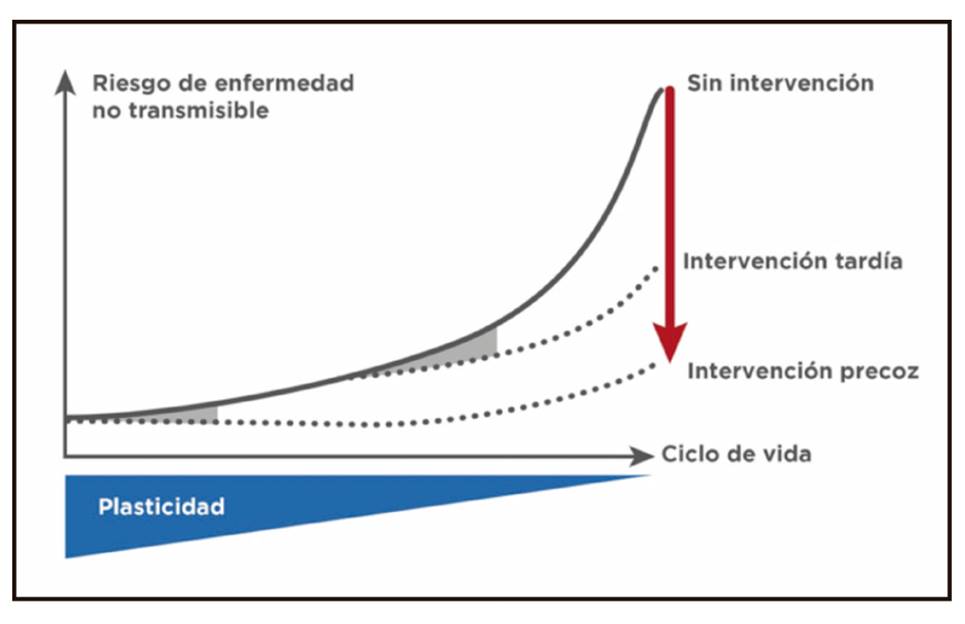
La prevención temprana constituye una estrategia prioritaria para reducir la prevalencia de las ENT, ya que no existen tratamientos para sus causas y su incidencia y prevalencia están en aumento. Al igual que la expresión génica puede variar en función del órgano o tejido, también se ve influenciada por los factores ambientales (epigenética), pudiendo provocar cambios estables de gran impacto en la susceptibilidad del individuo a desarrollar ENT 27. Como durante los primeros 1000 días de vida la expresión génica es intrínsecamente flexible, la posibilidad de intervención para prevenir o revertir los cambios epigenéticos en este periodo de mayor plasticidad representa una ventana de oportunidad. La actuación sobre la alimentación en este periodo puede contribuir a disminuir la frecuencia de estas enfermedades 28 (Fig. 1).
LOS PRIMEROS 1000 DÍAS EN LA PREVENCIÓN DE LA OBESIDAD Y LAS ENFERMEDADES ALÉRGICAS
FACTORES PRENATALES
La situación nutricional de la mujer, pero también del varón, en el momento de la concepción influyen en el riesgo de aparición de ENT en la descendencia.
Durante el embarazo, las necesidades de energía aumentan solo un 10% respecto a la ingesta energética antes del embarazo y dicho aporte energético debe obtenerse de alimentos ricos en proteínas, vitaminas y minerales. Especialmente en la segunda mitad del embarazo, se debería aumentar la ingesta de frutas y verduras para alcanzar los requerimientos de vitaminas y minerales, y tomar tres o cuatro raciones de lácteos al día, ya que la leche tiene proteínas de alto valor biológico y un alto contenido en calcio, además de contar con otros componentes importantes para el desarrollo como la vitamina D, necesaria para el crecimiento óseo del feto y para la función inmunológica 29).
En España, la suplementación con ácido fólico, hierro y yodo durante el embarazo es una práctica generalizada que permite cubrir de forma adecuada los respectivos requerimientos. Sin embargo, la situación no es la misma para otros nutrientes como los ácidos grasos omega-3, en especial el ácido docosahexaenoico (DHA), y algunos minerales antioxidantes, en los que los depósitos dependen fundamentalmente de la calidad de la dieta materna 30.
FACTORES GESTACIONALES Y OBESIDAD EN LA INFANCIA
Es importante conocer e interpretar adecuadamente la relevancia de los determinantes de la obesidad en las primeras etapas de la vida para desarrollar estrategias saludables desde la etapa prenatal. En España, el 45% de las mujeres en edad reproductiva tienen un exceso de peso (sobrepeso u obesidad), lo que puede aumentar el riesgo de diabetes y eclampsia durante el embarazo y puede contribuir a una mayor adiposidad del recién nacido, contribuyendo a la programación de obesidad en la infancia 31.
El ejemplo más claro de la influencia de los factores gestacionales lo podemos observar entre hermanos nacidos de madres con obesidad antes y después de que la madre se sometiera a una cirugía de bypass gastrointestinal para perder peso. Los hijos nacidos tras dicha intervención quirúrgica presentaron menor frecuencia de macrosomía (1,8% vs. 14,8%) y obesidad grave en la adolescencia (11% vs. 35%) que sus hermanos nacidos antes de dicha intervención en la madre 32,33). La obesidad materna representa duplicar el riesgo de tener niños grandes para la edad gestacional y un riesgo cinco veces mayor de desarrollar obesidad en la adolescencia para los hijos, respecto a embarazadas con normopeso y sus hijos 34.
El peso materno al inicio del embarazo y la ganancia de peso durante el mismo están asociados de forma positiva e independiente con la adiposidad del niño a los cinco años 35,36. En caso de sobrepeso/obesidad al inicio del embarazo, se debe realizar, desde el primer trimestre, una intervención de alimentación y actividad física intentando adaptarse a las ganancias de peso recomendadas. Es importante que la embarazada no pierda peso ni lo gane en demasía. La obesidad del padre, aunque se ha asociado en algunos estudios con la obesidad de los hijos, siempre lo ha hecho en menor grado que la de la madre 37,38.
Es importante destacar que, como recogen los protocolos de la Sociedad Española de Ginecología de 2010 39, las mujeres con obesidad requieren mayores suplementos de ácido fólico que las que presentan normopeso 40. Además, los niveles en sangre de vitamina D están reducidos en mujeres obesas, ya que al ser liposoluble se distribuye o es secuestrada por el gran reservorio de grasa materno, dejando de estar disponible para su transferencia al feto. Así pues, es importante tener unos niveles de vitamina D apropiados durante el embarazo y más aún si se trata de una embarazada con obesidad.
Otro parámetro estrechamente vinculado con el peso de la madre durante la etapa de embarazo es la realización de actividad física. Se estima que solo un 15% de las mujeres embarazadas siguen las recomendaciones actuales de actividad física. Según una revisión reciente en la base de datos Cochrane, las intervenciones con dieta, ejercicio o ambas ayudan a reducir la ganancia excesiva de peso durante el embarazo 41. Si el ejercicio se hace en el exterior, esto además podría contribuir a mejorar las concentraciones de vitamina D de las embarazadas. La realización de actividad física durante el embarazo reduce significativamente el riesgo de desarrollar diabetes gestacional, que es un factor de riesgo de obesidad infantil 42, y el riesgo de tener niños grandes para la edad gestacional 43. En cuanto a sus efectos a largo plazo sobre el desarrollo de obesidad infantil, se necesitan más estudios y con mayor número de sujetos.
FACTORES GESTACIONALES Y ALERGIAS EN LA INFANCIA
Si bien existe una predisposición genética para el desarrollo de enfermedades alérgicas en el niño, también los factores ambientales a los que está expuesta la madre durante el embarazo pueden condicionar la predisposición a desarrollar alergia en edades tempranas.
La obesidad materna se asocia con mayor riesgo de sibilancias, asma y enfermedad respiratoria en niños 44,45,46. La causa puede estar relacionada con una programación adversa de las señales inflamatorias Th2 ligadas a la obesidad de la madre 47.
La ingesta de ciertas vitaminas como A, D y E 48 y el consumo de la dieta Mediterránea durante el embarazo (rica en estas vitaminas antioxidantes) se asocia con menor riesgo de asma en los hijos 49. La vitamina E en el primer trimestre se asocia con mayor función pulmonar en niños de cinco años, lo que apoya la idea de una programación fetal del crecimiento pulmonar en el útero materno 50. Además, países con altos niveles de vitamina E tienden a tener menor prevalencia de asma.
Diversos estudios epidemiológicos asocian concentraciones bajas de vitamina D en embarazadas con un mayor riesgo en el hijo de desarrollar algunas patologías alérgicas como el asma 51. En un metaanálisis reciente, se observó que la suplementación con vitamina D durante el embarazo redujo significativamente el riesgo de asma en niños (RR 0,812; 95% CI 0,67-0,98) 52. Tanto la vitamina D como los ácidos grasos omega-3 contribuyen al balance de respuestas inmunológicas Th1/Th2 53 y su consumo debe de ser adecuado durante el embarazo.
Además de la nutrición materna, existen otros factores ambientales, como los contaminantes, entre los que destaca el humo del tabaco, que influyen en el desarrollo y la función del sistema inmunitario.
El tabaco es un factor de riesgo asociado claramente con la enfermedad alérgica respiratoria 54,55. Las madres deben evitar fumar durante el embarazo y la lactancia. Además, existen claras evidencias con gran número de estudios y un metaanálisis reciente que indican consistentemente que fumar durante el embarazo se asocia con la obesidad de los hijos 56, lo que podría retroalimentar el riesgo de asma en los niños 57.
LA MICROBIOTA INTESTINAL
La microbiota humana se define como el conjunto de bacterias y otros microorganismos que residen en diferentes nichos del cuerpo humano, como la piel (microbiota cutánea), la boca (microbiota oral), el intestino (microbiota intestinal) o la vagina (microbiota vaginal), entre otros.
En el tracto gastrointestinal, la microbiota está formada por una comunidad bacteriana compleja, dinámica y en equilibrio que juega un papel fundamental en la salud, interviniendo en importantes funciones fisiológicas, metabólicas e inmunológicas del hospedador. A las alteraciones en el equilibrio, la composición y/o la función de la microbiota se las denomina "disbiosis", y esta conlleva un aumento de patógenos y disminución de la diversidad microbiana. Como respuesta a esto, se produce inflamación de bajo grado que puede cronificarse, asociándose a un mayor riesgo de desarrollar ciertas ENT como, por ejemplo, alergias, problemas inflamatorios intestinales, diabetes mellitus tipo 1, obesidad y también trastornos neurológicos y cognitivos 58,59.
MICROBIOTA PERINATAL EN LA PROGRAMACIÓN DE LA SALUD DEL NIÑO
La gestación es un proceso biológico que incluye cambios simultáneos en muchos sistemas fisiológicos (cambios hormonales, ganancia de peso, modulación del sistema inmune, etc.) de la madre que garantizan el desarrollo fetal, y estos han de estar sincronizados para preservar la salud materna-fetal 60. En paralelo a estos, se producen modificaciones en la composición y diversidad microbiana materna, no solo en la microbiota intestinal sino también en la vaginal y en la de la cavidad oral 60,61. El primer contacto de los recién nacidos con bacterias es a través de la microbiota materna. Diversos estudios han mostrado que existen cepas bacterianas específicas comunes entre el intestino materno, la leche materna y el intestino de los recién nacidos 62, lo que indica la transmisión vertical de las bacterias maternas al neonato. De esta manera, alteraciones en la microbiota materna podrían ser transferidas al neonato durante la gestación, el parto y/o a través de la leche de la madre, favoreciendo el desarrollo de alteraciones en la microbiota del recién nacido y el consecuente efecto en su salud a corto y largo plazo.
Hasta ahora, se pensaba que el ambiente intrauterino era estéril y se había asumido que el inicio de la colonización microbiana comenzaba en el momento del parto. Sin embargo, este concepto está cambiando debido a la detección de ADN de bacterias típicas del tracto intestinal (familias Firmicutes, Proteobacteria, Bacteroidetes y Fusobacteria) en muestras del binomio materno-fetal como la placenta, el cordón umbilical, el líquido amniótico y el meconio procedentes de embarazos sanos 58,60,63,64,65. Esto implica que bacterias maternas pueden ser transferidas al niño durante todo el periodo perinatal, tanto durante la gestación como en el momento del parto, aunque existen otros estudios que sugieren que la exposición a bacterias durante la gestación es limitada 66.
Por tanto, las bacterias que la madre transfiere a sus hijos tanto durante la gestación como en el parto son claves para la adecuada colonización microbiana y el correcto desarrollo y maduración del sistema inmune. Esta transferencia de microorganismos tiene un gran impacto en una de las etapas más críticas de la vida, pudiendo afectar al riesgo de desarrollar ciertas ENT a corto y largo plazo.
MICROBIOTA POSNATAL. FACTORES QUE INFLUYEN EN LA COLONIZACIÓN MICROBIANA
La microbiota intestinal neonatal es un complejo ecosistema bacteriano vinculado con la nutrición, el metabolismo y la estimulación del sistema inmune que afecta al desarrollo del niño durante las distintas etapas del crecimiento. La microbiota materna resulta ser el primer inóculo del feto y, tras el nacimiento, esta va aumentando gradualmente en diversidad filogenética para, al final de los tres años de vida, converger hacia una composición semejante a la del adulto.
La colonización microbiana del niño sucede de un modo paralelo con la maduración de su sistema inmunitario y desempeña un importante papel en la fisiología intestinal, así como también en el metabolismo. El establecimiento de la microbiota intestinal es un proceso dinámico, influenciado por factores ambientales tales como el tipo de parto, la exposición a microorganismos del ambiente, el uso de antibióticos, la prematuridad, el tipo de alimentación tanto de la madre como del lactante, así como también el genotipo del hospedador (Fig. 2).

Figura 2 Factores perinatales que influyen en la colonización y el desarrollo de la microbiota intestinal en el niño. Las alteraciones en los patrones de colonización bacteriana se asocian a un mayor riesgo de desarrollar ciertas enfermedades, incluidas obesidad y enfermedades alérgicas.
Como se ha visto en la sección anterior, durante la gestación existe relación entre el feto y las bacterias maternas. Sin embargo, la mayor exposición bacteriana ocurre en el momento del parto, cuando el neonato entra en contacto con la microbiota materna y el entorno. Tras el nacimiento, el intestino neonatal es colonizado rápidamente por un consorcio de microorganismos, principalmente de enterobacterias y bacterias acidolácticas como Lactobacillus spp, que son posteriormente desplazados por bacterias anaerobias estrictas como Bifidobacterium y Bacteroides spp 67.
Una vez establecida la microbiota intestinal inicial, la comunidad microbiana continúa su evolución a lo largo del periodo de lactancia y durante la introducción de la alimentación complementaria. Posteriormente, su composición sigue evolucionando al mismo tiempo que el hospedador y aumenta gradualmente en diversidad filogenética para finalmente converger hacia una microbiota que se podría denominar adulta.
MICROBIOTA Y OTROS COMPONENTES DE LA LECHE MATERNA
Entre los diversos factores que rodean al momento del parto y que influyen en el desarrollo y la composición de la microbiota intestinal, adquiere gran importancia el tipo de lactancia que recibe el niño. La leche materna es un alimento complejo y vivo que se adapta a las necesidades del recién nacido y que, además de macro y micronutrientes, incluye componentes inmunológicos, oligosacáridos, bacterias y metabolitos bacterianos, que van a modular la composición de la microbiota intestinal, favoreciendo a su vez el desarrollo del tracto gastrointestinal y del sistema inmune 68.
La leche materna es una fuente de bacterias comensales, mutualistas y potencialmente probióticas que apoyan el proceso de la colonización intestinal neonatal. Se estima que un lactante que ingiera aproximadamente 500-800 ml de leche al día recibe entre 105 y 107 bacterias 69,70.
A pesar de la gran variabilidad interindividual, la leche de cada mujer tiene una composición bacteriana única, de forma análoga a lo que sucede con la microbiota intestinal de niños y adultos. La microbiota de la leche materna contiene principalmente Streptococcus y Staphylococcus 71, seguidos por enterobacterias, Bifidobacterium, Enterococcus, Lactococcus y Lactobacillus, que están entre los primeros colonizadores del intestino del recién nacido, aunque se ha llegado a describir la presencia de unas 700 especies de bacterias en la leche 72. Estudios recientes muestran que recién nacidos alimentados con leche materna poseen en su microbiota intestinal un 27,7% de bacterias de la leche materna y un 10,3% de bacterias procedentes de la piel materna (areola) 73. Este estudio señala la relevancia de las bacterias transmitidas durante la lactancia en el proceso de colonización intestinal neonatal.
Además, hay que tener en cuenta que, al igual que ocurre con otros componentes de la leche de mujer, la composición de su microbiota puede sufrir cambios a lo largo del día y a lo largo del tiempo de lactancia, existiendo también diferencias en función de los individuos, la localización geográfica y otros factores 74.
La leche humana contiene diferentes oligosacáridos que constituyen el tercer componente más abundante de la misma. Se ha descrito que la leche madura de mujer contiene aproximadamente entre 5 y 20 g/L de oligosacáridos. Sus concentraciones varían a lo largo de la lactancia y es en el calostro y la forma temprana de leche donde se encuentran las concentraciones más altas, disminuyendo su concentración total a medida que avanza el curso de lactancia. Los oligosacáridos de la leche materna son carbohidratos complejos, de los que se estima que existen más de 1000 formas diferentes, si bien solo se han descrito más de 200 moléculas. Su presencia es única para los humanos. Poseen muchas funciones biológicas, incluida la protección contra bacterias y virus patógenos, acción inmunomoduladora, así como una acción prebiótica por su influencia en el crecimiento de bacterias beneficiosas, especialmente de Bifidobacterias.
Los compuestos de oligosacáridos más comunes utilizados en la nutrición infantil que tienen efectos prebióticos similares a los alcanzados con la leche materna incluyen galactooligosacáridos de cadena corta (scGOS), fructooligosacáridos de cadena larga (lcFOS) y la combinación de ambos. Los datos clínicos han demostrado que el efecto de esta combinación de prebióticos en el lactante y los primeros años de vida puede favorecer el desarrollo del sistema inmune, lo cual disminuye el riesgo de alergia 75.
MICROBIOTA INTESTINAL E INMUNIDAD
El intestino juega un papel crítico en el desarrollo y mantenimiento del equilibrio del sistema inmune. Al nacer, el sistema inmunitario no está totalmente desarrollado, por lo que es susceptible a infecciones y otras alteraciones como las alergias 76. Las interacciones entre la microbiota intestinal y el sistema inmune son esenciales en su maduración 77.
La disbiosis se acompaña habitualmente de sobrecrecimiento de bacterias u hongos patógenos y pérdida significativa de diversidad microbiana y grupos de bacterias clave. Estos cambios se asocian a desregulación inmunológica y a una respuesta inflamatoria del hospedador que puede cronificarse y contribuir al desarrollo de ENT. Además de múltiples elementos ambientales, pueden actuar como factores de riesgo de disbiosis la cesárea, por evitar la colonización por Bifidobacterium spp en el canal del parto, la rotura prematura de membranas, que aumenta el riesgo de infección perinatal y, por tanto, de estancia en unidades de cuidados intensivos neonatales y uso temprano de antibióticos, la ausencia de lactancia materna y el empleo de antibióticos en los primeros años de vida 78. Los estudios que muestran que los niños que desarrollan una enfermedad alérgica tienen una composición diferente y disbiótica de su microbiota intestinal 79,80 indican la importancia de su equilibrio en la programación inmune.
La modulación de la microbiota intestinal durante los primeros meses de vida, cuando el establecimiento de la microbiota y la maduración del sistema inmune no se han completado aún, brinda una importante oportunidad de intervención en el entrenamiento inmunológico 81. Así, se ha observado que los prebióticos, probióticos y simbióticos, que actúan sobre la microbiota, pueden estimular la inmunidad innata y optimizar el funcionamiento de la inmunidad adquirida 82.
PERIODO DE LACTANCIA EXCLUSIVA
La lactancia materna exclusiva está considerada como el mejor alimento para el neonato. Representa el vínculo materno-filial postnatal más importante y es vehículo de comunicación inmunológico, microbiológico y psicológico entre la madre y el niño. Organizaciones como la Organización Mundial de la Salud (OMS), Naciones Unidas para la Infancia (UNICEF), la Academia Americana de Pediatría (AAP) o la Asociación Española de Pediatría (AEP) recomiendan la lactancia materna exclusiva y a demanda durante los primeros seis meses de vida. Cuando no es posible la alimentación al pecho, se debe realizar con fórmulas para lactantes.
El impacto positivo de la lactancia materna sobre la reducción del riesgo a padecer enfermedades infecciosas durante el periodo de lactante y en los primeros años de vida es bien conocido 83. Además, un creciente cuerpo de evidencia sugiere que la lactancia juega también un papel relevante en el proceso de la programación de ENT a largo plazo, en especial la protección frente al sobrepeso y la obesidad infantil y frente al desarrollo de enfermedades alérgicas.
PROTECCIÓN FRENTE A LA OBESIDAD
Varias revisiones sistemáticas y metaanálisis publicados en los últimos años sugieren el papel de la lactancia materna como factor protector en la aparición del exceso de peso en la infancia y en la adolescencia 84,85. Un metaanálisis reciente, que recogía los resultados de 25 estudios epidemiológicos que engloban un total de 226.508 participantes, demuestra que la lactancia materna se asocia con una disminución significativa del riesgo de obesidad en la infancia (OR = 0,78, IC 95%, 0,74-0,81). Esta asociación tiene, además, un gradiente ascendente, de tal manera que la protección se incrementa a mayor duración de la misma 86.
Sin embargo, los resultados de un ensayo clínico aleatorizado reciente contradicen estas observaciones. La intervención consistente en aumentar la duración y la exclusividad de la lactancia materna en 13.557 lactantes seguidos hasta los 16 años de edad no se asoció con un menor riesgo de obesidad al llegar a la adolescencia. Al contrario, la prevalencia de sobrepeso/obesidad fue mayor en el brazo de intervención 87.
Se han propuesto distintos mecanismos plausibles para explicar la relación entre la lactancia materna exclusiva y el menor riesgo de desarrollo de obesidad, como la introducción más tardía de la alimentación complementaria y la menor ingesta energética y proteica. Estos mecanismos podrían estar mediados por una menor liberación de insulina y/u otras hormonas pancreáticas e intestinales en los lactantes amamantados o por el contenido de la leche materna en hormonas y otros factores biológicos, así como la distinta respuesta a los mecanismos de hambre y saciedad cuando se comparan con lactantes alimentados con una fórmula infantil.
Por otro lado, existen estudios que observan que la escasa masa grasa durante el periodo de lactante se asocia con mayores índices de obesidad en la edad adulta. También, que la ganancia de peso excesiva durante ese periodo se asocia con un mayor riesgo de obesidad en la edad pediátrica 88. Si bien puede haber variaciones entre razas o en función del nivel socioeconómico, se ha observado que la asociación es más clara en minorías raciales o niños con menor nivel socioeconómico 89.
PROTECCIÓN FRENTE A LAS ENFERMEDADES ALÉRGICAS
La leche humana contiene una variedad de sustancias inmunológicamente activas que incluyen inmunoglobulinas, factores antimicrobianos y leucocitos, así como compuestos con propiedades antiinflamatorias y promotoras de la tolerancia como los ácidos grasos poliinsaturados de cadena larga, factor activador de plaquetas e interleucina 10 90. También contiene agonistas y antagonistas de las respuestas inmunes innatas, incluidos CD-14 y factores que modulan la señalización de receptores toll-like. Desde hace algo más de una década se conoce que la leche humana contiene pequeñas glicoproteínas denominadas citocinas. Algunas citocinas como ciertos factores de crecimiento (TGF-beta 1 y 2, esta última la más frecuente en leche materna) pueden proteger frente a problemas inmunológicos (sibilancias, atopia, eccema), mediante su efecto en el desarrollo y mantenimiento del sistema inmune, la producción de IgA y la generación de tolerancia en estudios experimentales y humanos 91. Se desconoce el mecanismo último por el que estos compuestos inmunológicamente activos interactúan con el sistema inmune del recién nacido 92.
Es difícil evaluar el impacto de la lactancia sobre el riesgo de alergia puesto que no es posible llevar a cabo ensayos clínicos específicos. Los datos procedentes de los estudios epidemiológicos publicados no han podido confirmar que la lactancia materna exclusiva durante tres o cuatro meses se asocie a una disminución de la incidencia de eccema, aunque sí a la disminución en la frecuencia de sibilancias de repetición en los dos primeros años de vida 93,94.
A pesar de los numerosos factores biológicos presentes en la leche materna que pueden influir en distintos procesos homeostáticos, como el desarrollo y la reparación de los tejidos, la regulación inmune o el establecimiento de la microbiota, no ha podido demostrarse un efecto preventivo sobre el desarrollo de enfermedades alérgicas. Se especula que el auge de estas enfermedades es relativamente reciente, de tal modo que un alimento como la leche materna, que se ha ido adaptando a las necesidades del recién nacido a lo largo de la historia de la humanidad, no ha tenido tiempo de modificar su composición en este sentido. Sin embargo, puede modificarse por el ambiente materno. Esta característica abre la posibilidad de actuar en la prevención de la alergia mediante intervenciones en la madre 95.
EL CASO ESPECIAL DE LOS RECIÉN NACIDOS PREMATUROS
El niño recién nacido prematuro (RNPT) tiene mayores requerimientos nutricionales que el nacido a término. Las consecuencias a corto plazo de una desnutrición son el mayor riesgo de enfermedades infecciosas y de daño pulmonar e intestinal. Una nutrición adecuada implica un mejor neurodesarrollo y crecimiento posterior, así como menor riesgo de desarrollar diabetes mellitus de tipo 1. Dado que una alimentación inadecuada durante los primeros meses de la vida tiene importantes consecuencias fisiológicas y metabólicas en la edad adulta, satisfacer las necesidades nutricionales de los RNPT tendrá efectos positivos en el desarrollo de estos niños a corto y largo plazo.
El objetivo prioritario en la alimentación del RNPT es alcanzar un crecimiento y composición corporal similar al fetal, así como un desarrollo funcional satisfactorio. Se estima que los requerimientos energéticos del RNPT oscilan entre 115-130 kcal/kg/d y las necesidades proteicas, entre 3,5-4 g/kg/d. Se puede llegar hasta los 4,5 g/kg/d, especialmente en menores de 1000 g de peso. En cambio, en el recién nacido a término sano es suficiente un aporte de 1,5 g/kg/d de proteínas, aumentando hasta 2-3 g/kg/d si presenta patología. En resumen, el objetivo en el RNPT es conseguir un equilibrio adecuado entre aporte proteico y energético (3,2-4,1 g/100 Kcal) 96.
Aunque al nacimiento el estado nutricional es variable, la mayoría de los recién nacidos prematuros presentan déficits nutricionales. Es clave que se reconozca que el nacimiento prematuro es una urgencia nutricional y que se debe hacer todo lo posible para evitar déficits. El principio fundamental del soporte nutricional es que la ingesta cubra los requerimientos, asegurando así los mejores resultados. Los recién nacidos más prematuros y graves requieren mayor tiempo para alcanzar una ingesta adecuada 97.
Por otro lado, la influencia de la microbiota sobre el sistema inmune puede conllevar modificaciones en la respuesta inflamatoria y pueden estar asociadas a daños en la mucosa intestinal del recién nacido prematuro.
PREMATURIDAD Y OBESIDAD
Los efectos a largo plazo de la prematuridad tienen cada vez mayor importancia. Se sabe que los niños con menor peso al nacimiento tienen un riesgo aumentado de enfermedad coronaria e ictus 98. El periodo posnatal es crítico para el desarrollo del tejido adiposo. Así, por ejemplo, se ha observado que los niños nacidos prematuros tienen a la edad de adulto joven mayor resistencia insulínica y mayor tensión arterial diastólica y sistólica 99. Aunque los RNPT a la edad del término tienen más masa grasa que los recién nacidos a término, la desnutrición precoz se asocia con peor neurodesarrollo y menor masa grasa a los tres años de edad en recién nacidos prematuros 100. Sin embargo, su rápido crecimiento en los primeros meses de vida se ha asociado con mayor masa grasa entre los seis y los 19 años 101. La nutrición precoz puede programar las concentraciones de leptina y afectar la relación leptina:masa grasa 102. Esta observación no se aplica exclusivamente a los recién nacidos muy prematuros sino también a los prematuros tardíos 103. Estos cambios persisten en la edad adulta y se transmiten a su descendencia, presentando más masa grasa y alteración en su distribución, mayor grasa abdominal, al medirla por densitometría dual de rayos X (DEXA) 104.
PREMATURIDAD Y ALERGIA
Los recién nacidos muy prematuros tienen mayor riesgo de padecer enfermedades atópicas más adelante. La suplementación con ácido docosahexanoico a altas dosis reduce la incidencia de rinitis alérgica en estos niños a la edad de 12-18 meses 105. Además, la suplementación con oligosacáridos durante las primeras semanas de vida puede estimular la maduración del sistema inmune y conducir a una menor incidencia de enfermedades alérgicas 106.
INTRODUCCIÓN DE LA ALIMENTACIÓN COMPLEMENTARIA
El primer año de vida es un periodo de máximo crecimiento y desarrollo de los distintos aparatos y sistemas y, por tanto, de riesgo nutricional. La evolución de la alimentación del niño en este periodo está condicionada fundamentalmente por su curva de crecimiento y por el desarrollo de su aparato digestivo, renal y sistema nervioso. Las recomendaciones actuales sitúan la introducción de la alimentación complementaria nunca antes del cuarto mes (semana 17) y preferiblemente alrededor del sexto mes (no posterior). El motivo por el que se deben introducir en este momento los alimentos sólidos y líquidos, distintos de la leche, es fundamentalmente nutricional. La leche materna continúa siendo el alimento principal, pero no suficiente para cubrir las necesidades de macro y micronutrientes. Todos estos factores marcan una impronta metabólica que va a condicionar la salud del niño a corto, medio y largo plazo. La introducción de la alimentación complementaria es una ventana de oportunidad para la promoción de la salud que, además, podemos modular con facilidad.
INTRODUCCIÓN DE LA ALIMENTACIÓN COMPLEMENTARIA Y RIESGO DE OBESIDAD
Los desencadenantes del sobrepeso y la obesidad infantil son muy complejos. Existe controversia sobre si el momento de introducción de la alimentación complementaria guarda relación o no con el riesgo de sobrepeso u obesidad en la infancia. Una revisión sistemática realizada por Pearce y cols., así como el estudio realizado por Fewtrell y cols., establecieron que una introducción temprana de alimentos sólidos (≤ 4 meses de edad) puede dar como resultado un aumento en el IMC 107,108. Sin embargo, en un reciente estudio, la introducción de la alimentación complementaria antes de los cuatro meses se asoció positivamente con los niveles de masa grasa en niños franceses de cinco años, pero no en los niños procedentes de los otros tres países europeos que participaban en el estudio (el Reino Unido, Grecia y Portugal) 109. Por otra parte, Wang y cols. no observaron una relación significativa entre retrasar la introducción de la alimentación complementaria después de los seis meses de edad y el sobrepeso u obesidad durante la infancia 110.
Con respecto a la forma de introducir la alimentación complementaria, se postulaba que la alimentación dirigida por el lactante (baby led weaning) podría fomentar una autoalimentación con autorregulación energética por el propio lactante, reduciendo así el riesgo de obesidad. Sin embargo, un ensayo clínico aleatorizado realizado recientemente no objetivó diferencias significativas en el riesgo de obesidad en función del modo de hacer la introducción de la alimentación complementaria 111.
No se ha encontrado relación entre el desarrollo de la obesidad y la ingesta de algún tipo específico o grupos de alimentos durante el periodo de introducción de la alimentación complementaria. A la hora de realizar una intervención nutricional en lactantes, es importante tener en cuenta las creencias nutricionales y la dinámica familiar, así como su nivel socioeconómico y educativo 112.
Entre las diversas recomendaciones nutricionales, la correspondiente a limitar el consumo de proteínas durante la etapa de la alimentación complementaria podría constituir un enfoque potencialmente importante para reducir el riesgo de sobrepeso y obesidad en la infancia. Pearce y cols., en una revisión sistemática, concluyen que la ingesta alta de energía y proteínas, particularmente proteína láctea, durante el periodo de alimentación complementaria se asocia con un aumento del índice de masa corporal (IMC) infantil, especialmente en el segundo año de vida 113.
Del mismo modo, Braun y cols. concluyen que una mayor ingesta de proteínas en el primer año de vida, especialmente proteínas animales, se asocia con una mayor altura, peso e IMC en la infancia hasta los nueve años de edad 114. Weber y cols. compararon grupos de lactantes que en el primer año de vida se alimentaban con leche de fórmula con alto o bajo contenido proteico (leches de inicio de 3,0 vs. 1,78 g/100 kcal; leches de continuación de 4,57 vs. 2,28 g/100 kcal), y observaron un mayor IMC y un riesgo de obesidad 2,43 veces mayor al inicio de la edad escolar en el grupo que consumió fórmulas con un alto contenido proteico 115.
En la misma línea, un estudio reciente concluyó que la ingesta de un porcentaje de proteínas del 15-20% de la dieta a los 12 meses, así como un consumo de leche de fórmula de 600 ml a los ocho meses, en comparación con lactancia materna, se asociaba con un mayor peso a los diez años de edad 116. Por tanto, se aboga por promocionar la continuidad de la lactancia materna o una fórmula de continuación baja en proteínas (1,8-2,5 g proteína/100 kcal) 117 hasta cumplir el año de edad 118.
Otra recomendación nutricional importante se centra en la introducción de una alimentación variada, especialmente en el momento de la incorporación a la mesa familiar, y donde el papel de los padres en el desarrollo de preferencias alimentarias saludables en sus hijos es fundamental. En este periodo deben evitarse los productos bajos en grasas, ya que los alimentos con un contenido de grasa más bajo pueden contener una concentración más elevada de azúcar 119. Faith y cols. observan una asociación positiva entre la ingesta de zumos de frutas y el aumento de la adiposidad 120. Tras el destete, se debe fomentar la ingesta de grasas adecuadas en la dieta que no se ha visto asociada con un incremento en el riesgo de obesidad 121,122,123.
INTRODUCCIÓN DE LA ALIMENTACIÓN COMPLEMENTARIA Y RIESGO DE ALERGIA
En relación con el desarrollo de alergia alimentaria, mientras que las estrategias anteriores de prevención de la alergia a los alimentos se basaron en evitar la ingesta de alimentos alergénicos en la infancia, el paradigma actual está cambiando de la "evitación" a la "exposición controlada" 124.
Se ha visto que hay niños sensibilizados a alimentos antes de una ingesta conocida de los mismos 125. En estudios observacionales se ha sugerido que la sensibilización ocurre a través de la piel, especialmente en niños con dermatitis atópica, debido a defectos de la barrera cutánea. Estos estudios parecen indicar que la introducción oral temprana de alimentos alergénicos podría promover la tolerancia a los mismos 126. Las investigaciones futuras deben centrarse en estrategias para prevenir la sensibilización a alérgenos alimentarios en la vida temprana antes de la introducción de la alimentación complementaria 125.
Adicionalmente, se debe tener presente el hecho de que, en determinadas situaciones, los niños con alergia alimentaria pueden presentar problemas nutricionales, sobre todo derivados de una evitación del alimento, especialmente antes del diagnóstico, al no recibir un adecuado consejo nutricional 127.
ALIMENTACIÓN DEL NIÑO DE CORTA EDAD. ESTILOS DE VIDA SALUDABLE
El niño de uno a tres años se encuentra en una etapa de transición entre el periodo de crecimiento rápido del lactante y el periodo de crecimiento estable del escolar. Además de un crecimiento sostenido, es un periodo madurativo sobre todo en las funciones psicomotoras, en especial la marcha y el lenguaje. En este periodo se inician los hábitos sociales y se adquieren las costumbres familiares. Respecto a la alimentación, además de ampliar su experiencia en sabores y texturas comienzan a establecer sus preferencias.
Las necesidades energéticas son menores al enlentecerse el crecimiento y, por tanto, su ingesta disminuye, lo que puede dar la sensación de que comen poco. Su patrón de alimentación diario puede ser irregular, variando las cantidades de una comida a otra o de un día a otro, pero bastante constante cuando se estudian periodos más prolongados.
En la Tabla 1 puede observarse la progresión por parte del niño desde el inicio de la alimentación complementaria hasta la incorporación a la dieta familiar 128.
NECESIDADES NUTRICIONALES DEL NIÑO DE CORTA EDAD
Tabla I Guía práctica sobre la cantidad y frecuencia de comidas en niños de 9-23 meses, además de la lactancia (en el caso de lactancia materna, a demanda) (modificado de OMS, 2010) 128

Los niños de uno a tres años tienen necesidades nutricionales específicas diferentes a las de la edad adulta. Su dieta ha de cubrir requerimientos determinados de nutrientes como proteínas, lípidos, hierro y vitamina D, entre otros.
Se dispone de algunos estudios que muestran la ingesta real de nutrientes entre los niños de uno a tres años en nuestro medio. En el estudio Enkid (incluye niños de uno a tres años, además de otros rangos de edad), se observó que el grupo de dos a cinco años ingiere una cantidad de proteínas muy alta (65 g/día), una dieta deficitaria en vitaminas D y E y una ingesta menor de la necesaria de otras vitaminas y minerales, como el hierro 129. El estudio ALSALMA muestra resultados similares en niños con edades entre uno y tres años y en él se observa una elevada ingesta proteica y deficiencias en minerales y vitaminas, principalmente en vitamina D 130,131. Alimentos diseñados para este grupo de edad, como las leches de crecimiento, son una opción útil para paliar estas deficiencias cuando no se consigue con una dieta variada 132.
ACTITUDES DE LOS PADRES FRENTE A LA ALIMENTACIÓN DE SUS HIJOS
El establecimiento de prácticas alimentarias saludables desde edades tempranas promueve patrones de alimentación permanentes que tienen un papel preventivo en la aparición de enfermedades crónicas como la obesidad 133. Existen factores de conducta y ambientales que se han asociado a un patrón de ingesta obesogénico en los niños pequeños. Algunos de estos factores proceden de los propios niños, como, por ejemplo, las elecciones inadecuadas de los alimentos por falta de supervisión parental. Sin embargo, otros proceden de los padres u otras personas del entorno e incluyen un modelo negativo (autoritario, permisivo o negligente) frente al positivo (autoridad responsable) en el que se comparten hábitos saludables, junto a falta de conocimientos y/o de tiempo y al uso de la comida como recompensa. En este contexto, otros factores como las influencias sociales y culturales juegan también un papel en el desarrollo de hábitos alimentarios obesogénicos en este grupo de edad 134,135.
El objetivo de lograr prácticas alimentarias saludables a través de la alimentación complementaria óptima depende no solamente de con qué se alimenta al niño, sino también de cómo, cuándo, dónde y quién lo alimenta. Los estudios del comportamiento han revelado que un estilo más activo de alimentación puede mejorar la ingesta de los alimentos. Así, el término de "alimentación perceptiva" se emplea para describir que el cuidador o cuidadora actúa en respuesta a las señales del niño (atención, hambre/saciedad, etc.). La literatura más reciente pone en evidencia la influencia del modelo parental en el cómo y el qué comen los niños 136, así como las propias características psicosociales de las madres 137. En la práctica se observa que las madres usan una variedad importante de claves a la hora de guiar las prácticas alimentarias de sus hijos, muchas de ellas no relacionadas con buenos hábitos alimentarios y muy influidas por factores tanto familiares como culturales 138. Aunque son las madres las principales responsables en la tarea de alimentar a los niños pequeños, el papel de los padres es también importante y creciente a medida que el niño tiene más edad 139.
La participación de padres y educadores de niños de corta edad en programas educativos basados en una alimentación perceptiva, en respuesta a las actitudes de cada niño y orientados a ofrecer frecuentemente alimentos frescos, de temporada y de proximidad y en el entorno de la mesa familiar, se relaciona con hábitos más saludables en los niños que se mantienen, al menos, durante toda la edad infantil 140.
INVESTIGACIONES DE FUTURO Y OPORTUNIDADES DE ACTUACIÓN
La identificación de los factores de riesgo durante el embarazo (elevado IMC antes de la concepción, excesiva ganancia de peso durante el embarazo, diabetes gestacional, tabaquismo) y la infancia temprana (peso elevado al nacimiento, ganancia excesiva de peso, patrón de sueño, interacción madre-niño, introducción muy temprana o muy tardía de la alimentación complementaria) es clave para establecer intervenciones precoces enfocadas a esos factores modificables 141.
Algunos autores han propuesto una serie de prácticas o recomendaciones que ayudarían a minimizar el riesgo de obesidad 121:
Modificar los hábitos dietéticos de los padres, en especial de la madre, encaminados a tener un IMC preconcepcional adecuado y una ganancia de peso correcta a lo largo del embarazo.
Reducir el número de cesáreas. El nacimiento por cesárea se ha asociado con un aumento en el riesgo de sobrepeso y obesidad en la descendencia 142.
Existe una relación directa entre la ganancia de peso en los dos primeros años de vida y el riesgo de obesidad en la infancia tardía. Los primeros años son el momento en el que se establecen conductas fundamentales en relación con la alimentación, los hábitos de sueño y la actividad física. Conocer, además, los cambios en la composición corporal (adiposidad, masa magra) en este periodo y qué los motiva ayudaría a señalar áreas de intervención basadas en datos científicos.
La lactancia materna se asocia de forma consistente con un efecto protector frente a la obesidad.
La introducción de la alimentación complementaria no debe ser nunca antes del cuarto mes y, en la medida de lo posible, alrededor del sexto mes. El uso de alimentos con alto contenido en energía y en proteínas se asocia a un IMC mayor durante la edad infantil. Limitar la cantidad de proteínas de origen animal en los dos primeros años de vida es una buena recomendación.
La apetencia por las frutas y las verduras comienza pronto. Su consumo se asocia a menor riesgo de obesidad. Estrategias como ofrecer una variedad amplia de frutas y verduras en el primer año, la exposición repetida y un estilo de alimentación perceptiva, teniendo en cuenta las respuestas del lactante, facilitan su consumo.
Los hábitos de alimentación se desarrollan muy pronto en la vida del niño y son el resultado de la interacción entre la predisposición genética, las respuestas a la comida y las preferencias, pero sobre todo, las influencias ambientales. Las actitudes de los padres ante la alimentación de sus hijos es, quizá, el factor que más influye en el establecimiento de una conducta alimentaria.
Garantizar un consumo de grasas suficiente en este periodo. Se debe evitar el consumo de productos bajos en grasas durante el periodo de alimentación complementaria, pues una dieta baja en grasas se asocia a un rebote adiposo más temprano y obesidad posteriormente 143.
Los padres deben actuar como modelo. El ambiente familiar en las comidas influye de modo importante en los patrones de consumo de los niños y proporciona una herramienta imprescindible para establecer hábitos saludables. En esa "mesa familiar" deben excluirse las pantallas de televisión y otros dispositivos con imágenes.
Estas medidas se acompañan de la promoción de la actividad física y un tiempo de sueño suficiente 144.
También este periodo es clave en la prevención de las enfermedades alérgicas. Esta influencia se puede producir en parte de forma indirecta, ya que existe una relación directa entre obesidad y riesgo de asma y/o alergia alimentaria 145. Aunque el interés radica en conocer cómo los cambios metabólicos de la obesidad pueden influir en el riesgo de alergia, hay que recordar que los efectos de la obesidad actúan ya desde antes del nacimiento. En los hijos de madres con obesidad, los niveles de adipoquinas en sangre de cordón pueden influir en el riesgo de sibilancias en la descendencia 146, pero también de forma directa a través de la microbiota intestinal y, en el caso de la lactancia materna, a través de las sustancias inmunológicamente activas que contiene. La leche humana contiene inmunoglobulinas, enzimas antimicrobianas, leucocitos, compuestos antiinflamatorios y también otros inductores de la tolerancia. Sin embargo, no se ha podido demostrar una relación simple entre la existencia de estos compuestos y el estado atópico de la madre o del niño 147.
La colonización intestinal del recién nacido, influida por factores prenatales, durante el parto y posnatales, tiene también una gran trascendencia en el desarrollo del sistema inmune y, por tanto, en el riesgo de alergia 148. El papel de la microbiota endógena en la aparición de la alergia, bajo la hipótesis de la higiene, se apoya en la correlación positiva entre factores ambientales que afectan a la microbiota intestinal y las manifestaciones alérgicas (por ejemplo, el parto por cesárea o el uso de antibióticos en edades tempranas) 149. Los niños que desarrollan una enfermedad alérgica tienen diferente composición de la microbiota intestinal en los primeros años de vida 150,151. La modulación de la microbiota constituye la base para la intervención dietética y abre nuevas posibilidades en el manejo de enfermedades en las que la disbiosis microbiana desempeña un papel relevante 81.
CONCLUSIONES
Actualmente, la evidencia científica disponible sugiere que en las etapas tempranas de la vida se establece la base para la salud a lo largo de la misma. El desarrollo de un individuo está determinado no solo por la herencia genética, sino principalmente por la interacción de sus genes con el medio ambiente. Estudios epidemiológicos muestran que tanto un ambiente pregestacional y gestacional como perinatal adverso, de acuerdo con la teoría de la programación metabólica temprana, pueden alterar los patrones fisiológicos y estructurales de desarrollo en el periodo fetal-neonatal, lo que induce cambios en la susceptibilidad a desarrollar enfermedad a corto, medio y largo plazo.
En este informe se ha descrito cómo acontecimientos que suceden durante los primeros 1000 días de vida, desde la concepción del niño hasta los dos años de edad, pueden afectar el riesgo de desarrollar enfermedades, y en particular la obesidad infantil, auténtico problema de salud pública que constituye un factor de riesgo para el desarrollo de otras ENT.
Además, este periodo pre y perinatal de los primeros 1000 días constituye una ventana de oportunidad única para intervenir en la prevención de las ENT, dado que la plasticidad disminuye rápidamente con la edad. Optimizar el estado nutricional de la madre antes y durante el embarazo, así como la nutrición del lactante y del niño de corta edad, es clave para ayudar a aliviar la carga de las ENT en las próximas generaciones.
Las interacciones entre el hospedador y la microbiota intestinal tienen el potencial de influir en la programación temprana de las funciones intestinales. La microbiota intestinal juega un papel importante en la función y el desarrollo del sistema inmune y constituye la principal fuente de exposición microbiana. La colonización del intestino sucede de un modo paralelo con la maduración del sistema inmunitario. Alteraciones en los patrones de colonización bacteriana se asocian a un mayor riesgo de desarrollar ciertas enfermedades, incluidas las alergias, cuya prevalencia no cesa de aumentar en niños y jóvenes. Por tanto, optimizar la colonización intestinal temprana puede ser una oportunidad para apoyar una salud óptima durante los primeros años de vida e influir en la salud futura.
En resumen, todos los profesionales al cuidado de los niños deben fomentar que las madres, los lactantes y los niños pequeños tengan una alimentación adecuada y optimizada en esos primeros 1000 días. En esa tarea deben participar también las autoridades, promocionando políticas que garanticen el acceso a una nutrición adecuada en calidad y cantidad durante esos periodos críticos, con el fin de alcanzar el mejor desarrollo y salud a largo plazo.