INMUNONUTRICIÓN: CONCEPTO
La inmunonutrición (IN) puede definirse como el área de la nutrición dedicada al estudio de los procesos por los cuales los nutrientes modulan las acciones del sistema inmune y su empleo para este propósito (1). Engloba factores relacionados con la nutrición, la infección, la inflamación, el daño tisular y la inmunidad, con un papel clave de los sistemas inmune, endocrino, nervioso y de la microbiota (2,3).
La IN va más allá de las fórmulas de nutrición enteral y parenteral y comprende todos los aspectos de la dieta que influyen sobre el sistema inmune, como son la calidad y cantidad de los alimentos, el índice inflamatorio de la dieta y los nutrientes aportados (4). Las dietas proinflamatorias se asocian con niveles elevados de proteína C-reactiva e interleuquina 6 y bajos niveles de adiponectina, entre otros. Las dietas proinflamatorias, con alto contenido en productos procesados, carne roja, azúcares y alimentos muy grasos, se relacionan con una mayor inflamación y contribuyen al desarrollo de enfermedades crónicas como la obesidad, la diabetes mellitus de tipo 2, la enfermedad cardiovascular o el cáncer, entre otros. Por el contrario, las dietas con un alto contenido en vegetales y frutas son antiinflamatorias y protectoras frente a estas enfermedades crónicas.
En esta interacción de los sistemas endocrino, inmune, nervioso y de la microbiota no existe un parámetro único a evaluar sino que existen una batería de biomarcadores a tener en cuenta en el contexto clínico. La ciencia de la IN no solo se centra entre las relaciones entre nutrición y sistema inmune, aisladamente, sino que debe ponerse en el contexto del estado nutricional de la persona y su genética, estilo de vida y otros condicionantes clínicos. Ello implica que el carácter de la IN sea multidisciplinar (3).
La IN aporta especialmente valor y certidumbre en situaciones clínicas habituales como es el manejo del paciente quirúrgico, ya de por sí complicado y en muchos casos sumado a una desnutrición previa, pero también en otras situaciones clínicas. El propio estrés de la cirugía predispone a los pacientes a un mayor riesgo de infección y alteración del sistema inmune. De hecho, los pacientes quirúrgicos desnutridos tienen mayores tasas de morbimortalidad en el postoperatorio, más reingresos y costes asociados mayores. Todo esto se suma al reto de mantener al paciente nutrido en un escenario perioperatorio que puede variar desde la planta de hospitalización hasta las unidades de reanimación o las unidades de cuidados intensivos.
En situación de desnutrición, la respuesta inmune está alterada ya que se deterioran las barreras externas, la inmunidad humoral y la inmunidad celular. A nivel humoral se altera el funcionamiento de los linfocitos T colaboradores y, a nivel celular, el cociente CD4/CD8. La activación de los linfocitos T y B provoca una cascada de citoquinas proinflamatorias, entre ellas IL-1, IL-6 y TNF-α. Esta cascada inflamatoria trata de captar combustible y ello implica la activación del catabolismo graso y proteico. Esta cascada además activa genes concretos como los del factor nuclear kappa beta (NFkβ) y de la proteína activadora 1, que también modulan la respuesta inflamatoria (1,4,5).
Los objetivos claves de la inmunomodulación son: mejorar la inmunidad celular, alterar el balance de las citoquinas pro y antinflamatorias, prevenir la excesiva activación del factor nuclear NFkβ, facilitar la activación óptima de la proteína activadora 1 y moderar la depleción de nutrientes tisulares (1,6).
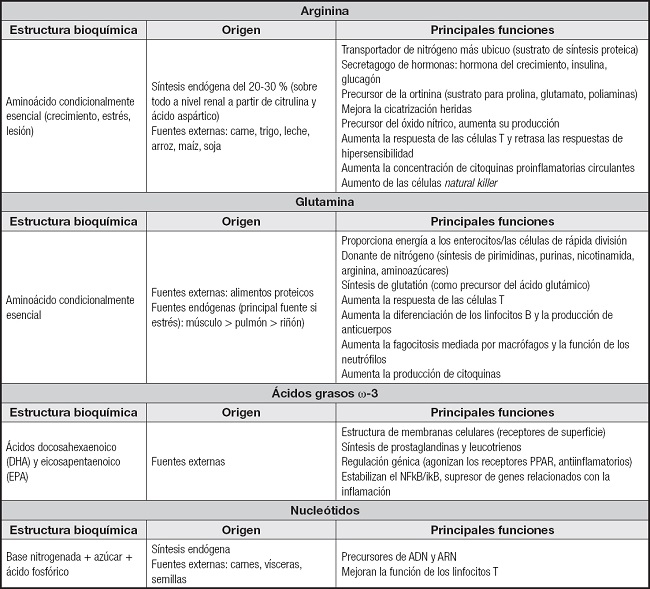
Los inmunonutrientes o farmaconutrientes mejoran particularmente la respuesta de los linfocitos a los estímulos mitogénicos y aumentan los anticuerpos circulantes. Estos beneficios inmunológicos se han reflejado en la práctica clínica en determinadas patologías, como detallaremos en los siguientes apartados. Además, en algunas situaciones se ha visto que existen déficits de algunos inmunonutrientes, lo que corrobora la necesidad de un aporte extra. Los inmunonutrientes más estudiados y sobre los que disponemos de un mayor grado de evidencia son: arginina, nucleótidos, glutamina y ácidos grasos ω-3. Su estructura bioquímica, sus fuentes y funciones se resumen en la tabla I (1,5,7-10). A nivel práctico, definimos las fórmulas inmunomoduladoras como aquellas suplementadas con glutamina, arginina, ácidos grasos ω-3 y nucleótidos, solos o en combinación (12).
Estas fórmulas han demostrado beneficios en una amplia variedad de situaciones clínicas. Los protocolos fast track surgen en el contexto de cirugías cada vez más complejas, una mayor disponibilidad de medios técnicos y quirófanos más seguros. Inicialmente, estos protocolos se centraban en la información preoperatoria, en disminuir las ayunas preoperatorias, en el control del dolor, en evitar la sobrecarga de líquidos, en la movilización progresiva y en el inicio de la tolerancia oral precoz, entre otros. Estos protocolos han evolucionado a los actuales protocolos ERAS (enhanced recovery after surgery) con un carácter multimodal y multidisciplinar del cuidado del paciente quirúrgico. En estos protocolos se va más allá del acto quirúrgico en sí y toma especial relevancia el soporte nutricional durante todo el proceso, para mejorar los resultados en salud (13,14).
MATERIAL Y MÉTODOS
El objetivo de este trabajo es definir el papel de la IN en diferentes situaciones clínicas sobre la base de la mejor evidencia científica disponible.
Se ha realizado una búsqueda en Medline-PubMed en el último trimestre de 2021. Las palabras clave empleadas fueron: inmunonutrición, arginina, glutamina, nucleótidos, ácidos grasos omega-3, ERAS, fast-track. Se han incluido ensayos clínicos, revisiones y guías de práctica clínica publicadas en inglés o español, sin límite de tiempo. Cabe destacar que en la gran mayoría de las publicaciones se presentaron ensayos clínicos aleatorizados (ECA) sobre IN en pacientes quirúrgicos antes de la implementación de los protocolos fast track/ERAS, en un entorno clínico tradicional. Recientemente se ha publicado una revisión sobre una propuesta de IN en el contexto de protocolos ERAS en pacientes quirúrgicos (15).
INMUNONUTRICIÓN EN CÁNCER DE CABEzA Y CUELLO (CCC)
La desnutrición afecta al 50 % de los pacientes en el momento de diagnóstico (16) y se estima que puede llegar al 88 % tras el tratamiento con radioterapia (RT). El CCC habitualmente precisa cirugías complejas (17) y la incidencia de complicaciones postoperatorias es alta (20-50 %) (18). Por otra parte, la RT, con la fibrosis que genera sobre los tejidos, conlleva dolor, disgeusia, xerostomía, vómitos e inapetencia (19). La IN en el CCC se ha estudiado en diferentes escenarios quirúrgicos.
En 1999 se publicó el primer ensayo aleatorizado en periodo perioperatorio de pacientes suplementados con IN (20). Los resultados fueron beneficiosos, a favor de una reducción de la tasa de infecciones (p = 0,02) y una mayor concentración de albúmina (p = 0,05), resultados que fueron confirmados en estudios posteriores, lo que llevó a que las guías clínicas ESPEN 2006 (21), ASPEN 2009 (22) y North American Surgical Nutrition Summit (23) recomendaran con nivel A el uso de estas fórmulas en la cirugía del CCC.
Actualmente, la ESPEN (24) indica que la IN en el período perioperatorio o, al menos, postoperatorio debería valorarse en los pacientes desnutridos sometidos a una cirugía mayor oncológica (grado de recomendación B). Una revisión sistemática (25) demostró que la suplementación con arginina en dosis crecientes (6,25 a 18,7 g/L de arginina libre) redujo significativamente las fístulas (OR: 0,36; IC del 95 %: 0,14-0,95, p = 0,039) y la estancia hospitalaria [diferencia de medias: 6,8 días (IC: -12,6, a 0,9), p = 0,023] en pacientes sometidos a cirugía por CCC. A largo plazo, en una cohorte de 32 pacientes con CCC, la suplementación perioperatoria con arginina se asoció con un incremento de la supervivencia y un menor riesgo de recurrencia locorregional (26).
La revisión Cochrane específica sobre la IN para el CCC de 2018 (27) concluye que el riesgo de formación de fístulas postoperatorias puede reducirse con la IN: RR, 0,48 (IC del 95 %: 0,27-0,85, p = 0,01). Otros beneficios no alcanzaron la significación estadística. Los propios autores señalan que la mayoría de los trabajos incluidos en esta revisión eran pequeños y tenían múltiples sesgos.
TRACTO DIGESTIVO SUPERIOR
El cáncer gástrico (CG) es el quinto tumor más frecuente y la tercera causa de muerte por cáncer a nivel mundial (28). En los pacientes con CG, la malnutrición está causada por un descenso de la ingesta por obstrucción mecánica, anorexia y la caquexia asociada con factores tumorales como TNF-α, IL-1 e IL-6 y la desregulación de la leptina (29). Por todo ello, es esencial una apropiada valoración nutricional y una subsiguiente intervención nutricional antes de la gastrectomía en los pacientes con CG. La ESPEN recomienda la nutrición oral/enteral siempre que sea posible (24).
Okamoto y cols. (30) reportaron que la administración preoperatoria de una fórmula enteral enriquecida con arginina, ácidos grasos ω-3 y nucleótidos mejoraba el estado inmune de los pacientes, reducía la respuesta inflamatoria y disminuía la incidencia de complicaciones infecciosas. Fujitani y cols. (31) describen que la administración preoperatoria de IN oral durante 5 días no aportó beneficio a pacientes normonutridos sometidos a gastrectomía total electiva. En una comparación retrospectiva de 164 pacientes con CG, sin y con IN, esta no redujo las complicaciones postoperatorias (32) pero se asoció a una mejor supervivencia a 6 meses (p = 0,011), 1 año (p = 0,006) y 5 años (p < 0,001). En otro trabajo, el uso postoperatorio de una fórmula enteral enriquecida con arginina, ácidos grasos ω-3 y nucleótidos (frente a una fórmula normocalórica normoproteica) demostró que la fórmula inmunomoduladora incrementaba las concentraciones de hidroxiprolina (59,7 vs. 28 nmol, p = 0,0018) y reducía los problemas en relación a la cicatrización de heridas (p = 0,005), los fallos de sutura y las complicaciones infecciosas globalmente (33). Un metaanálisis centrado en casos de cirugía por CG, que incluyó 9 estudios con 785 pacientes, concluyó que el uso de IN producía un aumento de los niveles de IgA, IgG, IgM, CD4, ratio CD4/CD8 y células NK mientras que disminuía los valores de IL-6 y TNF-α. Sin embargo, no se observaron cambios significativos en otros parámetros (34). Estos datos deben analizarse con cautela ya que incluyeron poblaciones heterogéneas, en diferentes momentos y con fórmulas de IN con distinta composición.
Sultan y cols. (35) aleatorizaron a 195 pacientes sometidos a cirugía por cáncer esofagogástrico en tres grupos: nutrición enteral suplementada con ω-3, nutrición enteral estándar (en ambos casos durante 7 días antes y después de la cirugía) o solo suplementación postoperatoria. Las concentraciones de ω-3 fueron superiores en el grupo que recibió IN (p < 0,001) y la ratio ω-6/ ω-3 fue más favorable también en estos pacientes (p < 0,001). No hubo diferencia entre los grupos en cuanto a morbilidad, mortalidad o estancia hospitalaria. La expresión de HLA-DR en monocitos o linfocitos T activados tampoco fue diferente. En otro ensayo, el uso perioperatorio de IN durante 3 días antes y después de la esofaguectomía condujo a un aumento significativo del recuento total de linfocitos en los días 3 y 5, y a un cambio en la proliferación de células B en los días 5 y 7 (36). Otro metaanálisis que incluyó 628 pacientes sometidos a cirugía por cáncer esofagogástrico tratados con IN no demostró consistencia en los parámetros de los resultados clínicos (37), si bien este metaanálisis adolece de defectos metodológicos a tener en cuenta, dada la amplia heterogeneidad de los trabajos incluidos, que no permitió obtener el poder estadístico suficiente para los objetivos planteados.
En un metaanálisis Cochrane de seis estudios de alta calidad en pacientes sometidos a cirugía gastrointestinal, en su mayoría desnutridos, se demostraron beneficios significativos con respecto a las complicaciones postoperatorias (RR: 0,64; wIC del 95 % 0,46-0,87) (38). Wong y cols., en su metaanálisis de 19 ECA con 2016 pacientes sometidos a esofaguectomía, gastrectomía y pancreatectomía (2.2:1.2:1.0), encontraron beneficios significativos para el uso postoperatorio de la IN con respecto a una disminución de las infecciones de las heridas y la duración de la estancia hospitalaria (39).
Recientemente se ha publicado otra revisión sistemática y metaanálisis centrada en la IN del paciente con cáncer de esófago (40). Incluyó 15 ensayos clínicos con 1864 pacientes. Los autores concluyen que la IN perioperatoria reduce las complicaciones infecciosas (OR: 0,51; IC: 0,26-0,98) y la estancia hospitalaria en 2,1 días (IC: -3,72 a -0,47); sin embargo, no hubo diferencias significativas en cuanto a otras complicaciones, la mortalidad o las fugas de la anastomosis.
La IN ha demostrado ser coste-efectiva en un amplio grupo de pacientes (41,42) debido fundamentalmente a la disminución de complicaciones, hallazgo respaldado también por un metaanálisis (43).
La ESPEN (grado de recomendación B) aconseja la IN postoperatoria en pacientes desnutridos que van a ser sometidos a cirugía mayor oncológica de forma inespecífica, pero indica que no existe evidencia suficiente que apoye el uso de IN preoperatoria (24). La ASPEN da un grado de recomendación fuerte para la IN en pacientes quirúrgicos, si bien estas guías no recogen las últimas evidencias disponibles (44). Las Guías Francesas de Nutrición perioperatoria, en una actualización de 2012, recomiendan la IN preoperatoria 5 -7 días antes de la cirugía oncológica en todos los pacientes tanto si están malnutridos como si no (45).
INMUNONUTRICIÓN Y PÁNCREAS
La desnutrición es frecuente en la patología pancreática, especialmente en el cáncer de páncreas (CP). Gianotti y cols. (46) aleatorizaron a 212 pacientes que iban a ser sometidos a una pancreatoduodenectomía (PD) para recibir una fórmula enriquecida con IN, una fórmula isocalórica enteral o bien nutrición parenteral. El grupo de la fórmula con IN presentó una mejoría significativa en su respuesta inmunometabólica y tuvo menos complicaciones en el postoperatorio y una menor estancia hospitalaria frente a las otras dos alternativas. El mismo grupo, demostró en otro trabajo similar (47), con 100 pacientes con CP que iban a ser sometidos a PD, siguiendo el mismo esquema de aleatorización, que los pacientes que recibieron IN presentaban una menor tasa de complicaciones postoperatorias (si había infección quirúrgica, era de menor gravedad) y menor duración de la estancia hospitalaria.
En una revisión sistemática y metaanálisis sobre cirugía gastrointestinal en pacientes oncológicos (48), y dado el impacto significativo sobre las complicaciones infecciosas y la tendencia a acortar la estancia hospitalaria, se concluye que debe aconsejarse el uso de la IN preoperatoria, incluso en los pacientes con CP. Una revisión más reciente, del año 2020, arrojó las mismas conclusiones (49). En otro metaanálisis (50) centrado en pacientes que iban a ser sometidos a una PD, se aconseja también el uso de la IN y se pone de manifiesto la necesidad de más ensayos clínicos aleatorizados bien diseñados y con potencia estadística suficiente.
En las guías ESPEN (24), en relación a la cirugía pancreática, se indica que el preacondicionamiento oral con glutamina, antioxidantes y extracto de té verde frente a un placebo eleva significativamente las concentraciones plasmáticas de vitamina C y mejora la capacidad antioxidante endógena total sin reducir el estrés oxidativo y la respuesta inflamatoria. En las guías ASPEN (22) del año 2009 se sugería usar fórmulas poliméricas estándar en los pacientes con pancreatitis aguda grave y se indicaba que no hay suficiente evidencia para recomendar la IN. El Grupo de Trabajo de Metabolismo y Nutrición de la Sociedad Española de Medicina Intensiva, Crítica y Unidades Coronarias (SEMICyUC) (51) recomienda, en la pancreatitis aguda grave que precisa suplementación nutricional parenteral, usar lípidos enriquecidos con ácidos grasos ω-3 (nivel de evidencia: bajo; grado de recomendación: moderado) y la administración de 0,5 g/kg/día de dipéptido de glutamina en ausencia de contraindicación (nivel de evidencia: moderado; grado de recomendación: moderado).
COLON Y RECTO
Se han demostrado los beneficios de la IN en la cirugía del cáncer colorrectal (CCR). En un ensayo clínico multicéntrico (52) en el que los participantes fueron aleatorizados a recibir una fórmula con inmunonutrientes frente a un suplemento hipercalórico hiperproteico durante 7 días antes de la cirugía y hasta 5 días después de la misma, se observó una disminución del número total de complicaciones en el grupo que recibió la IN a expensas fundamentalmente de reducir las complicaciones infecciosas (23,8 % vs. 10,7 %, p = 0,0007). Dentro de estas, disminuyeron especialmente las infecciones de la herida quirúrgica (16,4 % vs. 5,7 %, p = 0,0008). No se observaron diferencias significativas en otros parámetros.
Braga y cols. (53) aleatorizaron a 200 pacientes con CCR entre 4 grupos, en dos de los cuales se administraba una fórmula enriquecida con inmunonutrientes (arginina, ácidos grasos ω-3) preoperatoriamente o perioperatoriamente; en los otros dos grupos, o bien una fórmula equivalente pero sin IN o no se usaba suplementación. Se constató que la administración de IN en el preoperatorio mejoraba la respuesta inmunometabólica y disminuía la tasa de infección.
En el estudio SONVI (54), 264 pacientes con CCR normonutridos fueron aleatorizados a recibir IN vs. un suplemento hipercalórico e hiperproteico. Los pacientes en la rama de IN presentaron una disminución del número total de complicaciones en comparación con el grupo de control, principalmente debida a una reducción de las complicaciones infecciosas (23,8 % frente a 10,7 %, p = 0,0007).
Xu y cols. (55) presentaron los datos de un metaanálisis en el que se incluyeron estudios donde se comparaban pacientes con CCR sometidos a cirugía electiva de colon que recibieron IN oral/enteral vs. nutrición oral/enteral estándar (seis estudios, de los cuales en dos trabajos se aplicaba un protocolo ERAS) e IN por vía parenteral vs. un soporte nutricional parenteral estándar (3 estudios). El uso de una fórmula con inmunonutrientes tanto enteral como oral redujo la estancia hospitalaria 2,53 días (IC del 95 %: 1,29-3,41) y las complicaciones infecciosas (OR: 0,33; IC del 95 %: 0,21-0,53), tanto en el campo quirúrgico como en la herida. En el caso de la nutrición parenteral con inmunonutrientes, su uso se asoció a una menor estancia hospitalaria (2,66 días, IC del 95 %: 0,62-4,86), menores concentraciones de IL-6 y mejor capacidad de respuesta inmune medida por los niveles de CD4, CD3, CD8 y el cociente CD4/CD8.
En la tabla II se resumen las recomendaciones de ASPEN (22), ESPEN (21, 52) y vía RICA (57) sobre el uso de inmunonutrientes en pacientes oncológicos. En las guías ERAS (58), 2019, se hace referencia a la importancia del cribado nutricional y del inicio del soporte nutricional en los pacientes desnutridos o con riesgo nutricional, preferiblemente por vía oral, 7-10 días antes de la cirugía. En relación al postoperatorio, se indica que la mayoría de los pacientes son tributarios de ingesta oral y/o suplementación oral desde el mismo día de la cirugía. Se recoge, asimismo, que si existe desnutrición, la IN perioperatoria es recomendable en la cirugía del CCR con una calidad de evidencia baja pero con un grado de recomendación fuerte.
Tabla II. Recomendaciones de ESPEN, ASPEN y vía RICA sobre el uso de inmunonutrientes en pacientes oncológicos.
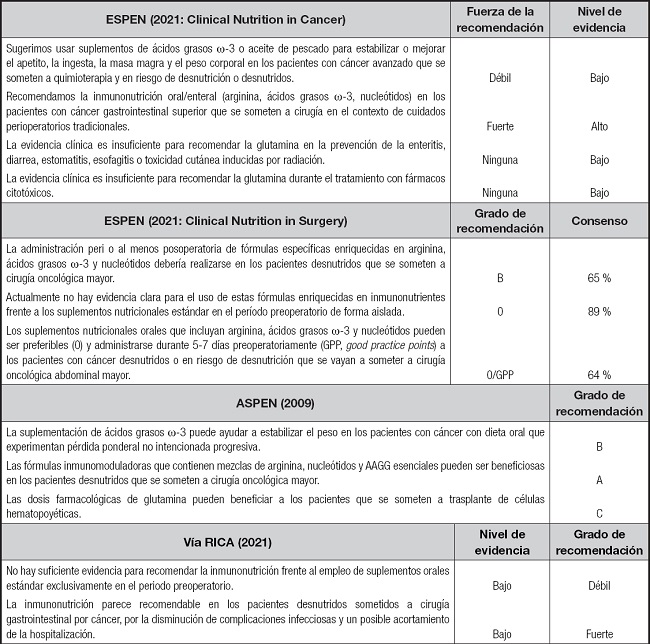
ESPEN: European Society of Parenteral and Enteral Nutrition; ASPEN: American Society for Parenteral and Enteral Nutrition; Vía RICA: vía clínica de Recuperación Intensificada en Cirugía del Adulto; AAGG: ácidos grasos; GPP: “good practice points”, recomendaciones de buenas prácticas basadas en la experiencia clínica del grupo que desarrolla la guía clínica.
Grado de recomendación: A: al menos un metaanálisis, revisión sistemática o ensayo clínico 1++ y directamente aplicable a la población diana, o cuerpo de evidencia a partir de trabajos 1+, directamente aplicable a la población diana y que demuestren globalmente la consistencia de los resultados; B, evidencia que incluya estudios 2++, directamente aplicable a la población diana, o evidencia que incluya resultados 2+, directamente aplicable a la población y con resultados consistentes, o demostrar consistencia global de los resultados o evidencia extrapolada de estudios clasificados como 1++ o 1+; 0: evidencia de nivel 3 o 4 o evidencia extrapolada de estudios clasificados como 2++ o 2+.
1++: metaanálisis, revisión sistemática de ensayos clínicos aleatorizados o ensayos clínicos con bajo riesgo de sesgos, de alta calidad.
1+: metaanálisis, revisión sistemática o ensayos clínicos aleatorizados con bajo riesgo de sesgos y bien ejecutados.
2++: revisiones sistemáticas de alta calidad de estudios de casos y controles o estudios de cohortes. Estudios de casos y controles o estudios de cohortes de alta calidad con muy bajo riesgo de sesgos o confusores y alta probabilidad de que la relación sea causal.
2+: estudios de casos y controles o de cohortes bien ejecutados, con bajo riesgo de confusores o sesgos y probabilidad moderada de que la relación sea causal.
3: estudios no analíticos; por ejemplo, casos clínicos o series de casos.
4: opinión de expertos.
CIRUGÍA TORÁCICA
Son escasas las publicaciones que han analizado el impacto de la IN en la cirugía torácica no esofágica. Un grupo seleccionado de pacientes de cirugía cardíaca que recibió IN con arginina, nucleótidos y ácidos grasos ω-3 presentó menores niveles de IL-6, mayor número de epítopos HLA-DR en los monocitos y menor tasa de infección que el grupo de la fórmula estándar (59). El empleo de glutamina y otros micronutrientes en el postoperatorio cardíaco de pacientes con ángulo de fase inferior a 5,5° consiguió una elevación significativa de los linfocitos T (60). La IN perioperatoria en pacientes con timoma y miastenia gravis redujo la estancia hospitalaria y el número de crisis con menor estancia en la UCI, extubación precoz y menos neumonías frente a una fórmula estándar (61). Una triple intervención con IN prequirúrgica, bebida de carbohidratos y probiótico en cirugía torácica oncológica disminuyó las complicaciones y la estancia hospitalaria (62). En la cirugía pulmonar oncológica, la IN prequirúrgica con arginina, nucleótidos y omega-3 durante 10 días permitió desarrollar menos complicaciones, un menor tiempo de drenaje torácico y mayores concentraciones de albúmina posquirúrgica (63).
UROLOGÍA
La literatura disponible es escasa y se limita al cáncer vesical. La cistectomía radical es el tratamiento de elección y generalmente implica manipulación de asas y cirugía intestinal asociada. La presencia de desnutrición en estos pacientes oscila entre un 16 y un 55 % en función de los parámetros utilizados.
En el estudio de Bertrand (64) se incluyeron de manera prospectiva 30 pacientes que recibieron IN y se compararon con un grupo de control emparejado retrospectivamente. En el primer grupo se evidenciaron menos complicaciones postoperatorias y menor gravedad (escala Clavien-Dindo) de las mismas, disminución de las infecciones (salvo la pielonefritis) y menor incidencia de íleo paralítico. No se encontraron diferencias significativas en mortalidad, embolia pulmonar, fistulas anastomóticas y dehiscencia de la herida. En el estudio de Lyon y cols. tampoco se obtuvo una disminución de la tasa de complicaciones a los 90 días posingreso (65).
Otros estudios más recientes sobre la IN en el cáncer vesical han sido llevados a cabo por Hamilton Reeves y cols. (62,63). Se aleatorizaron 29 pacientes para recibir IN preoperatoria durante 5 días antes de la cirugía y 5 días después de la cirugía frente a una fórmula estándar con el mismo esquema temporal. En el grupo tratado con IN se observó un impacto significativo en el equilibrio Th1/Th2 que se desplazó hacia una respuesta Th1, con menor número de complicaciones, concentraciones más bajas de IL-6 posquirúrgicas y más elevadas de ornitina sérica a los 30 días de la cirugía, y una menor pérdida muscular a las dos semanas de la cistectomía. No se encontraron diferencias estadísticamente significativas en las concentraciones de PCR.
Maffezzini y cols. (68), en un estudio en el que también se comparaban pacientes que recibían IN postoperatoria con un grupo de control emparejado retrospectivamente, se encontraron un menor tiempo en la recuperación de la función intestinal, una menor tasa de íleo postoperatorio y una estancia más corta, pero estos resultados no fueron estadísticamente significativos. Tampoco se demostró en este trabajo ningún beneficio de la IN respecto a la depleción de proteínas.
Ninguno de los distintos trabajos permitió demostrar una disminución de la mortalidad con el empleo de la IN; no se evaluó el coste/beneficio ni se realizaron análisis de subconjuntos de pacientes (tratamiento quimioterápico, presencia o no de desnutrición, etc.). Por tanto, y dada la heterogeneidad de los trabajos, es posible que otros factores hayan alterado su rendimiento y constituyan factores de confusión a la hora de obtener conclusiones firmes.
Otros pacientes que podrían obtener beneficio con el empleo de la IN serían los pacientes con trasplante renal. En los estudios de Alexander y cols. (65,66) con 147 pacientes receptores de trasplante renal que recibieron suplementos diarios con inmunonutrientes, se observó un menor rechazo agudo estadísticamente significativo después del primer año en comparación con aquellos pacientes que no recibieron suplementos específicos. Aunque la frecuencia de hemocultivos positivos fue menor en los pacientes suplementados que en los pacientes control, no hubo diferencias en el número de infecciones respiratorias, urinarias o por citomegalovirus.
PACIENTES CRÍTICOS
El término paciente crítico engloba a pacientes con patologías diversas, diferentes grados de gravedad y en distintos momentos evolutivos, lo que hace que no se puedan establecer recomendaciones globales. El tratamiento nutrometabólico, cuyo objetivo es, además de proporcionar nutrientes, modular la respuesta inflamatoria, metabólica e inmunitaria, tiene numerosos puntos controvertidos (71).
En las dos últimas décadas varios estudios han examinado los efectos de la suplementación con glutamina en pacientes críticos, sugiriéndose que puede reducir la tasa de infección y mortalidad. Sin embargo, dos estudios sembraron dudas respecto a su utilidad y seguridad. En el estudio REDOX, el grupo de pacientes que recibió glutamina presentó un incremento significativo de la mortalidad durante el ingreso y a los 6 meses (72), si bien pudo deberse al uso de dosis altas por vía enteral y parenteral, al bajo aporte de calorías y proteínas, y a su utilización en pacientes con contraindicación. El estudio MetaPlus no pudo demostrar beneficio sobre las complicaciones infecciosas, la puntuación de fracaso multiorgánico, la duración de la ventilación mecánica y la duración de la estancia en críticos u hospitalaria, de una dieta enriquecida con glutamina y antioxidantes, objetivándose, por el contrario, una tasa de mortalidad ajustada a los seis meses más alta en el grupo de intervención (73).
En la última revisión de la Cochrane, los autores concluyen que existe evidencia moderada de que la suplementación con glutamina reduce la tasa de infección y los días de ventilación mecánica, evidencia baja respecto a la disminución de la estancia hospitalaria y poco o ningún efecto sobre la mortalidad o la estancia en críticos (74), sin evidenciarse diferencias entre la administración parenteral o enteral. Wischmeyer y cols. (75), tras una revisión sistemática de 26 estudios (2484 pacientes), concluyen que la glutamina parenteral como parte del soporte nutricional se asocia a una reducción significativa de la estancia y la mortalidad hospitalaria, y a una tendencia a disminuir las complicaciones infecciosas. Estos resultados fueron confirmados en una posterior revisión sistemática (76) que incluyó 16 publicaciones (842 pacientes) aplicando estrictos criterios de selección: ausencia de fallo renal/hepático, estabilidad hemodinámica/metabólica y administración de glutamina intravenosa según las recomendaciones vigentes en combinación con un adecuado soporte nutricional. Van Zanten (77) no objetivó ninguna reducción de la mortalidad hospitalaria, la estancia en críticos o las complicaciones infecciosas en un metaanálisis que incluía 11 estudios (1079 pacientes) que evaluaban la administración de glutamina enteral. Sí observó una disminución significativa en la estancia hospitalaria.
En la tabla III pueden verse las recomendaciones de distintas sociedades científicas sobre el uso de la inmunomodulación en pacientes críticos y sus subgrupos más relevantes (47,74-76).
Tabla III. Recomendaciones de SEMICyUC, ESPEN y SCCM/ASPEN sobre el uso de la inmunomodulación en pacientes críticos y subpoblaciones específicas.
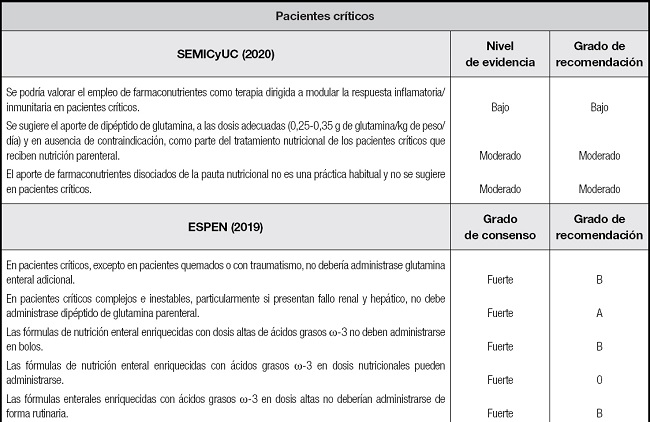
Tabla III (cont.). Recomendaciones de SEMICyUC, ESPEN y SCCM/ASPEN sobre el uso de la inmunomodulación en pacientes críticos y subpoblaciones específicas.
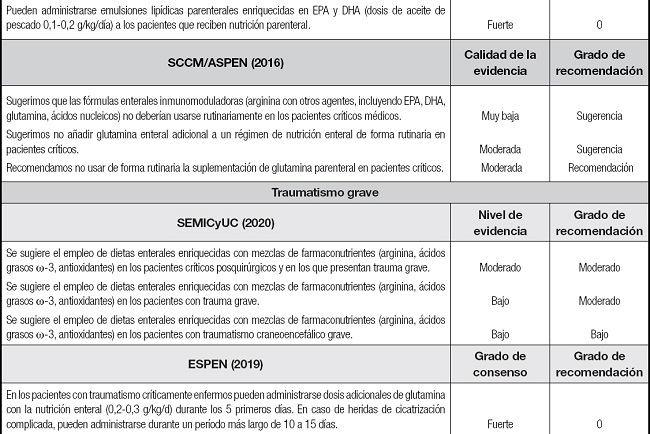
Tabla III (cont.). Recomendaciones de SEMICyUC, ESPEN y SCCM/ASPEN sobre el uso de la inmunomodulación en pacientes críticos y subpoblaciones específicas.
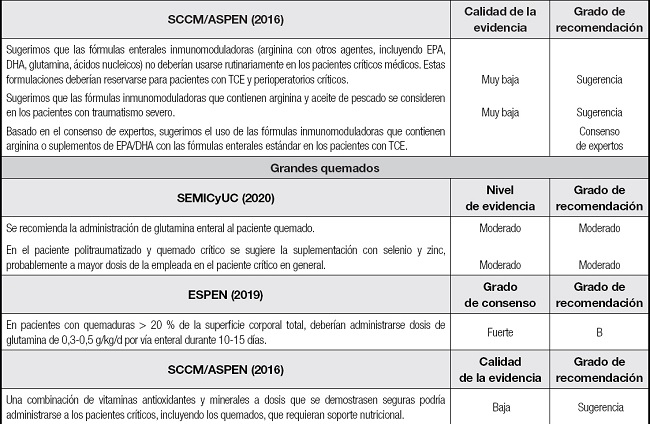
Tabla III (cont.). Recomendaciones de SEMICyUC, ESPEN y SCCM/ASPEN sobre el uso de la inmunomodulación en pacientes críticos y subpoblaciones específicas.
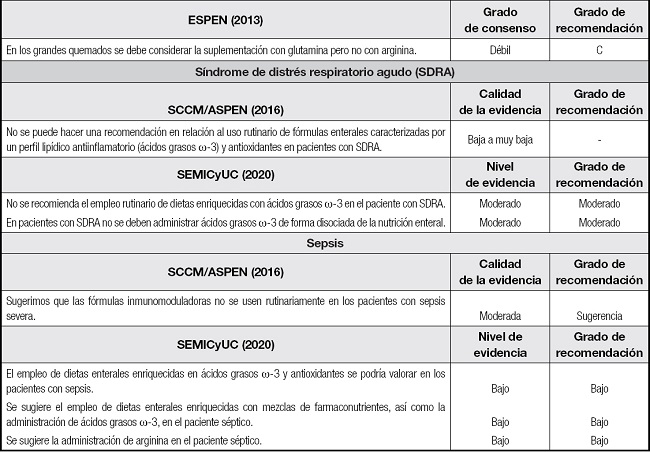
SEMICyUC: Sociedad Española de Medicina Intensiva, Crítica y de Unidades Coronarias; ESPEN: European Society of Parenteral and Enteral Nutrition; SCCM/ASPEN: Society of Critical Care Medicine and American Society for Parenteral and Enteral Nutrition; EPA: ácido eicosapentaenoico; DHA: ácido docosahexaenoico; TCE: traumatismo craneoencefálico; SDRA: síndrome de distrés respiratorio agudo.
POLITRAUMATISMO
El politraumatismo pone en riesgo al individuo que lo sufre como consecuencia no solo del insulto inicial, sino también de los cambios que le siguen y que favorecen la aparición de complicaciones e incluso el fallecimiento. Varias líneas de evidencia apoyan teóricamente el uso de IN en pacientes con traumatismo severo. Marik (81), en un metaanálisis de 8 estudios (372 pacientes), no demostró diferencias en estancia hospitalaria, infecciones o mortalidad con el uso de estas fórmulas respecto a fórmulas estándar. Van Zanten tampoco demostró beneficio clínico con el uso de glutamina enteral en politraumatizados (77). En pacientes con traumatismo craneoencefálico, el metaanálisis de Wang objetivó una reducción significativa en las infecciones con el uso de fórmulas inmunomoduladoras (82).
GRANDES QUEMADOS
Los grandes quemados se caracterizan por un estado hipercatabólico e hiperdinámico directamente proporcional a la superficie corporal afectada, sumado a la pérdida de nutrientes a través de la piel.
En el análisis por subgrupos del metaanálisis de Van Zanten (77) se observó que la suplementación enteral con glutamina en quemados redujo significativamente la mortalidad y la morbilidad infecciosa por gramnegativos. Actualmente está en marcha un ensayo clínico multicéntrico y doble ciego internacional (RE-ENERGIZE) que analiza la administración de glutamina (0,5 g/kg/día) enteral frente a un placebo en 2700 quemados graves (83). Evaluará como resultado primario la mortalidad a los seis meses, y, como secundarios, la estancia media y la calidad de vida.
INMUNONUTRICIÓN: MISCELÁNEA
Otros usos menos frecuentes de la IN corresponden a pacientes sometidos a cirugía hepática, cáncer ginecológico y cirugía de cadera. Recientemente se han publicado trabajos en relación a la COVID-19.
CIRUGÍA HEPÁTICA
Aunque las recomendaciones de las guías ESPEN en nutrición preoperatoria de cirugía hepática recomiendan suplementos estándar (84), se han publicado en los últimos años varios trabajos favorables al uso de la IN. En 2017, Zhang y cols. (85), en un metaanálisis de 805 pacientes (402 en grupo de IN y 403 en el grupo de control) sometidos a hepatectomía, encontraron que el uso de IN se relacionaba con un menor número de complicaciones posquirúrgicas e infecciosas y una reducción de la estancia hospitalaria en el grupo que recibió los suplementos enriquecidos en ácidos grasos ω-3. Posteriormente, Wong (86) publicó un nuevo metaanálisis que incluyó 11 ensayos clínicos con 1084 pacientes y encontró una disminución de la tasa de infección de la herida quirúrgica sin diferencias entre los grupos de suplementación pre y postoperatoria. La estancia hospitalaria fue inferior en el grupo de IN. No se encontraron diferencias en morbilidad (fístula biliar, fallo hepático, íleo) y mortalidad entre ambos grupos.
CÁNCER GINECOLÓGICO
Se han realizado varios estudios en cáncer ginecológico con fórmulas inmunomoduladoras. En algunos se han reportado una menor incidencia de infecciones de la herida quirúrgica (83,84) y una menor estancia hospitalaria (87), mientras que en otro no se encontraron diferencias estadísticamente significativas (89).
ARTROPLASTIA DE CADERA
En la artroplastia de cadera, el uso de la IN en conjunto con el protocolo ERAS mostró una disminución de las concentraciones de PCR posquirúrgicas (90) y una reducción de la estancia hospitalaria (90,91), de las complicaciones infecciosas y de la necesidad de trasfusión sanguínea (91).
COVID-19
Una de las principales consecuencias de la pandemia de COVID-19 es la desnutrición que experimentan los pacientes, especialmente aquellos que precisan ingreso en unidades de críticos (92,93). Si bien es conocido el papel que juegan algunos inmunonutrientes de forma aislada en la cascada inmune en caso de infecciones, como vitamina D, zinc, vitamina A, selenio y ácidos grasos ω-3, entre otros, en el momento actual no es posible dar una recomendación sobre el uso de la IN en estos pacientes (94). Probablemente, estos datos puedan ampliarse a medida que dispongamos de más estudios al respecto.
DISCUSIÓN
Se han revisado los datos sobre el papel de la IN en diversas situaciones clínicas. Dada la evidencia disponible, el uso de la IN en pacientes que van a ser sometidos a cirugía de CCC ha demostrado reducir las fístulas en el postoperatorio. Como inmunonutriente aislado, la arginina es el que tiene mayor evidencia en estos casos. Dada la variedad de los trabajos analizados, son necesarios estudios con más población y solidez estadística. El uso de la IN perioperatoria en el paciente con CG y cáncer de esófago se asocia a reducción de complicaciones infecciosas y menor estancia hospitalaria. Además, ha demostrado ser coste-eficiente. La evidencia sugiere superioridad en el uso de la IN por vía oral en el preoperatorio del paciente que va a ser sometido a cirugía pancreática por CP, si bien son necesarios más estudios que lo refrenden, mientras que en la pancreatitis aguda, esa evidencia es menor y va a favor del uso de inmunonutrientes específicos como la glutamina en el soporte nutricional parenteral. En el CCR, la evidencia apoya el uso de la IN perioperatoria, especialmente en caso de existir desnutrición. Si bien los datos son limitados, el uso de la IN pre y postoperatoria en la cirugía torácica ha mostrado beneficios en cuanto a reducción de la estancia hospitalaria y disminución de las complicaciones. Son necesarios más estudios controlados, prospectivos y aleatorizados para confirmar los beneficios de la IN en los pacientes con cáncer vesical. La IN en receptores de trasplante de riñón podría disminuir la frecuencia de complicaciones como el rechazo y las infecciones. Aunque el uso de farmaconutrientes y fórmulas inmunomoduladoras en los pacientes críticos es controvertido, los grandes quemados podrían ser una excepción. Otros usos menos frecuentes de la IN corresponden a los pacientes sometidos a cirugía hepática, con cáncer ginecológico, de cirugía de cadera y con COVID-19. En estas situaciones, la evidencia es limitada.
CONCLUSIONES
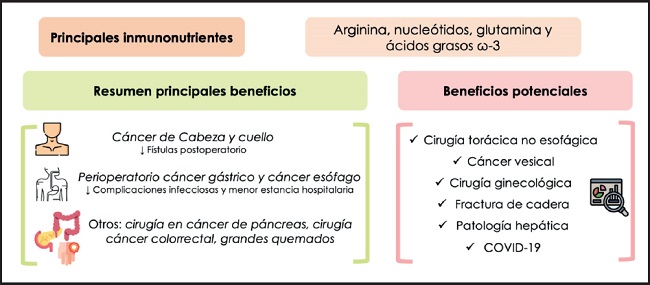
En este trabajo se ha revisado la evidencia disponible sobre la IN. En el diseño de futuros trabajos debería prestarse especial atención a la composición concreta de inmunonutrientes de las fórmulas empleadas, a la dosis y duración del tratamiento, y al momento de la patología en que se administran, para poder disponer de una mayor calidad de la evidencia que permita ofrecer la mejor atención a nuestros pacientes. En la figura 1, se resumen los beneficios de la IN así como los potenciales beneficios clínicos en otras situaciones.