Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Archivos de la Sociedad Española de Oftalmología
versão impressa ISSN 0365-6691
Arch Soc Esp Oftalmol vol.81 no.9 Set. 2006
ARTÍCULO ORIGINAL
Trabeculoplastia con dos tipos de láser en gato, monos y humano: Estudio morfológico con microscopía electrónica de barrido
Trabeculoplasty with two different lasers in cats, monkeys and humans: A scanning electron microscopy study
Simón G.1
Boston University, Departamento de Ingeniería Biomédica. Boston Massachussets. Estados Unidos.
1Doctor en Medicina
Dirección para correspondencia
RESUMEN
Objetivo:Verificar el impacto estructural inducido por la trabeculoplastia con dos tipos de láser, Titanio-Zafiro (Ti-Za) y argón sobre cuatro tipos de malla trabecular.
Material y Métodos: Se utilizaron cuatro tipos diferentes de malla trabecular procedentes del gato doméstico, dos tipos de monos y humano. Este estudio se practicó sobre ojos frescos de cadáver («ex vivo»), excepto en el gato, en el que se realizó «in vivo». La morfología observada bajo un microscopio electrónico de barrido (40/100X), se efectuó sobre las mallas trabeculares tratadas con argón a 0,1 sg/pulso, de 600 a 1.000 mW, y 50 mm de diámetro de spot y para el Ti-Za, a 7 msg/pulso, de 25 a 110 mJ y 175 mm de diámetro por spot. El estudio en gato permitió analizar el efecto inducido a las 24 horas y 4 semanas después del tratamiento. Los parámetros utilizados comprenden los rangos de la trabeculoplastia clínica para ambos láseres.
Resultados: Los modelos utilizados fueron muy adecuados para la práctica de la trabeculoplastia, observando una cámara profunda y un ángulo muy accesible a la acción del láser. El láser de argón fue el que provocó una mayor alteración del tejido trabecular en todos los modelos. La malla trabecular del gato demostró capacidad de reparación después de un mes del tratamiento. Para el Ti-Za fue necesario el uso de energías superiores a los 100 mJ para inducir un cambio estructural evidenciable en la malla trabecular a 100X.
Conclusiones: El efecto de la trabeculoplastia con argón (600/1.000 mW) sobre la malla trabecular implica una alteración «estructural» producida por la contracción del colágeno en el punto tratado (efecto térmico). Para el láser de Ti-Za y a niveles energéticos inferiores a 80mJ no se produce ningún cambio estructural.
Palabras clave: Microscopía electrónica de barrido, trabeculoplastia, Titanio Zafiro, argón, malla trabecular.
ABSTRACT
Purpose:To study the structural changes induced by trabeculoplasty with two different lasers (Ti-Sph and argon) and observe the differences between four trabecular meshwork models.
Materials and methods: Four different trabecular meshwork (TM) models were used from cats, monkeys, and humans. This study was performed on fresh cadaver eyes («ex vivo») except for the cat in which this study was performed «in vivo». The morphology of the trabecular meshwork was observed by scanning electron microscope (40/100X) after being treated with argon (0.1s/pulse, 600 to 1,000mW, 50µ spot size) and Ti-Sph (7µsg/pulse, 25 to 110mJ,175µm of spot size). The study on cats allowed assessment of the induced effect after 24 hours, and 4 weeks after the treatment on the TM. Typical clinical trabeculoplasty parameters were used for both lasers during this study.
Results: The models used in this study were found to be adequate for trabeculoplasty. They exhibited a deep anterior chamber and an accessible TM. The argon laser induced significant changes in the TM in all models studied. The cat model demonstrated TM repair response one month after treatment. For Ti-Sph, high levels of energy (>100mJ) were required to induce significant structural changes in the TM.
Conclusion: The IOP reduction effect by argon trabeculoplasty (600/1,000mW) induced structural shrinkage of the collagen in the TM via thermal effects. The Ti-Sph laser works through non-structural mechanisms. At clinical levels (lower than 80mJ), Ti-Sph does not show evidence of TM changes (Arch Soc Esp Oftalmol 2006; 81: 527-536).
Key words: Scanning electron microscopy, trabeculoplasty, Ti-Sapphire, argon, trabecular meshwork.
Introducción
Clásicamente se han descrito dos vías de drenaje del humor acuoso en diferentes especies: la vía trabecular o convencional, que conduce el humor acuoso desde la cámara anterior a las venas epiesclerales atravesando la malla trabecular, y la vía uveoescleral o no convencional (1,2) que elimina el humor acuoso atravesando la malla ciliar hasta el espacio supracoroideo. Esta última vía representa una ruta de drenaje muy activa durante el primer tercio de la vida, reduciendo su actividad con el tiempo hasta representar solo un 10% del valor total de drenaje en humanos adultos (3,4). La malla trabecular es de fácil acceso a un láser utilizando una lente gonioscópica, por lo que es posible actuar sobre ella para reducir su resistencia al flujo (5) (trabeculoplastia). Este método se practica de una forma ambulatoria y totalmente incruenta. La trabeculoplastia con láser de argón ha demostrado su efectividad en el tratamiento del glaucoma (6,7) y se admite que actúa por un efecto térmico y biológico. Durante su aplicación clínica es posible observar el blanqueamiento del punto tratado (50 mm) y una retracción de los tejidos vecinos. También se ha descrito la aparición de picos hipertensivos postoperatorios relacionados con la magnitud energética utilizada y en un número reducido de casos (3%) (8) un aumento de la presión intraocular a largo plazo. Este tipo de trabeculoplastia está limitado a un número de impactos ya que los puntos coagulados sobre la malla trabecular no son funcionalmente activos. Parece contradictoria la necesidad de utilizar un láser que destruye cierta área de la malla trabecular aunque su objetivo sea inducir una mayor permeabilidad de la red trabecular no tratada.
Recientemente se ha propuesto el uso de un nuevo láser con una longitud de onda de 790 nm y con pulsos de exposición de 7 µsg para la práctica de la trabeculoplastia clínica.
Este tipo de láser no es térmico, y su mecanismo de acción sobre la malla trabecular no está bien definido actualmente. Se trata de una longitud de onda que ha sido utilizada en estudios piloto con la metodología de la trabeculoplastia convencional (9), que podría tener un mayor efecto hipotensor, con la posibilidad de aplicarse periódicamente y generar un menor daño tisular local.
Sujetos, material y métodos
Se utilizaron cuatro modelos diferentes de malla trabecular, tres «ex vivo»: Cynomologous (Macaca fascicularis), Rhesus (Macaca mulatta), humano y una «in vivo» en gato (Felis domesticus). Los cuatro modelos presentados ofrecen unas características anatómicas semejantes de la vía trabecular de drenaje del humor acuoso (vía convencional). Los tres modelos «ex vivo» utilizados pertenecen a especies muy próximas entre sí, y la estructura del ojo presenta mínimas diferencias. En todos los casos la curvatura, potencia y grosor corneal fue normal, y la amplitud de cámara y exposición de la malla trabecular fue óptima.
Modelo «in vivo»
El protocolo de investigación en gato se obtuvo bajo la aprobación por parte del comité de experimentación animal de la Universidad de Miami. El manejo de estos animales se realizó de acuerdo a la resolución de ARVO para animales de laboratorio en investigación. Se utilizaron dos grupos (Grupo A y Grupo B) de seis gatos domésticos hembra de un año de edad (n=12) para ser tratados monocularmente por los dos láseres. Todos ellos recibieron un examen oftalmológico completo antes de ser tratados con un láser de argón (514 nm, 0,1 s/pulso, 600 a 1.000 mW, 50 m diámetro de spot) y un láser de Ti-Za (Ti: Al2O3, 790 nm, 7 µs/pulso, de 25 a 110mJDE3, 175 µ diámetro de spot) previamente calibrados. Los animales fueron tratados bajo anestesia general (hidrocloruro de Ketamina, 20mg/kg de peso, maleato de acepromacina 1 mg/kg y 0,20 mg/kg de sulfato de atropina) utilizando un soporte especialmente diseñado para facilitar su manejo. Los láseres utilizados fueron de tipo comercial (argón de Coherent Inc, Palo Alto, USA y Ti-Za de Solx C. Boston, USA), y se aplicaron utilizando una lente gonioscópica pediátrica. La extensión del ángulo tratado fue de 180º. El número de impactos fue de 40 a 60, no siendo en ningún caso confluentes y dejando una distancia entre ellos de aproximadamente el doble de su tamaño de spot (250µm o cada 3,6º). El impacto se localizó sobre la malla trabecular, entre la línea de Schwalve y el espolón escleral. En todos los casos se observó una respuesta tisular en el momento de la aplicación del láser semejante a la observada en la práctica clínica con humanos9, con blanqueamiento, formación de burbujas (fig. 1) y sin la inducción de tyndall celular o inflamatorio. A las 24 horas fue difícil reconocer el blanqueamiento inicial e imposible a los 14 días (fig. 1). En dos casos se observó una pequeña ruptura de la red vascular en la zona tratada, originándose un discreto tyndall hemático transitorio sin la formación de hipema. No se utilizó ningún tipo de miótico tópico durante el tratamiento. Durante todas las observaciones efectuadas durante el postoperatorio no se evidenciaron alteraciones oculares ni generales. A las 24 horas de ser tratados se procesaron para su estudio seis ojos, tres del grupo tratado con Ti-Za y tres del grupo tratado con argón, para ser estudiados bajo microscopia electrónica y el resto de los ojos fueron procesados a las 4 semanas.
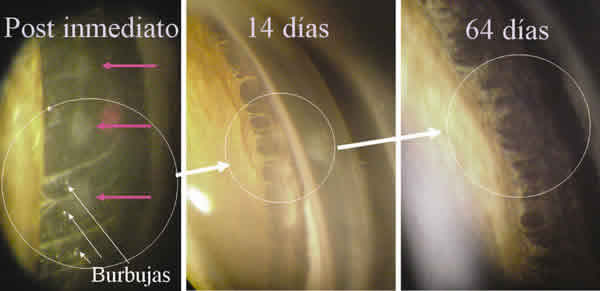
Fig. 1. Aspecto del lugar impactado por el láser de TiZa. Imagen inicial, a los 14 días y a los 2 meses.
Modelo «ex vivo»
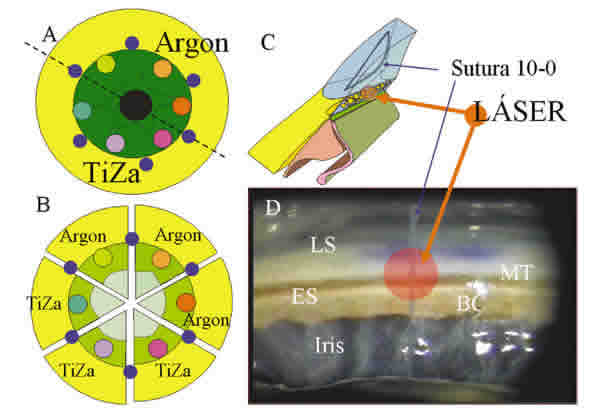
Se utilizaron dos pares de ojos provenientes del vivario de estudios en primate de la Universidad de Miami (un mono rhesus de 6 años de edad y un mono cynomologous de 12 años) y un par de ojos frescos provenientes del banco de ojos de «The Florida Lyons» (humano varón de 69 años de edad). Todos ellos presentaron un óbito inferior a las 12 horas sin presentar alteración ocular observada bajo exámen biomicroscópico, ni ningún tipo de cirugía previa. Dado que el mismo ojo fue utilizado tanto para efectuar la trabeculoplastia con argón como con Ti-Za, y para evitar factores que pudieran afectar el grado de absorción de la energía del láser a través de la córnea y humor acuoso (ojos de cadáver), se procedió del siguiente modo (fig. 2): Se colocaron seis marcas equidistantes en el limbo corneal con un rotulador de azul de metileno, que dividía el perímetro de la córnea en seis fragmentos idénticos. Seguidamente se procedió a seccionar con un cuchillete de diamante cada uno de los sectores delimitados por el marcado limbar (60º cada uno) dividiendo el sector correspondiente de iris y eliminando el cristalino para una mejor exposición del ángulo (fig. 2C). Se colocaron entre las marcas seis puntos de nylon 10-0 para identificar el lugar donde se va a realizar el tratamiento con el láser y así poderlo localizar tras su fijación y procesado para microscopia electrónica de barrido. Cada uno de los ojos recibió las dos modalidades de láser y tres niveles diferentes de energía (un tratamiento por sección). Con láser de argón se usaron energías de: 600, 800 y 1000 mW en todos los ojos y con el láser de Ti-Za: 15, 30, 50mJ en tres ojos y 80, 100 y 130mJ en los tres restantes (DE 3mJ). El tratamiento se efectuó por lo tanto a través del aire, directamente sobre la malla trabecular (entre la línea de Schwalve y el espolón escleral) sin utilizar la lente gonioscópica (fig. 2C, D).
Fig. 2. Preparación del globo para trabeculoplastia "ex vivo". LS (Línea de Schwalbe),
MT (Malla Trabecular), ES (Espolón Escleral), BC (Banda Ciliar).
Tras realizarse el tratamiento, cada una de las secciones del ojo fue procesada para ser estudiada con microscopio electrónico de barrido. Para ello se fijaron en paraformaldehido al 2% y glutaraldehido al 2,5% y posteriormente en tetróxido de osmio al 1% durante 2 horas en series de deshidratación de etanoles según punto crítico (dióxido de carbono). Posteriormente se saturaron con oro (Hummer V, Technics, Alexandria, USA) y se examinaron bajo un microscopio electrónico (JSM-35, JEOL Ldt., Tokio, Japón) con un voltaje de aceleración de 25 kV.
Resultados
Modelo «in vivo»
En la figura 3 se muestra una composición fotográfica de un sector (45º aprox) de la malla trabecular tratada con láser para este estudio. La imagen se corresponde con uno de los ojos de gato doméstico tratados un mes antes con unos 12 impactos del láser Ti-Za. La malla trabecular expuesta no presenta ningún tipo de alteración o marca que pueda indicar el lugar donde impactó el láser. El nivel energético utilizado fue de 50mJ idéntico al propuesto en el tratamiento de la trabeculoplastia en humanos. En la imagen se ha indicado con 12 círculos los lugares donde podría haber impactado el láser. El tamaño del circulo se corresponde con las dimensiones relativas entre el spot (175µ), la distancia entre impactos (250µ) y el tamaño de la malla trabecular del gato. Lógicamente el lugar que ocupa el circulo en la malla trabecular de la imagen no tiene porqué corresponder con el lugar exacto tratado. La figura 4 muestra las secuencias correspondientes al estudio efectuado en gato doméstico tras un día y un mes del tratamiento. La columna B muestra las imágenes control de una malla trabecular intacta. La columna A muestra el tratamiento efectuado con argón. Las columnas C, D y E muestran la respuesta tisular a tres diferentes niveles de energía utilizando un láser de Ti-Za. La sección superior corresponde al estudio inmediatamente después de efectuarse el tratamiento y la inferior a un mes después. Como puede observarse, aparece una gran desestructuración de la retícula trabecular tras el tratamiento con argón tanto si se observa a las 24 horas como al mes, momento en el que se han consolidado los fenómenos de reparación tisular. En las mallas tratadas con Ti-Za no se pudo poner en evidencia ningún tipo de alteración con niveles de energía menores de 81mJ (columnas C y D). Las piezas que recibieron más de 100mJ apenas presentaron roturas en los filamentos que conforman la malla trabecular cuando se estudiaron 24 horas después de ser tratadas, y no presentaron alteración alguna cuando se observaron un mes después (fig. 4E).
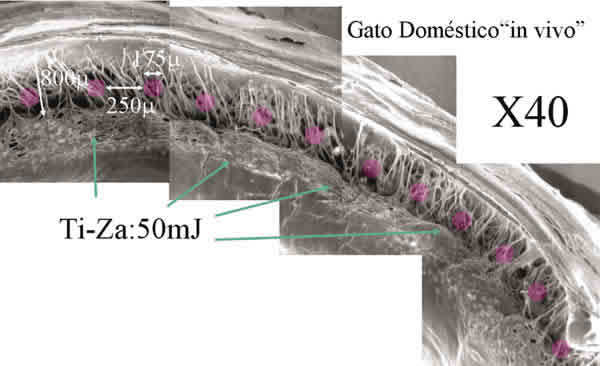
Fig. 3. Sector del ángulo de gato tratado con láser de Ti-Za (50mJ). Esta energía se corresponde
con la utilizada en la trabeculoplastia clínica. No se observan alteraciones de la malla trabecular
en todo el área expuesta un mes después.
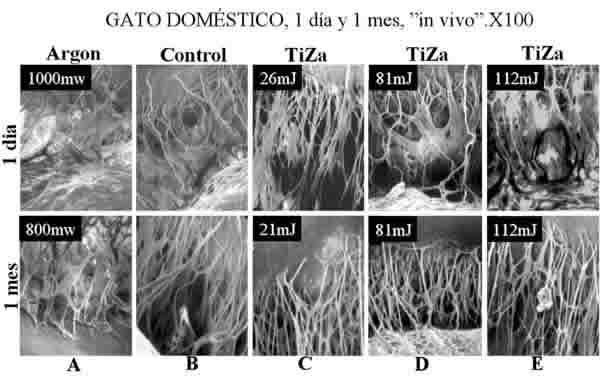
Fig. 4. El cambio estructural observado instantáneamente tras la acción del láser,
tanto argón como Ti-Za, aparece reparado un mes después.
Modelo «ex vivo»
Las observaciones efectuadas en los modelos de Cynomologous y Rhesus son semejantes (figs. 5 y 6). La imagen control presenta una arquitectura trabecular prácticamente idéntica en cuanto a dimensión y disposición estructural. El impacto del láser de argón (A) origina una clara desestructuración de la malla trabecular en forma de cráter, e induce pliegues radiales por la compresión inducida al colágeno por parte del efecto térmico del láser. En la imagen del mono Cynomologous aparecen dos puntos alcanzados por el láser sobre la malla trabecular tangentes a la línea de Schwalbe en una imagen 100X (fig. 5A). En el modelo del mono Rhesus, con el láser Ti-Za y energías por debajo de los 50mJ no se observó ningún efecto apreciable sobre la malla trabecular (fig. 6C, D). En el caso del mono Cynomologous, se comenzaron a observar alteraciones con energías superiores a los 80mJ en un 30% de los lugares impactados (fig. 5D) y en ambos tipos de monos, Rhesus y Cynomologous, se observaron roturas de las redes trabeculares cuando se utilizaron energías por encima de los 110mJ (C). Las imágenes obtenidas del modelo humano presentaron una malla trabecular más delicada y definida que en los dos modelos anteriores aunque con unas dimensiones y estructura semejante. La trabeculoplastia con argón (fig. 7A) muestra un área compactada y lisa en la que no se puede apreciar la arquitectura trabecular. El tejido circundante rápidamente recobra su aspecto control. Tampoco se pudieron observar alteraciones para energías por debajo de los 50mJ en el caso de Ti-Za, aunque en algunos casos aparecieron placas de las primeras capas de la malla trabecular rotas, dejando ver a su través el tejido subyacente (7D). Para energías de 100 mJ se observa una afectación muy profunda hacía el canal de Schlemm (7E). Energías de 130 mJ llegaron a originar una dehiscencia tisular muy marcada (7F), y en algunas casos incluso desinserción de la raíz del iris.
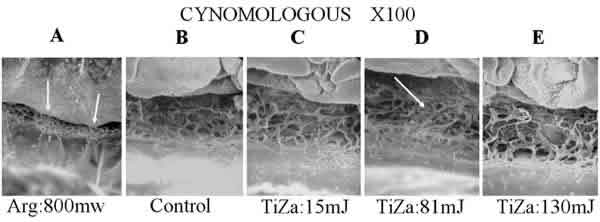
Fig. 5. No se observan variaciones en la malla trabecular (C) hasta alcanzar un nivel energético de 81 mJ (D).
A 130 mJ se observa una gran alteración de la arquitectura de la red trabecular (E). Los impactos con argón
(A) muestran contracción del colágeno local.
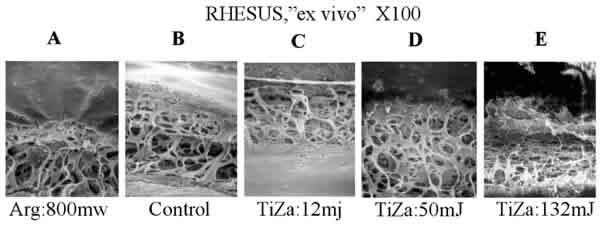
Fig. 6. No se observan cambios estructurales para energías de 12 y 50 mJ utilizando Ti-Za (C,D).
La imagen A muestra claramente el punto de absorción de la energía térmica transmitida por le láser argón.
Se observa un cráter de destrucción tisular y líneas de contracción lineal radialmente (A).
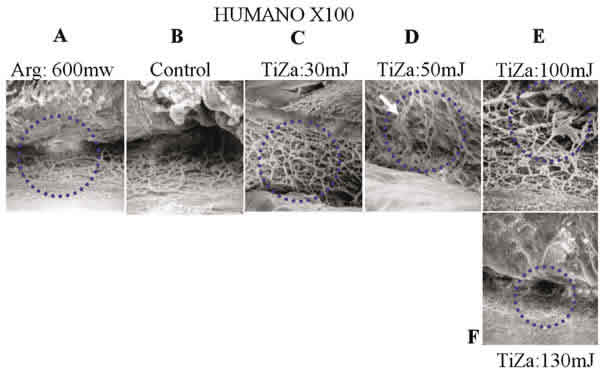
Fig. 7. El efecto térmico es menos obvio que en los demás modelos (A). Niveles clínicos de energía TiZa
no presentaron alteraciones sobre la red trabecular (C,D,E) hasta valores muy por encima de los utilizados en la trabeculoplastia.
Discusión
Aunque el mecanismo de acción de la trabeculoplastia con láser de argón sigue siendo controvertido, se puede apreciar un claro efecto mecánico de tracción inducido en la malla trabecular próxima al punto coagulado originado por la compactación del colágeno. Este fenómeno seria comparable al que se consigue sobre la córnea cuando se practica la fototermoqueratoplastia (11). Existen diversos autores que han analizado el impacto del láser de argón sobre la malla trabecular haciendo alusión a este efecto biomecánico (12-14). El lugar propuesto donde se deben localizar los impactos de láser para su máxima acción es en la intersección de la malla trabecular pigmentada y no pigmentada. Parece contradictorio anular una cierta área de la malla trabecular para conseguir una mayor permeabilidad del tejido trabecular entre dos impactos (15). Habitualmente en la trabeculoplastia térmica se utilizan entre 50 y 60 impactos, en dos sesiones, con un tamaño de spot de 50 a 100 µ. Esta densidad de impacto distribuida en los 360º significa una aplicación aproximadamente cada 3,6º (16) (360/100). El área de la malla trabecular en humanos viene a ser el de una banda circular de 300-400µ de ancho con un radio de 6mm. El cálculo de esta área muestra un valor de 11,3 mm2(300x2πr). El cálculo del área tratada por el láser es de a unos 0,25mm2(120 impactos x π 252m), es decir, este tipo de trabeculoplastia destruye al menos un 2% de su malla trabecular. Tras un seguimiento de 5 años y después de la trabeculoplastia con argón, al menos un 50% de los casos presentan una PIO inadecuada. El retratamiento con argón ha demostrado ser poco efectivo y está asociado a un alto grado de fracasos (17,18).
El uso de los láseres fríos permiten ser menos agresivo con la malla trabecular, y teóricamente seria posible efectuar trabeculoplastias periódicas para mejorar el drenaje de la vía trabecular. El mecanismo de acción para este tipo de longitud de onda (790 nm) será controvertido, y probablemente difícil de descifrar en su totalidad. Se ha propuesto un modelo teórico (10) que predice la gran penetrancia del láser Ti-Za a través de la malla trabecular. Posiblemente, la mayor penetrancia de longitudes de onda próximas a los 800 nm puedan explicar una mayor efectividad en la reducción de la PIO (10). El tamaño de spot utilizado por el láser de Ti-Za (175µ) es mayor que el de argón (50µ), por lo que un tratamiento de la malla trabecular con 50 impactos representa un área de 1,5mm2, o un 10% del área filtrante total. Las micrografías de la malla trabecular tratadas con niveles energéticos por debajo de los 100mJ apenas si demuestran alteraciones (figs. 4, 5, 6 y 7) y el nivel energético propuesto para la trabeculoplastia clínica es aún menor encontrándose entre los 20 y los 50mJ (fig. 3). De los modelos aquí presentados, únicamente el gato doméstico ha sido tratado «in vivo» y bajo las mismas características clínicas efectuadas en humano (lente gonioscópica). El resto de modelos, «ex vivo», han recibido la acción de láser a través del aire en lugar de atravesar la córnea y el humor acuoso, por lo que la cantidad de energía que alcanza la malla trabecular es discretamente superior (aproximadamente un 15% más). Stoiber et al (19) indican un mecanismo de acción asociado a la absorción de la energética del láser por parte de la melanina intracelular e intersticial presente en la malla trabecular (fenómeno de ablación). Este hecho podría eliminar cierta cantidad de melanina trabecular y reducir su resistencia al paso de humor acuoso. También es posible que la onda de choque generada en este proceso induzca una respuesta inflamatoria local con la atracción de células fagocíticas que igualmente eliminen detritus tisulares y material amorfo extracelular. Estos hechos son coherentes con la ausencia de daño observada en la estructura de la malla trabecular tras ser tratados con el láser Ti-Za y podrían apoyar la posibilidad de indicar una trabeculoplastia periódica con este tipo de láser como tratamiento del glaucoma.
Aunque no se han presentado cambios morfológicos de la malla trabecular con el láser de Ti-Za en ampliaciones 40/100X, es posible que estos cambios ocurran a un nivel estructural menor. La interacción de este láser con la malla trabecular posiblemente desencadene una cascada de acontecimientos difíciles de enumerar (biológicos y/o bioquímicos) que determinen una menor resistencia al paso de humor acuoso a través de la misma, desde la cámara anterior hasta el canal de Schlemm.
Bibliografía
1. Bill A. The aqueous humor drainage mechanism in the cynomolgus monkey (Macaca irus) with evidence for unconventional routes. Invest Ophthalmol 1965; 4: 911-919. [ Links ]
2. Bill A. Phillips CL. Uveoscleral drainage of acuose humor on human eyes. Exp Eye Res 1971; 12: 275-281. [ Links ]
3. Bill A. The drainage of albumin from the uvea. Exp Eye Res 1964; 75: 179-187. [ Links ]
4. Bill A. Conventional and uveo-scleral drainage of aqueous humor in the cynomolgus monkey (Macaca irus) at normal and high intraocular pressures. Exp Eye Res 1966; 5: 45-54. [ Links ]
5. Gasterland D, Kupfer C. Experimental glaucoma in the rhesus monkey. Invest Ophthalmol 1974; 13: 455-457. [ Links ]
6. Krupin T, Kolker AE, Kass MA, Becker B. Intraocular pressure the day of argon laser trabeculoplasty in primary open-angle glaucoma. Ophthalmology 1984; 91: 361-365. [ Links ]
7. Shingleton BJ, Richter CU, Bellows AR, Hutchinson BT, Glynn RJ. Long-term efficacy of argon laser trabeculoplasty. Ophthalmology 1987; 94: 1513-1518. [ Links ]
8. Thomas JV, Simmons RJ, Belcher CD 3rd. Argon laser trabeculoplasty in the presurgical glaucoma patient. Ophthalmology 1982; 89: 187-197. [ Links ]
9. Simon G. Vivar A, Lowery JA. Clinical results following gonioscopic laser trabecular ablation (GLTA) with a Ti:Sapphire laser for the treatment of glaucoma. Invest Opthalmol Vis Sci 1995; 36: S838. Abstract No 3861. [ Links ]
10. Manns F, Parel JM, Fernandez V, Stoiber J, Lamar P, Salas N, et al. Qualitative-optical thermal model of argon, selective, and microsencond infrared laser trabeculoplasty. Opthalmic Technologies XIII 2003; 4951: 71-76. [ Links ]
11. Parel JM, Ren Q, Simon G. Noncontact laser photothermal keratoplasty. I: Biophysical principles and laser beam delivery system. J Refract Corneal Surg 1994; 10: 511-518. [ Links ]
12. Alexander RA, Grierson I. Morphological effects of argon laser trabeculoplasty upon the glaucomatous human meshwork. Eye 1989; 3: 719-726. [ Links ]
13. McMillan TA, Stewart WC, Legler UF, Powers T, Nutaitis MJ, Apple DJ. Comparison of diode and argon laser trabeculoplasty in cadaver eyes. Invest Ophthalmol Vis Sci 1994; 35: 706-710. [ Links ]
14. Kramer TR, Noecker RJ. Comparison of the morphologic changes after selective laser trabeculoplasty and argon laser trabeculoplasty in human eye bank eyes. Ophtalmology 2001; 108: 773-779. [ Links ]
15. Wise JB, Witter SL. Argon laser therapy for open-angle glaucoma. A pilot study. Arch Ophthalmol 1979; 97: 319-322. [ Links ]
16. Wise JB. Errors in laser spot size in laser trabeculoplasty. Ophthalmology 1984; 91: 186-190. [ Links ]
17. Starita RJ, Fellman RL, Spaeth GL, Poryzees E. The effect of repeating full-circumference argon laser trabeculoplasty. Ophthalmic Surg 1984; 15: 41-43. [ Links ]
18. Brown SV, Thomas JV, Simmons RJ. Laser trabeculoplasty re-treatment. Am J Ophthalmol 1985, 99: 8-10. [ Links ]
19. Stoiber J, Fernandez V, Lamar PD, Decker SJ, Dubovy S, Hitzl W, et al. Trabecular meshwork alteration and intraocular pressure change following pulsed near-infrared laser trabeculoplasty in cats. Ophthalmic Surg Lasers Imaging 2005; 36: 471-481. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Gabriel Simón
Instituto Oftalmológico Gabriel Simón
C/ Fuencarral, 7
28007 Madrid
España
E-mail: gabrielsimon@dr-simon.net
Recibido: 22.9.05
Aceptado: 21.9.06