Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO  Similares em Google
Similares em Google
Compartilhar
Revista Española de Enfermedades Digestivas
versão impressa ISSN 1130-0108
Rev. esp. enferm. dig. vol.96 no.2 Madrid Fev. 2004
|
TRABAJOS ORIGINALES |
Significado pronóstico de la proteína p185 en cáncer colorrectal
M. T. Sanz-Casla, M. Vidaurreta, M. L. Maestro, J. A. López1, F. Jiménez2, C. Fernández3,
C. Maestro4, J. L. Balibrea2 y F. J. Cerdán2
Servicio de Análisis Clínicos. Sección Biología Tumoral. 1Servicio de Anatomía Patológica. 2Servicio de Cirugía General II.
3Unidad de Investigación. Hospital Clínico San Carlos. 4Departamento de Ciencias Morfológicas I. Facultad de Medicina.
Universidad Complutense. Madrid
RESUMEN
La amplificación y/o sobre-expresión del oncogén c-erbB2/neu puede contribuir al desarrollo y progresión tumoral. El objetivo de este trabajo es el estudio del valor pronóstico de la proteína p185 mediante técnicas de inmunohistoquímica en el carcinoma colorrectal. Se trata de un estudio de cohortes prospectivo en 106 muestras de tejido tumoral colorrectal de pacientes intervenidos quirúrgicamente por un mismo cirujano y con una mediana de tiempo de seguimiento de 3 años. El 33% de los pacientes presenta sobre-expresión de p185, que se relaciona con estadios avanzados de la enfermedad. En los pacientes con tumores adenocarcinoma localizados en colon y sin metástasis a distancia, la determinación de p185 muestra valor pronóstico clínicamente relevante (p=0,06).
Palabras clave: Oncogén c-erbB2/neu. Proteína p185. Carcinoma colorrectal. Pronóstico.
INTRODUCCIÓN
El protooncogén c-erbB-2/neu es miembro de una familia de receptores con actividad tirosín-kinasa. Se encuentra localizado en el cromosoma 17q21 y codifica una glicoproteína transmembrana de 185 kDa, de estructura similar al receptor del factor de crecimiento epidérmico, que induce la proliferación y diferenciación celular (1,2).
La alteración genética más frecuente es la amplificación, que conduce a una sobre-expresión proteica, aunque no siempre la sobre-expresión proteica se debe a la amplificación génica (3). La amplificación y/o sobre-expresión de c-erbB-2 puede contribuir a una proliferación celular descontrolada y al desarrollo y progresión tumoral (4). El estudio de esta alteración puede hacerse mediante análisis genético o el estudio de la proteína. El análisis del gen se realiza, en la mayoría de los casos, mediante técnicas de hibridación in situ (FISH) y el estudio de la proteína frecuentemente mediante técnicas cualitativas como la inmunohistoquímica (IHQ). Se estudió la relación entre los resultados obtenidos por hibridación in situ y por inmunohistoquímica y se observó un porcentaje de concordancia del 92% (5). Esto permite comparar y confirmar los resultados obtenidos por ambas técnicas.
La amplificación y/o sobre-expresión de c-erbB-2 ha sido asociada con un peor pronóstico en tumores de mama (6,7), ovario (6) y estómago (8,9). La mayoría de los estudios del oncogén c-erbB2/neu en los tumores colorrectales se han realizado determinando la proteína p185 mediante técnicas inmunohistoquímicas, detectándose un porcentaje de sobre-expresión proteica entre un 35 y un 100% (10-12). En el carcinoma colorrectal existen muchas dudas acerca del significado pronóstico de este oncogén (13-16).
El objetivo de nuestro trabajo es realizar un estudio del valor pronóstico de la proteína p185 mediante técnicas de inmunohistoquímica (IHQ) en pacientes diagnosticados de carcinoma colorrectal.
PACIENTES Y MÉTODO
Pacientes
La población objeto de nuestro estudio comprende un total de 106 pacientes intervenidos quirúrgicamente por carcinoma colorrectal primario en el Servicio de Cirugía II del Hospital Clínico San Carlos de Madrid entre 1995 y 1998. Se trata de un estudio de cohortes prospectivo. Todos los pacientes fueron intervenidos por el mismo cirujano, realizándose una cirugía radical oncológica en función de la localización del tumor. La cirugía se definió como curativa cuando tras la resección no existía evidencia de tumor macroscópico residual. Según este criterio, en 84 pacientes (80%) se efectuó una resección curativa y en 22 pacientes (20%) se resecó el tumor primario con intención paliativa. Fueron excluidos de nuestro estudio los casos de carcinomas metacrónicos, las poliposis familiares y la enfermedad inflamatoria intestinal. Ninguno de los pacientes había recibido tratamiento neoadyuvante. Se obtuvo el consentimiento informado de los pacientes previo a la investigación, este proyecto fue valorado favorablemente por el comité de ética e investigación clínica de este hospital. El seguimiento clínico de los pacientes se realizó según el protocolo diseñado en nuestro servicio (17). Los tumores fueron estadificados según la clasificación de Dukes. Los pacientes con estadios B,C y D menores de 80 años recibieron quimioterapia adyuvante con 5-fluoracilo (5-FU) y leucovorín, lo que representa el 75% de la población estudiada.
Métodos
Procesamiento de las muestras
Durante el acto quirúrgico se recogió una muestra del tumor que se introdujo en formol para su posterior inclusión en parafina. El estudio anatomopatológico lo realizaron dos patólogos de forma independiente y especialmente para este estudio. Se comprobó que todas las muestras tumorales tenían más del 80% de células tumorales.
Determinación de la proteína p185 por inmunohistoquímica
La técnica de inmunohistoquímica se ha realizado en cortes de 7 mm de tejido incluido en parafina. En el análisis inmunohistoquímico se emplea el conjugado peroxidasa-antiperoxidasa. Las secciones de tejido son desparafinadas en xileno y, posteriormente, deshidratadas en etanol. En la recuperación antigénica se ha empleado un anticuerpo monoclonal de conejo frente a la proteína p185 de DAKO (K5206). Después de la incubación durante 30 minutos a temperatura ambiente con el anticuerpo primario se procede a la incubación con el anticuerpo secundario biotinilado y el complejo peroxidasa-antiperoxidasa. Los resultados del marcaje son visualizados después de incubar las secciones con hidrógeno peroxidasa al 0,02% y 0,6 mmol/l de diaminobenzidina en metanol durante 10 minutos a temperatura ambiente. Como control positivo se utilizó una sección de tejido tumoral de mama con sobre-expresión de p185 y como control negativo se incubó uno de los portas con PBS.
Para evaluar el valor pronóstico de la proteína p185 se distribuyó la determinación del porcentaje de células teñidas en citoplasma y/o membrana en percentiles y, mediante el modelo estadístico de riesgos proporcionales de Cox, se estableció el valor que mejor discriminaba en cuanto al riesgo de fallecer de los pacientes con cáncer colorrectal. Se consideró la determinación positiva cuando más del 20% de las células estaban teñidas en citoplasma y/o membrana.
Análisis estadístico
Las variables cualitativas se presentan con su distribución de frecuencias. Las variables cuantitativas se RESUMEN en su media, desviación estándar (DE) y rango. Se evaluó la asociación entre cualitativas con el test de c2 y, en el caso que más de un 25% de los esperados fuera menor de 5, por la prueba exacta de Fisher. Se estimaron las funciones de supervivencia global (SG) y de la supervivencia libre de enfermedad (SLE) por el método de Kaplan-Meier, y se compararon las funciones de supervivencia de los distintos grupos mediante el test exacto de Breslow. Se incluye como definición del evento en la SG aquellos fallecimientos producidos como consecuencia del tumor y quedando censurados los pacientes vivos y fallecidos por otra causa. La SG fue calculada como el tiempo transcurrido entre la fecha de la cirugía y la del éxitus o última revisión. En la SLE se define el evento como el diagnóstico de una recidiva locorregional o a distancia en pacientes previamente libres de enfermedad, es decir, en todos aquellos en los que se realiza cirugía curativa. La SLE fue calculada como el tiempo transcurrido entre la fecha de la cirugía y la del diagnóstico de la primera recidiva. Se ajustó un modelo de regresión de riesgos proporcionales de Cox para realizar la asociación de los factores pronóstico en el análisis univariante y multivariante. En todos los contrastes de hipótesis se rechazó la hipótesis nula con un error de tipo I menor a 0,05.
El paquete informático utilizado para el análisis fue SSPS para Windows versión 11.5.
RESULTADOS
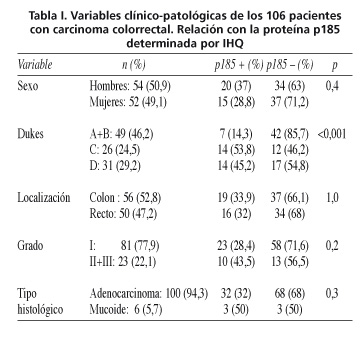
De los 106 pacientes del estudio el 50,9% son varones y el 49,1% mujeres. La edad media es de 69 años con un rango comprendido entre 35 y 91 años y una desviación estándar de 12. Las variables clínico-patológicas de la población se muestran en la tabla I. El 52,8% de los tumores estaban localizados en colon y el 47,2% en recto. El 5,7% son adenocarcinomas mucinosos.
El 33% de los pacientes (35/106) presentaban sobre-expresión de p185. La proteína se relaciona con el estadio tumoral; en estadios precoces el porcentaje de positividad de p185 es menor que en estadios avanzados (p < 0,001) (Tabla I).
Evolución postoperatoria. Estudio de la supervivencia global
La mediana del tiempo de seguimiento de nuestro estudio fue de 37 meses (3 años), con un rango intercuartílico entre 8 y 69 meses.
En nuestra población de pacientes la SG a los 3 años fue del 67%. Todos los análisis de supervivencia quedan referidos a nuestra mediana de seguimiento. Durante el seguimiento fallecieron 43 pacientes, 33 de los cuales como consecuencia de la neoplasia. En un paciente no se pudo determinar su evolución.
La SG de los pacientes con p185 negativa fue del 72% y con p185 positiva del 51% (p=0,08) (Fig. 1). En el análisis estratificado según la localización del tumor, en los tumores de recto con neu negativo la SG fue mayor (82%) que con neu positivo (62%) (p=0,05). Según el tipo histológico, en los tumores adenocarcinomas con p185 negativa la SG fue del 76%, mayor que con p185 positiva (53%) (p=0,09).
En el análisis multivariante se incluyeron las variables proteína p185, sexo, grado de diferenciación, estadios A, B y C y tipo histológico adenocarcinoma, excluyendo a los pacientes en estadio D en los cuales la información pronóstica tiene poco valor clínico, o con adenocarcinomas mucoides por representar el 5% de los tumores y tener una evolución más agresiva. Este análisis se ha realizado en los pacientes con tumores localizados en colon y en recto independientemente, ya que la SG es significativamente diferente en ambos grupos. En los tumores de recto, la proteína p185 no presentaba valor pronóstico independiente del resto de las variables. En los tumores localizados en colon, la determinación de p185 muestra importancia clínicamente relevante: el riesgo relativo de fallecer en los pacientes con sobre-expresión de la proteína es 3,9 veces mayor (p=0,06) (IC95%=0,9-16,4).
Evolución postoperatoria. Estudio de la supervivencia libre de enfermedad
En nuestra población de pacientes la SLE es del 75%. Durante el seguimiento se objetivó recidiva en 19 pacientes, incluyendo a los 8 pacientes con estadio D en los cuales se pudo realizar cirugía curativa. La localización de la recurrencia fue locorregional en 5 pacientes (26,3%) y a distancia en 14 pacientes (73,7%).
La SLE de los pacientes con p185 negativa es mayor (82%) que con p185 positiva (58%) (p = 0,02); el riesgo relativo de recidivar es 3,3 veces mayor en pacientes con sobre-expresión del neu (p = 0,03) (IC95%=1,2-10,0) (Fig. 2). En el análisis estratificado según la localización del tumor, en los tumores de colon con p185 negativa la SLE es mayor (83%) que con p185 positiva (54%) (p = 0,08). Según el tipo histológico, en los tumores adenocarcinoma con p185 negativa la SG es del 82%, mayor que con p185 positiva (56%) (p=0,01).
En el análisis multivariante de los pacientes con adenocarcinoma localizados en colon y con estadio A, B y C, la determinación de p185 presenta importancia clínica pero no es estadísticamente significativa: el riesgo relativo de recidivar en los pacientes con sobre-expresión de p185 es 3,3 veces mayor que con p185 negativa (p = 0,09) (IC95%=0,8-13,6).
DISCUSIÓN
La mayoría de los estudios del oncogén c-erbB2/neu en tumores colorrectales se han realizado determinando la sobre-expresión proteica mediante técnicas inmunohistoquímicas. Respecto a los criterios para considerar la positividad de la sobre-expresión del oncogén, parece que no existe un criterio unificado entre los autores. Esto hace que el porcentaje de la sobre-expresión de p185 en tumores colorrectales varíe entre un 35 y un 100% (10-12).
En relación con los factores pronóstico clásicos, la mayoría de los autores están de acuerdo en que no existe relación significativa entre la sobre-expresión de p185 y la edad y sexo del paciente, ni con la localización y tipo histológico del tumor (10-12). Numerosos estudios han mostrado que la sobre-expresión de c-erbB-2 puede predecir la evolución en distintos tumores humanos, como el cáncer de estómago (8,9) y el de mama (6,7). En el caso del cáncer colorrectal existen muchas dudas acerca del significado pronóstico de este oncogén (13-16). Mientras que autores como McKay y cols. (18), o Webb y cols. (19) indican que c-erbB2 no tiene significado pronóstico, otros como Kay y cols. (10), Kapitanovic y cols. (11), y Osako y cols. (12) describen a este oncogén como un factor pronóstico independiente en el cáncer colorrectal: la supervivencia global es significativamente menor en pacientes con sobre-expresión de c-erbB2/neu que en aquellos que no la presentan. Además parece que la sobre-expresión de p185 se relaciona con el estadio Dukes, de modo que pacientes en estadio Dukes A o B muestran una sobre-expresión significativamente menor (p<0,05) que los que se encuentran en estadio C o D (11).
En nuestro estudio consideramos que existía sobre-expresión de p185 cuando presentaban tinción en más del 20% de las células en citoplasma y/o membrana. Estos resultados están de acuerdo con la mayoría de los estudios en este y otros tumores (7,10,15). Aunque, p185 es un receptor transmembrana, detectamos esta proteína no sólo en la membrana celular, sino también en el citoplasma, debido a que es en este lugar donde se produce la modificación post-transcripcional (20).
El 33% de la población presentaba sobre-expresión de p185 y la frecuencia de esta sobre-expresión proteica es significativamente mayor en los estadios C y D, con respecto a estadios precoces, A y B, lo cual podría indicar que el oncogén c-erbB2 juega un papel importante en la progresión de la tumorogénesis colorrectal. En los adenocarcinomas de colon sin evidencia de metástasis a distancia en el momento del diagnóstico, la sobre-expresión de p185 aumenta cuatro veces el riesgo de fallecer; sin embargo, aunque esta asociación presenta importancia clínica, no es estadísticamente significativa.
Hay que tener en cuenta en la búsqueda de nuevos factores pronóstico biológicos que el pronóstico del cáncer colorrectal no sólo depende de factores clínicos, como el estadio, sino de aspectos tan puntuales como la experiencia del cirujano (21). Esto resta importancia a muchas series que, probablemente, no son representativas del tratamiento idóneo de la enfermedad. En este estudio se ha intentado eliminar dicho sesgo al incluir únicamente pacientes intervenidos por un mismo cirujano. Sin embargo, el diseño del estudio y el tamaño de la muestra hacen imposible extraer conclusiones de mayor significado clínico.
A pesar de que en nuestra serie de pacientes la proteína p185 presenta significado pronóstico clínico, este no llega a ser estadísticamente significativo. El estudio de la sobre-expresión del oncogén c-erbB2 neu en el cáncer colorrectal no tiene, hasta la actualidad, ninguna utilidad diferente que la de comprender mejor la biología tumoral y que la de abrir un camino en la búsqueda de opciones terapéuticas en modelos de experimentación.
BIBLIOGRAFÍA
1. Yamamoto T, Ikawa S, Akiyama T, et al. Similarity of protein encoded by the human c-erbB-2 gene to epidermal growth factor receptor. Nature 1986; 319: 230-4. [ Links ]
2. Hung MC, Lau YK. Basic science of HER-2/neu: a review. Semin Oncol 1999; 26: 51-9. [ Links ]
3. Lemoine LR, Jain S, Silvestre F, Lopes C, Hughes CM, McLelland E, et al. Amplifiaction and overexpression of the EGF receptor and c-erbB-2 proto-oncogenes in human stomach cancer. Br J Cancer 1991; 64: 79-83. [ Links ]
4. Klapper LN, Kirschbaum MH, Sela M, Yarden Y. Biochemical and clinical implications of the ErbB/HER signalling network of growth factor receptors. Adv Cancer Res 2000; 77: 25-79. [ Links ]
5. Bozzeti C, Nizzoli R, Guazzi A, Flora M, Bassano C, Crafa P, et al. HER-2/neu amplification detected by fluorescence in situ hybridization in fine needle aspirates from primary breast. Ann Oncol, 2002; 13: 1398-403. [ Links ]
6. Slamon DJ, Godolphin W, Jones LA, Holt JA, Wong SG, Keith DE, et al. Studies of the HER-2/neu proto-oncogene in human breast and ovarian cancer. Science 1989; 244: 707-12. [ Links ]
7. Gusteson BA, Price KN, Gelber RD, Goldhirsch A, Säve-Söderborgh AR, Styles J, et al. Prognostic importance of c-erbB-2 expression in breast cancer. J Clin Oncol 1992; 10: 1049-56. [ Links ]
8. Amadori D, Maltoni M, Volpi A, Nanni O, Scarpi E, Renault B, et al. Gene amplification and proliferative kinetics in relation to prognosis of patients with gastric carcinoma. Cancer 1997; 79: 226-32. [ Links ]
9. Yonemora Y, Ninomiya I, Tsugawa K, Fushida S, Fujimura T, Miyazaki I, et al. Prognostic significance of c-erbB-2 gene expression in the poorly differentiated type of adenocarcinoma of the stomach. Cancer Detect Prev 1998; 22: 139-46. [ Links ]
10. Kay EW, Mulcahy H, Walsh CB, Leader M, O'Donoghue D. Cytoplasmic c-erbB-2 protein expression correlates with survival in Dukes'B colorectal carcinoma. Histopathology 1994; 25: 455-61. [ Links ]
11. Kapitanovic S, Radosevic S, Kapitanovic M, Andelinovic S, Ferencic Z, Tavassolo M, et al. The expression of p185 HER-2/neu correlates with the stage of disease and survival in colorectal cancer. Gastroenterology 1997; 112: 1103-13. [ Links ]
12. Osako T, Miyahara M, Uchino S, Inomata M, Kitano S, Kobayashi M. Inmunohistochemical Study of c-erbB-2 protein in colorectal cancer and the correlation with patient survival. Oncology 1998; 55: 548-55. [ Links ]
13. Yokota J, Yamamoto T, Toyoshima K, Terada M, Sugimura T, Battifora H, et al. Amplification of c-erbB-2 oncogene in human adenocarcinomas in vivo. Lancet 1986; i: 765-6. [ Links ]
14. McCann A, Dervan PA, Johnston PA, Gullick WJ, Carney DN. c-erbB-2 oncoprotein expression in primary human tumors. Cancer 1990; 65: 88-92. [ Links ]
15. D'Emilia J, Bulovas K, D'Ercole B, Wolf B, Steele G Jr, Summerhayes IC. Expression of the c-erbB-2 gene product (p185) at different stages of neoplastic progression in the colon. Oncogene 1989; 4: 1233-9. [ Links ]
16. Ohmori K, Uchino J, Kondou Y, et al. Prediction of hepatic metastasis after resection of colorectal carcinoma-From the viewpoint of pathologic features. C-erbB-2 expression and nuclear DNA content. Jpn J Gastroenterol Surg 1991; 24: 2963-9. [ Links ]
17. Cerdán FJ. Seguimiento de los pacientes intervenidos por cáncer colorrectal. Rev Cancer 1997; 11: 32-41. [ Links ]
18. McKay JA, Loane JF, Ross VG, Ameyaw MM, Murray GI, Cassidy J. c-erbB-2 is not a major factor in the development of colorectal cancer. Br J Cancer 2002; 86: 568-73. [ Links ]
19. Webb A, Scott-Mackie P, Cunningham D, Norman A, Andreyev J, O'Brien M. The prognostic value of CEA, beta HCG, AFP, CA125, CA19-9 and C-erb B-2, beta HCG immunohistochemistry in advanced colorectal cancer. Ann Oncol 1995; 6: 581-7. [ Links ]
20. Corbett IP, Henry JA, Angus B, Watchorn CJ, Wilkinson L, Hennessi C, et al. NCLA-CB11, a new monoclonal antibody recognizing the internal domain of the c-erbB-2 oncoge protein effective for use on formalin-fixed, paraffin-embedded tissue. J Pathol 1990; 161: 15-25. [ Links ]
21. Cerdán J. Recidiva locorregional en el cáncer de recto. Cir Esp 2003; 73: 63-7. [ Links ]











 texto em
texto em