Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO  Similares em Google
Similares em Google
Compartilhar
Revista Española de Enfermedades Digestivas
versão impressa ISSN 1130-0108
Rev. esp. enferm. dig. vol.97 no.1 Madrid Jan. 2005
| TRABAJOS ORIGINALES |
Estudio piloto sobre la vigilancia endoscópica de la displasia y del cáncer colorrectal en la colitis ulcerosa de larga evolución
S. Khorrami Mashhadi, M. Trapero, J. P. Gisbert, E. Gómez Domínguez y J. Maté-Jiménez
Servicio de Aparato Digestivo. Hospital Universitario de La Princesa. Madrid
RESUMEN
Introducción: los pacientes con colitis ulcerosa (CU) tienen un mayor riesgo de desarrollar cáncer colorrectal (CCR) que la población general. La displasia epitelial precede a esta neoplasia por lo que se recomienda la vigilancia endoscópica de estos pacientes Este estudio piloto pretende determinar la incidencia de la displasia y del CCR en pacientes con CU de larga evolución en nuestro hospital.
Material y métodos: estudio prospectivo y observacional en pacientes con el diagnóstico firme de CU de más de 8 años de evolución a los que se propuso entrar en un programa de vigilancia endoscópica del CCR. A todos los enfermos se les sometió cada 18/24 meses a una colonoscopia con múltiples biopsias para detectar displasias epiteliales.
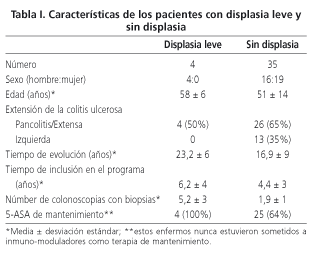
Resultados: se incluyeron 39 pacientes desde enero de 1994 hasta diciembre de 2003. La mitad de ellos eran varones. La edad media fue de 52 años (±13 años). La duración media de la CU fue de 15 ± 8 años. Trece (35%) enfermos sufrían una colitis izquierda y 26 (65%) una pancolitis o colitis extensa. Se detectó la presencia de displasia leve en 4 pacientes, en uno de ellos en dos ocasiones (13%, IC 95%: 6,1-33,5), la incidencia de displasia leve fue de 1,3% pacientes por año de vigilancia. No se detectaron displasias graves ni
CCRs.
Conclusión: la incidencia de displasia en nuestra área es menor que la esperada y no sustenta los programas de vigilancia en estos enfermos. Aunque por el pequeño número de pacientes no se pueden sacar conclusiones firmes.
Palabras clave: Displasia. Colitis ulcerosa. Carcinoma colorrectal. Enfermedad inflamatoria intestinal.
INTRODUCCIÓN
Los pacientes con colitis ulcerosa (CU) tienen un mayor riesgo de desarrollar cáncer colorrectal (CCR) que la población general, especialmente aquellos con una forma extensa y de larga evolución de la enfermedad (1). En un reciente metanálisis, la incidencia global del CCR en la CU se estima en 3 por 1.000 pacientes/año (2). En la colitis extensa y la pancolitis, el riesgo acumulado de esta complicación es del 2-5% por año en los primeros 10 años de evolución de la enfermedad, del 5-10% anuales durante la segunda década y del 12-20% por año a lo largo de la tercera década (2-5). La colitis izquierda presenta un aumento similar del riesgo de CCR, una década más tarde que en las formas más extensas (6,7). Actualmente, se acepta que la displasia constituye un estadio previo al desarrollo de CCR y su presencia en biopsias de la mucosa cólica, especialmente si es de alto grado, o si se asocia a lesiones o masas (DALM), predice la coexistencia de un carcinoma o una situación de alto riesgo (5,8). Con el fin de reducir la mortalidad por CCR en estos pacientes se recomienda la realización de colonoscopias periódicas con toma de numerosas biopsias para detectar displasia (9-11). En nuestro medio se desconoce la incidencia del CCR postcolítico y de la displasia, por lo que no queda probada la rentabilidad de esta estrategia.
Este trabajo pretende ser un estudio piloto que nos aproxime a la realidad y permita planificar otro prospectivo que determine la incidencia de la displasia y del CCR en pacientes con CU de larga evolución en España.
MATERIAL Y MÉTODOS
Se trata de un estudio piloto, prospectivo y observacional en pacientes con el diagnóstico firme de CU de larga evolución a los que se propuso entrar en un programa de vigilancia endoscópica del CCR.
Fuente y características de los pacientes
Los enfermos incluidos en el programa de vigilancia endoscópica del CCR postcolítico procedían de la consulta monográfica de enfermedad inflamatoria intestinal de nuestro hospital y habían firmado el consentimiento informado. Los datos demográficos de los enfermos están parcialmente recogidos en la tabla I. Un total de 39 pacientes fueron incluidos de forma consecutiva en el programa de vigilancia, desde enero de 1994 hasta diciembre de 2003. La relación H/M fue de 1 y la edad media de 52 ± 13 años. La duración media de la CU fue de 17,8 ± 8 años. La media del tiempo de inclusión en el programa fue de 4,6 ± 5 años y se realizaron una media de 2,5 ± 2 colonoscopias por paciente. Trece (35%) enfermos presentaban una colitis izquierda y 26 (65%) una pancolitis o colitis extensa.
Definiciones
Diagnóstico de CU: se estableció de acuerdo con hallazgos endoscópicos sugestivos (mucosa eritematosa, edematosa, ulcerada y con fragilidad vascular espontánea o por contacto) e histológicos compatibles y un seguimiento de más de 8 años.
Extensión de la CU: se determinó mediante la exploración endoscópica del colon durante un brote agudo de la enfermedad.
1. Pancolitis: la lesión sobrepasa el ángulo hepático del colon.
2. Colitis: extensa la lesión sobrepasa el ángulo esplénico sin sobrepasar el ángulo hepático.
3. Colitis izquierda: la lesión sobrepasa el recto sin sobrepasar el ángulo esplénico.
CU de larga evolución: se consideró como aquella de más de 8 años de evolución en el caso de la pancolitis y la colitis extensa, y de más de 10 años en la forma izquierda.
Displasia: se definió como la proliferación neoplásica de las células epiteliales de la mucosa cólica en remisión inflamatoria sin signos de invasión de la submucosa. El diagnóstico fue verificado por al menos dos anatomopatólogos de plantilla.
Grados de displasia: la displasia de bajo grado o leve se definió como aquella en la que la mayoría de los núcleos de las células neoplásicas se localizan en el polo inferior de las glándulas, mientras que la displasia de alto grado o grave es aquella en la que existía una mayor desestructuración celular.
Terapéutica de mantenimiento con 5-ASA: los enfermos sometidos a esta medicación tomaban un mínimo de 1,2 g de 5-ASA de forma indefinida, y desde su diagnostico y sólo interrumpida durante los periodos de tratamiento estereoideo.
Métodos
A todos los pacientes con el diagnóstico de CU de más de 8 años de evolución y extensión mayor a 15 cm, se les propuso someterse a vigilancia toda la mucosa del colon afectada por la enfermedad. Para descartar la presencia de displasia cólica y/o de carcinoma de colon asociado a CU, los pacientes que aceptaron entrar en el estudio fueron sometidos a una colonoscopia en periodos de remisión clínica de la enfermedad y cada 18-24 meses con toma de múltiples biopsias. El número total de biopsias osciló entre 25 y más de 30 en los enfermos con colitis extensa o pancolitis y de 10-15 en los enfermos con colitis izquierda. No se tomaron muestras de la mucosa que nunca estuvo afectada por la enfermedad. Estas muestras fueron revisadas por dos patólogos que determinaron la presencia de: displasia su grado y la de carcinoma. En la figura 1 se describe el manejo de los pacientes en función de los hallazgos endoscópicos e histológicos. En ausencia de displasia, los pacientes fueron sometidos a revisiones endoscópicas periódicas con toma de biopsias, cada 18-24 meses. En el caso de detectar displasia en el seno de una mucosa con signos endoscópicos e histológicos de inflamación, se indicaría la realización de una nueva exploración con toma de biopsias tras la remisión completa de la inflamación. En presencia de displasia leve sin signos de inflamación de la mucosa, se indicaría una nueva endoscopia con toma de muestras a los tres meses. En caso de displasia grave sin inflamación, se realizaría una nueva exploración con toma de biopsias 4 semanas después de la anterior. Por último, ante el hallazgo de displasia grave no asociada a inflamación en dos exploraciones consecutivas, el paciente sería remitido a cirugía para una pancolectomía profiláctica. La variable principal fue la aparición de displasia en el programa de vigilancia endoscópica. Otras variables evaluadas fueron la duración de la enfermedad, la presencia o no de actividad endoscópica en caso de que se detectase displasia, la regresión de la displasia tras la administración de tratamiento de mantenimiento con 5-ASA.
Análisis estadístico
Se realizó un estudio estadístico descriptivo, calculando la media y la desviación estándar para las variables cuantitativas, y el porcentaje y el intervalo de confianza del 95% (IC 95%) para las variables cualitativas. Se utilizó el paquete estadístico SPSS 11.0.
RESULTADOS
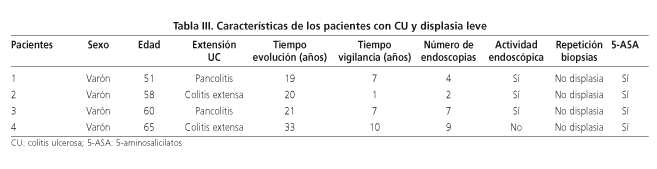
Se detectó la presencia de displasia leve en 4 pacientes, en uno de ellos en dos ocasiones separados por 5 años (13%, IC 95%: 6,1-33,5), la incidencia de displasia leve fue de 1,3% pacientes por año de vigilancia. No se detectaron displasias graves ni CCR. En la tabla I se resumen las características de los pacientes con y sin displasia leve en las biopsias de la mucosa cólica. De las 5 displasias leves detectadas, 4 (80%) se presentaban sobre una mucosa con signos endoscópicos de inflamación aguda, a pesar de que los pacientes carecían de síntomas sugerentes de brote agudo. En la tabla II se puede ver el rendimiento del protocolo de seguimiento de los enfermos afectados de CU de larga evolución. En la tabla III se muestran las características de los cuatro enfermos en los que se detectaron lesiones displásicas. No se expresan niveles de significación por que el escaso número de displasias encontradas hacen poco fiable cualquier resultado estadístico.
DISCUSIÓN
No se detectó ningún caso de carcinoma ni de displasia de alto grado en nuestros pacientes. Cabe destacar que todas las displasias leves menos una se observaron sobre una mucosa inflamada, a pesar de que los pacientes no presentaban sintomatología de brote agudo de enfermedad lo que hace sospechar que eran lesiones reactivas. Así mismo, todas ellas regresaron tras administrar tratamiento con dosis altas de 5-ASA entre uno y tres meses. No se observó una asociación o progresión de la displasia leve a displasia de alto grado o carcinoma. Estos resultados son acordes con la impresión clínica de que el CCR asociado a CU no es frecuente entre nuestros pacientes y discrepan de la experiencia acumulada por otros grupos (1-8).
Resulta difícil explicar la razón de estos sorprendentes resultados y podrían ser un sesgo derivado del reducido número de pacientes incluidos en el programa, agravado por el corto periodo de seguimiento. Así mismo, podrían intervenir otros factores como el alto porcentaje de pacientes en tratamiento con 5-ASA, que parece tener un efecto protector frente al desarrollo del CCR (9-17), o la diferente incidencia del CCR en la población general del área, que es menos de la mitad de la observada en otros países occidentales (18).
Aunque no dispongamos de otro método diagnóstico mejor en la práctica clínica, es posible que la incidencia de displasia entre los enfermos de colitis ulcerosa no sea representativa de la incidencia del carcinoma asociado a CU. El verdadero valor predictivo de la displasia leve en la detección del CCR es aún objeto de controversia. En los primeros estudios su utilidad parecía escasa, puesto que tan sólo un 16-29% de los casos progresaban a lesiones más agresivas (5,8,12). Con la unificación de los criterios histológicos, ha mejorado la especificidad de este marcador en la detección de lesiones malignas. Connell y cols. describieron un aumento de su valor predictivo desde un 16% inicial a un 54%, tras revisar 128 biopsias compatibles con displasia de bajo grado (12). Ullman y cols., tras 32 meses de seguimiento, al reevaluar las biopsias procedentes de 18 pacientes con CU de larga evolución y displasia leve, observaron una progresión de las lesiones en el 50% de los casos con una incidencia acumulada de displasia de alto grado o carcinoma del 33% a los 5 años (14). En un trabajo más reciente, el mismo autor describe una progresión de la displasia de bajo grado en un 30% de los pacientes, con una tasa de progresión del 53% a los 5 años (19). En cambio, otro trabajo detectó la progresión de la displasia leve en tan sólo un 10% de los casos tras revisar las biopsias de una cohorte de 128 pacientes vigilados durante 10 años (20).
Existe una gran variabilidad inter e intraobservador en el diagnóstico histológico de la displasia leve, con una concordancia entre patólogos expertos de tan sólo un 50-60% (21-22). Esto, añadido a la imposibilidad de biopsiar todo el colon, elevaría el número de falsos positivos, y lo que es más grave, de falsos negativos. Creemos que en nuestro programa de vigilancia, el número de biopsias tomadas y el tramo del colon explorado son suficientes. Dado que la displasia es parcheada (20), la American Gastroenterological Association (AGA), la American Society of Gastrointestinal Endoscopy (ASGE) y la British Society of Gastroenterology (12,23), recomiendan realizar una exploración completa del colon, independientemente de la extensión de la enfermedad, y tomar 2-4 biopsias cada 10 cm. Ello se traduce en mayores costes y molestias para el paciente. Además de que, la inmensa mayoría de los tumores y las lesiones premalignas se encuentran en los tramos más distales del colon y hasta el 25% de los carcinomas postcolíticos no se asocian a la presencia de displasia (19,24-27). Por todo ello, estas recomendaciones han sido clasificadas como "grado C", es decir, con tan sólo moderada evidencia respecto a su eficacia, donde los beneficios son muy similares a los perjuicios, lo que no aconseja su aplicación de forma generalizada (28).
Por lo que antecede y por tratarse de un pequeño estudio piloto nuestros resultados hay que tomarlos como una aproximación a la realidad. Para establecer la relación coste/beneficio de un programa de cribaje del carcinoma postcolítico habrá que realizar estudios amplios, prospectivos y multicéntricos con el fin de determinar la verdadera incidencia del CCR en la CU de larga evolución en nuestro medio.
AGRADECIMIENTOS
Este estudio ha sido financiado en parte por una beca concedida por el Instituto de Salud Carlos III (C03/02).
BIBLIOGRAFÍA
1. Langholz E, Munkholm P, Davidsen M, Binder V. Colorectal cancer risk and mortality in patients with ulcerative colitis. Gastroenterology 1992; 103: 1444-51. [ Links ]
2. Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut 2001; 48: 526-35. [ Links ]
3. Ekbom A, Helmick C, Zack M, Adami HO. Ulcerative colitis and colorectal cancer. A population-based study. N Engl J Med 1990; 323: 1228-33. [ Links ]
4. Gyde SN, Prior P, Allan RN, Stevens A, Jewell DP, Truelove SC, et al. Colorectal cancer in ulcerative colitis: a cohort study of primary referrals from three centres. Gut 1988; 29: 206-17. [ Links ]
5. Lennard-Jones JE, Melville DM, Morson BC, Ritchie JK, Williams CB. Precancer and cancer in extensive ulcerative colitis: findings among 401 patients over 22 years. Gut 1990; 31: 800-6. [ Links ]
6. Connell WR, Lennard-Jones JE, Williams CB, Talbot IC, Price AB, Wilkinson KH. Factors affecting the outcome of endoscopic surveillance for cancer in ulcerative colitis. Gastroenterology 1994; 107: 934-44. [ Links ]
7. Lindberg B, Persson B, Veress B, Ingelman-Sundberg H, Granqvist S. Twenty years' colonoscopic surveillance of patients with ulcerative colitis. Detection of dysplastic and malignant transformation. Scand J Gastroenterol 1996; 31: 1195-204. [ Links ]
8. Ullman TA, Loftus EV Jr., Kakar S, Burgart LJ, Sandborn WJ, Tremaine WJ. The fate of low grade dysplasia in ulcerative colitis. Am J Gastroenterol 2002; 97: 922-7. [ Links ]
9. Levin B. Risk of cancer in ulcerative colitis. Gastrointest Endosc 1999; 49: S60-2. [ Links ]
10. Nugent FW, Haggitt RC, Gilpin PA. Cancer surveillance in ulcerative colitis. Gastroenterology 1991; 100: 1241-8. [ Links ]
11. Bernstein CN, Shanahan F, Weinstein WM. Are we telling patients the truth about surveillance colonoscopy in ulcerative colitis? Lancet 1994; 343: 71-4. [ Links ]
12. Kornbluth A, Sachar DB. Ulcerative colitis practice guidelines in adults. American College of Gastroenterology, Practice Parameters Committee. Am J Gastroenterol 1997; 92: 204-11. [ Links ]
13. Eaden JA, Mayberry JF. Guidelines for screening and surveillance of asymptomatic colorectal cancer in patients with inflammatory bowel disease. Gut 2002; 51 (Supl. 5): V10-2. [ Links ]
14. Provenzale D, Onken J. Surveillance issues in inflammatory bowel disease: ulcerative colitis. J Clin Gastroenterol 2001; 32: 99-105. [ Links ]
15. Pinczowski D, Ekbom A, Baron J, Yuen J, Adami HO. Risk factors for colorectal cancer in patients with ulcerative colitis: a case-control study. Gastroenterology 1994; 107: 117-20. [ Links ]
16. Eaden J, Abrams K, Ekbom A, Jackson E, Mayberry J. Colorectal cancer prevention in ulcerative colitis: a case-control study. Aliment Pharmacol Ther 2000; 14: 145-53. [ Links ]
17. Ryan BM, Russel MG, Langholz E, Stockbrugger RW. Aminosalicylates and colorectal cancer in IBD: a not-so bitter pill to swallow. Am J Gastroenterol 2003; 98: 1682-7. [ Links ]
18. Registro de Cáncer de Navarra. Sección de enfermedades no transmisibles y estadísticas vitales. Incidence and mortality of cancer in Navarra, 1993-1997. Tendencies in the last 25 years. An Sist Sanit Navar 2001; 24: 339-62. [ Links ]
19. Ullman TA, Croog V, Harpaz N, Sachar DB, Itzkowitz S. Progresion of flat low-grade dysplasia to advanced neoplasia in patients with ulcerative colitis. Gastroenterology 2003; 125: 1311-9. [ Links ]
20. Rubin CE, Haggitt RC, Burmer GC, Brentnall TA, Stevens AC, Levine DS, et al. DNA aneuploidy in colonic biopsies predicts future development of dysplasia in ulcerative colitis. Gastroenterology 1992; 103: 1611-20. [ Links ]
21. Eaden J, Abrams K, McKay H, Denley H, Mayberry J. Inter-observer variation between general and specialist gastrointestinal pathologists when grading dysplasia in ulcerative colitis. J Pathol 2001; 194: 152-7. [ Links ]
22. Lim CH, Dixon MF, Vail A, Forman D, Lynch DA, Axon AT. Ten year follow up of ulcerative colitis patients with and without low grade dysplasia. Gut 2003; 52: 1127. [ Links ]
23. The role of colonoscopy in the management of patients with inflammatory bowel disease. Gastrointest Endosc 1998; 48: 689-90. [ Links ]
24. Prior P, Gyde SN, Macartney JC, Thompson H, Waterhouse JA, Allan RN. Cancer morbidity in ulcerative colitis. Gut 1982; 23: 490-7. [ Links ]
25. Slater G, Greenstein AJ, Gelernt I, Kreel I, Bauer J, Aufses AH Jr. Distribution of colorectal cancer in patients with and without ulcerative colitis. Am J Surg 1985; 149: 780-802. [ Links ]
26. Choi PM. Predominance of rectosigmoid neoplasia in ulcerative colitis and its implication on cancer surveillance. Gastroenterology 1993; 104: 666-7. [ Links ]
27. Connell WR, Talbot IC, Harpaz N, Britto N, Wilkinson KH, Kamm MA, et al. Clinicopathological characteristics of colorectal carcinoma complicating ulcerative colitis. Gut 1994; 35: 1419-23. [ Links ]
28. Harris R, Helfand M, Woolf S, Lohr K, Mulrow C, Teutsch S, et al. for the Methods Work Group, Third U.S. Preventive Services Task Force. Current methods of the U.S. Preventive Services Task Force: a review of the process. Am J Prev Med 2001; 20: 21-35. [ Links ]











 texto em
texto em