Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Española de Enfermedades Digestivas
versão impressa ISSN 1130-0108
Rev. esp. enferm. dig. vol.106 no.4 Madrid Abr. 2014
Hiperplasia nodular regenerativa hepática y linfoma cutáneo de células T: una asociación no descrita
Nodular regenerative hyperplasia of the liver and cutaneous T-cell lymphoma: An unreported association
Verónica Ciria Bru1, Álvaro Giráldez Gallego1, Diego Pascual Vaca Gómez2, Teresa Zulueta Dorado2 y Verónica Nacarino Mejías3
1Unidad de Gestión Clínica de Aparato Digestivo. Sección de Hepatología
2Servicio de Anatomía Patológica
3Servicio de Radiodiagnóstico. Sección de Radiología Vascular e Intervencionista.
Hospitales Universitarios Virgen del Rocío. Sevilla
Dirección para correspondencia
RESUMEN
La hiperplasia nodular regenerativa hepática -una modalidad de hipertensión portal no cirrótica- es una enfermedad poco frecuente de etiopatogenia desconocida que se ha asociado a multitud de trastornos diversos, incluyendo enfermedades hematológicas de distinta índole. Presentamos el caso de una paciente de 36 años diagnosticada de linfoma cutáneo de células T, tipo micosis fungoide, estadio T2N0M0B0, en la que una biopsia por vía transyugular demostró la existencia de una hiperplasia nodular regenerativa con gradiente de presión venosa hepática de 15 mm Hg; el detonante del estudio fue la aparición radiológica de una hepatomegalia incidental con datos indirectos de hipertensión portal.No nos consta que la asociación entre hiperplasia nodular regenerativa y micosis fungoide esté descrita en la literatura médica.
Palabras clave: Hiperplasia nodular regenerativa. Linfoma cutáneo de células T. Vitamina A. Micosis fungoide.
ABSTRACT
Nodular regenerative hyperplasia of the liver -a type of non-cirrhotic portal hypertension- is a rare condition of unknown etiopathogenesis that has been associated with multiple disorders, including diverse types of hematologic disease. We report the case of a 36-year-old female patient diagnosed with cutaneous T-cell lymphoma of the mycosis fungoides variety, staged as T2N0M0B0, where a transjugular liver biopsy demonstrated the presence of nodular regenerative hyperplasia with a hepatic venous pressure gradient of 15 mm Hg. The study was triggered by the incidental radiologic finding of hepatomegaly with indirect evidence of portal hypertension. We are not aware of any previous reports on the association of nodular regenerative hyperplasia with mycosis fungoides in the medical literature.
Key words: Nodular regenerative hyperplasia. Cutaneous T-cell lymphoma. Vitamin A. Mycosis fungoides.
Introducción
Los linfomas cutáneos primarios -de estirpe T o B- son, tras los gastrointestinales, los segundos más frecuentes de los no-Hodgkin extraganglionares, con una incidencia anual estimada de 1/100.000. La micosis fungoide y el síndrome de Sézary son dos entidades que constituyen las variantes más comunes de linfoma cutáneo de células T (LCCT). Su pronóstico depende no solo del tipo y extensión de las lesiones cutáneas sino también de la afectación extracutánea, para la que, en consecuencia, también se recomienda confirmación histológica; la afectación hepatoesplénica constituye, no obstante, una excepción a esta norma puesto que suele manifestarse en forma de nódulos en las pruebas de imagen y la biopsia no es, por lo tanto, imprescindible (1,2).
La hiperplasia nodular regenerativa (HNR) es una de las categorías englobadas dentro del síndrome conocido como hipertensión portal no cirrótica (HPNC), para el que es necesario la ausencia de una trombosis venosa del eje esplenoportal y la exclusión de una causa clásica de enfermedad hepática (3). En la HNR, por definición,la fibrosis es mínima o está ausente. Se trata de una condición poco frecuente en el mundo occidental que se ha relacionado con multitud de trastornos (infecciosos, genéticos y autoinmunes), con diversos estados de inmunodeficiencia y con la exposición a un amplio número de fármacos y tóxicos. En ocasiones, diferentes posibles etiologías están presentes de forma simultánea en un mismo caso. La asociación de HNR con enfermedades hematológicas de distinta naturaleza también está ampliamente documentada, postulándose especialmente en estos casos un estatus trombofílico subyacente, solo en ocasiones manifiesto, como factor etiopatogénico fundamental (4). Sin embargo, la asociación entre HNR y LCCT no nos consta que esté descrita en la literatura médica.
Caso clínico
Una mujer de 36 años fue enviada a nuestras consultas por Dermatología y Hematología para estudio de una hepatomegalia radiológica incidental. Desde aproximadamente tres años antes, la paciente presentaba lesiones cutáneas de aspecto eccematoso, en placas, algunas de ellas pigmentadas, eritemato-descamativas, poco pruriginosas y circulares, que abarcaban la práctica totalidad del tronco y miembros superiores e inferiores. Había sido sometida a dos biopsias cutáneas previas, con resultados inespecíficos (focos de paraqueratosis, mínimo infiltrado linfocitario perivascular superficial -con presencia de eosinófilos- y leve hiperplasia epidérmica), habiéndose sugerido los diagnósticos de eccema crónico -quizá por proceso atópico de contacto- vs. pitiriasis rosada atípica; había sido tratada básicamente con distintas modalidades de corticoides tópicos. Cuatro meses antes de nuestra primera visita fue finalmentediagnosticada de un LCCT, tipo micosis fungoide. En esta ocasión la biopsia cutánea mostró un denso infiltrado inflamatorio linfocitario dérmico superficial, con mínima exocitosis en epidermis pero manifiesta en bulbo piloso; el inmunofenotipo del componente linfocitario fue predominantemente CD3/CD4 sobre CD8, con escasa representación CD20; el índice mitótico (ki-67) fue del 25-30 %. Se realizó amplificación del segmento VJ de la región hipervariable del gen TCR-γ (T cell receptor-gamma) a través de PCR con cebadores específicos y sucesivos análisis de fragmentos, usando el secuenciador ABI Prism® 3730 (Applied Biosystems, Foster City, CA, USA) y utilizando el kit comercial MAD-003994TP-2/5® (Master Diagnóstica, Granada, España). La muestra analizada contenía una celularidad tumoral mayor del 70 % y una cantidad de ADN de 21,2 ng/μl. Se confirmó un reordenamiento monoclonal específico de la línea T: el material analizado mostró un fragmento de amplificación del tamaño de 156 pares de bases.
En el momento de la confirmación diagnóstica del LCCT la paciente estaba embarazada de 26 semanas, lo que limitaba las posibilidades terapéuticas. Como parte del estadiaje se programó una TC con contraste i.v., que igualmente hubo de ser retrasada hasta el parto, que detectó una hepatomegalia homogénea sin lesiones ocupantes de espacio como única alteración significativa. El estadio al diagnóstico se estableció como T2 (afectación de más del 10 % de la superficie corporal), N0, M0 (ausencia de infiltración linfomatosa en ganglios u otros órganos), B0 (una citofluorometría no mostró alteraciones en los linfocitos T ni alteraciones en el cociente CD4/CD8 y el frotis de sangre periférica fue normal). En nuestra primera visita la paciente había finalizando un ciclo de 24 sesiones de fototerapia con radiación ultravioleta B (dosis acumulada de 19.804 MJ), con mejoría significativa. Por lo demás, se encontraba asintomática, no había adenopatías ni masas abdominales palpables ni estigmas de hepatopatía crónica en la inspección general. El índice de masa corporal era de 20,6 kg/m2. El hemograma fue normal en sus tres series y los parámetros habituales mostraron una función hepática rigurosamente conservada. Las enzimas hepáticas fueron normales. Las serologías para los virus B y C de la hepatitis fueron negativas así como los autoanticuerpos asociados a enfermedad hepática. No había sobrecarga férrica ni alteraciones en el proteinograma ni en la inmunoelectroforesis.
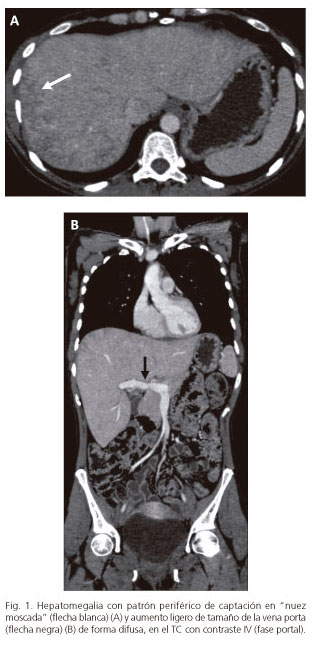
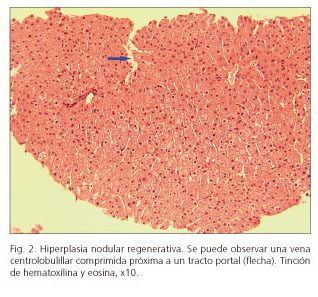
A los tres meses de suspender la fototerapia la paciente presentó una severa recurrencia de las lesiones cutáneas por lo que comenzó tratamiento con bexaroteno (150 mg/m2: 225 mg diarios, ajustados a su superficie corporal [1,6 m2]), tiroxina (25 μg diarios), fenofibrato (180 mg diarios) y triglicéridos omega-3 (1.000 mg diarios) junto con la asociación de psoraleno con radiación ultravioleta A (PUVA). De forma simultánea, se le repitió la TC con contraste i.v., en la que comparativamente aparecieron datos de hipertensión portal (HTP) radiológica (porta aumentada de calibre y esplenomegalia) que no estaban descritos previamente; persistía la hepatomegalia pero esta vez con visualización de un patrón periférico de captación en "nuez moscada" que sugería la posibilidad de una enfermedad venooclusiva hepática (Fig. 1). En esta situación se realizó una biopsia hepática transyugular con medición simultáneade presiones enclavada (25 mm Hg) y libre (10 mm Hg) en suprahepáticas: gradiente de presión venosa hepática (GPVH) resultante de 15 mm Hg. Para este procedimiento no se realizó ningún tipo de sedación. Se analizaron histológicamente cinco fragmentos de tejido hepático de tamaños oscilantes entre 5 y 10 mm: existía una distorsión de la arquitectura con alteración de la relación de las venas centrales con tractos portales y ausencia de fibrosis (Fig. 2).
No se documentaron varices esofagogástricas ni otras manifestaciones de la HTP en la endoscopia oral. Una ecografía abdominal no mostró datos de esteatosis. La rigidez hepática medida por elastometría de transición (ET) mostró un resultado de 6,1 kilopascales (kPa) con un rango intercuartílico de 0,8 kPa. La excrección urinaria de Na/K obtenida en situación basal fue de 132/141 mmol/24 horas. No se encontraron alteraciones dignas de mención en un completo estudio de hipercoagulabilidad que incluyó determinaciones de antitrombina III, proteínas C y S, homocisteína, anticuerpos antifosfolípidos y de las mutaciones del gen de la protrombina y del factor V Leiden. Han transcurrido ya seis meses desde el diagnóstico de HNR sin aparición de complicaciones.
Discusión
La distorsión hepática en la HNR se produce como consecuencia de una transformación difusa del parénquima en nódulos de regeneración (monoacinares y menores de 3 mm), con hiperplasia central, que alternan con áreas de atrofia tisular; característicamente, a diferencia de lo que sucede en la cirrosis, los nódulos no están separados por fibrosis (5). La hipótesis más aceptada con respecto a su génesis considera la HNR una consecuencia de la adaptación tisular generalizada (hepatocitos hiperplásicos y/o atrofia) a la interrupción y/o distribución heterogénea del flujo sanguíneo, secundaria a la obliteración, estrechamiento luminal y destrucción de las pequeñas venas portales (de hasta 0,2 mm de diámetro). Independientemente del trastorno subyacente, la lesión histológica unificadora, pues, para la HNR, es la venopatía portal obliterante (6) -sin fibrosis septal signiticativa-, probablemente asociada a un estatus basal protrombótico (7). Estas alteraciones, no obstante, no son patognomónicas y están presentes en otras entidades emparentadas con la HNR (8). El comportamiento clínico de la HNR es generalmente silente, cursando con largos periodos asintomáticos, sin alteraciones analíticas ni radiológicas específicas. No obstante, la mayoría de los pacientes (50-70 %) presentan finalmente y de forma irreversible signos o complicaciones de la HTP. La ascitis es peculiarmente poco frecuente y el pronóstico no es tan malo como en la cirrosis hepática, probablemente porque la función hepática está generalmente conservada hasta fases finales de la enfermedad. Por lo demás, las recomendaciones respecto a la profilaxis y el tratamiento de las manifestaciones clínicas de la HTP son similares a las establecidas para la de los pacientes con cirrosis (3). En consecuencia, en la práctica clínica habitual, es necesario tener un alto nivel de sospecha sobre esta entidad, para la que la confirmación histológica se considera imprescindible. Sin embargo, en la práctica clínica, la diferenciación entre HNR y cirrosis hepática puede ser compleja en especímenes de biopsia hepática obtenidos de forma convencional (5). En nuestro caso no se pudo determinar el tamaño ni el número de los nódulos de la muestra, al tratarse de cilindros de tejido hepático y no de una biopsia en cuña. Por otra parte, no existía infiltrado linfocitario en el parénquima hepático estudiado de forma que no procedió realizar el estudio de reordenamiento TCR-γ; esta técnica permite diagnosticar hasta el 95 % de los procesos linfoproliferativos T (9).
El patrón hemodinámico característico de los pacientes con HNR es predominantemente presinusoidal, con GPVH normal o ligeramente elevado, encontraste con los pacientes con cirrosis e HTP que presentan generalmente un GPVH elevado. Bissonnette y cols. (10) demostraron que el GPVH era menor de 10 mm Hg (umbral para la HTP clínicamente significativa) en 15 de 21 pacientes con HNR -con varices o ascitis- sometidos a mediciones de la presión venosa hepática enclavada y libre. En cambio, encontraron una cifra de presión venosa portal de más de 12 mm Hg en el 100 % de los 12 casos en los que se realizó dicha medición directa. No obstante, el componente presinusoidal (por venopatía obliterante) no es el único capazde explicar la HTP en los pacientes con HNR: puede existir compresión sinusoidal directa por los nódulos de regeneración. Algunos autores (11) postulan un componente mixto (presinusoidaly sinusoidal) en la HPNC pudiendo depender el resultado de la medición de las presiones del mecanismo predominante en cada caso y/o del momento evolutivo de la enfermedad: 6 de los 21 (28,6 %) pacientes del estudio de Bissonnette y cols. tenían un GPVH mayor de 10 mm Hg, algunos de ellos sin varices esofágicas, como en nuestro caso. Recientemente, han aparecido publicados datos prometedores sobre la capacidad de la ET para discriminar entre cirrosis hepática y la HPNC (12): Seijo y cols. estudian mediante determinación del GPVH y ET a una cohorte de 27 pacientes con HPNC (7,1 ± 3,1 mm Hg y 8,4 ± 3,3 kPa, respectivamente) y comparan sus datos con los de una cohorte de cirróticos con HTP (17,0 ± 3,0 mm Hg y 40,9 ± 20,5 kPa, respectivamente), encontrando diferencias estadísticamente significativas en ambos casos. Solo 5/27 (18,5 %) pacientes con HPNC presentaron un GPVH mayor de 10 mm Hg y sólo dos pacientes una cifra de rigidez hepática mayor de 13,6 kPa. En consecuencia, en los pacientes con signos inequívocos de HTP, unas cifras de GPVH y/o de rigidez hepática inferiores a las consideradas significativas para la cirrosis deben hacer sospechar alguna de las entidades de las que forman parte del complejo sindrómico de la HPNC.
En definitiva, la HNR (al igual que otras formas de HPNC) es una entidad de pronóstico serio, probablemente infradiagnosticada y que tiende a confundirse con la cirrosis hepática. Las herramientas diagnósticas de las que disponemos son la biopsia, el estudio hemodinámico hepático y, recientemente, la ET, pero la enfermedad puede manifestarse con un amplio espectro de datos inespecíficos e, incluso, en ocasiones, aparentemente contradictorios. La descripción de la asociación de la HNR con nuevas entidades (como en nuestro caso, con un LCCT) puede promover el conocimiento de esta enfermedad aún tan misteriosa, sobre cuya etiopatogenia todas las teorías entran en el terreno de la conjetura. Su tratamiento es actualmente el genérico de la HTP, pero la hipótesis de que el tratamiento anticoagulante puede ser beneficioso es francamente atractiva (3).
![]() Dirección para correspondencia:
Dirección para correspondencia:
Álvaro Giráldez Gallego
Unidad de Gestión Clínica de Aparato Digestivo
Hospitales Universitarios Virgen del Rocío
Avda. Manuel Siurot, s/n
41013 Sevilla
e-mail: giraldezg@hotmail.com
Recibido: 31-10-2013
Aceptado 27-01-2014
Bibliografía
1. Willemze R, Dreyling M; ESMO Guidelines Working Group. Primary cutaneous lymphoma: ESMO clinical recommendations for diagnosis, treatment and follow-up. Ann Oncol 2009;20:115-8. [ Links ]
2. Olsen EA, Whittaker S, Kim YH, Duvic M, Prince HM, Lessin SR, et al. Clinical end points and response criteria in mycosis fungoides and Sézary syndrome: A consensus statement of the International Society for Cutaneous Lymphomas, the United States Cutaneous Lymphoma Consortium and the Cutaneous Lymphoma Task Force of the European Organisation for Research and Treatment of Cancer. J Clin Oncol 2011;29:2598-607. [ Links ]
3. Schouten JN, Garcia-Pagan JC, Valla DC, Janssen HL. Idiopathic noncirrhotic portal hypertension. Hepatology 2011;54:1071-81. [ Links ]
4. Wanless IR, Godwin TA, Allen F, Feder A. Nodular regenerative hyperplasia of the liver in hematologic disorders: a possible response to obliterative portal venopathy. A morphometric study of nine cases with an hypothesis on the pathogenesis. Medicine (Baltimore) 1980;59:367-79. [ Links ]
5. Steiner PE. Nodular regenerative hyperplasia of the liver. Am J Pathol 1959;35:943-53. [ Links ]
6. Cazals-Hatem D, Hillaire S, Rudler M, Plessier A, Paradis V, Condat B, et al. Obliterative portal venopathy: Portal hypertension is not always present at diagnosis. J Hepatol 2011;54:455-61. [ Links ]
7. Bayan K, Tüzün Y, Yilmaz S, Canoruc N, Dursun M. Analysis of inherited thrombophilic mutations and natural anticoagulant deficiency in patients with idiopathic portal hypertension. J Thromb Thrombolysis 2009;28:57-62. [ Links ]
8. Verheij J, Schouten JN, Komuta M, Nevens F, Hansen BE, Janssen HL, et al. Histological features in western patients with idiopathic non-cirrhotic portal hypertension. Histopathology 2013;62:1083-91. [ Links ]
9. Yang H, Xu C, Tang Y, Wan C, Liu W, Wang L. The significance of multiplex PCR/heteroduplex analysis-based TCR-gamma gene rearrangement combined with laser-capture microdissection in the diagnosis of early mycosis fungoides. L Cutan Pathol 2012;39:337-46. [ Links ]
10. Bissonnette J, Généreux A, Côté J, Nguyen B, Perrealt P, Bouchard L, et al. Hepatic hemodynamics in 24 patients with nodular regenerative hyperplasia and symptomatic portal hypertension. J Gastroenterol 2012;27:1336-40. [ Links ]
11. Duseja A, Chawla Y. Portal hypertension in nodular regenerative hyperplasia: A mixed bag! J Gastroenterol Hepatol 2012;27:1260-2. [ Links ]
12. Seijo S, Reverter E, Miquel R, Berzigotti A, Abraldes JG, Bosch J, et al. Role of hepatic vein catheterisation and transient elastography in the diagnosis of idiopathic portal hypertension. Dig Liver Dis 2012;44:855-60. [ Links ]











 texto em
texto em