Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.37 no.5 Toledo Set./Out. 2013
https://dx.doi.org/10.7399/FH.2013.37.5.703
CASOS CLÍNICOS
Toxicodermia por bendamustina: elaboración de un protocolo de desensibilización
Toxicodermia by bendamustine: development of a desensization protocol
C. Sangrador Pelluz1, M. M. Luis Hidalgo2, M. Martínez García3, M. D. Pérez-Serrano Lainosa1 y E. Soler Company1
1 Servicio de Farmacia.
2 Servicio de Hematología.
3 Servicio de Alergología. Hospital Arnau de Vilanova. Valencia. España.
Dirección para correspondencia
Las toxicodermias o reacciones cutáneas adversas provocadas por medicamentos son dermatosis que pueden afectar a la piel, mucosas o anexos cutáneos por la administración de un medicamento ya sea por vía tópica, oral o parenteral. La frecuencia de dichas reacciones se basa habitualmente en reportes de casos y en estudios retrospectivos que únicamente permiten establecer una estimación, no existiendo por tanto datos epidemiológicos de su prevalencia.1
Desde el punto de vista patogénico las toxicodermias pueden subdividirse en: reacciones inmunológicas (mediadas por mecanismos de hipersensibilidad tipo I y IV) y no inmunológicas (sobredosificación, teratogenicidad, interacciones o acumulación).1
Las manifestaciones cutáneas representan un 30% de las reacciones adversas a medicamentos, aunque sólo el 10% son debidas a verdaderos mecanismos alérgicos (inmunológicos).1,2
Los principales factores predisponentes a dichas reacciones son el sexo femenino, la polimedicación, la obesidad, la predisposición genética, las enfermedades subyacentes (principalmente neoplasias), las infecciones virales (VIH, hepatitis y citomegalovirus), la exposición solar y la vía de administración.1,2
En el tratamiento con bendamustina, las reacciones de hipersensibilidad (RHS) son reacciones adversas frecuentes (9-16% casos) que en ocasiones pueden dificultar la administración óptima del mismo. Los síntomas suelen ser leves e incluyen fiebre, escalofríos, prurito y erupciones cutáneas. Sin embargo, en los ensayos clínicos un 3% de los casos experimentaron RHS de grado 3 o superior a los que no se les volvió a aplicar el tratamiento.3-5
La combinación de Rituximab-Bendamustina es en la actualidad uno de los tratamientos estándar para pacientes con leucemia linfática crónica (LLC) en recaída o refractarios a tratamientos previos.6,7
Los protocolos de desensibilización (PD) tienen el objetivo de alcanzar una tolerancia temporal al fármaco por parte del paciente, permitiendo así su administración. Consisten en la reintroducción gradual de pequeñas cantidades del fármaco causante de la RHS hasta alcanzar la dosis terapéutica total durante periodos de tiempo prolongados (4-12h).8
A continuación se describe un protocolo de desensibilización (PD) a bendamustina en paciente con reacción tóxica dérmica grave a dicho citostático.
Descripción del caso
Varón de 55 años diagnosticado en 2006 de LLC que recibió tratamiento inmunoquimioterápico en 2008 con Rituximab-Ciclofosfamida-Fludarabina alcanzando respuesta parcial. En 2011 se evidenció progresión de enfermedad e inició tratamiento de segunda línea con Rituximab 375mg/m2 día 1 del ciclo y Bendamustina 90 mg/m2 días 1 y 2 cada 28 días. Transcurridas 4 horas de la administración del día 1 del segundo ciclo inmunoquimioterápico, el paciente acudió a Urgencias presentando sensación distérmica, fiebre de 38oC y reacción urticariforme con prurito y eritrodermia descamativa en más del 50% de la superficie corporal que persistió 15 días. Se decidió la realización de pruebas cutáneas con bendamustina ante la posibilidad de que se tratase de una reacción alérgica a dicho citostático. La solución madre utilizada fue bendamustina 2,5mg/ml, realizándose diluciones 1/10, 1/100, 1/1000 y 1/10000 para administración intradérmica.
Dada la buena tolerancia previa al rituximab durante 6 ciclos, se asoció la reacción cutánea a la bendamustina. La toxicodermia fue clasificada de grado 4 según la Common Toxicity Criteria (versión 4.0)9 y notificada mediante la tarjeta amarilla al Sistema Español de Farmacovigilancia. Las pruebas cutáneas realizadas resultaron negativas para todas las diluciones. Sin embargo, tras la valoración del beneficio/riesgo entre la gravedad de la toxicodermia y el potencial beneficio del tratamiento con bendamustina, se decidió elaborar un PD para la administración de los siguientes ciclos de bendamustina.
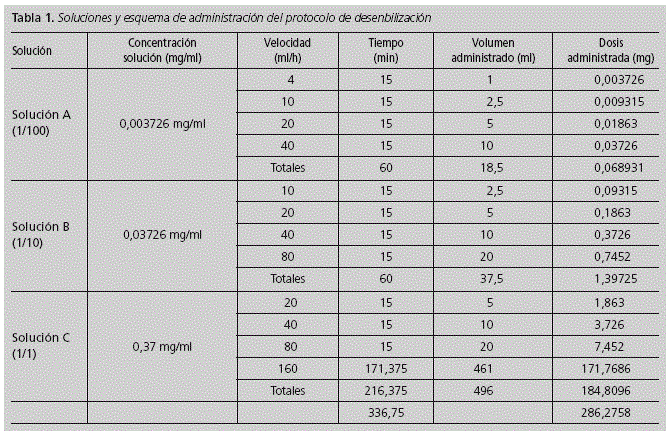
El PD consistió en 12 etapas para la administración de la dosis total del fármaco (186,3mg). El protocolo consistió en ir aumentando de forma progresiva la velocidad de infusión y la concentración del fármaco, hasta alcanzar la dosis terapéutica total. Se prepararon 3 soluciones A, B, y C de las diluciones 1/100, 1/10 y 1/1 respectivamente. Cada una de las soluciones se utilizó durante cuatro pasos, incrementando la velocidad de infusión cada quince minutos, de manera que con cada paso se administraba el doble que en el paso anterior. En el último paso se mantuvo la velocidad constante hasta completar la administración de la dosis total definida. En la tabla 1 se resumen las soluciones y el esquema de administración del protocolo de desensibilización.
La administración se realizó en la planta de Hematología bajo supervisión médica, con una duración total de 5 horas y 37 minutos. El paciente recibió 6 ciclos de inmunoquimioterapia con bendamustina mediante dicho PD con discreto prurito cutáneo pero sin complicaciones graves.
Comentario
La RHS fue clasificada como RHS no inmediata dado que transcurrió un tiempo de latencia de cuatro horas.
El diagnóstico de neoplasia hematológica, la polimedicación y la presencia de anticuerpos antihepatitis B positivos presentados en el caso de nuestro paciente han sido definidos por algunos autores como factores predisponentes a padecer reacciones tóxicas dérmicas1,2. Además, también se ha asociado una mayor incidencia de reacciones inmunológicas en el uso concomitante con rituximab, hecho que tuvo lugar en nuestro caso, aunque el paciente había recibido previamente 6 ciclos con rituximab con excelente tolerancia.3
Actualmente, no existen publicaciones acerca del empleo de pautas de desensibilización con bendamustina en pacientes con RHS previas, siendo la suspensión de la bendamustina y el cambio de tratamiento la actitud terapéutica usual.
El establecimiento de un PD por parte de los servicios de alergia, hematología y farmacia, permitió en este paciente la administración del tratamiento quimioteràpico de primera elección de manera completa y segura.
Bibliografía
1. Ramírez Boscá A, Navarro Belmonte R, Molina Gil C. Toxicodermias. Erupciones cutáneas por fármacos. Pediatr Integral. 2004;8: 243-9. [ Links ]
2. Campos-Fernández MM, Ponce-de-León-Rosales S, Archer-Dubon C, Orozco-Topete R. Incidence and risk factors for cutaneous adverse drug reactions in an intensive care unit. Rev. Invest. Clín. (online). 2005 Dic (citado 2013 Jun 15) ;57: 770-74. Disponible en: HYPERLINK " http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0034-83762005000600002&lng=es»http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0034-83762005000600002&lng=es. [ Links ]
3. Alamdari HS, Pinter-Brown L, Cassarino DS, Hiu MW. Severe cutaneous interface drug eruption associated with bendamustine. Dermatol Online J. 2010;16:1. [ Links ]
4. Agencia Española del Medicamento y Productos Sanitarios: Levact 2,5mg/ml: Ficha técnica (consultado 12 Mayo 2013). Disponible en: HYPERLINK http://www.aemps.gob.es/cima/especialidad.do?metodo=verFichaWordPdf&codigo=72571&formato=pdf&formulario=FICHAS&file=ficha.pd»http://www.aemps.gob.es/cima/especialidad.do?metodo=verFichaWordPdf&codigo=72571&formato=pdf&formulario=FICHAS&file=ficha.pdf. [ Links ]
5. Gavini A, Gladys H, Telang, Adam J. Olszewski. Generalized purpuric drug exanthem with hemorrhagic plaques following bendamustine chemotherapy in a patient with B-prolymphocytic leukemia. Int J Hematol. 2012;95:311-4. [ Links ]
6. Fischer K, Cramer P, Busch R, et al. Bendamustine combined with rituximab in patients with relapsed and/or refractory chronic lymphocytic leukemia: a multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol. 2011;29:3559-66. [ Links ]
7. lannitto E, Morabito F, Mancuso S, et al. Bendamustine with or without rituximab in the treatment of relapsed chronic lymphocytic leukaemia: an Italian retrospective study. Br J Haematol. 2011;153: 351-7. [ Links ]
8. Sangrador Pelluz C, Martínez García M, Pérez-Serrano Lainosa MD, Soler Company E. Protocolo de desensibilización a cisplatino. Farm Hosp. 2013;37:260-2. [ Links ]
9. Common Terminology Criteria for Adverse Events (CTCAE) Version 4.03 National Institutes of Health National Cancer Institute 2010 (consultado 12 Mayo 2013). Disponible en: HYPERLINK " http://ctep.cancer.gov/»http://ctep.cancer.gov. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Cristina Sangrador Pelluz
E-mail: sangrador_cri@gva.es
Recibido: 27/06/2013.
Aceptado: 26/07/2013.