Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.41 no.2 Toledo Mar./Abr. 2017
https://dx.doi.org/10.7399/fh.2017.41.2.10596
Originales
Estudio de adherencia y seguridad en pacientes a tratamiento con capecitabina
1Pharmacy Unit. Complejo Hospitalario Universitario de Pontevedra. Spain.
Introducción:
La introducción en la terapéutica de antineoplásicos orales ha provocado un cambio en la estrategia de tratamiento frente al cáncer. El objetivo de este trabajo fue analizar la adherencia en pacientes en tratamiento con capecitabina, los acontecimientos adversos y el estado general de salud de los pacientes, así como la relación de estos factores con la adherencia.
Método:
Estudio observacional prospectivo, de siete meses de duración, en una cohorte de pacientes en tratamiento con capecitabina, incluyendo los inicios y las continuaciones de tratamiento, independientemente del diagnóstico o la indicación. Se registraron variables demográficas (edad, sexo), de diagnóstico (cáncer de mama, colon-recto, gástrico, off-label), de adherencia (recuento de comprimidos, test de Morisky, de Sackett), de seguridad (valoración de acontecimientos adversos, evaluación clínica del oncólogo) y calidad de vida (performance status, test SF-12). Fuentes de datos: historia clínica electrónica (IANUS®), programa de dispensación a pacientes externos (Silicon®) y entrevistas al paciente.
Resultados:
111 pacientes evaluables, media de edad de 66,7 años (rango 32-86), ECOG PS 1 en el 76,6%. Nivel de adherencia: 78,4% (subgrupo inicio 81,7% vs. continuación 72,5%). Acontecimientos adversos: toxicidad cutánea (33,33%), astenia (25,22%), toxicidad gastrointestinal (24,32%) y neurológica (24,32%), en su mayoría G1. Estado de salud, test SF-12: valoración subjetiva “buena” en el 33,30%.
Conclusiones:
El bajo nivel de adherencia en el subgrupo de continuación puede relacionarse con la duración del tratamiento, las toxicidades, la evolución clínica y la percepción de su estado de salud. Es necesario un seguimiento individualizado en este grupo de pacientes para obtener una respuesta clínica favorable.
PALABRAS CLAVE: Adherencia; Capecitabina; Acontecimientos adversos; Calidad de vida; Atención farmacéutica
Aportación a la literatura científica
La relevancia de este trabajo radica en la necesidad de conocimiento del nivel de adherencia para promover estrategias que la favorezcan, repercutiendo en un aumento de eficacia del tratamiento y mejorando la calidad de vida de los pacientes.
Tras los resultados obtenidos en este trabajo, podemos decir, que todos los componentes del equipo multidisciplinar deben implicarse en mejorar los resultados de adherencia, especialmente en aquellos pacientes que reciben tratamiento durante periodos prolongados de tiempo.
Introducción
Se define adherencia (ADH) a un tratamiento como el grado en que un paciente actúa de acuerdo al intervalo y dosis prescritas en el régimen de dosificación, como consecuencia del compromiso del paciente con las recomendaciones acordadas entre éste y el profesional sanitario1-4.
Los pacientes con cáncer se presupone que son particularmente adherentes dada la gravedad de la enfermedad. Sin embargo, diferentes estudios han demostrado que esto no siempre es cierto, y que las tasas de adherencia oscilan entre 16-100%, dependiendo del medicamento y del método de medida5,6. Se ha demostrado que tras varios ciclos de tratamiento la ADH tiende a disminuir fundamentalmente por relajación, desmotivación y/o acontecimientos adversos (AA)1-5,7.
En los últimos años se ha incrementado la utilización de antineoplásicos orales (AO), este cambio en la terapéutica influye en la forma de abordar la enfermedad por parte del paciente y de los profesionales sanitarios, pasando a ser el paciente responsable del manejo del tratamiento y la adherencia un factor importante, pues puede condicionar la eficacia del tratamiento3,6,8,9.
La mayoría de los pacientes (80%) prefieren el tratamiento oral frente al endovenoso, pero suelen tener dudas acerca de su efectividad e importancia9. Esto unido a la complejidad de los tratamientos y a los AA puede suponer un obstáculo a la hora de conseguir un nivel adecuado de cumplimiento terapéutico y por tanto de eficacia1-5.
Autorizado por la EMA en febrero del 2001, la capecitabina es un profármaco oral del 5FU, utilizado en protocolos antineoplásicos en cáncer de mama, colon-recto y gástrico, siendo las dos primeras patologías de alta incidencia. Presenta una eficacia similar al 5FU parenteral pero con menor toxicidad asociada1,10 y puede combinarse con quimioterapia clásica o terapia dirigida, aumentando en este caso la complejidad del tratamiento, y la posibilidad de AA5,10,11. Su administración cada 12 horas, con periodos de descanso, de forma cíclica y duración prolongada, requiere el compromiso del paciente para conseguir un adecuado cumplimento y un resultado eficaz.
La intervención del farmacéutico proporcionando información de todos los aspectos relacionados con el tratamiento ha demostrado que puede incrementar o favorecer la ADH2,3,5.
El objetivo de este trabajo fue analizar la ADH en pacientes a tratamiento con capecitabina, los AA y el estado general de salud de los pacientes, así como la relación de estos factores con la ADH.
Método
Estudio observacional prospectivo durante un período de 7 meses (febrero-agosto 2014), de una cohorte de pacientes a tratamiento en neoadyuvancia, adyuvancia y en enfermedad metastásica con capecitabina (nT), incluyendo tanto los inicios (ni) como las continuaciones de tratamiento (nc), independientemente del diagnóstico. Se excluyeron los pacientes que recibieron menos de 3 ciclos de capecitabina (nE), por no ser posible su seguimiento.
Criterios de inclusión:
pacientes adultos con diagnóstico de cáncer de mama, colon-recto, gástrico y off-label;
se admitieron tanto pacientes en continuación de tratamiento con capecitabina como los inicios durante los 7 meses de recogida de datos;
número de ciclos mínimo para evaluación: 3 ciclos.
Consideramos un ciclo de tratamiento a la administración de capecitabina en:
adyuvancia y en enfermedad metastásica:
monoterapia: 1250 mg/m2 / 12h x 14 días / 21 días , vía oral (vo)
combinación, según esquema quimioterápico: 800-1250 mg/m2 / 12h x 14 días / 21 días, vo.
neoadyuvancia:
cáncer de recto: 625 mg/m2 / 12h vo continuo hasta fin de la radioterapia, consideramos un ciclo al intervalo entre visitas con el oncólogo, cada 21-28 días
cáncer gástrico: esquema ECX en neoadyunvacia como en adyuvancia (epirubicina 50 mg/m2 intravenoso (iv) día 1, cisplatino 60 mg/m2 iv día 1, capecitabina 625 mg/m2 / 12 h vo, cada 21 días).
(nT población total evaluada; nE pacientes excluídos; n: población evaluada según criterios de inclusión, n = nT-nE; ni: subgrupo de inicio; nc: subgrupo de continuación; n = ni + nc)
La programación de las visitas al Servicio de Farmacia
(V) (8 en 7 meses) se realizó en concordancia con el día 1 de cada ciclo, cada 21días, según el siguiente esquema:
V1 (1º ciclo)
• Recogida de datos demográficos: edad, sexo; de diagnóstico: cáncer de mama, colon-recto, gástrico, off-label; y performance status (ECOG PS)12,13.
Información oral y escrita del tratamiento a cada paciente, así como del manejo de los AA más comunes.
V2,V5 y V6 (2º,5º y 6º ciclo)
• Visitas de seguimiento: revisión de los evolutivos notificados por el oncólogo en la historia clínica del paciente; resolución de dudas del paciente sobre la administración, conservación y manejo de los AA derivados del tratamiento; recuento de comprimidos sobrantes.
V3 y V7 (3º y 7º ciclo)
Valoración de la calidad de vida: se entregó a cada paciente el test SF-12 (Figura 1)1,14 que debía devolver cumplimentado en la siguiente visita.
Valoración de AA: se entregó a cada paciente el test de AA (Figura 2)7,15 que debían devolver cumplimentado en la siguiente visita.
V4 y V8 (4º y 8º ciclo)
Revisión de las toxicidades descritas por el oncólogo en la historia clínica electrónica (IANUS®) desde la V1 a la V4 y desde V5 hasta V8, según la clasificación de NCICTCAE v4.016. Evaluación de los resultados de los test de AA entregados a los pacientes en las V3 y V7.
Evaluación de la calidad de vida: revisión de los resultados de los test SF-12.
Evaluación de ADH: se realizó el cálculo de la adherencia de cada paciente mediante el test de Morisky2,17,18, el test de cumplimiento autocomunicado de Sackett (Figura 2)2,17,18 y el recuento de comprimidos sobrantes. A todos los pacientes se les dispensó la medicación justa para cada ciclo; la frecuencia de las dispensaciones se obtuvo del programa de dispensación a pacientes externos (Silicon®).
Consideramos que un paciente era adherente cuando el resultado de los test de Morisky y Sackett eran correctos, es decir, si el paciente responde de forma adecuada a las preguntas realizadas en los test (Mo risky: NO/SI/NO/NO; Sackett: NO/SI/NO), y el recuento de medicación sobrante era nulo.
En una base de datos EXCEL® se registraron los datos obtenidos, así como las intervenciones farmacéuticas realizadas. Para el procesamiento de datos los pacientes se agruparon en 2 subgrupos: inicio (ni) y continuación de tratamiento (nc).
El análisis estadístico se realizó mediante el programa SPSS® versión 15, empleando el test Chi-cuadrado y el test exacto de Fisher.
Resultados
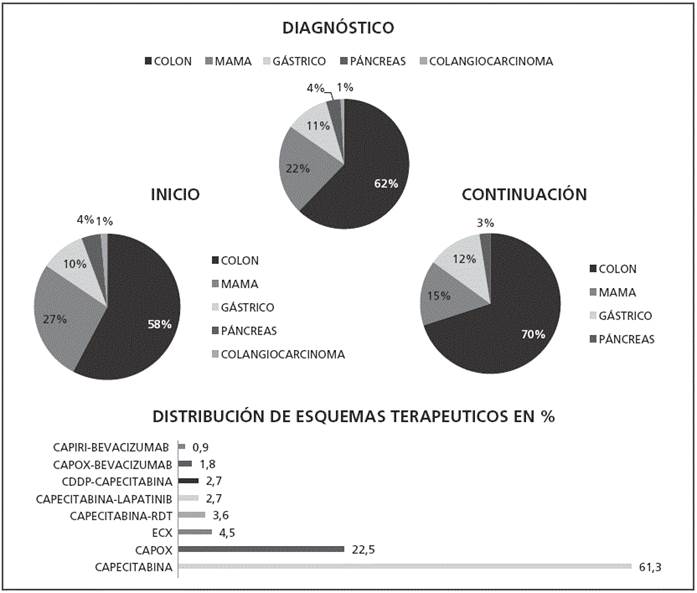
De una cohorte de 130 pacientes (nT), se evaluaron 111 (n: 57 hombres, 54 mujeres), con media de edad 66,7 años (rango 32-87 años). Subgrupo de inicio, ni = 71 y subgrupo de continuación, nc = 40. Se excluyeron 19 pacientes (nE) por duración del tratamiento inferior a 3 ciclos (dispensado solo un ciclo). La distribución de pacientes en función del diagnóstico y del esquema de tratamiento se refleja en la Figura 3.
Nivel de adherencia
En la V4 el porcentaje de pacientes adherentes fue del 78,4%, siendo superior en el subgrupo de inicio (ni81,7% vs nc72,5%). En la V8 solo 19 pacientes seguían en tratamiento. El porcentaje de ADH de estos pacientes fue del 89,5%, siendo superior en el subgrupo de inicio (ni91,6% vs nc85,7%) (Figura 4).

Figura 4 Distribución de los % de ADH registrados en la V4 y V8, en la muestra total y en los subgrupos. Conjunción de los datos de los test de ADH y recuento de la medicación sobrante.
Los 92 pacientes restantes no fueron evaluables en V8 por finalización del tratamiento, progresión y/o cambio en la terapéutica.
En cuanto al recuento de medicación tras ciclo, solamente en 2 pacientes hubo medicación sobrante por olvidos puntuales.
Una limitación del estudio es el reducido numero de pacientes que entregaron el test de Morisky y Sackett en la V8, y aunque el nivel de adherencia fue del 89,5% (91,6% ni vs 85,7% nc), la muestra no fue representativa respecto a la población inicial del estudio (17,11% de n = 111). Necesitaríamos un estudio de mayor duración, para poder concluir que la atención farmacéutica prestada favoreció la adherencia.
Acontecimientos adversos (AA)
Valoración clínica del oncólogo: revisión de historia clínica.
Los AA encontrados se ajustan a los descritos en ficha técnica10. El 33% de los pacientes presentaron toxicidad cutánea, 14% dolor abdominal, 26% astenia, 25% diarrea y toxicidad neurológica en el 25%, especialmente en aquellos con esquema CAPOX (oxaliplatino 130mg/ m2 iv día 1 + capecitabina 1000mg/m2/12h x 14 días vo, cada 21 días) necesitando reducción o suspensión temporal del oxaliplatino.
En el subgrupo de inicio los AA de grado 1 (G1) más frecuentes (> 10%) fueron: toxicidad cutánea, diarrea y neurotoxicidad; de G2 (> 7%), toxicidad cutánea y astenia; y de G3 (> 3%) dolor gastrointestinal. No hubo toxicidad G4.
En el subgrupo de continuación la toxicidad G1 más frecuente (> 9%) fue la cutánea; G2 el dolor gastrointestinal (4,5%); G3 toxicidad cutánea y neurotoxicidad (1,8%); y neutropenia G4 (0,9%).
El nivel de ADH en V4 y V8, en pacientes con toxicidades G2/G3 se refleja en la Figura 5.

Figura 5 Acontecimientos Adversos. Valoración clínica del oncólogo en la población total. Resultados de ADH vs valoración del paciente en intensidad moderada y duración > 7 días.
Todos los AA relacionados con la capecitabina fueron reversibles y no precisaron suspensión del tratamiento.
b. Valoración subjetiva del paciente
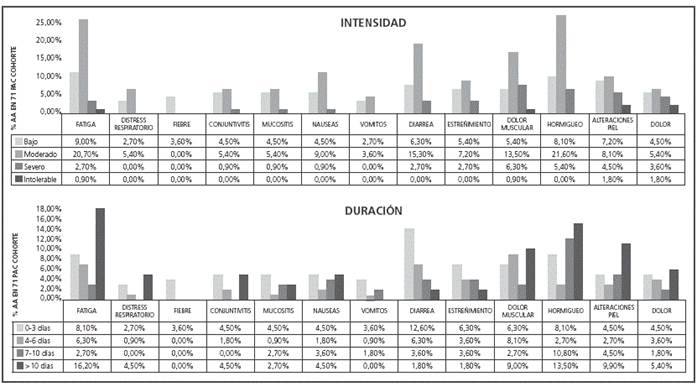
El 74,7% de los pacientes entregaron el test de AA (Figura 2) , y de ellos el 63,96% señaló algún AA en duración-intensidad (Figura 6), siendo los más relevantes en duración: fatiga, hormigueo, diarrea, dolor muscular.
El nivel de ADH en V4 y V8, en pacientes que señalaron AA con duración igual o superior a 7 días e intensidad de grado “moderado” se refleja en la Figura 5.
Calidad de vida
71 pacientes (63,96%) entregaron el test SF-12 en la V4, y 15 (13,51%) en la V8. La distribución de pacientes por ECOG15,16 y los resultados de la pregunta 1º del test SF-12 vs nivel de ADH en V4 y V8 se muestran en la Figura 7.
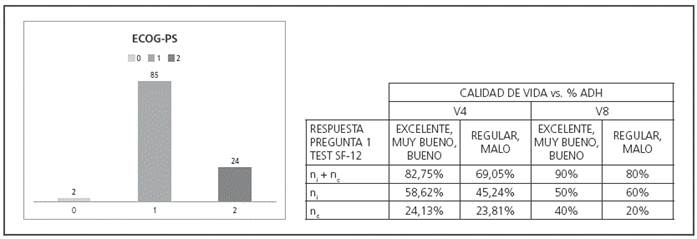
Figura 7 Distribución de la población según ECOG PS. Resultados de ADH vs Test SF-12 pregunta 1 (calidad de vida).
El resultado de la pregunta 5º: ¿Tuvo que dejar de hacer algunas tareas en su trabajo o en sus actividades cotidianas? En V4 el 34,30% del los pacientes del subgrupo de inicio necesitaron modificar sus actividades cotidianas vs 21,4% en el subgrupo de continuación. En la V8, el 42,90% de los pacientes del subgrupo de inicio necesitó modificar sus hábitos vs 0% en el subgrupo de continuación. La diferencia fue estadísticamente significativa, (p = 0,016), aplicando el estadístico de Fisher.
Discusión
Aunque en oncología se presupone una ADH cercana al 100%, los datos publicados en la bibliografía indican que es similar a otras patologías, por la complejidad de los tratamientos y la duración de los mismos1-4. En los estudios publicados sobre la adherencia a capecitabina, el rango oscila entre el 75-91%, debido entre otros, al efecto de las toxicidades sobre la actitud del paciente a la hora de tomar la medicación1-5. Además se ha observado que disminuye con el tiempo, pudiendo pasar del 99% al 64% a los 3 meses2.
Existen discrepancias sobre el porcentaje mínimo de adherencia a un tratamiento para obtener eficacia terapéutica. Para Gordis et al. (1969) el mínimo fue del 75%; Ebrahim et al. (1998) y Mayer et al. (2009), consideraron el 80% como “aceptable”. Pero para Patterson et al. (2000) y Timmers et al. (2014), el 95% debe ser el valor mínimo de adherencia para obtener un nivel óptimo de eficacia2,4. Una adherencia baja repercute directamente en la efectividad del tratamiento, siendo un factor crítico a la hora de obtener una respuesta clínica favorable1,2,4,6.
En los estudios publicados de ADH a antineoplásicos orales las tasas de ADH variaron entre el 40-100%, considerando aceptable un 85%2.
En nuestra cohorte de pacientes el porcentaje ADH fue del 78,4%, inferior al mínimo establecido por Timmers et al.2,4, pero similar a los recogidos en otros estudios1,3,5,7, siendo superior en el subgrupo de inicio vs continuación. Esta diferencia puede deberse a que el paciente que inicia tratamiento está más motivado por el reciente diagnóstico y por la ansiedad que le produce la falta de tratamiento, mostrándose muy receptivo a la información aportada, oral y escrita.
Se considera que los regímenes de dosificación cíclica, como la capecitabina, aunque son más complejos que los de dosificación continuada requieren mayor atención por parte del paciente y la ADH es superior, sin embargo, esto no se ha visto reflejado en nuestro estudio.
Cuando el tratamiento se prolonga en el tiempo, las toxicidades, evolución de la enfermedad o modificaciones de tratamiento pueden influir negativamente en la motivación y disminuir la ADH2,3,4,6. Esto se refleja en los datos obtenidos en el subgrupo de continuación en nuestro estudio, en el que la ADH fue inferior.
La mayoría de las toxicidades descritas por los pacientes fueron de duración e intensidad reducidas (excepto hormigueo, fatiga, dolor muscular y diarrea), siendo éstas las más frecuentes y afectaron a la calidad de vida. Aunque se percibe una buena tolerancia al tratamiento, el nivel de adherencia del subgrupo de inicio siempre fue superior, posiblemente por la toxicidad acumulativa del tratamiento observada en el subgrupo de continuación y la afectación de la calidad de vida. Por otro lado, en los pacientes con toxicidades G2-3, a pesar de ser más frecuentes en el subgrupo de inicio, la ADH siempre fue mayor que en el subgrupo de continuación, probablemente por un control más estricto al inicio del tratamiento. Es importante monitorizar adecuadamente los AA durante el tratamiento debido a su influencia en la calidad de vida del paciente y la ADH.
Respecto a la calidad de vida, la mayoría de los pacientes pudieron desarrollar una actividad normal, mostrando una actitud favorable al tratamiento, siendo la fatiga el factor más limitante y con mayor influencia sobre el estado anímico.
Los resultados difieren poco entre ambos subgrupos en el aspecto emocional, aunque si en el físico. El porcentaje de pacientes que consideran tener un buen estado de salud fue mayor en el subgrupo de inicio, sin embargo, fue en éstos en los que la sensación de dificultad física para la vida diaria fue mayor, posiblemente por las limitaciones derivadas del inicio de la terapia, como un horario de administración regular de la capecitabina, las necesidades hídricas-dietéticas y el cuidado de la piel.
Se observó una correlación entre calidad de vida y adherencia. En los pacientes con una valoración positiva sobre su calidad de vida, la ADH fue superior, siendo mayor en el subgrupo de inicio. Por tanto podríamos decir, que una calidad de vida percibida como buena por nuestros pacientes favorece la adherencia al tratamiento.
Es en los pacientes del subgrupo de continuación en los que más se debe incidir para mantener una adecuada adherencia. El incumplimiento terapéutico puede producirse por evolución de la enfermedad o deterioro de la calidad de vida, parámetros influyentes en la motivación11,12,13.
En conclusión, los antineoplásicos orales presentan ventajas para el paciente oncológico, pero la aparición de toxicidades y alteración de la calidad de vida pueden disminuir la adherencia. Aunque la adherencia a capecitabina es relativamente alta, hay un importante número de pacientes no adherentes en el subgrupo de continuación, por lo que es necesario realizar un seguimiento individualizado e implantar nuevas estrategias para favorecer la adherencia, especialmente en pacientes con tratamiento prolongado en el tiempo.
References
Timmers L, Swart EL, Boons CC, Mangnus D, van de Ven PM, Peters GJ, et al. The use of capecitabine in daily practice: a study on adherence and patients´ experiences. Patient Prefer Adherence. 2012; 6: 741-8. [ Links ]
Bassan F, Peter F, Houbre B, Brennstuhl MJ, Costantini M, Speyer E, et al. Adherence to oral antineoplastic agents by cancer patients: definition and literature review. Eur J Cancer Care. 2014; 23(1):22-35 [ Links ]
Mathes T, Antoine SL, Pieper D, Eikermann M. Adherence enhancing interventions for oral anticancer agents: A systematic review. Cancer Treat Rev. 2014;40(1):102-8. [ Links ]
Timmers L, Boons CC, Kropff F, van de Ven PM, Swart EL, Smit EF, et al. Adherence and patients´ experiences with the use of oral anticancer drugs. Acta Oncol. 2014; 53(2):259-67. [ Links ]
Krolop L, Ko YD, Schwindt PF, Schumacher C, Fimmers R, Jaehde U. Adherence management for patients with cancer taking capecitabine: a prospective two-arm cohort study. BMJ Open. 2013; 3(7) [ Links ]
Gebbia V, Bellavia G, Ferraù F, Valerio MR. Adherence, compliance and persistence to oral antineoplastic therapy: a review focused on chemotherapeutic and biologic agents. Expert Opin Drug Saf. 2012;11 Suppl 1:S49-59. [ Links ]
Cirillo M, Venturini M, Ciccarelli L, Coati F, Bortolami O, Verlato G. Clinician versus nurse symptom reporting using the National Cancer Institute- Common Terminology Criteria for Adverse Events during chemotherapy: results of a comparision based on patient´s self-reported questionnaire. Ann Oncol. 2009; 20(12):1929-35. [ Links ]
Verbrugghe M, Verhaeghe S, Lauwaert K, Beeckman D, Van Hecke A. Determinants and associated factors influencing medication adherence and persistence to oral anticancer drugs: A systematic review. Cancer Treat Rev. 2013;39(6):610-21. [ Links ]
Foulon V, Schöffski P, Wolter P. Patient adherence to oral anticancer drugs: an emerging issue in modern oncology. Acta Clin Belg. 2011;66(2):85-96. [ Links ]
Xeloda. Ficha técnica del medicamento. EMA. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000316/WC500058151.pdf. [ Links ]
Bhattacharya D, Easthall C, Willoughby KA, Small M, Watson S. Capecitabine non-adherence: exploration of magnitude, nature and contributing factors. J Oncol Pharm Pract. 2012;18(3):333-42. [ Links ]
Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, et al. Toxicity And Response Criteria Of The Eastern Cooperative Oncology Group. Am J Clin Oncol. 1982; 5:649-655. [ Links ]
Ferriols Lisart R, Ferriols Lisart F, Magraner Gil J. Calidad de vida en oncología clínica. Farm Hosp 1995; 19 (6):315-322. [ Links ]
Schmidt S, Vilagut G, Garin O, Cunillera O, Tresserras R, Brugulat P, et al. Reference guidelines for the 12-Item Short-Form Health Survey version 2 based on the Catalan general population. Med Clin (Barc). 2012;139(14):613-25. [ Links ]
Basch E, Iasonos A, McDonough T, Barz A, Culkin A, Kris MG, et al. Patient versus clinician symptom reporting using the National Cancer Institute Common Terminology Criteria for AdverseEvents: results of a questionnaire-based study. Lancet Oncol. 2006;7(11):903-9. [ Links ]
National Cancer Institute, Cancer Therapy Evaluation Program. Common Terminology Criteria for Adverse Events (CTCAE), version 4.03: June 14, 2010. Febrero 2014. Disponible en: http://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf. [ Links ]
Rodríguez Chamorro MA, García-Jiménez E, Amariles P, Rodríguez Chamorro A, Faus MJ. Revisión de tests de medición de cumplimiento terapéutico utilizados en la práctica clínica. Aten Primaria. 2008;40(8):413-7. [ Links ]
Palop Larrea V, Martínez Mir I. Adherencia al tratamiento en el paciente anciano. Inf Ter Sist Nac Salud. 2004;28:113-120. [ Links ]
Recibido: 12 de Julio de 2016; Aprobado: 18 de Octubre de 2016











 texto em
texto em