Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.42 no.4 Toledo Jul./Ago. 2018
https://dx.doi.org/10.7399/fh.10976
REVISIÓN
Revisión sistemática sobre la suplementación profiláctica de L-carnitina en la nutrición parenteral de recién nacidos pretérmino
1Unidad de Farmacia Hospitalaria, Hospital Universitario Puerta del Mar, Cádiz. Spain.
2Unidad de Farmacia Hospitalaria, Hospital General Universitario Gregorio Marañón, Madrid. Spain.
3Unidad de Neonatología, Hospital Universitario Puerta del Mar, Cádiz. Spain.
Introducción
La carnitina (ácido 3-hidroxi-4-N-trimetilaminobutírico) es un dipéptido ampliamente distribuido en todos los tejidos de los mamíferos y particularmente abundante en el tejido muscular1 que se sintetiza en el hígado, riñones y cerebro a partir de dos aminoácidos esenciales, lisina y metionina. Se presenta en forma de D y L-isómero, siendo este último la forma biológicamente activa y la que se encuentra en los alimentos, y aunque el D-isómero no lo es, es capaz de competir con el primero por los sitios de unión, lo que aumenta el riesgo de deficiencia en L-carnitina. Actúa como lanzadera de los ácidos grasos de cadena larga, facilitando su entrada en la matriz mitocondrial para que tenga lugar la β-oxidación lipídica y consecuente producción de energía2. Para ello se une a la molécula del ácido graso activado (acil-CoA), generando acilcarnitina, y a través de una enzima transportadora de la membrana mitocondrial interna permite el paso de esta molécula al interior mitocondrial, donde se separa de nuevo para que el ácido graso continúe la ruta y se obtenga adenosín trifosfato (ATP). La carencia intracelular de carnitina deteriora la capacidad de utilizar la grasa como combustible. Concretamente, parece ser que limita el metabolismo de los lípidos, dando lugar a un incremento en plasma de triglicéridos, ácidos grasos y cuerpos cetónicos (ácidos acetil-acético y β-hidroxibutírico), por lo que los aminoácidos serían utilizados para satisfacer las necesidades energéticas endógenas al estar afectada la disponibilidad de energía no proveniente de las proteínas, influyendo en el crecimiento y en la formación de tejido nuevo3. Los niños sanos y los adultos no necesitan consumir carnitina a partir de los alimentos, siempre que su hígado, riñones y cerebro produzcan cantidades suficientes para satisfacer las necesidades diarias. Algunos alimentos ricos en este producto son la carne roja (fundamentalmente el cordero), el suero de la leche, el pescado, el pollo, el arroz, el pan, los espárragos y el aguacate.
La inmadurez del aparato digestivo y las frecuentes complicaciones que suceden en las primeras semanas de vida dificultan el establecimiento de una nutrición enteral suficiente para satisfacer las necesidades metabólicas del recién nacido pretérmino (RNPT), precisando adecuar su balance energético y metabólico mediante el empleo de nutrición parenteral (NP), que en muchas ocasiones se precisa durante incluso más de un mes (NP prolongada: NPP). Las reservas tisulares de L-carnitina en un recién nacido a término (RNT) son un 25-50% de las de los adultos aproximadamente4, y las de los RNPT son aún más inferiores de las de los RNT5. Tanto la leche materna como las fórmulas infantiles contienen carnitina, aunque no se añade normalmente a las soluciones de NP. Por este motivo, los RNPT con nutrición parenteral total (NPT) tienen tanto una reducción de la ingesta como de las reservas tisulares de carnitina, y dado que son propensos a tener mayores demandas debido al rápido crecimiento, no es sorprendente que los recién nacidos alimentados con NP sin suplementos alcancen niveles muy bajos de carnitina al cabo de dos semanas de vida6.
Clásicamente, los RNPT se mantenían a dieta absoluta y recibían aportes de calorías muy por debajo de sus requerimientos energéticos de manera prolongada, durante varios días o semanas, por miedo a presentar complicaciones metabólicas derivadas de la alimentación enteral precoz o del aumento rápido de macronutrientes. Hoy en día se consideran seguras prácticas de alimentación enteral mucho más aceleradas7, así como la administración de nutrientes por vía parenteral de forma más precoz que entonces y con mayor cantidad de lípidos desde el primer día de vida8. La carencia de carnitina puede ser un factor etiológico en la capacidad limitada de los neonatos prematuros para utilizar los lípidos parenterales. En estudios in vitro se ha sugerido que la oxidación de los ácidos grasos es irregular cuando los niveles de carnitina tisular se encuentran por debajo del 10% del valor normal9. El objetivo de este trabajo fue revisar la literatura en busca de los posibles beneficios de la administración de L- carnitina profiláctica en la NP de RNPT, como son una posible mejoría en el perfil lipídico, aumento de la ganancia ponderal, disminución de la morbimortalidad, reducción de la estancia hospitalaria o la aparición de apnea del prematuro.
Métodos
Se trata de un estudio descriptivo y análisis crítico de los trabajos recuperados, mediante técnica sistemática, en las siguientes bases de datos: MEDLINE/ Pubmed, Scopus, The Cochrane Library, British Library EThOS y TESEO (base de datos de tesis doctorales del Ministerio de Educación, Cultura y Deporte). Se decidió seleccionar para su análisis los trabajos que cumplieran los siguientes criterios de inclusión: los documentos debían ser originales y adecuados a los objetivos de la búsqueda (relación entre niveles séricos de L-carnitina y mejoría de parámetros clínicos como progreso significativo en el perfil lipídico, aumento de la ganancia ponderal o reducción de la estancia hospitalaria, entre otros), publicados en cualquier país, por cualquier institución o investigador individual y en inglés o español. Para definir los términos de la búsqueda se empleó el Medical Subject Headings (MeSH) desarrollado por la U.S. National Library of Medicine. Se consideraron adecuados como descriptores (MeSH) «Total Parenteral Nutrition» y «Carnitine». La ecuación de búsqueda final se desarrolló mediante la utilización de conectores booleanos para su empleo en la base de datos MEDLINE/ Pubmed, quedando de la siguiente forma: (“Parenteral Nutrition, Total”(Mesh) OR “Parenteral Nutrition Solutions”(Mesh)) AND “Carnitine”(Mesh) (English (lang) OR Spanish (lang)).
La misma estrategia se adaptó posteriormente a las características del resto de bases de datos anteriormente mencionadas. La búsqueda se realizó desde la primera fecha disponible hasta diciembre de 2017. Además se examinó el listado bibliográfico de los artículos seleccionados con el objeto de identificar estudios no detectados en la revisión de las bases de datos. Se excluyeron aquellos trabajos cuya población en estudio no fueran RNPT, así como artículos que no fueran originales (criterios de exclusión).
La selección de los artículos se realizó de forma independiente por dos de los autores de la presente revisión. Las discrepancias identificadas se resolvieron mediante discusión y, en caso de no alcanzar el consenso, se recurrió a la participación de un tercer evaluador. La calidad metodológica de los estudios fue analizada mediante la escala de Jadad o el sistema de evaluación de calidad de Oxford, herramienta de lectura crítica de 5 preguntas relacionadas con el análisis de ensayos clínicos que confiere una puntuación que clasifica el estudio como de baja calidad si ésta es inferior a 3 puntos, considerando como riguroso un ensayo clínico aleatorizado de 5 puntos10.
Resultados
La estrategia de búsqueda en las distintas bases de datos reportó un total de 93 referencias. Después de la primera revisión de duplicidad se obtuvieron 52 estudios y, tras aplicar los criterios de inclusión y exclusión (Figura 1), 30 fueron rechazados por no ajustarse al tema de la revisión, 3 por no cumplir los criterios de inclusión al tratarse de revisiones, comentarios u otra tipología documental y otros 2 porque la población en estudio no eran RNPT (criterio de exclusión). Al evaluar la calidad de los 18 artículos2,6,11-26 seleccionados a través de la escala Jadad, las puntuaciones oscilaron entre 2 y 5, con una mediana de 5 puntos (Tabla 1). Se rechazaron aquellos trabajos con una puntuación inferior a 3 puntos, por lo que quedaron un total de 14 referencias para la revisión2,6,11-22, como se recoge en la Figura 1. Los artículos procedían de instituciones internacionales y estaban escritos en inglés.
Tabla 1 Evaluación de la calidad metodológica y el riesgo de sesgo con la escala de Jadad
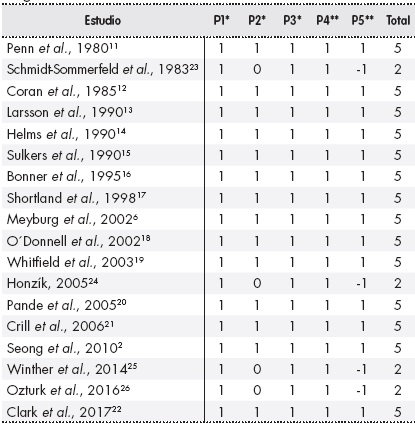
Puntuación = *0: no; 1: sí; **-1: no; 1: sí; P1-P3: se refieren a la forma de aleatorización de los pacientes; P2-P5: se refieren al uso del doble ciego; P3: se refiere a la pérdida de individuos durante el estudio. Si la puntuación es inferior a 3 puntos, el ensayo clínico se considera de baja calidad.
Todos los datos relevantes de cada trabajo se resumieron en una tabla (Tabla 2 y Tabla 2 (cont), en concreto se codificaron según primer autor de la referencia bibliográfica y año de publicación, población a la que se le suministró la carnitina, variables medidas, tanto clínicas como analíticas, objetivo principal, dosis y tiempo durante el cual se suplementó, así como conclusión final del estudio.
Tabla 2 (cont.) Características de los estudios evaluados sobre la suplementación de carnitina en RNPT
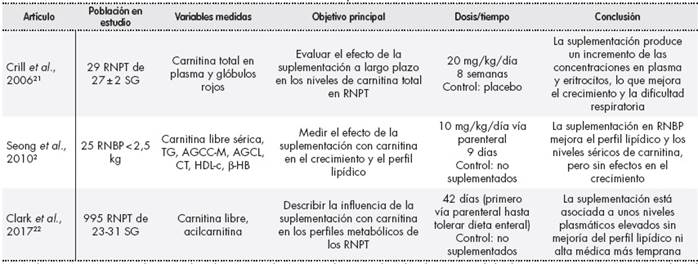
AG: ácidos grasos; AGCC-M: ácidos grasos de cadena corta-media; AGCL: ácidos grasos de cadena larga; -HB: -hidroxibutirato; CC: cuerpos cetónicos; CT: colesterol total; d: día; IV: intravenoso; NP: nutrición parenteral; NPP: nutrición parenteral prolongada; NPT: nutrición parenteral total; RN: recién nacido; RNPT: recién nacido pretérmino; RNT: recién nacido a término; RNBP: recién nacido de bajo peso; RNMBP: recién nacido de muy bajo peso; SC: semanas corregidas; SDR: síndrome de distrés respiratorio; SG: semanas de gestación; TG: triglicéridos.
La población en estudio de los diferentes trabajos fue muy heterogénea, aunque todos RNPT. Casi la totalidad de los estudios coincidían en las variables analíticas medidas (carnitina libre y acilcarnitina, triglicéridos, ácidos grasos libres y cuerpos cetónicos). En algunos además, como en los de Whitfield y cols.19 y Pande y cols.20, se tenían en cuenta otras variables clínicas, como la ganancia ponderal o la apnea. En la mayoría de los trabajos se adicionaba carnitina a la solución de NP hasta tolerabilidad de la vía enteral, momento en el cual la suplementación pasaba a ser oral. Sólo en algunos no se suplementaba, como en el de Meyburg y cols.6, y sólo se medían niveles plasmáticos para compararlos con los de los RNT. La duración de la suplementación fue durante un corto plazo (inferior a 4 semanas) salvo en el estudio de Crill y cols.21, que se suplementó 8 semanas.
Discusión
La L-carnitina facilita la entrada en la matriz mitocondrial de los ácidos grasos de cadena larga para su oxidación y la consecuente producción de energía, por lo que su carencia podría limitar el metabolismo lipídico e incrementar los triglicéridos, ácidos grasos y cuerpos cetónicos plasmáticos. De la misma manera, se podría producir una disminución de la ganancia ponderal al verse aumentado el metabolismo proteico para la producción de energía, sobre todo en el RNPT, cuyos niveles de L-carnitina están muy por debajo de lo habitual debido a una menor reserva tisular y a un dificultoso aporte de nutrientes. No obstante, la evidencia disponible es aún controvertida en cuanto a la relevancia clínica de los niveles tisulares bajos y de que, por tanto, sea necesaria una suplementación profiláctica.
Los primeros estudios sobre niveles séricos de L-carnitina en RNPT datan de los años 80, los cuales concluían que aquellos que no recibían suplementos presentaban déficits importantes11,12. Estudios experimentales posteriores, como el realizado por Larsson y cols.13, demostraron ya una mejor tolerancia a los lípidos parenterales en pacientes que recibían L-carnitina, con un efecto positivo en el metabolismo de los ácidos grasos. No obstante, no se recogieron datos de variables con mayor relevancia clínica, como la ganancia ponderal. En muchas Unidades de Cuidados Intensivos Neonatales se inició de manera rutinaria la suplementación profiláctica con L-carnitina en la NP de los RNPT a raíz de estas publicaciones.
Tras esta tendencia, estudios realizados en los años 90 ya comenzaron a incluir dentro de sus variables medidas no sólo aquellas de tipo bioquímico, sino también clínicas, como el incremento de peso o la estancia hospitalaria. Helms y cols.14 y Sulkers y cols.15 observaron en sus estudios un modesto incremento de peso, aunque con muestras de pacientes no muy grandes. Posteriormente y con un tamaño muestral ya más elevado, Shortland y cols.17 en 1998 concluyeron que la adición de carnitina a la NP no mejoraba el crecimiento del RNPT. No es hasta el año 2005 cuando Pande y cols.20 diseñaron un estudio específico solamente para demostrar el incremento de peso en este tipo de pacientes que recibían suplementación prolongada (hasta la semana 36 de gestación o alta hospitalaria) de L-carnitina, cuyo resultados no mostraron diferencias estadísticamente significativas en la variable principal de eficacia, la ganancia ponderal: la media de aumento de peso en el grupo suplementado fue 18,9 ± 4,7 gramos/día frente a 18,5 ± 4,6 gramos/día en el grupo control (p > 0,05); tampoco se encontraron diferencias estadísticamente significativas en el resto de variables secundarias medidas en ambos grupos.
En concordancia con lo anterior, cabe destacar el estudio realizado por Clark y cols.22, que incluye un total de 995 recién nacidos de muy bajo peso (RNMBP) y demuestra que la adición de L-carnitina a la solución de NP genera un aumento de los niveles plasmáticos sin mejoría alguna del perfil lipídico (medido en forma de carnitina libre, acilcarnitina y ácidos grasos libres), ganancia ponderal en los primeros 28 días de vida, mortalidad ni morbilidad específica. Durante la fase de NP, los valores de carnitina libre fueron consistentemente más altos en los lactantes suplementados y la recuperación de los niveles plasmáticos ocurrió más rápidamente en los lactantes de mayor edad gestacional, relacionado muy probablemente con el inicio temprano de la nutrición enteral, suplementada con carnitina. A pesar de estos resultados, la suplementación con carnitina no alteró el metabolismo de los ácidos grasos de cadena larga. En este estudio también se recogió la variable de estancia hospitalaria, al igual que ya hicieron Whitfield y cols.19 en 2003, llegando ambos a la conclusión de que la suplementación con L-carnitina no se traduce en una disminución de la misma.
El estudio de Clark y cols.22 estaba diseñado con lactantes prematuros que no requerían aportes nutricionales de manera parenteral por más de 28 días, de manera que los niveles plasmáticos de carnitina se normalizaron a medida que ocurría la transición de nutrición parenteral a enteral (días 7-28), suplementada con L-carnitina. Sin embargo, en la práctica clínica habitual nos encontramos con RNMBP que necesitan NP de manera prolongada, durante más de un mes. Serían necesarios más estudios para demostrar si esta población de pacientes se beneficiarían de la suplementación rutinaria de L-carnitina en la solución de NP, cuyos niveles plasmáticos están muy por debajo de lo habitual debido a una menor reserva tisular e imposibilidad de transición a la nutrición enteral por su inmadurez digestiva.
Cabe destacar que O’Donnell y cols.18 en 2002 y Whitfield y cols.19 en 2003 diseñaron sus estudios incluyendo parámetros relacionados con la apnea idiopática en el RNPT. La apnea del prematuro puede deberse a una alteración en el centro de control respiratorio del cerebro, denominada apnea central, o a un proceso mecánico, la apnea obstructiva, en la que la respiración se detiene por un bloqueo de las vías respiratorias. Los problemas presentes en otros órganos también pueden afectar al centro de control respiratorio. Es posible que la apnea del prematuro no tenga otra causa identificable sino la inmadurez del sistema nervioso central. La explicación a que la carnitina pueda mejorar esta patología radica en que su deficiencia produce una disminución de la producción de energía a nivel muscular. En ambos estudios no se manifestaron efectos positivos con su suplementación en la solución de NP. Posteriormente, Crill y cols.21 publicaban en 2006 sus resultados y concluían que la suplementación en niños prematuros podía mejorar la respiración periódica en este grupo de pacientes, pero sin diferencias estadísticamente significativas en cuanto a necesidad de ventilación mecánica y duración, e incidencia de displasia broncopulmonar en ambos grupos de pacientes. En el estudio de Ozturk y cols.26, la incidencia de displasia broncopulmonar fue menor en el grupo tratado con carnitina, aunque sin significación estadística. La causa de esta discordancia podría radicar en la distinta dosis de carnitina utilizada en cada estudio: 20 mg/-kg/día en el caso del primero y 30 mg/kg/ día en el caso del segundo. El diseño de ambos estudios también era diferente, ya que Ozturk y cols.26 pretendían demostrar el beneficio clínico de la suplementación de carnitina en lactantes prematuros con síndrome de distrés respiratorio (SDR). Numerosos estudios han identificado la presencia de niveles plasmáticos bajos de carnitina en RNPT con SDR27. El tratamiento con carnitina de niños prematuros con SDR puede disminuir la duración de la ventilación mecánica, el uso de surfactante pulmonar y la aparición de displasia broncopulmonar26.
A pesar del alto riesgo de deficiencia de carnitina, no existen estándares para la administración de suplementos en RNPT que reciben NPT.
Prácticamente todos los estudios parecen confirmar que la deficiencia en los niveles plasmáticos de carnitina a corto plazo no se relaciona con síntomas clínicamente relevantes en los pacientes que la padecen: ni menor ganancia ponderal, ni hipertrigliceridemia ni menor estancia hospitalaria. Por ello, no recomiendan la suplementación profiláctica de L-carnitina en la NP, ya que además no está exenta de riesgos. Sulkers y cols.15 observaron un aumento de la tasa metabólica y de la excreción de nitrógeno, aunque bien es cierto que utilizaban una dosis (48 mg/kg/día) muy por encima de las recomendadas en la actualidad (10-20 mg/kg/día). Recientemente Clark y cols.28 publicaron los resultados de su estudio, que realizaron con el objetivo de evaluar el conocimiento, las creencias y la práctica clínica con respecto a la deficiencia de carnitina y la administración de suplementos entre los neonatólogos a través de una encuesta electrónica. Un total de 492 profesionales fueron encuestados, y solo el 5% determinó analíticamente la deficiencia en los lactantes pretérmino; el 40% administró de manera rutinaria suplementos de L-carntina, a pesar de que el 60% creía que su déficit podría tener consecuencias graves. Los resultados pusieron de manifiesto una falta de consenso entre los profesionales sanitarios sobre el posible beneficio de la suplementación, así como de los posibles riesgos de su deficiencia para los RNPT.
Las limitaciones de esta revisión radican en la diferencia del diseño de los diferentes estudios, así como en las dosis de carnitina utilizadas (rango de 8 a 48 mg/kg/día) o duración de la suplementación. Sería conveniente realizar estudios más homogéneos en cuanto al diseño, así como analizar la necesidad de suplementación en aquellos recién nacidos que requieren NP a largo plazo.
En conclusión, y según la revisión de la bibliografía existente, casi la totalidad de los autores demuestran que la suplementación rutinaria en la NP de RNPT con L-carnitina sí que puede mejorar los niveles plasmáticos pero sin llegar a alcanzar una mejoría significativa en el perfil lipídico, y lo más importante, tampoco un aumento de la ganancia ponderal, disminución de la morbilidad y mortalidad o reducción de la estancia hospitalaria. Son necesarios más estudios para demostrar si la suplementación sistemática con L-carnitina de RNPT que requieren NPT durante más de un mes aportaría algún beneficio con relevancia clínica a estos pacientes tan vulnerables.
Bibliography
Gil A. Tratado de nutrición. Bases fisiológicas y bioquímicas de la nutrición. Tomo I. 2ª ed. Madrid: Editorial Médica Panamericana; 2010. [ Links ]
Seong SH, Cho SC, Park Y, Cha YS. L-carnitine supplemented parenteral nutrition improves fat metabolism but fails to support compensatory growth in premature Korean infants. Nutr Res. 2010;30(4):233-39. DOI: 10.1016/j.nutres.2010.04.004 [ Links ]
Cairns PA, Stalker DJ. Carnitine supplementation of parenterally fed neonates. Cochrane Database Syst Rev. 2007;4:CD000950. [ Links ]
Shenai JP, Borum PR. Tissue carnitine reserves of newborn infants. Pediatr Res. 1984;18(7):679-81. DOI: 10.1203/00006450-198407000-0002 [ Links ]
Penn D, Ludwigs B, Schmidt-Sommerfeld E, Pascu F. Effect of nutrition on tissue carnitine concentrations in infants of different gestational ages. Biol Neonate. 1985;47(3):130-5. DOI: 10.1159/000242103 [ Links ]
Meyburg J, Schulze A, Kohlmueller D, Pöschl J, Linderkamp O, Hoffmann GF, et al. Acylcarnitine profiles of preterm infants over the first four weeks of life. Pediatr Res. 2002;52(5):720-3. DOI: 10.1203/00006450-200211000-0001 [ Links ]
Morgan J, Young L, McGuire W. Incremento lento de los volúmenes de alimentación enteral para prevenir la enterocolitis necrosante en recién nacidos de muy bajo peso al nacer (Revisión Cochrane traducida). Cochrane Database Syst Rev. 2011;3:CD001241. [ Links ]
Gilbertson N, Kovar IZ, Cox DJ, Crowe L, Palmer NT. Introduction of intravenous lipid administration on the first day of life in the very low birth weight neonate. J Pediatr. 1991;119(4):615-23. [ Links ]
Long CS, Haller RG, Foster DW, McGarry JD. Kinetics of carnitine dependent fatty acid oxidation: implications for human carnitine deficiency. Neurology. 1982;32(6):663-6. [ Links ]
Jadad AR, Moore RA, Carroll D, Jenkinson C, Reynolds DJM, Gavaghan DJ, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials. 1996;17(1):1-12. [ Links ]
Penn D, Schmidt-Sommerfeld E, Wolf H. Carnitine deficiency in premature infants receiving total parenteral nutrition. Early Hum Dev. 1980;4(1):23-4. [ Links ]
Coran AG, Drongowski RA, Baker PJ. The metabolic effects of oral L-carnitine administration in infants receiving total parenteral nutrition with fat. J Pediatr Surg. 1985;20(6):758-64. [ Links ]
Larsson LE, Olegard R, Ljung L, Niklasson A, Rubensson A, Gederblad G. Parenteral nutrition in preterm neonates with and without carnitine supplementation. Acta Anaesthesiol Scand. 1990;34(6):501-5. [ Links ]
Helms RA, Mauer EC, Hay WW, Christensen ML, Storm MC. Effect of intravenous L-carnitine on growth parameters and fat metabolism during parenteral nutrition in neonates. JPEN J Parenter Enteral Nutr. 1990;14(5):448-53. DOI: 10.1177/0148607190014005448 [ Links ]
Sulkers EJ, Lafeber HN, Degenhart HJ, Przyrembel H, Schlotzer E, Sauer PJJ. Effects of high carnitine supplementation on substrate utilization in low-birth-weight infants receiving total parenteral nutrition. Am J Clin Nutr. 1990;52(5):889-94. [ Links ]
Bonner CM, DeBrie KL, Hug G, Landrigan E, Taylor BJ. Effects of parenteral L-carnitine supplementation on fat metabolism and nutrition in premature neonates. J Pediatr. 1995;126(2):287-92. [ Links ]
Shortland GJ, Walter JH, Stroud C, Fleming PJ, Speidel BD, Marlow N. Randomised controlled trial of L-carnitine as a nutritional supplement in preterm infants. Arch Dis Child Fetal Neonatal Ed. 1998;78(3):F185-8. [ Links ]
O´Donnell J, Finer NN, Rich W, Barshop BA, Barrington KJ. Role of L-carnitine in apnea of prematurity; a randomized, controlled trial. Pediatrics. 2002;109(4):622-6. [ Links ]
Whitfield J, Smith T, Sollohub H, Sweetman L, Roe CR. Clinical effects of L-carnitine supplementation on apnea and growth in very low birth weight infants. Pediatrics. 2003;111(3):477-82. [ Links ]
Pande S, Brion LP, Campbell DE, Gayle Y, Esteban-Cruciani NV. Lack of effect of L-carnitine supplementation on weight gain in very preterm infants. J Perinatol. 2005;25(7):470-7. DOI: 10.1038/sj.jp.7211334 [ Links ]
Crill CM, Storm MC, Christensen ML, Hankins CT, Jenkins MB, Helms RA. Carnitine supplementation in premature neonates: effect on plasma and red blood cell total carnitine concentrations, nutrition parameters and morbidity. Clin Nutr. 2006;25(6):886-96. DOI: 10.1016/j.clnu.2006.05.002 [ Links ]
Clark RH, Chace DH, Spitzer AR. Impact of L-carnitine supplementation on metabolic profiles in premature infants. J Perinatol. 2017;37(5):566-71. DOI: 10.1038/jp.2016.253 [ Links ]
Schmidt-Sommerfeld E, Penn D, Wolf H. Carnitine deficiency in premature infants receiving total parenteral nutrition: effect of L-carnitine supplementation. J Pediatr. 1983;102(6):931-5. [ Links ]
Honzík T, Chrastina P, Hansíková H, Böhm M, Martincová O, Plavka R, et al. Carnitine concentrations in term and preterm newborns at birth and during the first days of life. Prague Med Rep. 2005;106(3):297-306. [ Links ]
Winther B, Jackson D, Mulroy C, MacKay M. Evaluation of serum carnitine levels for pediatric patients receiving carnitine-free and carnitine-supplemented parenteral nutrition. Hosp Pharm. 2014;49(6):549-53. DOI: 10.1310/hpj4906-549 [ Links ]
Ozturk MA, Kardas Z, Kardas F, Gunes T, Kurtoglu S. Effects of L-carnitine supplementation on respiratory distress syndrome development and prognosis in premature infants: a single blind randomized controlled trial. Exp Ther Med. 2016;11(3):1123-7. DOI: 10.3892/etm.2015.2964 [ Links ]
Korkmaz A, Tekinalp G, Coskun T, Yigit S, Yurdakok M. Plasma carnitine levels in preterm infants with respiratory distress syndrome. Pediatr Int. 2005; 47(1):49-52. DOI: 10.1111/j.1442-200x.2005.01998.x [ Links ]
Clark MA, Stein REK, Silver EJ, Khalid S, Fuloria M, Esteban-Cruciani NV. Carnitine deficiency in preterm infants: A national survey of knowledge and practices. J Neonatal Perinatal Med. 2017;10(4):381-6. DOI: 10.3233/NPM-16146 [ Links ]
Recibido: 26 de Enero de 2018; Aprobado: 26 de Marzo de 2018











 texto em
texto em 




