Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Farmacia Hospitalaria
versão On-line ISSN 2171-8695versão impressa ISSN 1130-6343
Farm Hosp. vol.44 no.1 Toledo Jan./Fev. 2020 Epub 06-Jul-2020
https://dx.doi.org/10.7399/fh.11333
Artículos Especiales
Funciones y responsabilidades del farmacéutico de hospital con los medicamentos CAR-T
1Servicio de Farmacia, Hospital de la Santa Creu i Sant Pau, Barcelona. España.
2Servicio de Farmacia, Hospital Sant Joan de Déu, Esplugues de Llobregat. España.
3Servicio de Farmacia, Institut Català d’Oncologia-Hospitalet, Hospitalet de Llobregat. España.
4Servicio de Farmacia, Hospital Universitari Vall d’Hebron, Barcelona. España.
El desarrollo y la comercialización de medicamentos de terapia celular con células T con receptor de antígeno quimérico (CAR-T) suponen un nuevo reto para la farmacia hospitalaria en España. El objetivo de este artículo es revisar los aspectos clave de estos medicamentos y describir el papel del farmacéutico oncohematológico dentro del equipo clínico multidisciplinar en las diferentes fases del proceso transversal que implica el tratamiento con medicamentos CAR-T, desde la indicación hasta el seguimiento a corto y largo plazo de los pacientes tratados con este tipo de terapias, con una importante mención al manejo de sus principales efectos adversos. La terapia tipo CAR-T ofrece al farmacéutico hospitalario la oportunidad de trabajar en estrecha colaboración con el resto de los profesionales clínicos implicados en el proceso, permitiendo su contribución en el desarrollo de procedimientos, guías de práctica clínica de abordaje global y estableciendo puntos de partida para afrontar tratamientos futuros de complejidad similar e incluso mejorar procesos base anteriormente establecidos.
PALABRAS CLAVE: Receptor antigénico quimérico de células T; Síndrome de liberación de citoquinas; Síndrome de encefalopatía relacionada con CAR-T; Atención farmacéutica
Introducción
Los progresos científicos en biotecnología celular y molecular de los últimos 15 años han llevado al desarrollo de medicamentos de terapia celular con las células T con receptor de antígeno quimérico (CAR-T), que se han convertido en una de las principales terapias inmunocelulares contra el cáncer. La Comisión Europea ha autorizado la comercialización de los dos primeros medicamentos con células CAR-T: tisagenlecleucel (Kymriah®), titular de la autorización Novartis Europharm Limited, y axicabtagene ciloleucel (Yescarta®), titular de la autorización KitePharma EU B.V. grupo Gilead. El objetivo de este artículo es revisar los aspectos clave de estos medicamentos y describir el papel que el farmacéutico oncohematológico tiene en todo el proceso, desde la indicación hasta el seguimiento de los pacientes tratados con células CAR-T, con una importante mención al manejo de los principales efectos adversos.
Descripción de las células CAR-T
Las células CAR-T consisten en linfocitos T del propio paciente (autólogos) o de donantes (alogénicos) modificados genéticamente in vitro para expresar un receptor de antígeno quimérico que les confiere una especificidad de antígeno para su unión y posterior destrucción de las células malignas. La modificación genética la realiza el fabricante utilizando un vector viral derivado de un retrovirus o un lentivirus que lleva un nuevo gen que codifica para el receptor del antígeno quimérico. En los últimos años se han desarrollado CAR-T en múltiples centros académicos con constructos contra diferentes antígenos. Los dos medicamentos CAR-T comerciales actualmente disponibles, Kymriah® y Yeskarta®, son células CAR-T de segunda generación, en los que el vector viral lleva un gen que codifica para el punto de unión del anticuerpo específico para CD19, un dominio coestimulador de linfocitos T y un dominio intracelular para iniciar la señalización de la célula T. Estos medicamentos llevan el mismo receptor, por lo que son específicos para el mismo antígeno. Estas células CAR-T se dirigen a los tumores de células B, como la leucemia aguda linfoblástica de células B, el linfoma B difuso de células grandes y el linfoma B primario mediastínico de células grandes1,2. Sin embargo, muchos otros antígenos tumorales son también considerados diana de la terapia CAR-T en numerosos ensayos clínicos en fase de desarrollo, mayoritariamente dirigidos a neoplasias hematológicas, debido a la complejidad asociada a la utilización de células CAR-T en tumores sólidos.
Marco regulatorio de los medicamentos CAR-T
Las células CAR-T son medicamentos de terapia avanzada, por lo que están sujetos al Reglamento 1394/20073, que introduce disposiciones adicionales a las establecidas en la Directiva 2001/83/CE4 y el Reglamento 726/2004 sobre medicamentos de uso humano5. Este tipo de terapia implica su utilización en el contexto hospitalario. Así, el farmacéutico de hospital, como profesional clave en la gestión eficiente de cualquier medicamento dentro de su ámbito competencial, tiene la responsabilidad de contribuir al uso racional de los medicamentos CAR-T garantizando y asumiendo la responsabilidad técnica de su selección, adquisición, calidad, correcta conservación y custodia, gestión y cobertura de su demanda, así como de su adecuación final para su dispensación. Pero, además, la gestión de los medicamentos CAR-T exige establecer un sistema eficaz y seguro que garantice su correcta administración, así como el seguimiento y monitorización de su eficacia y seguridad a corto y a largo plazo6.
La autorización de comercialización de las células CAR-T obliga a cumplir con un plan de gestión de riesgos a nivel de farmacovigilancia, así como a registrar a todos los pacientes tratados en un registro europeo centralizado para monitorizar la seguridad y eficacia de estas terapias a largo plazo.
El Ministerio de Sanidad, Consumo y Bienestar Social (MSCBS) publicó en noviembre de 2018 el Plan de Abordaje de las Terapias Avanzadas en el Sistema Nacional de Salud: Medicamentos CAR7. Uno de los objetivos del Plan es organizar de forma planificada, equitativa, segura y eficiente la utilización de medicamentos CAR en el Sistema Nacional de Salud (SNS). Con el fin de garantizar la experiencia y los medios necesarios para realizar adecuadamente estos tratamientos, el Plan establece unos criterios para la selección de hospitales de referencia para la utilización de los medicamentos CAR-T en el SNS.
Funciones y responsabilidades del farmacéutico
La implantación de esta nueva modalidad terapéutica hospitalaria supone un importante reto para los servicios de farmacia y precisa formación específica en este ámbito, disponibilidad de nuevos recursos, así como gran coordinación con todos los profesionales del equipo multidisciplinar implicado en estos tratamientos, dentro del cual el farmacéutico será esencial para garantizar su optimización. En la Tabla 1 se resumen las responsabilidades del farmaceútico, recogidas en el Procedimiento de Gestión de Medicamentos CAR-T de la Sociedad Española de Farmacia Hospitalaria y en otros documentos elaborados por otras sociedades científicas. Algunos de estos puntos los ampliaremos a continuación8-11.
Tabla 1. Responsabilidades del farmacéutico8,9
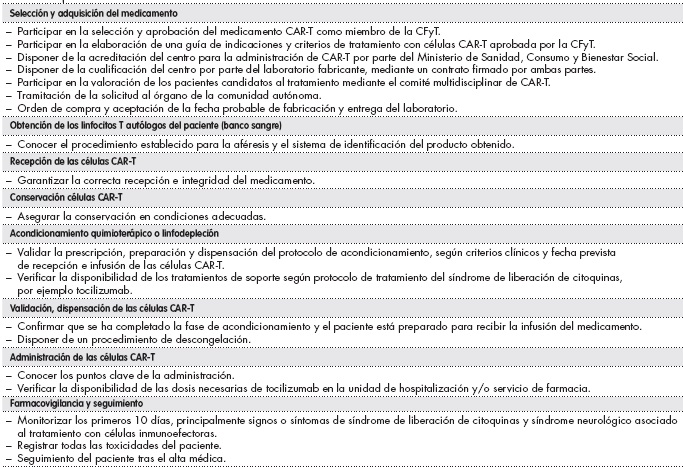
CAR-T: células T con receptor de antígeno quimérico; CFyT: Comisión de Farmacia y Terapéutica.
Selección y adquisición
La selección de los medicamentos CAR-T debe seguir el mismo procedimiento que otros medicamentos disponibles en el entorno hospitalario. Así, los medicamentos CAR-T serán evaluados por la Comisión de Farmacia y Terapéutica (CFyT), garantizando su calidad, seguridad, eficacia, coste y conveniencia, y comportará la aprobación del correspondiente protocolo de uso racional, así como su inclusión en la Guía Farmacoterapéutica del hospital. Esta inclusión implica garantizar la disponibilidad de los medios necesarios para su recepción, almacenamiento, dispensación y administración, así como la disponibilidad de los tratamientos de soporte necesarios para el manejo de los principales efectos secundarios asociados al tratamiento durante o después de su administración. Por otro lado, teniendo en cuenta las particularidades de este tipo de terapias, será necesario disponer de procedimientos específicos para su gestión logística.
La adquisición de los medicamentos CAR-T para uso asistencial dentro del SNS solo podrá realizarse en los hospitales seleccionados por el MSCBS a propuesta de las comunidades autónomas atendiendo a los criterios de selección establecidos por el grupo de expertos de terapia CAR‑T del Ministerio12. Los laboratorios fabricantes también cualifican a cada centro para la administración de su medicamento, firmando un con trato específico entre el laboratorio fabricante y el centro hospitalario.
La solicitud de un tratamiento CAR-T para un paciente dado implicará la evaluación individual del caso por parte del comité multidisciplinar de células CAR-T del centro del que forma parte un farmacéutico. En el comité se revisarán los datos demográficos, clínicos y administrativos relacionados con el paciente, así como la idoneidad de la indicación solicitada, según los criterios establecidos.
Una vez realizada la evaluación de la solicitud, si ésta se considera adecuada, el farmacéutico procederá a tramitarla al correspondiente órgano de la comunidad autónoma. La solicitud consiste en un formulario estandarizado e informe clínico anonimizado del paciente. Una vez validado por la comunidad autónoma, esta solicitud de tratamiento se remitirá a la Subdirección de Calidad y Medicamentos del MSCBS para su valoración y autorización, tal y como establece el Plan de Abordaje de las Terapias Avanzadas en el SNS: Medicamentos CAR. El grupo de expertos en la utilización de medicamentos CAR valorará, de manera individualizada, si cumple los criterios de indicación, informando y asesorando sobre los medicamentos CAR-T comercializados aptos para el paciente según el protocolo farmacoclínico de uso, así como la opción de acceso del paciente a los ensayos clínicos en marcha en el SNS, tanto académicos como industriales13,14. La Subdirección de Calidad y Medicamentos del MSCBS emitirá una decisión final respecto a la solicitud, que podrá ser favorable o no. Si la decisión es favorable, el farmacéutico será el responsable de:
Confirmar que la medicación CAR-T esté correctamente introducida y activada en todos los sistemas informáticos del hospital.
Realizar el pedido del medicamento CAR-T al correspondiente laboratorio, incluyendo informe clínico anonimizado del paciente vinculado a la prescripción médica y validación farmacéutica.
Comprobar la aceptación del pedido por parte del laboratorio, con fecha probable de fabricación.
Formalizar la orden de compra al aceptarse las condiciones de fecha de fabricación del laboratorio.
Obtención de los linfocitos T autólogos del paciente
A diferencia de los medicamentos convencionales, el material de partida para la fabricación de los medicamentos CAR-T deriva de un procedimiento de aféresis, técnica clínica mediante la cual se separan y seleccionan los componentes de la sangre necesarios para la producción de estos medicamentos, los linfocitos T9.
Habitualmente, los hospitales realizan las aféresis bajo una licencia de la Organización Nacional de Trasplantes, en las propias instalaciones del centro dependientes del servicio de hematología. El farmacéutico debe conocer el protocolo normalizado de trabajo (PNT) del procedimiento de aféresis e identificación del medicamento.
Recepción
El servicio de farmacia debe garantizar la correcta recepción de los medicamentos CAR-T en un área que cumpla las condiciones específicas requeridas para estos medicamentos8,9. El farmacéutico es responsable de la correcta recepción y es importante que tenga presentes los siguientes puntos:
Las células CAR-T criopreservadas se conservan y transportan por debajo de -120 ºC (Kymriah®) o -150 ºC (Yescarta®) en un contenedor criogénico en nitrógeno fase vapor.
El almacenamiento en nitrógeno en fase de vapor comporta riesgos para la salud, por lo que se requiere formación y un procedimiento específico de manipulación segura.
-
La recepción de las terapias celulares incluye:
-
- Revisión y validación de los sistemas de monitorización de temperatura que acompañan a los contenedores.
- Verificación de la integridad del medicamento, etiquetado y certificado de análisis detallado.
- Tiempo máximo que pueden estar a temperatura ambiente para el transfer al tanque de nitrógeno líquido.
- Procedimiento de recepción en horario fuera del habitual.
- Acuse de recibo de las células en la recepción, incluyendo la verificación de los criterios clínicos y de facturación del medicamento.
- Registro de la recepción en el sistema de gestión del medicamento del hospital.
-
Conservación
El servicio de farmacia debe asegurar que las células CAR-T se conservan en condiciones adecuadas, garantizando la disponibilidad de los siguientes requerimientos8,9:
Validación y dispensación
Acondicionamiento quimioterápico o linfodepleción
La mayoría de los medicamentos CAR-T son administrados después de un proceso de linfodepleción, que consiste en la administración de un régimen de acondicionamiento quimioterápico los días previos a la infusión de estos medicamentos. Por ello, esta fase del proceso requiere una gran coordinación entre el equipo multidisciplinar responsable del paciente, que debe valorar si éste sigue siendo candidato a recibir el tratamiento de lin fodepleción y el medicamento CAR-T y establecer la fecha prevista de infusión del CAR-T8.
Si el paciente es candidato al acondicionamiento de linfodepleción, el farmacéutico deberá validar la prescripción médica del protocolo correspondiente teniendo en cuenta los criterios de validación establecidos en el ámbito de los tratamientos oncohematológicos. En este caso, será necesario:
Disponer del correspondiente protocolo de acondicionamiento para CAR-T con su profilaxis antiinfecciosa asociada en el sistema habitual de prescripción, preparación y administración de quimioterapia propio del hospital.
Verificar la disponibilidad del medicamento CAR-T para el paciente, dado y que su fecha de caducidad es superior a la fecha de finalización de la linfodepleción y fecha estimada de infusión del medicamento CAR-T.
Registrar la preparación y dispensación de los fármacos del acondicionamiento.
Verificar la disponibilidad de los tratamientos de soporte que pueden ser necesarios durante o después de la administración del medicamento CAR-T. En este punto, el plan de gestión de riesgos obliga a disponer de 2-4 dosis de tocilizumab, fármaco con indicación aprobada en el tratamiento del síndrome de liberación de citoquinas (SLC) grave o potencialmente mortal que puede derivar de la administración del medicamento CAR-T. Se recomienda calcular la dosis de tocilizumab y reservar el número de viales necesarios para las dosis establecidas según el protocolo local, identificándolos con una etiqueta que incluya nombre del paciente, número de historia clínica, día de infusión de CAR-T, número de viales por dosis y el día que pueden volver al stock general en caso de no ser utilizados. La ubicación de estas dosis debe estar indicada en el PNT local, teniendo en cuenta las características propias de cada hospital. Alternativamente, pueden utilizarse fármacos similares, como siltuximab o anakinra15,16, aunque éstos no presentan dicha indicación en ficha técnica y se deben evaluar y aprobar en el protocolo de tratamiento del SLC por la CFyT.
El farmacéutico, como parte del equipo multidisciplinar, debe verificar que se ha completado la fase de linfodepleción correctamente y que el paciente está preparado para la infusión del medicamento CAR-T.
Validación, dispensación CART
De igual modo que el tratamiento de linfodepleción, el protocolo de infusión del medicamento CAR-T debe estar disponible en el sistema habitual de prescripción y administración propio del hospital, permitiendo su prescripción y programación para la fecha prevista y su posterior registro y seguimiento por parte de cualquier miembro del equipo responsable del paciente. Este protocolo debe incluir la premedicación concomitante, fármacos a evitar (por ejemplo, los corticoides desde cinco días antes de la infusión del CAR-T o los factores estimulantes de colonias de granulocitos y macrófagos), así como cualquier información relevante para su prescripción, validación o administración. El farmacéutico debe validar dicha prescripción teniendo en cuenta la finalización de las fases previas y los criterios clínicos del paciente8,9.
Después de la validación farmacéutica del tratamiento CAR-T, es importante la implicación del servicio de farmacia en la coordinación de la dispensación de los medicamentos CAR-T en la fecha y hora previstas para la infusión de los mismos, comprobando, junto con el resto del equipo multidisciplinar, que el paciente está preparado para la administración del medicamento9. Este proceso supone las siguientes actividades:
Realización de una doble verificación del nombre del paciente y nombre de la etiqueta del medicamento.
Retirada del medicamento del tanque de nitrógeno, con el correspondiente registro de su retirada.
Confirmación de un correcto procedimiento de descongelación del medicamento para su posterior dispensación. El servicio de farmacia debe asegurar que se dispone de equipos adecuados para la descongelación rápida de la/s bolsa/s criopreservada/s preparada/s para el paciente y que se utiliza una técnica aséptica para evitar la contaminación del medicamento. Al ser medicamentos cuya estabilidad descongelados puede ser corta (incluso menos de 30 minutos), se puede valorar descongelar en la unidad de hospitalización. En el caso de la existencia de dos o más bolsas para un paciente dado, las bolsas serán descongeladas de forma secuencial, de tal manera que hasta la finalización de la administración de la primera bolsa no se procederá con el proceso de adecuación de la segunda, y así sucesivamente. El proceso de descongelación debe ser registrado adecuadamente por el farmacéutico para cada una de las bolsas descongeladas.
Dispensación del medicamento CAR-T descongelado a la unidad de hospitalización clínica para su posterior administración, mediante su transporte en un contenedor específico con hielo seco o Dewar fase de vapor, si la descongelación se ha llevado a cabo fuera de la unidad de hospi talización. Dicha dispensación también debe ser registrada, dejando constancia de la fecha y hora de entrega para cada una de las bolsas destinadas al paciente y persona que recepciona el medicamento.
Confirmación de la disponibilidad en la unidad de hospitalización clínica de un carro de paradas y de las dosis necesarias de tocilizumab previamente consensuadas en el protocolo de tratamiento del SLC.
Administración
La correcta administración de las células CAR-T será responsabilidad del personal de enfermería. No obstante, es esencial la existencia de un registro, a ser posible en formato electrónico, que refleje el proceso de prescripción médica, validación farmacéutica y administración por parte de enfermería de los medicamentos CAR-T, así como de los tratamientos de soporte necesarios para este tipo de terapia y los posibles efectos adversos o complicaciones derivadas de la infusión9. En este sentido, se recomienda el sistema informático utilizado para los tratamientos oncohematológicos del hospital.
La administración de medicamentos CAR-T implica tener en cuenta una serie de puntos clave, que el farmacéutico puede verificar:
Disponer de los protocolos de premedicación, en los que se deberá indicar la dosis de todos los medicamentos a utilizar, como por ejemplo, paracetamol y antihistamínicos.
Suspender los corticoides antes de la administración del CAR-T (cinco días antes o cinco semividas de eliminación), excepto en caso de emergencia vital. Se permite el reemplazo fisiólogico de una dosis igual o menor de 40 mg al día de hidrocortisona o equivalente.
Manipular la bolsa con guantes y gafas para evitar el riesgo potencial de contagio de enfermedades infecciosas.
Utilizar equipo para infusión intravenosa sin látex y sin filtro de depleción de linfocitos.
Administrar la infusión a una velocidad de 10-20 ml por minuto.
Infundir todo el contenido de todas y cada una de las bolsas destinadas para el paciente.
Utilizar suero fisiológico para purgar el equipo antes de la infusión y para limpiarlo después de la infusión.
Lavar la bolsa con 10-30 ml de suero fisiológico, mediante retropur gado, cuando el volumen de la dispersión de células CAR-T ya ha sido infundido, para asegurar que se infunde el máximo número de células.
Tener disponible el carro de paradas en la unidad de hospitalización en la que se ha de administrar el medicamento CAR-T.
Comprobar la existencia en la unidad de enfermería y/o en el servicio de farmacia de las dosis necesarias de tocilizumab establecidas en el protocolo, además de otros medicamentos de soporte establecidos en los protocolos de manejo de efectos adversos de cada centro.
Disponer y tener conocimiento del PNT de gestión de residuos y derrames de fármacos peligrosos.
Farmacovigilancia y seguimiento
El plan de gestión de riesgos de los medicamentos CAR-T comercializados requiere la integración de un farmacéutico en el equipo asistencial, con responsabilidades clínicas sobre el paciente y con formación y experiencia en el reconocimiento y manejo de los efectos adversos asociados a este tipo de terapia, particularmente en el SLC, síndrome de lisis tumoral y sindrome neurologico asociado al tratamiento con celulas inmunoefectoras (ICANS), cuyos síntomas y recomendaciones se resumen en la Tabla 2 10,15.
Tabla 2. Efectos adversos de las células CAR-T10,15

CAR-T: células T con receptor de antígeno quimérico.
El efecto adverso que más preocupa es el SLC, el cual consiste en una respuesta sistémica de la activación y proliferación de las células CAR-T con liberación masiva y rápida de citoquinas en sangre. Inicialmente, se manifiesta con fiebre y síntomas gripales, como náuseas, cefalea y dolor corporal que se consideran síntomas leves, de grado 1 o 2. Se manejan con terapia de soporte, que incluye fluidoterapia intravenosa basada principalmente en suero fisiológico, antibióticos de amplio espectro, como meropenem, y analgésicos y antipiréticos como el paracetamol. El SLC puede presentar otros síntomas como insuficiencia renal, insuficiencia cardíaca, arritmias, diarrea o síndrome de debilidad capilar, y progresar a un síndrome de activación macrofágica/linfohistiocitosis hemofagocítica, con alteración hepática y trastornos de la coagulación.
Es necesario monitorizar cualquier signo de empeoramiento del SLC, como hipotensión (que puede llegar a requerir dosis altas de vasopreso res como la noradrenalina) o hipoxia (que puede llegar a requerir de oxigenoterapia e incluso ventilación mecánica). Tocilizumab debe estar disponible para poder iniciar el tratamiento en menos de dos horas y prevenir un daño orgánico irreversible. En los casos graves puede ser necesario iniciar tratamiento con corticoides, dexametasona o metilprednisolona. Existen otras estrategias terapéuticas recomendadas por expertos en algunos casos o situaciones en las que el paciente no responde o es refractario al tratamiento estándar con tocilizumab con o sin corticoides, como por ejemplo siltuximab (otro antiinterleucina-6), anakinra o filtros antiinterleucinas (como Cytosorb®), aunque no se dispone de una amplia experiencia para recomendar su incorporación a las guías de práctica clínica15,16. No se aconseja la administración en las primeras tres semanas de factores estimulantes de colonias de granulocitos y macrófagos por empeorar los síntomas del SLC15.
El otro efecto adverso grave es el ICANS, que se manifiesta con cambios marcados en el estado mental, afasia, somnolencia, confusión, temblores, alucinaciones, agitación, alteraciones en el habla, delirio, convulsiones e inconsciencia, entre otros. Se recomienda tener una valoración neurológica basal, que debe repetirse diariamente ante la sospecha de neurotoxicidad. A veces, la fisiopatología del SLC e ICANS se solapa, aunque son efectos adversos distintos que se deberán reconocer y tratar por un equipo multidisciplinar. En el caso de que el paciente presente SLC y neurotoxicidad de forma concomitante, puede ser necesario tratar con tocilizumab; sin embargo, si sólo presenta ICANS, no se recomienda su administración al poder empeorar los síntomas asociados15.
El alta del paciente se recomienda plantearla pasados al menos 10 días postinfusión de las CAR-T, pero residiendo el paciente en un alojamiento a menos de dos horas del centro los primeros 28 días después de la infusión, periodo en el que es más frecuente la aparición de efectos adversos. El farmacéutico debe participar como parte del equipo multidisciplinar en el seguimiento a largo plazo del paciente y conocer las recomendaciones de actuación en caso de:
-
Hipogammaglobulinemia:
- Valorar la utilización de antibióticos profilácticos.
- Valorar la terapia sustitutiva con inmunoglobulinas intravenosas, según la edad y las pautas estándar.
-
Citopenias prolongadas:
- Evitar la administración de factores estimulantes de colonias granulocíticas durante las tres primeras semanas postinfusión, ya que puede empeorar los síntomas de SLC.
-
Vacunas vivas:
- Evitar la administración de estas vacunas hasta la recuperación inmunológica.
Evaluación y registro de resultados en salud
En el Plan de Abordaje de las Terapias Avanzadas en el Sistema Nacional de Salud: Medicamentos CAR7 se plantea la necesidad de definir el modelo para la medición de los resultados en salud en la práctica clínica, con el objetivo de determinar el valor terapéutico añadido de los medicamentos CAR-T. Estas variables deben estar incluidas en el registro europeo específico de la European Society for Blood and Marrow Transplantation Cellular Therapy Registry and activities. El Plan establece que se empleará un sistema de información, que actualmente está en diseño, denominado “Sistema de información para determinar el Valor Terapéutico en la práctica clínica real de los Medicamentos de alto impacto sanitario y económico en el Sistema Nacional de Salud (VALTERMED)“7. El farmacéutico, por su formación e implicación en la evaluación de fármacos, debe participar activamente en este registro y evaluación.
Conclusiones
La llegada de los medicamentos CAR-T supone un nuevo reto para el farmacéutico especialista en farmacia hospitalaria, y muy especialmente para aquel experto en el paciente oncohematológico. Es de vital importancia conocer todas las responsabilidades e implicaciones que debe asumir durante las diferentes fases comprendidas en un tratamiento con CAR-T. Por ello, el farmacéutico oncohematológico debe integrarse y formar parte de forma activa del equipo clínico multidisciplinar encargado del manejo y seguimiento de los pacientes tratados con CAR-T, y todas sus funciones deberán quedar establecidas en los correspondientes procedimientos y guías locales de cada hospital.
Agradecimientos
El Grupo de Farmacia Oncológica de la Sociedad Española de Farmacia Hospitalaria (GEDEFO-SEFH) quiere agradecer a todos los autores que participaron en el Documento Procedimiento de Gestión de Medicamentos CAR-T; Jose María Alonso Herreros, Miguel Ángel Calleja Hernández, Ana María Cordero Cruz, Javier García Pellicer, Garbiñe Lizeaga Cundin, Ana Lozano Blázquez, Silvia Martín Prado, María José Otero López, Montserrat Pérez Encinas, José Luis Poveda Andrés y Xosé Manuel Rey Piñeiro, y a la Directora de la revista Farmacia Hospitalaria por la invitación para publicar este artículo especial cuyo objetivo es destacar el papel del farmacéutico oncohematológico en todo el proceso, desde la fabricación, hasta la administración y seguimiento de los medicamentos CAR-T, con un planteamiento eminentemente práctico.
REFERENCIAS
Spanish Agency of Medicines and Medical Devices. Medication Information Center (CIMA) (internet). Kymriah® data sheet. Madrid: Spanish Agency of Medicines and Medical Devices (accessed 11/10/2019). Available at: https://www.ema.europa.eu/en/documents/product-information/kymriah-epar-product-information_en.pdf [ Links ]
Spanish Agency of Medicines and Medical Devices. Medication Information Center (CIMA) (internet). Yescarta® data sheet. Madrid: Spanish Agency of Medicines and Medical Devices (accessed 11/10/2019). Available at: https://www.ema.europa.eu/en/documents/product-information/yescarta-epar-product-information_es.pdf [ Links ]
Regulation (EC) N. 1394/2007 of the European Parliament and of the Council on November 13, 2007 on advanced therapy medicines. Official Journal of the European Union No. L324 (December 10, 2007, pages 121-37). [ Links ]
Directive 2001/83/EC of the European Parliament and of the Council on November 6, 2001 establishing a Community Code on medicinal products for human use. Official Journal of the European Union No. L311 (November 28, 2001, pages 61-128). [ Links ]
Regulation (EC) 726/2004 of the European Parliament and of the Council on March 31, 2004, establishing community procedures for the authorization and control of medicinal products for human and veterinary use and establishing the European Medicines Agency. Official Journal of the European Union No. L136 (April 30, 2004, pages 1-69). [ Links ]
Royal Legislative Decree 1/2015, of July 24, which approves the consolidated text of the Law on guarantees and rational use of medicines and medical devices. Official State Gazette, No. 177, (July 25, 2015). [ Links ]
Ministry of Health, Consumption and Social Welfare. Plan de abordaje de las terapias avanzadas en el Sistema Nacional de Salud: medicamentos CAR (internet). Madrid; 2018 (accessed 09/01/2019). Available at: https://www.mscbs.gob.es/profesionales/farmacia/pdf/Plan_Abordaje_Terapias_Avanzadas_SNS_15112018.pdf [ Links ]
Alonso Herreros JM, Calleja Hernández MA, Carreras Soler MJ, Cordero Cruz AM, García Pellicer J, Lizeaga Cundin G, et al. Procedimiento de gestión de medicamentos CAR-T. Madrid: Sociedad Española de Farmacia Hospitalaria; 2019. [ Links ]
Black A. Pharmacy Institutional Readiness for Marketed CAR-T Therapy: Checklists for Pharmacy Services. Version 3.0 (internet). Specialist Pharmacy Service; 2018 (accessed 09/01/2019). Available at: https://www.sps.nhs.uk/wp-content/uploads/2018/10/FINAL-Pharmacy-Institutional-Readiness-for-Marketed-CAR-TDec-2018.pdf [ Links ]
Mahmourdjafari Z, Hawks KG, Hsieh AA, Piesca D, Gatwood KS, Culos KA. American Society for Blood and Marrow Transplantation Pharmacy Special Interest Group Survey on Chimeric Antigen Receptor T Cell Therapy Administrative, Logistical and Toxicity Management Practices in the United States. Biol Blood Marrow Transplant. 2019;25(1):26-33. [ Links ]
Clemmons AB, Alexander M, DeGregory K, Kennedy L. The Hematopoietic Cell Transplant Pharmacist: Roles, Responsibilities and Recommendations from the ASBMT Pharmacy Special Interest Group. Biol Blood Marrow Transplant. 2018;24(5):914-22. [ Links ]
Dirección General de Cartera Básica de Servicios del SNS y Farmacia. Criterios y estándares designación de centros CAR-T (internet). Madrid: Ministerio de Sanidad, Consumo y Bienestar Social; 2019 (accessed 09/01/2019). Available at: https://www.mscbs.gob.es/profesionales/farmacia/pdf/20190304_Criterios_Estandares_Desig_Centros_CAR_T.pdf [ Links ]
Dirección General de Cartera Básica de Servicios del SNS y Farmacia. Protocolo farmacoclínico del uso de tisagenlecleucel en linfoma B difuso de células grandes en el Sistema Nacional de Salud (internet). Madrid: Ministerio de Sanidad, Consumo y Bienestar Social; 2019 (accessed 25/09/2019). Available at: https://www.mscbs.gob.es/profesionales/farmacia/pdf/20190508_Protocolo_farmacoclinico_tisagenlecleucel_LBDCG.pdf [ Links ]
Dirección General de Cartera Básica de Servicios del SNS y Farmacia. Protocolo farmacoclínico del uso de tisagenlecleucel en la leucemia linfoblastica aguda de células B en el Sistema Nacional de Salud.(internet). Madrid: Ministerio de Sanidad, Consumo y Bienestar Social; 2019 (accessed 25/09/2019). Available at: https://www.mscbs.gob.es/profesionales/farmacia/pdf/20190508_Protocolo_farmacoclinico_tisagenlecleucel_LLA.pdf [ Links ]
Dirección General de Cartera Básica de Servicios del SNS y Farmacia. Protocolo clínico para el manejo de los efectos adversos graves en pacientes tratados con medicamentos que contienen células T CAR (Chimeric Antigen Receptor) anti-CD 19 (CART-19) (internet). Madrid: Ministerio de Sanidad, Consumo y Bienestar Social; 2019 (accessed 25/09/2019). Available at: https://www.mscbs.gob.es/profesionales/farmacia/pdf/20190508_Protocolo_manejo_efectos_adversos_CAR_T.pdf [ Links ]
London Medicines Information Service. Evidence for use of siltuximab or anakinra as second line therapies (after failure of tocilizumab) for Cytokine Release Syndrome (CRS) following use of Chimeric Antigen Receptor T-cell (CAR- T) therapy (internet). London: National Health Service; 2019 (accessed 25/09/2019). Available at: https://www.sps.nhs.uk/wp-content/uploads/2019/05/SPS_Siltuximab_Anakinra_CRS_postCAR_T_FINALApr19.pdf [ Links ]
Recibido: 03 de Octubre de 2019; Aprobado: 20 de Noviembre de 2019











 texto em
texto em 


