Introducción
El objetivo del trasplante de progenitores hematopoyéticos (TPH), en indicaciones malignas, es regenerar la función medular, tras haberla suprimido al someter al paciente previamente a un régimen de acondicionamiento, y/o aportar un mecanismo antitumoral por el efecto del injerto contra el tumor1,2. Después del acondicionamiento, se pueden producir diversas complicaciones3 por lo que los pacientes requieren el uso de una gran cantidad de medicamentos, lo que aumenta las posibilidades de interacciones farmacológicas (IF). Las IF más preocupantes son las que resultan perjudiciales y, en consecuencia, debemos identificarlas, prevenirlas y resolverlas para evitar sus efectos adversos sobre los pacientes4,5.
Los pacientes sometidos a TPH son tratados con unos regímenes farmacológicos muy complejos, cuya combinación puede dar lugar a múltiples IF, lo que puede incrementar el riesgo de efectos adversos o reducir la efectividad del tratamiento. De hecho, algunos autores han descrito reacciones adversas graves, como rabdomiólisis6,7, e incluso complicaciones mortales asociadas con IF en el contexto de TPH8. Otros factores que pueden contribuir a aumentar las IF son el número de fármacos administrados, la duración de la estancia en el hospital y el tipo de procedimiento al que se somete el paciente. Además, estos pacientes pueden presentar comorbilidades asociadas, incluyendo disfunción renal y hepática, deficiente estado nutricional y disminución de la unión a proteínas, lo que amplía el riesgo de IF clínicamente relevantes9-11.
El objetivo primario de este trabajo es identificar, mediante revisión bibliográfica sistemática, los estudios sobre IF en pacientes sometidos a TPH. Los objetivos secundarios son describir la prevalencia de dichas IF y extraer información de interacciones fármaco-fármaco concretas.
Métodos
Se realizó una revisión bibliográfica estructurada, en las bases de datos PubMed y Embase, buscando identificar todos los artículos originales relacionados con las IF en pacientes sometidos a TPH, siguiendo la metodología PRISMA. Se incluyeron en el análisis artículos procedentes de ensayos clínicos, estudios observacionales, casos clínicos o series de casos originales y cartas al editor. Los criterios de inclusión fueron artículos originales con resultados relacionados directamente con el objetivo de la revisión, publicados en inglés o español, entre el 1 de enero de 2000 y el 27 de noviembre de 2020. Los criterios de exclusión fueron publicaciones sobre IF no relacionadas con el TPH, publicaciones no relacionadas con IF, estudios no originales y los trabajos publicados solo en forma de comunicación a congreso.
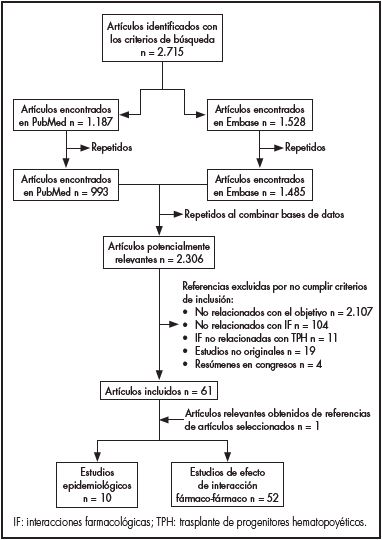
Los términos de búsqueda para “all fields” fueron: “drug-drug interaction”, “drug interaction”, “stem cell transplant”, “transplantation conditioning” y “conditioning regimen” para la base de datos PubMed; y “drug interaction”, “stem cell transplantation” y “transplantation conditioning” para la base de datos Embase, combinados con los operadores booleanos “OR” y “AND”. Las publicaciones adicionales se obtuvieron de referencias relevantes, a criterio de los autores, incluidas en los artículos seleccionados inicialmente. En la figura 1 se muestra el diagrama de flujo de selección de los artículos.
Los datos relevantes de cada publicación fueron extraídos por un autor y comprobados independientemente por otro de los autores, mientras que las discrepancias entre ambos fueron resueltas por un tercer investigador. La selección de las publicaciones pasaba un filtro inicial en el que se revisaba el título y el resumen, posteriormente se revisaba el texto completo para verificar que respondía al objetivo del estudio. En caso de información redundante, se seleccionaron los artículos más actualizados, claros y amplios.
Se recogieron y analizaron las características epidemiológicas de los estudios: tipo de estudio, base de datos utilizada, prevalencia y frecuencia de IF, número de IF totales, número de IF por paciente, IF más frecuentes, el mecanismo de acción, la severidad, los factores de riesgo y los fármacos implicados con mayor frecuencia, así como el efecto de la IF identificado en los estudios fármaco-fármaco.
Resultados
Se obtuvieron 2.715 títulos (PubMed 1.187 registros y Embase 1.528 registros). Después de eliminar los duplicados, los que por su título y resumen no tenían relación con el objetivo y los que eran resúmenes de congresos, se obtuvieron 62 registros que cumplían con los criterios de inclusión. De éstos, 10 artículos se clasificaron como epidemiológicos y 52 como estudios de análisis de los efectos de las interacciones fármaco-fármaco. Las tablas 1 y 2 recogen las características, objetivos y principales hallazgos de los estudios incluidos.
Tabla 1. Resumen de los estudios epidemiológicos incluidos en la revisión.

AUC: área bajo la curva; IF: interacción farmacológica; TFG: tasa de filtrado glomerular; TPH: trasplante de progenitores hematopoyéticos.
Tabla 2, (cont.). Resumen de los estudios farmacocinéticos incluidos en la revisión.

IF: interacción farmacológica.
Ocho de los 10 estudios epidemiológicos se centraban exclusivamente en pacientes sometidos a TPH, mientras que dos de ellos incluían también pacientes hematológicos en general12,13. El estudio en el que se incluyeron más pacientes contó con 38414. Seis estudios analizaron las IF del total de fármacos administrados, dos estudios se centraron en IF asociadas al uso de antimicrobianos15,16, uno en IF asociadas a antiinfecciosos, antineoplásicos e inmunomoduladores9 y otro en IF asociadas al ácido micofenólico17. El estudio de Sánchez et al. analizó de forma separada aquellas IF que pudiesen afectar a la función renal y las relacionó con reducción en la tasa de filtración glomerular18.
La mayoría de los estudios informaban sobre la base de datos utilizada, la prevalencia de IF, los fármacos más comúnmente implicados en las IF y las combinaciones de fármacos que presentaban más IF y de mayor gravedad. La base de datos más utilizada fue Micromedex®9,13,15,17. El estudio que más IF totales obtuvo en su población fue el de Gholaminezhad et al.14, con 13.600 IF en 384 pacientes, mientras que el que menos IF detectó fue el de Guastaldi y Secoli16, con 13 IF en 35 pacientes.
En cuanto a la prevalencia de IF por paciente, ésta osciló entre el 60% descrito por Guastaldi et al.19, utilizando la base de datos Drug Reax®, y el 100% en el estudio de Gholaminezhad et al.14, utilizando Lexi-Interact®. Fernández de Palencia et al.13, con una metodología distinta, describieron una prevalencia de IF por prescripción del 56,8%, utilizando Drug Interaction Facts® y un 74,1% con Micromedex®, en población hematológica no exclusivamente en TPH.
El mecanismo de acción de las IF detectadas fue mayoritariamente farmacocinético12,14,19, el inicio tardío16,19, la severidad moderada14,16,19o grave20. El estudio de Sánchez et al., sin embargo, indicó una prevalencia de IF farmacocinéticas diez veces menor que las IF farmacodinámicas18. Los antifúngicos azólicos se encontraron entre los fármacos más implicados en las IF en 6 de los 10 estudios epidemiológicos12-16,19.
Entre los factores que se asociaron al riesgo de IF se describen el número de medicamentos12,14,16, medicación concomitante no antineoplásica13,17y la edad y el sexo masculino según el estudio de Guastaldi y Secoli16.
De los 52 estudios de análisis de los efectos de las interacciones fármaco-fármaco, la mayoría farmacocinéticos, 18 trataban de la IF entre antifúngicos azólicos e inhibidores de la calcineurina7,8,21-36; 6 estudios de la IF entre antifúngicos azólicos y sirólimus37-42 5 estudios de la IF entre antifúngicos azólicos y otros fármacos (ciclofosfamida43, warfarina44, budesonida45, simvastatina6, inhibidores de la bomba de protones46); 15 estudios de la IF entre inhibidores de la calcineurina y otros fármacos (anfotericina B47, ciclofosfamida48, aprepitant49,50, micafungina51,52, caspofungina53, ritonavir54, bloqueadores de los canales de calcio55, imatinib56,57, fentanilo58, letermovir59,60, midostaurina61); 5 estudios sobre la IF de busulfán y otros fármacos (metronidazol62,63, N-acetilcisteína64, fludarabina65, blinatumumab66); un estudio sobre la IF entre aprepitant y ciclofosfamida66 67, un estudio sobre la IF entre rifampicina, sirólimus y voriconazol68 y otro estudio sobre la IF entre sirólimus y mirabegron69. Los efectos principales de estas IF se recogen en la tabla 2.
Según el estudio de Yang et al.8, 10 pacientes sufrieron complicaciones mortales asociadas potencialmente con la IF entre ciclosporina A e itraconazol o voriconazol al experimentar niveles supraterapéuticos de ciclosporina. Seis pacientes desarrollaron enfermedad injerto contra receptor de grado I a III y finalmente murieron por síndrome de neumonía idiopática o por hemorragia alveolar; otros cuatro pacientes murieron por complicaciones neurológicas asociadas a ciclosporina A. Otros autores describen reacciones graves, en concreto rabdomiólisis asociada a interacción entre azoles y estatinas6,7.
Discusión
El presente trabajo ha recopilado los estudios publicados sobre las IF en pacientes sometidos a TPH en los últimos 20 años. Destacan en los resultados de la búsqueda bibliográfica dos grupos de estudios: los epidemiológicos y los que analizan el resultado de la IF entre dos fármacos o grupos de fármacos concretos.
Los estudios epidemiológicos sobre las IF en pacientes sometidos a TPH son escasos y están realizados con metodologías muy dispares que muestran unos resultados heterogéneos. Se puede destacar de ellos la elevada prevalencia de IF en esta población, en particular de IF consideradas potencialmente graves o contraindicadas, y la heterogeneidad de resultados asociada, entre otros motivos, al uso de diferentes bases de datos.
Diversos autores han puesto de manifiesto esta heterogeneidad70,71, con diferencias relevantes en la prevalencia obtenida en una misma población al analizar con bases distintas. Por ejemplo, la diferente prevalencia descrita en pacientes hematológicos por Fernández de Palencia et al.13, del 56,8% usando Lexi Interaction Facts® y 74,1% usando Micromedex®, se observa en mayor grado en pacientes oncológicos72 (80% con Micromedex® y 30% con Drug Interaction Facts®) y en menor grado en pacientes oncohematológicos pediátricos73 (44,7% con Micromedex® y 51,3% con Drug Interaction Facts®). Un análisis estadístico de la concordancia entre estas dos bases de datos, comparando las IF detectadas en 1.166 tratamientos, pone de manifiesto una concordancia débil en la capacidad de detección de la presencia de IF potenciales y nula en los grados de severidad y evidencia científica otorgados a la misma IF71. Esta heterogeneidad dificulta su uso para la toma de decisiones en la práctica asistencial.
Destacan, en los estudios epidemiológicos, las IF entre grupos de fármacos de uso habitual en el TPH y riesgo bien conocido, como inhibidores de calcineurina y azoles. Sin embargo, emergen otras IF relevantes y quizás menos conocidas por los prescriptores, como las asociadas a los fármacos depresores del sistema nervioso central (benzodiacepinas, mórficos, etc.), antieméticos, corticoides, inhibidores de la bomba de protones, antidepresivos o antibióticos, descritas igualmente en estudios epidemiológicos en otros escenarios74-76.
El resto de los estudios, centrados mayoritariamente en una IF entre dos fármacos, destacan por focalizarse en el mecanismo de acción farmacocinético, no encontrando ninguno basado en IF farmacodinámicas. Los estudios farmacocinéticos tienen un patrón más similar a la hora de recoger la información.
La mayoría de los artículos publicados describen la IF entre antifúngicos azólicos e inhibidores de la calcineurina, que origina un aumento de las concentraciones séricas de los inhibidores de la calcineurina, al inhibir el metabolismo por el CYP3A4. Aunque, dependiendo del antifúngico y del inhibidor de calcineurina en cuestión, existen diferencias en cuanto a la potencia de la IF; por ejemplo, el aumento de las concentraciones séricas de los inhibidores de la calcineurina es aparentemente mayor con voriconazol que con fluconazol22,35, mientras que la magnitud de la IF con itraconazol es significativamente mayor para tacrólimus que para ciclosporina28. Varios estudios demuestran que las concentraciones de los azoles no se correlacionan con el aumento de las concentraciones de los inhibidores de la calcineurina26,27, aunque Masoumi et al. indican que sí existe dicha correlación31. Además, la vía de administración también desempeña un papel importante, ya que, por ejemplo, el fluconazol administrado por vía oral tiene un mayor impacto que por vía intravenosa en sus IF con los inhibidores intravenosos de la calcineurina23, o el tacrólimus vía oral se ve más afectado por el uso concomitante de voriconazol36. Cabe destacar que uno de los estudios identifica la implicación potencial de la IF entre ciclosporina y voriconazol o itraconazol en la muerte de diez pacientes que experimentaron niveles supraterapéuticos de ciclosporina: seis murieron por síndrome de neumonía idiopática o por hemorragia alveolar tras el desarrollo de enfermedad injerto contra receptor y cuatro por complicaciones neurológicas asociadas a ciclosporina A8.
Los antifúngicos azólicos están implicados en otra IF causada por su uso concomitante con sirólimus37-42, provocando un aumento de las concentraciones séricas de éste y requiriendo una reducción empírica de la dosis antes de combinarlo con azoles. También en la IF con fármacos como ciclofosfamida, en la que es más seguro utilizar fluconazol que itraconazol, ya que fluconazol inhibe el CYP2C9, lo que produce menor formación del 4-hidroxi-ciclofosfamida, metabolito tóxico de la ciclofosfamida43. Los azoles también aumentan las concentraciones séricas de warfarina44, budesonida45, simvastatina6 y lansoprazol46.
Por su parte, los inhibidores de la calcineurina están implicados en un gran número de IF, además de las producidas con los azoles. Las concentraciones de tacrólimus y de ciclosporina no parecen estar influenciadas por la presencia de micafungina51,52, tampoco la caspofungina influye en los niveles de tacrólimus; sin embargo, ésta parece aumentar las concentraciones séricas de ciclosporina53. La ciclosporina, en combinación con anfotericina B, conduce a un empeoramiento de la función renal estadísticamente significativo, pero clínicamente tolerable si se realiza una infusión de 24 horas y una estricta reposición de sales47. Además, la ciclosporina también se ha visto involucrada en IF con ciclofosfamida, la cual puede reducir sus concentraciones séricas48.
La mayoría de los estudios coinciden en el efecto de las IF que se producen entre los inhibidores de la calcineurina y otros fármacos, como el imatinib, que aumenta las concentraciones de ciclosporina56,57. Sin embargo, otros difieren; así, Shayani et al.50, en su estudio con 85 pacientes, concluyen que aprepitant aumenta las concentraciones de sirólimus pero no las de tacrólimus; en cambio, Ibrahim et al.49, con 26 pacientes en su estudio, sostienen que aprepitant sí aumenta las concentraciones de tacrólimus. Otro ejemplo lo encontramos en el estudio de Maples et al.60, con 46 pacientes, que defiende que no es necesario realizar ajustes de dosis de los inhibidores de calcineurina previos a la administración de letermovir; en cambio, la serie de tres casos publicada por Guo et al.59, sostiene que letermovir inhibe el CYP3A4 y aumenta las concentraciones de tacrólimus, aconsejando reducciones de dosis.
También cabe destacar estudios con varios fármacos de un mismo grupo terapéutico que muestran distinto perfil de IF. Así, Bernard et al.55 concluyen que nicardipino y amlodipino aumentan las concentraciones séricas de ciclosporina, mientras que lacidipino no interacciona con ésta. Por último, cabe destacar dos estudios que demostraron que la administración concomitante de metronidazol62 y fludarabina65 con busulfán aumenta las concentraciones séricas de éste.
Es muy relevante la publicación de casos clínicos que ponen de manifiesto consecuencias graves de algunas IF, como el presentado por Vives et al., en 2008, que describe cómo el uso concomitante de simvastatina, ciclosporina A y risperidona dio lugar a rabdomiólisis e insuficiencia renal7. También aquellos que describen IF relevantes con fármacos de reciente introducción en el mercado, como es el caso publicado recientemente por Mancini et al., que describe un aumento del 70% en los niveles séricos de ciclosporina A, por el uso concomitante con midostaurina61.
La principal limitación del presente estudio se deriva de la heterogeneidad de los estudios analizados y la ausencia de datos que cuantifiquen el impacto de las IF en los resultados clínicos de los pacientes.
En conclusión, la prevalencia de las IF en pacientes sometidos a TPH es alta en todos los estudios, siendo los resultados heterogéneos entre los diferentes autores, tanto en prevalencia como en el perfil de las IF. En ello repercuten las diferencias en los diseños de los estudios y en las bases de datos utilizadas. Entre los factores relacionados con el riesgo de que se produzcan IF destaca el elevado número de fármacos administrados a los pacientes. Los estudios que evalúan las interacciones fármaco-fármaco son todos farmacocinéticos y se centran mayoritariamente en las IF producidas entre antifúngicos azólicos e inhibidores de la calcineurina, o bien estos dos grupos con otros fármacos. Sería importante unificar los criterios de los estudios epidemiológicos para obtener unos resultados más consistentes que ayuden a establecer estrategias de reducción de riesgo, e investigar las IF de mecanismo farmacodinámico, así como estudiar en mayor profundidad las IF entre otros fármacos de uso muy frecuente en los TPH y en aquellos de introducción reciente en el arsenal terapéutico.