Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Anales del Sistema Sanitario de Navarra
versão impressa ISSN 1137-6627
Anales Sis San Navarra vol.28 no.3 Pamplona Set./Dez. 2005
REVISIONES
Implicación de la IL-6 y su polimorfismo -174G>C en el control del peso corporal y en las complicaciones
metabólicas asociadas a la obesidad
Role of IL-6 and its -174G>C polymorphism in weight management and in the metabolic comorbidities
associated with obesity
E. Goyenechea, M. D. Parra, J. A. Martínez Hernández
| RESUMEN La obesidad y sus comorbilidades se han relacionado con un estado proinflamatorio de bajo grado, en el que el tejido adiposo parece estar implicado. De hecho, el adipocito secreta diferentes citoquinas proinflamatorias, como la IL-6, entre otras. En efecto, las concentraciones elevadas de IL-6 se han asociado con elevados índices de masa corporal, con la diabetes mellitus tipo 2, con dislipemias y con la hipertensión arterial. Palabras clave. IL-6. Obesidad. Diabetes. Polimorfismo. Hipertensión arterial. | ABSTRACT Obesity and its comorbidities have been associated with a low grade proinflammatory state, in which the adipose tissue seems to be involved. In fact, this tissue produces different proinflammatory cytokines, such as IL-6 and others. Key words. IL-6. Obesity. Diabetes. Polymorphism. High blood pressure. |
| Departamento de Fisiología y Nutrición. Universidad de Navarra. Pamplona. Aceptado para su publicación el 29 de junio de 2005 | Correspondencia J. Alfredo Martínez Hernández Dpto. Fisiología y Nutrición (Universidad de Navarra) C/ Irunlarrea, 1 31008 Pamplona Tfno. 948 42 56 00; Ext: 6424 Fax 948 42 56 49 E-mail: jalfmtz@unav.es |
IMPLICACIÓN DE LA IL-6 SOBRE LA REGULACIÓN DEL PESO CORPORAL Y DEL METABOLISMO ENERGÉTICO
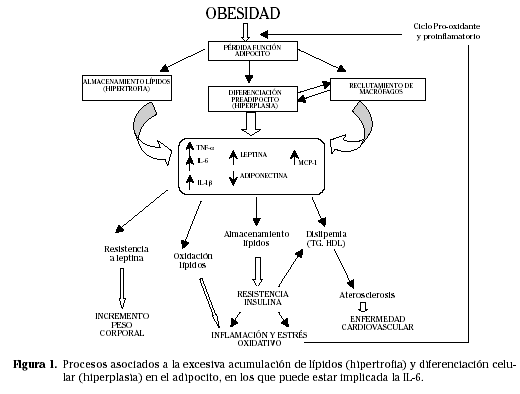
La obesidad se define como el resultado de un balance positivo entre la ingesta calórica y el gasto energético mantenido de forma crónica1. Este desequilibrio es clave para que el organismo acumule la energía excedente en el tejido adiposo y, por tanto, se promueva la ganancia de peso y la instauración de la obesidad. Los adipocitos poseen la capacidad de modificar su tamaño, así en épocas de grandes ingestas calóricas, las células adiposas almacenan triacilgliceroles, predominando la lipogénesis sobre la lipólisis2. Estos procesos están regulados por hormonas, por citoquinas y por diversos factores implicados en el metabolismo energético2.
Por otro lado, el tejido adiposo participa en la regulación de la función celular de muchos tejidos, así como del propio tejido adiposo, mediante un complejo entramado de señales endocrinas, paracrinas y autocrinas que influyen sobre el hipotálamo, el páncreas, el hígado, el músculo esquelético, así como sobre el sistema endotelial e inmunitario2. El acúmulo de grasa asociado a la obesidad, consecuencia del desequilibrio energético, se acompaña de hipertrofia e hiperplasia del tejido adiposo, es decir, aumento del número y tamaño de los adipocitos, además del reclutamiento de la serie monocito/macrófago (Fig. 1). De esta forma, el tejido adiposo libera adipoquinas, como la IL-6, el TNF- α y la IL-1β y hormonas como la leptina y la adiponectina. El incremento de la concentración de estas sustancias se asocia por un lado a otras alteraciones metabólicas, como la resistencia a la insulina, la dislipemia, la hipertensión arterial y la excesiva ganancia de peso entre otras, y por otro lado, este incremento da lugar a un ciclo pro-inflamatorio que podría contribuir al desarrollo de la obesidad, entrando así en un ciclo, en el que la inflamación del tejido adiposo juega el papel principal (Fig. 1). Así, la concentración de IL-6 se ha relacionado con distintos indicadores de adiposidad, como el peso, la masa grasa corporal y el perímetro de la cintura3,4. Los niveles elevados de esta citoquina también se han asociado con marcadores indirectos de la acumulación de grasa, como son el índice de masa corporal5 y el ratio cintura-cadera6. Otros autores han descrito niveles elevados de IL-6 circulante en obesos7 y en diabéticos de tipo 2 en relación a individuos de referencia8,9, por lo que se considera como un factor de riesgo en el desarrollo de estas patologías.
Por otro lado, el TNF-α, liberado junto a la IL-6 por el adipocito, podría estar implicado en estas observaciones, ya que su expresión se encuentra aumentada en la obesidad y podría estar induciendo la expresión de IL-6 tanto en el tejido adiposo como en otras células10. Además, el tejido adiposo visceral, cuya abundancia se relaciona con un mayor riesgo cardiovascular, libera de dos a tres veces más IL-6 que el tejido adiposo subcutáneo3, secretando otras moléculas que también inducen la expresión de IL-6. Además, se ha observado, un incremento de la concentración de IL-6 en el fluido intersticial del tejido adiposo subcutáneo, que aumenta tras la ingesta de alimentos junto con la glucemia y la insulinemia11, por lo que la IL-6 podría estar modulando el metabolismo hidrocarbonado del tejido adiposo12, de ahí su posible implicación en las patologías asociadas a la obesidad.
La IL-6 y su receptor se expresan en neuronas y células de la glía hipotalámica, pudiendo participar en la regulación de la masa grasa corporal13,14. En contraposición a lo expuesto anteriormente, los niveles de IL-6 en el líquido cefalorraquídeo se han correlacionado negativamente con el peso corporal y con la masa grasa, lo que sugiere que la obesidad podría estar relacionada paradójicamente con una deficiencia central de IL-6, que afectaría a la homeostasis energética15. Además, se ha descrito una mayor susceptibilidad a desarrollar obesidad y alteraciones metabólicas en ratones deficientes en IL-6, pudiendo ser causa de la obesidad la deficiencia central de esta citoquina. De hecho, otros autores han descrito que una inyección intracraneal de esta citoquina podría disminuir la masa grasa vía sistema nervioso central16.
En este contexto, el gen de la IL-6 se expresa en tejidos relacionados con el metabolismo energético, como el tejido adiposo, el músculo esquelético y el hipotálamo10. Según esto, diversas investigaciones han propuesto tres mecanismos para explicar la asociación de la expresión de la IL-6 con la regulación del metabolismo energético en humanos: a) la IL-6 podría activar la secreción de la hormona liberadora de corticotrofina (CRH) produciendo un aumento en el gasto energético16,17 b) la IL-6 podría activar el sistema nervioso simpático, aumentando el gasto energético18. De hecho, las neuronas del sistema simpático secretan esta citoquina, expresando además su receptor19 y c) la participación de la IL-6 en el metabolismo energético también podría estar mediada por la acción de la leptina20,21, que estimularía la lipólisis y la secreción de la hormona liberadora de corticotrofina, aumentando así el gasto energético22. Estos hallazgos resultan ser controvertidos con respecto a la implicación de la IL-6 en la obesidad, ya que un aumento del gasto energético parece favorecer la pérdida de peso y junto con la observación de que una deficiencia central de IL-6 podría estar implicada en el desarrollo de obesidad.
IMPLICACIÓN DE LA IL-6 SOBRE LAS ALTERACIONES METABÓLICAS RELACIONADAS CON LA OBESIDAD
La IL-6 se ha propuesto como un marcador de síndrome metabólico, ya que está implicada en muchas alteraciones relacionadas con la excesiva ganancia de peso. En la obesidad se produce una acumulación de tejido adiposo, relacionada con la resistencia a la insulina y con la enfermedad cardiovascular4. Así, la IL-6 ha sido implicada en la etiología de la resistencia a la insulina20, de la diabetes mellitus tipo 2, de la aterosclerosis y de la hipertensión arterial, entre otros procesos metabólicos23.
La IL-6 podría representar un factor hormonal inductor de la resistencia a la insulina a nivel del músculo24, mediado por la adiposidad25. Además, la administración de IL-6 recombinante humana (rh-IL-6) en sujetos normales indujo un aumento en los niveles de glucosa circulante26, sin modificar la concentración plasmática de insulina ni del péptido C, indicando un fallo en la respuesta pancreática de la célula beta. Complementariamente, se ha descrito una correlación inversamente proporcional entre la concentración plasmática de la IL-6 y los niveles plasmáticos basales de insulina en sujetos obesos24, sugiriendo una acción directa sobre la utilización metabólica de la glucosa. Por otro lado, la IL-6 induce lipólisis y oxidación de grasas, afectando posiblemente a la homeostasis de la glucosa de forma indirecta27. El desarrollo de la diabetes mellitus tipo 2 se caracteriza por presentar niveles elevados de marcadores de inflamación aguda, donde la IL-6 es el mediador principal9,28. De hecho, altos niveles de IL-6 se han relacionado con la intolerancia oral a la glucosa29 y con cierta capacidad predictiva en el desarrollo de diabetes mellitus tipo 2. Por el contrario, ratones transgénicos knockout para la IL-6 presentan niveles elevados de glucemia y una disminución de la tolerancia a la glucosa29. Este conjunto de investigaciones, confirman las discrepancias entre los niveles circulantes de IL-6 y su relación con el metabolismo hidrocarbonado y por tanto, la necesidad de realizar nuevos experimentos en esta área.
La IL-6, como potente inductor de la fase aguda de la inflamación, parece estar relacionada con alteraciones en el perfil lipídico, que acompaña a la resistencia a la insulina9,30. De hecho, la IL-6 se ha relacionado con la aparición de dislipemia en sujetos con síndrome metabólico30. El efecto de la IL-6 sobre el metabolismo lipídico podría depender del grado de activación de la citoquina, pudiendo llegar a inhibir la acción de la lipoproteín-lipasa hepática, aumentando la secreción de la fracción VLDL y de los niveles plasmáticos de ácidos grasos libres, aunque sin afectar a la concentración plasmática de colesterol9. De acuerdo con esta hipótesis, la concentración postpandrial de triacilgliceroles, de la fracción VLDL y de los ácidos grasos libres31, se ha asociado positivamente con la concentración de IL-6. Sin embargo, tras la activación de la fase aguda en situaciones de estrés, como tras cirugía mayor o tras infarto agudo de miocardio, se ha descrito una correlación negativa entre los niveles de IL-6 circulante y de colesterol total32.
Otros estudios han implicado a la IL-6 con la aterogénesis y con la hipertensión arterial33, habiéndose propuesto varios mecanismos para explicar esta asociación34, como la estimulación del sistema nervioso central y del sistema nervioso simpático mediada por IL-6. Además, podría estar contribuyendo a aumentar el colágeno de la pared vascular, induciendo la síntesis de fibrinógeno y aumentando la viscosidad sanguínea35. Por otra parte, se ha descrito que el tratamiento de la hipertensión arterial produce una disminución de los niveles circulantes de IL-6 en pacientes hipertensos jóvenes36, mientras que el m-RNA de la IL-6 y la propia citoquina han sido detectadas en lesiones ateroscleróticas37. También se ha demostrado que la IL-6 estimula otros procesos que contribuyen a la formación de la placa de ateroma, como la agregación plaquetaria, la producción de moléculas de adhesión por el endotelio, la proliferación de las células del tejido muscular liso y la producción de MCP-1 (monocyte chemotatic protein)38. Una elevación en la IL-6 es frecuente en pacientes con arterosclerosis carotídea, habiendo sido relacionados con un mayor riesgo a desarrollar isquemia cerebral39 y, en general, con las patologías asociadas a la arteriosclerosis y a la hipertensión.
GENÉTICA DE LA IL-6
El gen de la IL-6 en humanos se encuentra situado en el brazo corto de cromosoma 7 (7p21), mientras que el gen de su receptor (IL-6Rα) se sitúa en el brazo largo del cromosoma 1 (1q21)40. En los últimos años, se han descrito distintos polimorfismos de la región promotora del gen de la IL-6, como son el -572G>C, el -373A(n)T(n), el -597G>A y el -174G>C, siendo este último el de mayor prevalencia e importancia biológica.
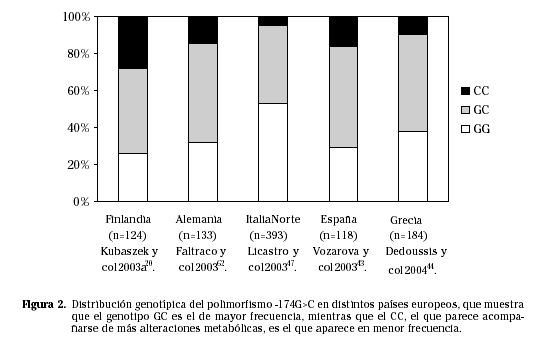
Existen tres genotipos para este polimorfismo: G/G, G/C y C/C, que parecen afectar a la trascripción de la citoquina41. El genotipo G/C presenta la prevalencia más elevada en la mayoría de estudios poblacionales realizados hasta el momento (Fig. 2). El genotipo CC, normalmente el de menor incidencia, ha sido relacionado con una menor expresión del gen y con niveles menores de IL-6 circulante. Otros estudios, han relacionado al alelo G con una mayor trascripción del gen y con una mayor producción de IL-6.
La distribución alélica del gen de la IL-6 parece estar influida por el origen étnico y la distribución geográfica. Por un lado, se puede observar una distribución alélica diferente entre la raza blanca y la afroamericana. El genotipo GG en americanos nativos y caucásicos43, ha sido asociado a diabetes mellitus tipo 2, mientras un estudio sueco y otro de población franco-canadiense han relacionado al alelo C con índices de obesidad44. En la población española, se ha asociado al alelo G con hiperglucemia, con una disminución en la sensibilidad a la insulina45 y con alteraciones lipídicas30.
EFECTOS FISIOPATOLÓGICOS ASOCIADOS A LA PRESENCIA DEL POLIMORFISMO -174G>C
El polimorfismo -174G>C se ha relacionado con una prevalencia elevada de algunas enfermedades, entre las que se encuentran algunas de origen inmunológico, como la artritis crónica juvenil42 y el linfoma de Hodgkin46, y enfermedades degenerativas como el Alzheimer47 y la osteoporosis48.
Además, las variantes de este polimorfismo se han asociado con la obesidad44 y con sus comorbilidades, tanto las de origen metabólico, como la resistencia a la insulina18 y la diabetes mellitus43, y con patologías relacionadas directamente con el sistema cardiovascular, como la arterosclerosis49, el infarto agudo de miocardio50 y la hipertensión arterial51.
Interacción del polimorfismo -174G>C con la regulación del peso corporal y del metabolismo energético
El polimorfismo -174G>C de la IL-6 se ha asociado, en repetidas ocasiones, con índices de obesidad y con sus comorbilidades, siendo el alelo C el que parece estar más relacionado con la adiposidad (Tabla 1). Así se ha observado, una mayor distribución del alelo G en sujetos delgados (índice de masa corporal<25kg/m2), presentando además un menor perímetro de la cintura44. En cuanto al alelo C, se ha asociado con valores elevados de índice de masa corporal52, con niveles elevados de leptina y con índices elevados de masa grasa corporal53.
Respecto al control del balance energético, los homocigotos para el alelo C presentaron un menor gasto energético y, por lo tanto, un mayor riesgo potencial a desarrollar obesidad18. Por otro lado, se ha descrito que los homocigotos GG adelgazan significativamente tras ejercicio físico, no observándose este efecto tan claramente en los portadores heterocigotos54, ni en los homocigotos del alelo C. Además, en los sujetos portadores del genotipo CC, la masa grasa y la insulina basal no disminuyeron significativamente con la actividad física54.
Sin embargo, estas relaciones del alelo C con medidas indirectas de la adiposidad contrastan con la investigación llevada a cabo por otros autores, que han hallado que los homocigotos GG presentan un mayor índice masa corporal y de otros marcadores asociados a la obesidad55. Estos resultados dispares en los datos publicados hasta el momento, justifican las futuras investigaciones en este campo.
Implicación del polimorfismo -174G>C en las alteraciones metabólicas relacionadas con la obesidad
La asociación entre el polimorfismo -174G>C y la sensibilidad a la insulina puede deberse a que el promotor de la IL-6 está situado muy próximo al promotor de esta hormona9. El genotipo CC se ha relacionado con niveles elevados de insulina basal y con una mayor respuesta a esta hormona tras sobrecarga44, con una menor sensibilidad a la misma9 y con un riesgo más elevado de desarrollar diabetes mellitus no insulinodependiente43,52. Además, un estudio reciente, realizado en adolescentes56, ha relacionado el genotipo CC con la diabetes mellitus tipo 1. De hecho, una mayor frecuencia del alelo G se ha descrito en sujetos que presentaban baja concentración circulante de glucosa e insulina44. Por el contrario, estudios recientes han relacionado el alelo G con una mayor resistencia a la insulina43, con un mayor riesgo de desarrollar diabetes mellitus tipo 2 y con una mayor susceptibilidad57 a desarrollar diabetes mellitus tipo 1. Siguiendo con esta hipótesis, el alelo C se ha asociado con bajos niveles de IL-6 circulante de insulina basal, de hemoglobina glicosilada, con un menor recuento de células blancas y una mayor sensibilidad a la insulina58. En contraposición, otros trabajos59 no han encontrado asociación entre el alelo C y el riesgo a desarrollar diabetes mellitus tipo 2. Dada la controversia, al relacionar los distintos genotipos con estas alteraciones, deberían realizarse estudios más completos que aclarasen lo expuesto.
La participación de la insulina en la utilización de los lípidos ha llevado a investigar la implicación del polimorfismo de la IL-6 en estas rutas metabólicas. Así, se ha observado que los individuos portadores del alelo G presentan niveles circulantes elevados tanto de triglicéridos totales como de la fracción VLDL y de ácidos grasos libres30, siendo la fracción HDL-colesterol más baja que en los portadores del alelo C. Además, el alelo C se ha asociado con marcadores de riesgo cardiovascular, como la hipertensión arterial sistólica, y con un mayor riesgo de enfermedad coronaria51 y de infarto agudo de miocardio50.
CONCLUSIONES
El estudio de la etiología de la obesidad ha permitido identificar más de 600 genes y regiones cromosómicas que participan en el control del apetito, en la regulación del gasto energético y del metabolismo, y en la adipogénesis60, entre los que se encuentran genes relacionados con la codificación y modulación de la IL-6.
El papel de esta citoquina en la obesidad y regulación del peso corporal es aún confuso, ya que por un lado su concentración parece estar aumentada en la obesidad como citoquina proinflamatoria, mientras que, otros estudios proponen que la obesidad es consecuencia de una deficiencia central de la misma. Esta controversia también aparece cuando se analiza la influencia de los distintos genotipos del polimorfismo -174G>C. Así, unos estudios relacionan al alelo C con marcadores fenotípicos de obesidad, mientras que otros encuentran la asociación contraria, relacionando una mayor prevalencia de obesidad en portadores GG. Por lo tanto, es necesario ampliar los estudios realizados en humanos sobre estos aspectos.
En resumen, esta citoquina así como la presencia de sus polimorfismos, se han asociado con la mayoría de parámetros metabólicos y antropométricos asociados a la adiposidad, presentando una importante implicación fisiopatológica, tanto en la obesidad como en las comorbilidades asociadas al síndrome metabólico. Sin embargo, para lograr comprender mejor la influencia de la IL-6 sobre la etiología de estos procesos, es necesario seguir explorando los locus adicionales del mismo, así como otros polimorfismos de este gen y sus interacciones con otros genes candidatos, junto con el estudio de las bases genéticas con factores ambientales (dieta y genes).
Agradecimientos
Los autores agradecen la ayuda económica de la Línea Especial de Investigación Obesidad, Nutrición y Salud de la Universidad de Navarra (LE 97) y al Gobierno de Navarra (Departamento de Educación 2005).
BIBLIOGRAFÍA
1. Martínez JA, Moreno MJ, Marqués-Lópes I, Marti A. Causas de la obesidad. An Sist Sanit Navar 2002; 25: 17-27. [ Links ]
2. Moreno MJ, Martínez JA. Tejido adiposo: órgano de almacenamiento y secreción. An Sist Sanit Navar 2002; 25: 29-39. [ Links ]
3. Fried SK, Bunkin DA, Greenberg AS. Omental and subcutaneous adipose tissues of obese subjects release interleukin-6: depot difference and regulation by glucocorticoid. J Clin Endocrinol Metab 1998; 83: 847-850. [ Links ]
4. Vozarova B, Weyer C, Hanson K, Tataranni PA, Bogardus C, Pratley RE. Circulating interleukin-6 in relation to adiposity, insulin action, and insulin secretion. Obes Res 2001; 9: 414-417. [ Links ]
5. Straub RH, Hense HW, Andus T, Scholmerich J, Riegger GA, Schunkert H. Hormone replacement therapy and interrelation between serum interleukin-6 and body mass index in postmenopausal women: a population-based study. J Clin Endocrinol Metab 2000; 85: 1340-1344. [ Links ]
6. Rexrode KM, Pradhan A, Manson JE, Buring JE, Ridker PM. Relationship of total and abdominal adiposity with CRP and IL-6 in women. Ann Epidemiol 2003; 13: 674-682. [ Links ]
7. Khaodhiar L, Ling PR, Blackburn GL, Bistrian BR. Serum levels of interleukin-6 and C-reactive protein correlate with body mass index across the broad range of obesity. J Parenter Enteral Nutr 2004; 28: 410-415. [ Links ]
8. Kado S, Nagase T, Nagata N. Circulating levels of interleukin-6, its soluble receptor and interleukin-6/interleukin-6 receptor complexes in patients with type 2 diabetes mellitus. Acta Diabetol 1999; 36: 67-72. [ Links ]
9. Pickup JC, Mattock MB, Chusney GD, Burt D. NIDDM as a disease of the innate immune system: association of acute-phase reactants and interleukin-6 with metabolic syndrome X. Diabetologia 1997; 40: 1286-1292. [ Links ]
10. Kubaszek A, Pihlajamaki J, Komarovski V, Lindi V, Lindstrom J, Eriksson J et al. Promoter polymorphisms of the TNF-alpha (G-308A) and IL-6 (C-174G) genes predict the conversion from impaired glucose tolerance to type 2 diabetes: the Finnish Diabetes Prevention Study. Diabetes 2003; 52: 1872-1876. [ Links ]
11. Orban Z, Remaley AT, Sampson M, Trajanoski Z, Chrousos GP. The differential effect of food intake and beta-adrenergic stimulation on adipose-derived hormones and cytokines in man. J Clin Endocrinol Metab 1999; 84: 2126-2133. [ Links ]
12. Mohamed-Ali V, Goodrick S, Rawesh A, Katz DR, Miles JM, Judkin JS et al. Subcutaneous adipose tissue releases interleukin-6, but not tumor necrosis factor-alpha, in vivo. J Clin Endocrinol Metab 1997; 82: 4196-4200. [ Links ]
13. Schobitz B, Van Den Dobbelsteen M, Holsboer F, Sutanto W, De Kloet ER. Regulation of interleukin 6 gene expression in rat. Endocrinology 1993; 132: 1569-1576. [ Links ]
14. Milagro F, Marques-Lopes I. Sistema nervioso y obesidad. An Sist Sanit Navar 2002; 25: 41-52. [ Links ]
15. Stenlof K, Wernstedt I, Fjallman T, Wallenius V, Wallenius K, Jansson JO. Interleukin-6 levels in the central nervous system are negatively correlated with fat mass in overweight/obese subjects. J Clin Endocrinol Metab 2003; 88: 4379-4383. [ Links ]
16. Wallenius K, Wallenius V, Sunter D, Dickson SL, Jansson JO. Intracerebroventricular interleukin-6 treatment decreases body fat in rats. Biochem Biophys Res Commun 2002; 293: 560-565. [ Links ]
17. Tsigos C, Papanicolaou DA, Defensor R, Mitsiadis CS, Kyrou I, Chrousos GP. Dose effects of recombinant human interleukin-6 on pituitary hormone secretion and energy expenditure. Neuroendocrinology 1997; 66: 54-62. [ Links ]
18. Fernández-Real JM, Vayreda M, Richart C, Gutiérrez C, Broch M, Vendrell J et al. Circulating interleukin 6 levels, blood pressure, and insulin sensitivity in apparently healthy men and women. J Clin Endocrinol Metab 2001; 86: 1154-1159. [ Links ]
19. Marz P, Cheng JG, Gadient RA, Patterson PH, Stoyan T, Otten U et al. Sympathetic neurons can produce and respond to interleukin 6. Proc Natl Acad Sci U S A 1998; 95: 3251-3256. [ Links ]
20. Kubaszek A, Pihlajamaki J, Punnonen K, Karhapaa P, Vauhkonen I, Laakso M. The C-174G promoter polymorphism of the IL-6 gene affects energy expenditure and insulin sensitivity. Diabetes 2003; 52: 558-561. [ Links ]
21. Gardner JD, Rothwell NJ, Luheshi GN. Leptin affects food intake via CRF-receptor-mediated pathways. Nat Neurosci 1998; 1: 103. [ Links ]
22. Rosenbaum M, Murphy EM, Heymsfield SB, Matthews DE, Leibel RL. Low dose leptin administration reverses effects of sustained weight-reduction on energy expenditure and circulating concentrations of thyroid hormones. J Clin Endocrinol Metab 2002; 87: 2391-2394. [ Links ]
23. Recasens M, Ricart W, Fernández-Real JM. Obesity and inflammation. Rev Med Univ Navarra 2004; 48: 49-54. [ Links ]
24. Kern PA, Ranganathan S, Li C, Wood L, Ranganathan G. Adipose tissue tumor necrosis factor and interleukin-6 expression in human obesity and insulin resistance. Am J Physiol Endocrinol Metab 2001; 280: 745-751. [ Links ]
25. Pradhan AD, Manson JE, Rifai N, Buring JE, Ridker PM. C-reactive protein, interleukin 6, and risk of developing type 2 diabetes mellitus. JAMA 2001 18; 286: 327. [ Links ]
26. Stouthard JM, Romijn JA, Van der Poll T, Endert E, Klein S, Bakker PJ et al. Endocrinologic and metabolic effects of interleukin-6 in humans. Am J Physiol 1995; 268: 813-819. [ Links ]
27. Hiscock N, Petersen EW, Krzywkowski K, Boza J, Halkjaer-Kristensen J, Pedersen BK. Glutamine supplementation further enhances exercise-induced plasma IL-6. J Appl Physiol 2003; 95: 145-148. [ Links ]
28. Vozarova B, Weyer C, Lindsay RS, Pratley RE, Bogardus C, Tataranni PA. High white blood cell count is associated with a worsening of insulin sensitivity and predicts the development of type 2 diabetes. Diabetes 2002; 51: 455-461. [ Links ]
29. Di Gregorio GB, Hensley L, Lu T, Ranganathan G, Kern PA. Lipid and carbohydrate metabolism in mice with a targeted mutation in the IL-6 gene: absence of development of age-related obesity. Am J Physiol Endocrinol Metab 2004; 287: 182-187. [ Links ]
30. Fernández-Real JM, Broch M, Vendrell J, Richart C, Ricart W. Interleukin-6 gene polymorphism and lipid abnormalities in healthy subjects. J Clin Endocrinol Metab 2000; 85: 1334-1339. [ Links ]
31. Greenberg AS, Nordan RP, McIntosh J, Calvo JC, Scow RO, Jablons D. Interleukin 6 reduces lipoprotein lipase activity in adipose tissue of mice in vivo and in 3T3-L1 adipocytes: a possible role for interleukin 6 in cancer cachexia. Cancer Res 1992; 52: 4113-4116. [ Links ]
32. Akgun S, Ertel NH, Mosenthal A, Oser W. Postsurgical reduction of serum lipoproteins: interleukin-6 and the acute-phase response. J Lab Clin Med 1998; 131: 103-108. [ Links ]
33. Furumoto T, Saito N, Dong J, Mikami T, Fujii S, Kitabatake A. Association of cardiovascular risk factors and endothelial dysfunction in japanese hypertensive patients: implications for early atherosclerosis. Hypertens Res 2002; 25: 475-480. [ Links ]
34. Woodward M, Rumley A, Tunstall-Pedoe H, Lowe GD. Associations of blood rheology and interleukin-6 with cardiovascular risk factors and prevalent cardiovascular disease. Br J Haematol 1999; 104: 246-257. [ Links ]
35. Dalmon J, Laurent M, Courtois G. The human beta fibrinogen promoter contains a hepatocyte nuclear factor 1-dependent interleukin-6-responsive element. Mol Cell Biol 1993; 13: 1183-1193. [ Links ]
36. Vázquez-Oliva G, Fernández-Real JM, Zamora A, Vilaseca M, Badimon L. Lowering of blood pressure leads to decreased circulating interleukin-6 in hypertensive subjects. J Hum Hypertens 2005; 19: 457-462. [ Links ]
37. Seino Y, Ikeda U, Ikeda M, Yamamoto K, Misawa Y, Hasegawa T et al. Interleukin 6 gene transcripts are expressed in human atherosclerotic lesions. Cytokine 1994; 6: 87-91. [ Links ]
38. Barton BE. The biological effects of interleukin 6. Med Res Rev 1996; 16: 87-109. [ Links ]
39. Grau AJ, Aulmann M, Lichy C, Meiser H, Buggle F, Brandt T et al. Increased cytokine release by leucocytes in survivors of stroke at young age. Eur J Clin Invest 2001; 31: 999-1006. [ Links ]
40. Ishihara K, Hirano T. IL-6 in autoimmune disease and chronic inflammatory proliferative disease. Cytokine Growth Factor Rev 2002; 13: 357-368. [ Links ]
41. Wernstedt I, Eriksson AL, Berndtsson A, Hoffstedt J, Skrtic S, Hedner T et al. A common polymorphism in the interleukin-6 gene promoter is associated with overweight. Int J Obes Relat Metab Disord 2004; 28: 1272-1279. [ Links ]
42. Fishman D, Faulds G, Jeffery R, Mohamed-Ali V, Yudkin JS, Humphries S et al. The effect of novel polymorphisms in the interleukin-6 (IL-6) gene on IL-6 transcription and plasma IL-6 levels, and an association with systemic-onset juvenile chronic arthritis. J Clin Invest 1998; 102: 1369-1376. [ Links ]
43. Vozarova B, Fernández-Real JM, Knowler WC, Gallart L, Hanson RL, Gruber JD et al. The interleukin-6 (-174) G/C promoter polymorphism is associated with type-2 diabetes mellitus in Native Americans and Caucasians. Hum Genet 2003; 112: 409-413. [ Links ]
44. Berthier MT, Paradis AM, Tchernof A, Bergeron J, Prudhomme D, Despres JP et al. The interleukin 6-174G/C polymorphism is associated with indices of obesity in men. J Hum Genet 2003; 48: 14-19. [ Links ]
45. Fernández-Real JM, Broch M, Vendrell J, Gutiérrez C, Casamitjana R, Pugeat M et al. Interleukin-6 gene polymorphism and insulin sensitivity. Diabetes 2000; 49: 517-20. [ Links ]
46. Cozen W, Gill PS, Ingles SA, Masood R, Martínez-Maza O, Cockburn MG et al. IL-6 levels and genotype are associated with risk of young adult Hodgkin lymphoma. Blood 2004; 103: 3216-3221. [ Links ]
47. Licastro F, Grimaldi LM, Bonafe M, Martina C, Olivieri F, Cavallone L et al. Interleukin-6 gene alleles affect the risk of Alzheimers disease and levels of the cytokine in blood and brain. Neurobiol Aging 2003; 24: 921-926. [ Links ]
48. Inanir A, Ozoran K, Tutkak H, Mermerci B. The effects of calcitriol therapy on serum interleukin-1, interleukin-6 and tumour necrosis factor-alpha concentrations in post-menopausal patients with osteoporosis. J Int Med Res 2004; 32: 570-582. [ Links ]
49. Chapman CM, Beilby JP, Humphries SE, Palmer LJ, Thompson PL, Hung J. Association of an allelic variant of interleukin-6 with subclinical carotid atherosclerosis in an Australian community population. Eur Heart J 2003; 24: 1494-1499. [ Links ]
50. Kelberman D, Fife M, Rockman MV, Brull DJ, Woo P, Humphries SE. Analysis of common IL-6 promoter SNP variants and the AnTn tract in humans and primates and effects on plasma IL-6 levels following coronary artery bypass graft surgery. Biochim Biophys Acta 2004; 1688: 160-167. [ Links ]
51. Humphries SE, Luong LA, Ogg MS, Hawe E, Miller GJ. The interleukin-6 -174 G/C promoter polymorphism is associated with risk of coronary heart disease and systolic blood pressure in healthy men. Eur Heart J 2001; 22: 2243-2252. [ Links ]
52. Mohlig M, Boeing H, Spranger J, Osterhoff M, Kroke A, Fisher E et al. Body mass index and C-174G interleukin-6 promoter polymorphism interact in predicting type 2 diabetes. J Clin Endocrinol Metab 2004; 89: 1885-1890. [ Links ]
53. Poitou C, Lacorte JM, Coupaye M, Bertrais S, Bedel JF, Lafon N et al. Relationship between single nucleotide polymorphisms in leptin, IL6 and adiponectin genes and their circulating product in morbidly obese subjects before and after gastric banding surgery. Obes Surg 2005; 15: 11-23. [ Links ]
54. McKenzie JA, Weiss EP, Ghiu IA, Kulaputana O, Phares DA, Ferrell RE et al. Influence of the interleukin-6 -174 G/C gene polymorphism on exercise training-induced changes in glucose tolerance indexes. J Appl Physiol 2004; 97: 1338-1342. [ Links ]
55. Dedoussis GV, Manios Y, Choumerianou DM, Yiannakouris N, Panagiotakos DB. The IL-6 gene G-174C polymorphism related to health indices in Greek primary school children. Obes Res 2004; 12: 1037-1041. [ Links ]
56. Gillespie KM, Nolsoe R, Betin VM, Kristiansen OP, Bingley PJ, Mandrup-Poulsen T et al. Is puberty an accelerator of type 1 diabetes in IL6-174CC females? Diabetes 2005; 54: 1245-1248. [ Links ]
57. Jahromi MM, Millward BA, Demaine AG. A polymorphism in the promoter region of the gene for interleukin-6 is associated with susceptibility to type 1 diabetes mellitus. J Interferon Cytokine Res 2000; 20: 885-888. [ Links ]
58. Hamid YH, Rose CS, Urhammer SA, Glumer C, Nolsoe R, Kristiansen OP et al. Variations of the interleukin-6 promoter are associated with features of the metabolic syndrome in Caucasian Danes. Diabetologia 2005; 48: 251-260. [ Links ]
59. Lieb W, Pavlik R, Erdmann J, Mayer B, Holmer SR, Fischer M et al. No association of interleukin-6 gene polymorphism (-174 G/C) with myocardial infarction or traditional cardiovascular risk factors. Int J Cardiol 2004; 97: 205-212. [ Links ]
60. Perusse L, Rankinen T, Zuberi A, Chagnon YC, Weisnagel SJ, Argyropoulos G et al. The human obesity gene map: the 2004 update. Obes Res 2005; 13: 381-490. [ Links ]
61. Illig T, Bongardt F, Schopfer-Wendels A, Huth C, Heid I, Rathmann W et al. Genetics of type 2 diabetes: impact of interleukin-6 gene variants. Gesundheitswesen 2005; 67: 122-126. [ Links ]
62. Faltraco F, Burger K, Zill P, Teipel SJ, Moller HJ, Hampel H et al. Interleukin-6-174 G/C promoter gene polymorphism C allele reduces Alzheimers disease risk. J Am Geriatr Soc 2003; 51: 578-579. [ Links ]