Introducción
Los leiomiomas cutáneos (LC), superficiales o suprafasciales, constituyen un grupo de neoplasias benignas poco frecuentes, derivadas de las células musculares lisas presentes en la dermis y el tejido celular subcutáneo. Pueden aparecer de forma esporádica o hereditaria, y se describieron por primera vez en el siglo XIX1. Son tumores de buen pronóstico, en los que su exéresis, mediante cirugía simple, se considera curativa.
Todos los leiomiomas superficiales (LS) están constituidos por una proliferación de células fusiformes eosinófilas, con núcleo en forma de puro, normalmente bien diferenciadas, que se disponen agrupadas en haces y forman estructuras compactas o infiltrativas. Se clasifican en tres tipos: piloleiomiomas (PL), con origen en el músculo piloerector de la unidad folicular dérmica; angioleiomiomas (AL), derivados de la pared de los vasos sanguíneos de la dermis reticular e hipodermis y leiomiomas genitales (LG), originados del músculo liso del dartos escrotal, del dartos muliebris vulvar y de la estructura muscular dérmica del complejo areola-pezón.
A pesar de existir varias series de casos publicadas1-18, algunos subtipos de leiomioma han recibido poca atención en la literatura y, debido a ello, no existe consenso respecto a algunas de sus características clínico-histológicas. En el caso concreto de los leiomiomas areolares, las diferencias con el resto de LG y su clasificación dentro de ese grupo ha sido cuestionada por varios autores2,11.
Los datos epidemiológicos de las tres variantes son muy limitados, por lo que su peso dentro del total de los leiomiomas no es conocido, estimándose en un 4%8.
Aunque se acepta mayoritariamente que los LG constituyen la variante menos frecuente, hay autores con posturas encontradas sobre qué variante es la más frecuente. Dentro de los LG, la subvariante areolar cuenta únicamente con tres series de casos publicadas y se estima que existen menos de sesenta casos reportados en la literatura(4-19;21).
El diagnóstico diferencial entre los leiomiomas con rasgos atípicos y los leiomiosarcomas mejor diferenciados es objeto de debate desde hace varias décadas, especialmente para los PL y los LG. Distintos autores han propuesto la creación de una entidad intermedia donde incluir las formas relativamente bien diferenciadas con rasgos atípicos y, en el caso de los leiomiosarcomas dérmicos (LSD), algunos autores han propuesto reclasificarlos como neoplasias atípicas, dado su buen pronóstico y su dudosa capacidad de metástasis a distancia4,5,19-21.
Recientemente se ha descrito la mutación responsable de hasta el 80% de los casos de leiomiomatosis cutánea y uterina múltiple (síndrome de Reed). El gen afectado codifica una enzima del ciclo de Krebs conocida como fumarato hidratasa (FH). Dado que se trata de una mutación en la línea germinal y hereditaria, se ha sugerido que podría asociarse con otros tumores y síndromes, aunque el mecanismo responsable del desarrollo tumoral no se conoce por completo22. Tampoco se conoce la etiopatogenia de los PL esporádicos, los AL y los LG.
La mayoría de trabajos previos sobre leiomiomas se limitan a una de las tres variantes7,14 o bien incluyen distintos tipos sin tener en cuenta que son variantes diferentes15. Otras series incluyen formas benignas y malignas de forma conjunta5,6,11,12. No hemos encontrado revisiones comparativas entre las tres variantes en la literatura. En lo que se refiere a Navarra, solo hay un caso de leiomioma escrotal publicado por Jiménez Aristu y col en 200323.
Por ello, el objetivo de esta revisión es establecer las características clinicohistológicas de las distintas variantes de leiomiomas cutáneos, aportar datos sobre la incidencia de cada variante y las posibles asociaciones con neoplasias internas. Para ello, presentamos una de las series más amplia de leiomiomas cutáneos, la revisión clínicohistológica más amplia de PL, la segunda más amplia en leiomiomas areolares y escrotales y la primera en introducir datos de incidencia sobre las tres variantes de LC y en estudiar la prevalencia de neoplasias asociadas a cada una de ellas.
Material y métodos
Revisión de los casos de leiomioma diagnosticados en los servicios de Anatomía Patológica del Complejo Hospitalario de Navarra, del Hospital de Tudela en Navarra y del Hospital Marina Salud de Denia en Alicante, entre los años 1982 y 2018.
Se realizó una búsqueda en las bases de datos centralizadas de los servicios de Anatomía Patológica de los hospitales participantes a partir de los términos leiomioma, leiomioblastoma, piloleiomioma y angioleiomioma. Los datos referentes a los pacientes se codificaron de forma anonimizada, no utilizando ni extrayendo datos que permitieran identificar al paciente. El estudio fue aprobado por el Comité Ético de Investigación Clínica con medicamentos de Navarra.
De cada tumor y/o paciente asociado se revisaron los parámetros demográficos (edad al diagnóstico, sexo) y clínicos (tamaño tumoral en cm, tiempo de evolución en años, tiempo de seguimiento, tumores asociados, sintomatología, localización anatómica, forma única o múltiple, evolución tras tratamiento). Los casos sin datos clínicos se incluyeron únicamente para la revisión histológica (localización a nivel cutáneo, número de mitosis en 10 campos de gran aumento [/ 10 cga], tamaño histológico, patrón de crecimiento, arquitectura tumoral, grado de atipia celular, presencia de necrosis, ulceración, estroma mixoide, anejos atrapados, infiltrado linfoide, acantosis, hiperpigmentación epidérmica). Se registraron también los resultados inmunohistoquímicos (IHQ) obtenidos con anticuerpos frente a actina específica de músculo liso (SMA), h-caldesmon (h-CD), desmina, calponina, s100, vimentina, receptores de estrógenos y receptores de progesterona. Todas las tinciones IHQ contaban con control externo en el mismo cristal. La inmunorreactividad del tejido se dividió en positivo, positivo débil y negativo.
La arquitectura tumoral se diferenció en tres patrones:
- infiltrativo: haces celulares poco cohesivos extendiéndose entre el tejido normal circundante
- sólido: masa tumoral de celularidad densa que desplaza e infiltra levemente el tejido sano circundante, dejando unos límites relativamente definidos pero no claramente demarcados
- nodular o encapsulado: formas densamente celulares que desplazan el tejido sano circundante, en ocasiones recubiertas de un área fibrosa y cuyos límites pueden delimitarse con una línea.
La localización histológica se dividió en: dermis superficial, dermis superficial-media, dermis media, dermis media-profunda, dermis profunda, dermis completa, dermis profunda-tejido celular subcutáneo (TCS), dermis completa-TCS y TCS.
Los AL se clasificaron según los subtipos histológicos más ampliamente aceptados: sólido/capilar (masa tumoral densa, de elevada celularidad, con múltiples vasos de pequeño tamaño en su seno), venoso (gruesas paredes musculares de las que parten haces de células tumorales perpendiculares a la luz del vaso) y cavernoso (vasos de luces dilatadas y paredes musculares finas, a veces agrupados en racimos, que se integran con la masa tumoral intervascular)14. En caso de presentar rasgos de más de un subtipo, se tuvo en cuenta el predominante.
Las localizaciones corporales fueron cuero cabelludo (CC), cara, cuello, tronco, extremidades superiores (EESS), manos (no incluidas en EESS), genitales, extremidades inferiores (EEII) y pies (no incluidos en EEII).
Para determinar la prevalencia de tumores dolorosos, se consideraron positivos aquellos casos manifiestos en la historia clínica. Se consideraron negativos los descritos en los informes como asintomáticos y los que contaban con una descripción clínica detallada y un diagnóstico diferencial de lesiones no dolorosas. El resto de las lesiones no se contabilizaron.
Se consideraron formas múltiples aquellas presentes en el mismo paciente (al menos dos) independientemente de no estar agrupadas o de aparecer con años de diferencia.
Para el estudio de neoplasias asociadas se utilizó como grupo de comparación pacientes con otra variante de leiomioma. Los casos con pólipos intestinales con displasia severa o carcinoma in situ se consideraron neoplasia; no se contabilizaron los pacientes con cáncer cutáneo. Se revisaron los casos de pacientes con leiomiosarcoma para descartar casos de transformación maligna.
La edad media al diagnóstico en los casos múltiples se calculó teniendo en cuenta la edad al diagnóstico de la primera lesión. Para la distribución corporal de las lesiones se contabilizó una única vez las formas múltiples agrupadas en la misma localización.
Se realizó un análisis descriptivo para las variables continuas, calculando los estadísticos de tendencia central y dispersión según su distribución: media y desviación típica (DT) o mediana y rango intercuartil (RIC), además de los valores extremos (rango). Las variables cualitativas se describieron mediante frecuencias y porcentajes. En el caso de las neoplasias asociadas y su comparación con el grupo control, se utilizó la prueba exacta de Fisher y se calculó la odds-ratio (OR) y su intervalo de confianza al 95% (IC95%). Se consideró estadísticamente significativo un valor de p < 0,05. Los datos fueron analizados mediante el programa informático SPSS versión 25.0 para Windows.
Los datos de incidencia se calcularon en función de los nuevos pacientes con leiomioma y no del número de leiomiomas diagnosticados durante ese periodo. La prevalencia entre sexos se calculó obviando los casos múltiples. Los casos del Hospital Marina Salud de Denia no se incluyeron en la revisión epidemiológica del área de Navarra.
Resultados
De los 530 registros obtenidos, se descartaron las formas profundas, los casos repetidos y los AL anteriores a 2007. De los 274 casos restantes, cinco se reclasificaron en otra variante de LC y 14 no se incluyeron por presentar dudas diagnósticas con otras entidades o corresponder a tumores profundos. Sí se incluyeron en el estudio 15 casos sin cristal disponible pero con descripción histológica detallada.
En total, se incluyeron en este estudio 255 casos valorables para revisión: 88 (34,5%) PL en 75 pacientes, 152 (59,6%) AL y 15 (5,9%) LG (diez escrotales, cuatro areolares y un vulvar). El Hospital Marina Salud de Denia únicamente contribuyó con siete PL y un LG.
La incidencia acumulada de los PL en Navarra entre 2007 y 2018 fue de 5,19 pacientes cada 100.000 habitantes en 12 años, lo que equivale a una incidencia anual de 4,3 casos por millón de habitantes; en el caso de los AL, la incidencia fue de 20 casos anuales por millón de habitantes24, y para los LG, 1,4 casos por millón de habitantes (0,94 casos escrotales y 0,47 areolares). Dada la población actual de Navarra (636.465), se puede estimar una incidencia anual de 2,4 casos de PL, 11,7 de AL y 0,7 casos de LG (0,47 escrotales y 0,19 areolares). En 2017 y 2018, las formas cutáneas supusieron el 3,5% del total de leiomiomas biopsiados (37 de 1053). La descripción demográfica completa de cada variante se detalla en la Tabla 1.
Tabla 1. Características de las variantes de leiomioma
| Característica | Piloleiomioma | Leiomioma genital | Angioleiomioma | ||
|---|---|---|---|---|---|
| Areolar | Escrotal | Vulvar | |||
| Sexo (mujer) | 49,10% | 50% | 0 | 100% | 54,30% |
| Edad (años) | |||||
| Media (DT) | 50,3 (18,64) | 50,5 (6,4) | 60 (16,8) | - | 55,6 (15.3) |
| Mediana (RIC) | 51 (41-61) | 49 (45-57) | 67,5 (50-72) | 45 | 58 (46-67) |
| Rango | 2-91 | 45-59 | 25-74 | - | 5-83 |
| Hombre/mujer* | 54/44 | 49/52 | -/45 | 54,9/56,5 | |
| Tamaño (mm) | |||||
| Media (DT) | 7,3 (5,5) | 6,7 (2,3) | 21 (10,5) | - | 10 (5) |
| Mediana (RIC) | 6 | 8 | 22 | 10 | 10 |
| Rango | 2-3 | 4-8 | 6-40 | - | 3-30 |
| Arquitectura tumoral [n(%)] | |||||
| Fascicular | 44 (53) | 3 (75) | 1 (10) | - | 1 (0,7) |
| Nodular | 10 (12) | - | 7 (70) | - | 141 (95) |
| Sólida | 29 (34,9) | 1 (33) | 2 (20) | 1 (100) | 5 (3,4) |
| Tipo de crecimiento (%) | |||||
| Expansivo | 44 | - | - | -- | 60 |
| Mixto | 32 | 100 | - | 20 | |
| Infiltrativo | 24 | 100 | - | 100 | 20 |
DT: desviación típica; RIC: rango intercuartil; *: media (DT); -: no calculable.
Clínica
Piloleiomiomas
La prevalencia de neoplasias en pacientes con PL fue del 20%; desagregado por sexo fue un 4% mayor en mujeres que en varones (21,4 vs. 17,4%), siendo las diferencias no significativas (p = 1). Los cánceres más frecuentes fueron el de mama (n = 5) y el de colon (n = 3). El 18% de las mujeres con PL asociaron también leiomiomas uterinos, de las cuales uno presentaba síndrome de Reed (mutación FH confirmada genéticamente). Considerando únicamente los casos solitarios, sin leiomiomas uterinos asociados ni antecedentes familiares, a fin de eliminar la posible implicación potencial de la FH, la prevalencia de cáncer de mama entre mujeres fue del 15,8%.
La localización más frecuente de los PL fue la EESS y el tronco (Tabla 2). El tamaño clínico medio fue 0,73 cm, similar en formas múltiples y solitarias (media 0,62 cm y 0,75cm, mediana 0,6 cm para ambos). La mayoría de los casos eran pápulas firmes induradas de normocoloreadas a rosadas, con un caso aislado pediculado. El 45,2% resultaron dolorosos al roce o la presión. Los pacientes con formas múltiples representaron solo el 26,1% del total, con mediana de edad muy similar en formas múltipes (49,5) y solitarias (48,7). Las formas solitarias se acompañaron de dolor en el 44% de los casos, y las múltiples en el 55%, no siendo las diferencias significativas.
El seguimiento de los pacientes tras el diagnóstico varió entre uno y 20 años. Únicamente reapareció (persistencia) un PL a los seis años de la primera extirpación, que había sido incompleta. Ninguno de los pacientes con PL desarrolló posteriormente un leiomiosarcoma (LS).
Angioleiomiomas
La prevalencia de neoplasias en pacientes con AL fue del 9,3 %; en varones fue el doble que en mujeres (14,8 vs. 6,17 %), siendo las diferencias no significativas (p = 0,153). Los cánceres más frecuentes fueron endometrio, próstata, colon y tiroides (todos con dos casos), con una prevalencia individual del 1,3%. La prevalencia de cáncer de mama fue del 0,7%. El cáncer de mama fue estadísticamente más prevalente en AL que en PL fueron significativas (OR = 4,8; IC95 %: 1,3-17,4; p = 0,006).
Los AL se localizaban principalmente en EEII y pies (Tabla 2), sin diferencias por sexo. El tamaño medio fue de 1 cm (Tabla 1). Clínicamente se presentaban como un nódulo normocoloreado doloroso a la palpación. La clínica más frecuente fue el dolor local, presente en el 78% de los casos (n = 65); todas las formas fueron solitarias. Con un seguimiento medio de seis años no se observaron recidivas ni transformación maligna en ninguno de los pacientes.
Tabla 2. Localización anatómica de los piloleiomiomas y angioleiomiomas del estudio
| Localización | Piloleiomioma | Angioleiomioma |
|---|---|---|
| n (%) | n (%) | |
| Cuero cabelludo | 3 (3,6) | 2 (1,5) |
| Cara | 5 (6,0) | 7 (5,2) |
| Cuello | 5 (6,0) | - |
| Extremidades superiores | 24 (28,9) | 15 (11) |
| Tronco | 24 (28,9) | 4 (2,9) |
| Genitales | 1 (1,2) | 1 (0,7) |
| Extremidades inferiores | 21 (25,3) | 74 (54,4) |
| Pies | 0 (0) | 33 (24,3) |
| 83 | 136 |
Leiomiomas genitales
Ningún LG asoció neoplasia interna. Los escrotales fueron los más frecuentes (n = 10) seguidos de areolares (n = 4) y vulvar (n = 1). El tamaño medio de los escrotales fue de 2,1 cm, de los areolares 0,67 cm y el vulvar 1 cm. No se objetivó recidiva posterior en ninguno de ellos. Entre los LG, el vulvar fue el único extirpado de forma incompleta; a los dos años de seguimiento no presentaba recidiva clínica.
Histología
Piloleiomiomas
La mayoría de PL se situaban en la dermis papilar y reticular superficial (39,2%) (Fig. 1), dermis completa (24,1%) y dermis reticular (13,9%). Un 14,8% de los casos llegaban a tocar el TCS sin infiltrarlo. El 53% de los PL tenían un patrón fascicular con crecimiento infiltrativo (Tabla 1).
Todos los casos eran bien diferenciados con atipia leve, salvo cinco casos que mostraban cierto pleomorfismo (6,4%). Se encontraron mitosis aisladas en el 5,9% de los PL (tres de ellos con una mitosis / 10 cga, otro con dos y otro con tres). El 62,5% de los PL presentaba algún anejo atrapado en la masa tumoral; en casi la mitad de los casos (47,5%) se trataba de una glándula ecrina, en el 32,5% de un folículo y en el 12,5 % de ambos. Dieciocho casos presentaban estroma mixoide (28%). No se observó necrosis en ningún caso y uno presentó ulceración. No se observaron diferencias inmunofenotípicas entre las formas solitarias y las múltiples. La presencia de anejos intratumorales y de estroma mixoide se asoció con los PL (p < 0,001).
Angioleiomiomas
Los AL se localizaban completamente en el TCS en el 80,2% de los casos, en el 5% no tenían conexión con el TCS y se situaban íntegramente en la dermis, y en el resto de los casos el tumor afectaba a la dermis y al TCS. La forma más frecuente de AL fue la sólida (67,6%) (Fig. 1B), seguida de la venosa (28,3%) y de la cavernosa (4,1%). El 14,5% de los casos exhibía simultáneamente rasgos de dos o tres de los patrones descritos. Así, uno de los casos presentaba un componente claro de AL (con vasos y patrón nodular) en plano subcutáneo y otro componente asemejaba un PL (infiltrativo y sin vasos asociados) en plano cutáneo.
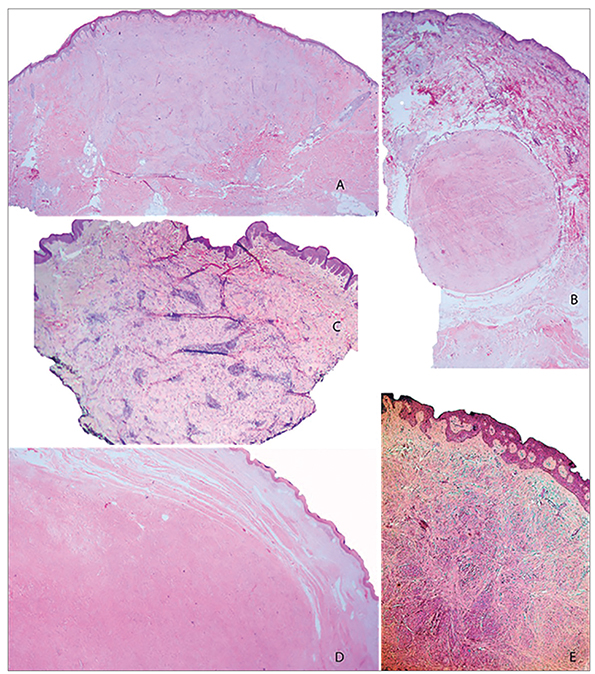
Figura 1. Imagen histológica de las variantes de leiomioma. A. Piloleiomioma. B. Angioleiomioma. C. Leiomioma vulvar. D. Leiomioma escrotal. E. Leiomioma areolar. Hematoxilina-eosina, x25.
La arquitectura fue nodular para el 96% de los casos, únicamente un caso presentó un patrón fascicular, cuatro casos presentaron un patrón sólido y un caso presentó áreas sólidas y nodulares. La mayoría de los casos (> 90%) no presentaron mitosis, cinco AL mostraron 1 mitosis / 10 cga, un caso cuatro y otro dos. Se observó atipia leve en el 6,5% de los casos, de los cuales cuatro asociaron también 1 mitosis / 10 cga. En un caso se encontró un anejo (folículo) atrapado en la masa tumoral. La presencia de estroma mixoide intratumoral se observó en el 52% de los casos. Uno de los AL presentó ulceración y dos presentaron calcificaciones intratumorales. La presencia de anejos intratumorales y de estroma mixoide se asoció en nuestra serie con AL (p = 0,024).
Leiomiomas genitales
Las cuatro lesiones areolares se localizaron en la dermis reticular superficial y presentaban mayoritariamente un patrón fascicular (Fig. 1A). El 70% de los casos escrotales presentaban infiltración del TCS y se situaban en planos dérmicos más profundos (dermis media-profunda), exhibiendo la mayoría (70%) un patrón nodular (Fig. 1D). La variante vulvar se situaba en dermis media y presentaba un patrón fascicular infiltrativo (Tabla 1, Fig. 1C).
Los cuatro casos areolares presentaron una buena diferenciación, sin atipias ni mitosis. Entre los 10 casos escrotales había uno con células de aspecto pleomórfico y 1-2 mitosis / 10 cga (ninguna aberrante), así como áreas con atipia ligera; otro presentó también áreas degenerativas con grandes núcleos pleomórficos, sin atipia ni mitosis. Uno de los leiomiomas escrotales se acompañó de agregados linfoides organizados como centros germinales; no presentaba atipia (Fig. 2).
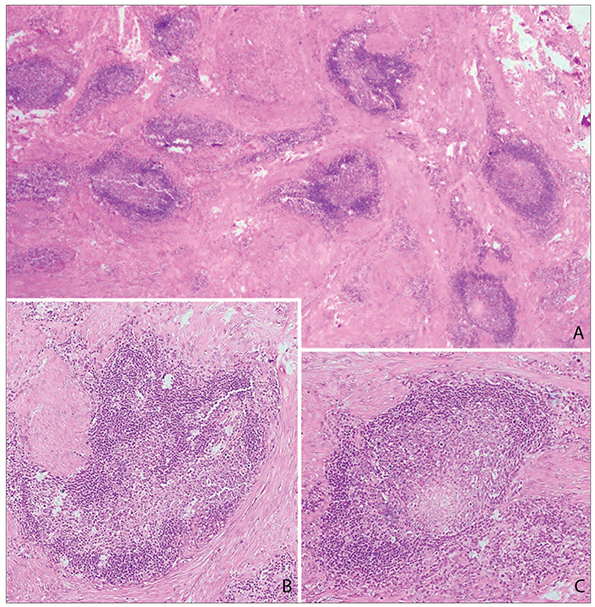
Figura 2 A. Leiomioma escrotal con infiltración linfocítica intratumoral organizada como centros germinales. Hematoxilina-eosina, x25. B, C. Detalle. Hematoxilina-eosina, x40.
La incidencia de tumores con rasgos atípicos o pleomórficos fue del 20% entre los LG escrotales, 0% para los areolares y el único caso vulvar presentaba áreas con núcleos pleomórficos y células algo atípicas, así como un infiltrado linfoide denso, intersticial y perivascular. En ningún caso se objetivó ulceración epidérmica o necrosis.
Inmunohistoquímica
Se consideraron los resultados obtenidos en aquellos tipos de leiomiomas con al menos diez lesiones. La SMA fue el anticuerpo más sensible para identificar PL (93%). Los AL fueron positivos para la SMA y el h-CD en todos los casos. No se encontraron formas areolares positivas para receptores de estrógenos y de progesterona. Todos los datos inmunohistoquímicos están recogidos en la Tabla 3.
Tabla 3. Datos inmunohistoquímicos de cada variante de leiomioma
| Antisuero | Piloleiomioma | Leiomioma genital | Angioleiomioma | ||
|---|---|---|---|---|---|
| Areolar | Escrotal | Vulvar | |||
| Actina de músculo lisoa | 93% | 100% | 100% | 100% | 100% |
| (43/44)b | (3/3) | (5/5) | (1/1) | (88/88) | |
| Desmina | 75% | 100% | 100% | 100% | 90% |
| (19/24) | -1 | (5/5) | (1/1) | (27/30)d | |
| h-caldesmon | 100% | 100% | |||
| -2 | (30/30) | ||||
| Vimentina | 85,70% | 100% | |||
| (6/7) | (4/4) | ||||
| Calponina | 50% | 100% | |||
| (1/2) | (3/3) | ||||
| S-100 | 20% | 0% | 0% | 100% | 20.8% |
| (3/15)c | (0/1) | (0/1) | (1/1) | (5/24)e | |
| Receptores de estrógenos | 100% | 50% | |||
| (1/1) | (1/2) | ||||
| Receptores de progesterona | 100% | 50% | |||
| (1/1) | (1/2) | ||||
a: cuatro tinciones de actina (en dos piloleiomiomas y dos angioleiomiomas) se realizaron con el clon HHF35 y todas fueron positivas; b: dos casos fueron positivos débiles y focales; c: uno de los casos fue positivo débil y focal; d: tres casos positivos débiles y focales; e: tres de los positivos fueron débiles y focales.
Discusión
De acuerdo a los casos biopsiados, la incidencia anual en Navarra de los distintos tipos de leiomiomas (PL, AL y LG) se situaría muy lejos de otras entidades con dermatoscopia y/o presentación clínica similar como los dermatofibromas (154 casos biopsiados en 2018). Lógicamente, la incidencia real tanto para leiomiomas como para dermatofibromas será mayor, dado que no todos los pacientes con estas lesiones consultan ni tampoco se biopsian el 100% de los casos que lo hacen.
En relación a los PL, y según nuestros datos y las series más extensas publicadas, son tumores con similar incidencia entre mujeres y hombres, preferentemente solitarios, que aparecen entre los 35 y 60 años con un pico de incidencia entre los 40 y 45 años (algo antes en las formas múltiples). Son dolorosos en un 50% y su localización más frecuente son las EESS y el tronco6-9,15,16. Su diagnóstico diferencial comprende otros tumores dolorosos como el espiradenoma, el neuroma, el angiolipoma, el neurilemoma, o el tumor glómico.
Su histología es típicamente fascicular, siendo menos frecuente la arquitectura sólida y menos aún la nodular. Se localiza predominantemente en dermis reticular superficial, media y papilar, pudiendo encontrarse alguna mitosis aislada (no acompañada de pleomorfismo ni atipia). La sensibilidad de la SMA y el h-CD es superior a la desmina7-9, como se describe en el presente estudio (93 vs. 75%).
A diferencia de las primeras series de los años 50 y 60 del siglo pasado, en las que predominaban las formas múltiples6,15,16, en las siguientes se observa un aumento gradual de los casos solitarios: 46% en la serie de 19977, 53% en 20108, 78% en 20139 y 74% en la serie actual. Esto podría deberse a la mayor conciencia social respecto a los riesgos asociados al cáncer de piel.
A nivel etiopatogénico se ha descrito la mutación del gen FH como responsable de las formas múltiples y hereditarias; esta mutación se considera un síndrome de predisposición hereditaria al cáncer y se ha descrito su asociación con distintas neoplasias internas, especialmente el cáncer renal, y otros síndromes10,22. Poco se conoce, sin embargo, de la etiopatogenia de los PL esporádicos. En nuestra serie, tras revisar la presencia de neoplasias internas en la población con leiomiomas, hemos observado una asociación entre PL y cáncer de mama, que se seguía manteniendo al separar los casos hereditarios. En el grupo de PL esporádicos y múltiples no sindrómicos, el cáncer de mama es 20 veces más prevalente que entre la población general para un rango de edad similar (entre 30 y 70 años), siendo aparentemente menos agresivo25. Para evaluar la asociación se ha comparado la prevalencia de cáncer de mama en el grupo con AL (con una media de edad ligeramente superior) y con PL. La prevalencia fue mayor en el grupo de PL siendo las diferencias estadísticamente significativas. Esta asociación no ha sido descrita previamente, aunque sí se ha sugerido entre los leiomiomas uterinos y el cáncer de mama26. En cualquier caso, será necesario confirmar esta asociación con una muestra más amplia de PL y utilizando como control población general. También se ha observado una mayor prevalencia de neoplasias en varones con PL respecto a varones con AL, pero las diferencias no fueron estadísticamente significativas.
Los AL constituyen la variante más frecuente y estudiada, existiendo varias series con más de 200 casos. En nuestra revisión sobre la población de Navarra esta variante es casi cinco veces más frecuente que los PL y casi 16 veces más frecuente que el grupo de los LG21.
Dada la menor densidad de células musculares por la reducción del calibre vascular conforme se asciende hacia la epidermis, la mayoría de los AL se forman a nivel del TCS14, lo que explica la elevada proporción (80%) de AL con afectación del TCS en nuestra serie.
Los AL suelen aparecer con mayor frecuencia en mujeres, con un índice aproximado de 1:1,5, entre los 30 y los 70 años, con un pico de incidencia entre los 45 y los 65. Clínicamente suelen ser lesiones únicas, localizadas preferentemente en EEII, con un tamaño entre 1 y 2 cm, induradas, móviles, y dolorosas en el 66% de los casos14,27. La etiopatogenia del dolor no se conoce con seguridad, pero se han sugerido varias teorías comunes a las otras variantes de LC: compresión nerviosa por el crecimiento tumoral, isquemia muscular por contracción de sus fibras, y secreción tumoral de factores algogénicos17,27-30.
A nivel histológico, los AL se caracterizan por su tendencia a aparecer encapsulados por una cápsula fibrosa de grosor variable, no siempre completa, y a presentar vasos intratumorales. Las características de los AL en nuestro trabajo coinciden con la serie más extensa publicada hasta la fecha14, siendo la variante más frecuente la sólida, seguida de la venosa y cavernosa; el 14% de los tumores parecían exhibir rasgos de dos o incluso las tres subvariantes. El sexo predominante es el femenino para la sólida, el masculino para la cavernosa y ligeramente el masculino para la venosa14. Se acepta que estos tumores pueden presentar alguna mitosis y cierto pleomorfismo14,31,32.
Los AL pueden expresar receptores de estrógenos y de progesterona determinados por IHQ33, como se observó en la presente serie.
Los LG son muy poco frecuentes; la serie más extensa publicada11 incluye 32 casos de los que solo 23 son LG. Respecto a la variante vulvar, el trabajo más amplio comprende 25 leiomiomas12, mientras que la serie escrotal más extensa abarca 19 casos4. La variante vulvar suele ser similar en frecuencia a la escrotal por lo que, de acuerdo a los presentes resultados, puede estar infrareportada en nuestro medio. La forma areolar es la más infrecuente de todas; solo existen tres series en la literatura1,2,11, la mayor de las cuales incluye únicamente seis lesiones1. Nuestro trabajo constituye el segundo más extenso en formas areolares1,11 y el segundo más numeroso en formas escrotales4.
Los leiomiomas areolares aparecen con mayor frecuencia entre los 40 y 50 años, siendo la edad media al diagnóstico de 41,14 años Se presentan con más frecuencia en mujeres (3:1) y suelen ser de pequeño tamaño, entre 0,5 y 1 cm. Normalmente son nódulos normocoloreados, indurados y alrededor del 50% dolorosos. Histológicamente suelen presentar un patrón similar a los PL, tanto por su localización en dermis media y superficial como por su arquitectura de predominio folicular, siendo ligeramente más frecuente el patrón nodular. No suelen exhibir atipia y es muy rara la presencia de mitosis1,11,18. La expresión inmunohistoquímica es similar a los PL, pero se han reportado algunos casos aislados de positividad a receptores de estrógenos (cuatro casos) y de progesterona (tres casos) (1,11,18; uno de nuestros casos fue positivo para estos dos receptores.
Los LG escrotales se diagnostican en pacientes de entre 24 a 79 años, situándose la mayoría de los casos entre 45 y 60 años (media 55,1 años). Clínicamente son tumores nodulares solitarios, normocoloreados frecuentemente asintomáticos (los casos dolorosos varían entre 0% y 25% según las series) y de mayor tamaño que las formas areolares y los PL, alrededor de 1,5-2 cm. A nivel histológico muestran un patrón predominantemente nodular en la mayoría de los casos, seguido de sólido e infiltrativo. Su localización predominante es la dermis media, con frecuentes extensiones al TCS. Es habitual encontrar pleomorfismo celular, como observamos en nuestra serie. Se han descrito casos con receptores androgénicos positivos4,11,33.
Las series de casos con LG vulvares11,12 incluyen de forma indistinta formas benignas y malignas. Una revisión reciente34 incluye tanto formas superficiales derivadas del dartos, como profundas derivadas del tejido erector y del ligamento redondo, lo que condiciona la interpretación de los resultados. En general los LG vulvares aparecen a edades más tempranas que los escrotales (35-40 años) y miden más de 1,5 cm. Se acompañan de dolor con mayor frecuencia que los escrotales, pero menos que los areolares, PL y AL (entre el 7 y el 50% de los casos según la serie). A nivel arquitectural más del 80% de los casos son nodulares, a pesar de que la nuestra mostró un patrón fascicular. Hasta el 85% tiene afectación del TCS, la mayoría presentan alguna mitosis / 10 cga (50% de los casos) y cerca del 40% exhiben rasgos de atipia. Pueden expresar positividad para receptores de estrógenos y progesterona5,11,12,35,36.
Las diferencias clínicohistológicas entre las formas areolares y el resto de LG, así como sus similitudes con los PL, han llevado a varios autores a plantear si es adecuado clasificar los leiomiomas areolares como LG2,11 Nosotros creemos que tanto estas diferencias (Tabla 4) como su distinta localización constituyen un motivo suficiente para plantear su separación del resto de LG. Por su similitud histológica parece conveniente incluirlos en un mismo grupo que los PL (a pesar de que estos aparentemente no expresen receptores hormonales) quizá como leiomiomas dérmicos, para diferenciarlos de los LG (con frecuente afectación del TCS) y de los AL (localizados casi exclusivamente en hipodermis).
Tabla 4. Comparativa de los diferentes rasgos clinicohistológicos de cada variante de leiomioma
| Afectación del TCS | Arquitectura tumoral | % con mitosis | Atipia celular | Tamaño (mm)* | Dolor | |
|---|---|---|---|---|---|---|
| Piloleiomioma | 7,70% | 85% fascicular /sólido | 10% | 8% | 6,6 | 44% |
| Raj7 | 5/53 | 44/53 | 15/53 | 5/53 | 5,7 (53) | 17/39 |
| Malhotra8 | - | 27/27 | 0/27 | - | - | - |
| Ghanadan9 | 0/20 | 20/20 | 0/20 | 0/20 | 6,52 (20) | 9/19 |
| Agulló | 7/83 | 73/83 | 4/85 | 5/58 | 7,3 (80) | 27/62 |
| Leiomioma genital | ||||||
| Areolar | 0% | 75% fascicular /sólido | 0% | 6% | 8,7 | 70% |
| Hammer1 | 0/6 | 02/6 | 0/6 | 01/6 | 7 (6) | 01/2 |
| Nakamura18 | 0/2 | 02/2 | 0/2 | 0/2 | 11 (2) | 02/2 |
| Newman11 | 0/4 | 02/4 | 0/4 | 0/4 | 7 (4) | 01/1 |
| Agulló | 0/4 | 04/4 | 0/4 | 0/4 | 6,7 (4) | 02/4 |
| Escrotal | 40% | 62% nodular | 3,50% | 46% | 20 | 4% |
| Matoso4 | - | 11/19 | 0/19 | 13/19 | 10 (19) | 0/19 |
| Newman11 | - | - | 0/3 | 01/4 | 60 (4) | 0/4 |
| Agulló | 04/10 | 07/10 | 01/10 | 01/10 | 21 (10) | 01/fev |
| Vulvar | 80% | 70% nodular | 41% | 44% | 61 | 3,80% |
| Newman11 | - | 11/15 | 3/15 | - | - | 1/17 |
| Tavassoli12 | - | - | 11/25 | set/25 | 34,1 (6) | - |
| Nielsen5 | 16/18 | - | - | - | - | - |
| Sun33 | - | - | - | - | 70 (23) | - |
| Agulló | 0/1 | 0/1 | 0/1 | 01/1 | 10 (1) | 0/1 |
| Angioleiomioma | 81% | 95,9% nodular | 6,70% | 6,50% | 15 | 60% |
| Hachisuga14 | - | - | - | - | 15 (562) | 327/562 |
| Akizawa26 | - | - | - | - | - | 88/124 |
| Ghanadan9 | 05/5 | 05/5 | - | - | 50 (5) | 04/5 |
| Agulló | 81/101 | 135/141 | 6/89 | 9/139 | 10 (90) | 65/83 |
TCS: tejido celular subcutáneo.
La presencia de un infiltrado inflamatorio linfocítico prominente se ha descrito tanto en formas escrotales como vulvares. Se localiza normalmente en la periferia tumoral y suele asociarse a formas benignas sin llegar a ser patognomónico (se ha observado también en leiomiosarcomas)4,11,13. En nuestra serie se observó en el caso vulvar y en dos de los diez escrotales, en uno de los cuales el infiltrado era intratumoral y muy intenso, formando centros germinales, hallazgo no reportado previamente en la literatura.
La clasificación de las neoplasias de músculo liso y el punto de corte entre leiomiomas y LS sigue siendo objeto de controversia hoy en día. A esto contribuye: la heterogeneidad de los leiomiomas y su diferente tendencia a mostrar rasgos de malignidad (mitosis, atipia, ulceración, gran tamaño, infiltración del TCS, etc.), mayor en formas escrotales, vulvares y AL, y menor en PL y formas areolares; a la escasa agresividad de los LS dérmicos, y a la falta de correlación entre los signos histológicos de atipia y la incidencia de recidivas o afectación a distancia12,19,20.
Todo ello ha provocado la creación de formas intermedias entre los leiomiomas y los LS, bien a costa de la variante benigna (leiomiomas simplásticos o atípicos, término usado especialmente en las formas genitales)4, o bien por una reclasificación de LS dérmicos a neoplasia atípica de músculo liso. También ha causado la existencia de múltiples criterios para el diagnóstico del LS, que cambian según cada variante de leiomioma y coexisten a su vez con los criterios generales para LS, que en la práctica son solo empleables para las formas profundas5,11,12,20,21.
A todo ello hay que añadir que histológicamente los LS dérmicos pueden no tener diferencias histológicas objetivas con los LS subcutáneos, salvo la localización más profunda de los segundos, a pesar del comportamiento mucho menos agresivo de los LS dérmicos, su diferente origen (folicular o perivascular) y de sus probables diferencias a nivel de transcriptoma. Es probable que la diferenciación clara entre ambos tipos de LS y la existencia o no de formas benignas atípicas, sabiendo que no existe la progresión benigno-intermedio-maligno en estos tumores, deba esperar a un estudio comparativo mediante técnicas moleculares.
Entre las limitaciones de este estudio encontramos, además de las derivadas de su carácter retrospectivo, que no ha sido diseñado para comparar incidencias de neoplasias entre los casos y un grupo control compuesto por población general, que el pequeño tamaño de muestra de alguna variante, por tratarse de lesiones muy poco frecuentes, ha podido limitar la potencia de las observaciones realizadas, y la probable infraestimación de las incidencias tumorales al trabajar únicamente con casos biopsiados.
Este estudio ha aportado datos sobre la incidencia aproximada de los leiomiomas en Navarra y ha realizado un compendio de las características clinicohistológicas de sus distintas variantes a partir de nuestros resultados y de la información de series previas disponible en la literatura. De acuerdo a las diferencias clínicas e histológicas encontradas, debería replantearse la clasificación de los leiomiomas areolares dentro de los LG. Además, la elevada frecuencia de cáncer de mama observada entre las mujeres con PL apuntaría a un posible papel del PL como marcador de riesgo que deberá confirmarse en futuros estudios.














